Para el diagnóstico de la infección urinaria (IU), además del recuento de bacterias en orina, debe tenerse en cuenta los elementos formes contenidos en la misma, el tipo de entidad clínica y el método de recogida empleado. Por ello, el diagnóstico microbiológico de la IU debe ser realizado por una persona experta que tenga en cuenta la diversidad de situaciones que traduce cada uno de los urocultivos que interpreta.
El procesamiento de las muestras de orina depende del numero de muestras recibidas diariamente. En laboratorios con un alto número es imposible el cultivo de cada una de ellas, por lo que se impone descartar las orinas negativas mediante sistemas automatizados y cultivar sólo aquellas positivas. La presente revisión incluye un análisis de los métodos disponibles actualmente para hacer este cribado. Incluye también procedimientos a realizar en situaciones especiales como prostatitis, IU por microorganismos fastidiosos e infecciones que se diagnostican con el examen de la orina.
For the diagnosis of urinary tract infection (UTI), besides the quantification of bacteria in the urine, cellular elements contained in the urine, the collection method used and the clinical syndrome should also be considered. Therefore, the microbiological diagnosis of UTI should be performed by an experienced person who takes into account the diversity of situations that may influence the result of each of the cultures.
The processing of urine samples depends on the number of samples received daily. In laboratories with a high number, it is impossible to culture each of them, so negative urines have to be ruled out by using automated systems and cultivate only those that are positive. This review includes an analysis of the methods currently available for this screening. It also includes procedures to be performed in special situations such as prostatitis, UTI caused by fastidious microorganisms and other kind of infections that may be diagnosed in a urine test.
La incidencia de infección urinaria (IU) ha ido cambiando en la última década. Así, según el estudio EPINE1, la prevalencia parcial de IU comunitaria aumentó de un 2,02% en 1991 a un 2,38% en 2003 (OR=1,008 (1,004-1,012); p<0,00), probablemente debido al aumento de la esperanza de vida, lo que a su vez aumenta la población susceptible. Por el contrario, durante este período descendió la prevalencia parcial de la IU nosocomial, desde un 2,68% en 1990 a un 1,56% en 2003 (OR=0,968 [0,964-0,972]; p<0,00), manteniéndose estable desde esta fecha, descenso que puede atribuirse fundamentalmente a la menor utilización de sondas urinarias y a la sustitución de circuitos abiertos por cerrados.
Se estima que en España un mínimo de 3.819.100 de mujeres de entre 20 y 44 años desarrollan al año una cistitis aguda y que de estas, 954.775 presentaran recurrencias2. Para este mismo período de edad se estima una incidencia de pielonefritis aguda de 18 casos por 10.000 mujeres, de las que el 7% precisaran hospitalización. Se calcula que presentan IU con muy poca sintomatología o bacteriuria asintomática (BA) el 10-15% de mujeres entre los 65 y 70 años, cifra que aumenta al 15-20% en mayores de 80 años, al 30-40% en ancianas hospitalizadas o ingresadas en geriátricos y prácticamente al 100% en portadoras de sonda urinaria permanente.
En el varón, tanto la BA como la IU sintomática son poco comunes, estimándose una incidencia anual de 5-8 episodios por 10.000 varones menores de 65 años. Casi siempre se relaciona con una anomalía urológica o con una prostatitis crónica subyacente. A partir de los 50 años, la prevalencia aumenta progresivamente en relación a obstrucción causada por patología prostática y/o a manipulaciones urológicas.
La BA es muy frecuente en el anciano, especialmente en mujeres, y su prevalencia aumenta con la edad. Es también muy frecuente en pacientes portadores de sonda permanente. La BA es la IU más frecuente en la embarazada, con una prevalencia que oscila entre el 2 y 11%; sin tratamiento, un 20-40% de las gestantes con BA desarrollan una pielonefritis aguda.
El diagnóstico microbiológico de la IU debe ser practicado en todos los casos, excepto en las cistitis no complicadas de las mujeres jóvenes, que dado la predictibilidad de los agentes etiológicos que la producen y su sensibilidad antimicrobiana, basta con confirmarla mediante el estudio de los elementos formes de la orina.
Consideraciones clinico-epidemiológicasSíndromes clínicosLa infección del tracto urinario incluye una gran variedad de síndromes clínicos, como son: bacteriuria asintomática, síndrome uretral agudo en mujeres, cistitis, pielonefritis, prostatitis e infecciones urinarias recurrentes. Además, la IU se clasifica en complicada, cuando ocurre en pacientes con cambios inflamatorios residuales consecuencia de infecciones recurrentes o con instrumentación, obstrucción, cálculos, anomalías anatómicas o fisiológicas o lesiones patológicas en su tracto urinario, u otras enfermedades sistémicas que predispongan a las infecciones bacterianas; y en IU no complicada cuando ocurre en personas sin estas anomalías. La obstrucción del tracto urinario puede complicarse con “shock” séptico, pionefrosis, absceso renal o perinefrítico.
La infección urinaria en el varón, en la infancia y en el paciente sondado, poseen unas características especiales que deben tenerse en cuenta en su diagnóstico microbiológico.
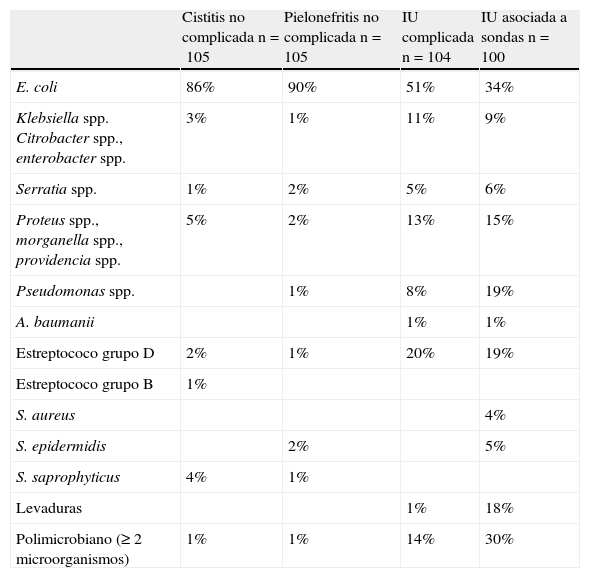
Etiología y resistencia antimicrobiana de los patógenos urinariosLa etiología se ha mantenido igual desde que se dispone de información y varía dependiendo del tipo de infección, de la existencia o no de factores predisponentes, de los tratamientos antimicrobianos previos, y del ámbito de adquisición, es decir comunitario o nosocomial. La gran mayoría de episodios están producidos por microorganismos que provienen del colon y por tanto, la flora fecal del paciente condiciona en gran medida su etiología. En la tabla 1 se exponen los agentes etiológicos productores de cistitis y pielonefritis en la mujer joven sin factores de riesgo, de la IU complicada en general y de la IU asociada a sondas. Si la etiología se contempla desde el ámbito comunitario, los agentes etiológicos mas frecuentes de la infección complicada o no complicada del tracto urinario inferior en un estudio nacional multicéntrico3 fueron: Escherichia coli (E. coli) 71%, Klebsiella spp. 6,8%, Proteus spp. 6,6% y Enterococcus spp. 5,5%.
Agentes etiológicos de la infección urinaria.
| Cistitis no complicada n=105 | Pielonefritis no complicada n=105 | IU complicada n=104 | IU asociada a sondas n=100 | |
| E. coli | 86% | 90% | 51% | 34% |
| Klebsiella spp. Citrobacter spp., enterobacter spp. | 3% | 1% | 11% | 9% |
| Serratia spp. | 1% | 2% | 5% | 6% |
| Proteus spp., morganella spp., providencia spp. | 5% | 2% | 13% | 15% |
| Pseudomonas spp. | 1% | 8% | 19% | |
| A. baumanii | 1% | 1% | ||
| Estreptococo grupo D | 2% | 1% | 20% | 19% |
| Estreptococo grupo B | 1% | |||
| S. aureus | 4% | |||
| S. epidermidis | 2% | 5% | ||
| S. saprophyticus | 4% | 1% | ||
| Levaduras | 1% | 18% | ||
| Polimicrobiano (≥ 2 microorganismos) | 1% | 1% | 14% | 30% |
Datos procedentes del Hospital Vall d’Hebron, Barcelona.
El aislamiento de estreptococos del Grupo B en gestantes, con frecuencia indica una colonización vaginal. Corynebacterium urealyticum (CDC grupo D2) causa cistitis incrustantes por cristales de estruvita en pacientes sometidos a cirugía urológica. Los adenovirus, especialmente el tipo 11 y el BK virus pueden causar cistitis hemorrágica en niños y en pacientes hematológicos respectivamente. Los anaerobios raramente son patógenos urinarios; su aislamiento indica la presencia de una fístula enterovesical. La patogenicidad de Ureaplasma urealyticum (U. urealyticum), Mycoplasma hominis (M. hominis) y Gardnerella vaginalis es discutible, por lo que su aislamiento debe ser valorado minuciosamente. En mujeres jóvenes sexualmente activas con síndrome uretral agudo, piuria y orina estéril debe investigarse Chlamydia trachomatis (C. trachomatis), Neisseria gonorrhoeae (N. gonorrhoeae) y VHS. Asimismo en pacientes adultos con piuria y orina estéril debe investigarse a Mycobacterium tuberculosis (M. tuberculosis).
Al contrario de lo que pasa con la etiología, el desarrollo de resistencias en los uropatógenos es constante y diverso según las zonas geográficas, dependiendo en gran medida del consumo de antimicrobianos, aunque la mayoría de datos publicados pueden sobredimensionar los porcentajes de resistencias, ya que se realizan en base a infecciones en las que se solicita cultivo, correspondientes fundamentalmente a infecciones complicadas o resistentes al tratamiento. Es de especial importancia el conocimiento de los mecanismos y las tasas de resistencia en E. coli, responsable de una amplia mayoría de IU. En España, en un estudio antes mencionado3, se encontraron tasas de resistencia por encima del 30% a amoxicilina y cotrimoxazol, inferiores al 10% a amoxicilina-ácido clavulánico y las cefalosporinas de segunda y tercera generación, del 3,8% a nitrofurantoína y del 1,7% a fosfomicina. La resistencia a ciprofloxacino fue del 23,9%, con importantes diferencias dependiendo de la edad (6,7% en < 40 años frente al 33,9% en > 60, p<0, 001) y de las zonas geográficas (desde el 12,5 hasta el 37,3%). La producción de β-lactamasas de espectro ampliado (BLEA) se ha identificado en los últimos años en un número creciente de cepas, incluso de origen comunitario. En 2006, su prevalencia en E. coli uropatógenos en nuestro país3 se estableció en el 5,2%, con importantes variaciones geográficas (del 0,8 al 18,4%).
La menor incidencia de otras especies condiciona el que existan pocos datos de resistencias en cepas exclusivamente de origen urinario. En un estudio multicéntrico realizado en Brasil y varios estados europeos, incluido España, entre los años 2003 y 20064 en mujeres con cistitis no complicadas, se encontraron pocos problemas de resistencia en Staphylococcus saprophyticus, con resistencia natural a fosfomicina y adquirida únicamente a la ampicilina en un 36% y al cotrimoxazol en el 10% de las cepas. En cuanto a otras enterobacterias, comparando con los datos de E. coli, las cepas de Klebsiella pneumoniae (K. pneumoniae) (intrínsecamente resistentes a amoxicilina) presentaban porcentajes de resistencia superiores para nitrofurantoína, fosfomicina y cefalosporinas y Proteus mirabilis (P. mirabilis) se encontraron niveles de resistencia inferiores frente a betalactámicos y superiores frente a otras familias antibióticas.
PatogeniaEn los últimos años, se ha avanzado en el conocimiento más preciso de los factores que predisponen a la IU, que fundamentalmente dependen de la edad, los hábitos sexuales y las condiciones fisiológicas y anatómicas del tracto urinario.
Las cepas de E. coli uropatógenos, derivan principalmente del grupo filogenético B2 y en menor medida del D y albergan genes que codifican factores extraintestinales de virulencia, siendo tanto más virulentas cuanto más factores concurran en ellas. Los genes responsables de los factores de virulencia se encuentran en el cromosoma bacteriano agrupados en fragmentos de ADN muy particulares denominados “islas de patogenicidad” o PAI. E. coli de los grupos B2 y D producen más del el 83% de las cistitis, pielonefritis y sepsis urinarias5,6. E. coli de los grupos A y B1 poseen pocos factores de virulencia, se consideran cepas comensales constituyendo el núcleo de la flora fecal, y solo causan infección urinaria cuando existen factores favorecedores.
La dinámica de las poblaciones de E. coli en la flora fecal parece jugar un papel importante en la producción de la infección. La proporción de mujeres que albergan un clon E. coli B2 en heces se incrementa desde un 36% en mujeres sanas hasta un 71% en mujeres con IU, y este clon B2 se asocia a abundancia, dominancia, pauciclonalidad y gran virulencia6. Ello sugiere que la colonización fecal por E. coli B2 puede promover la abundancia del mismo y la pauciclonalidad y ello contribuir a las posteriores etapas del desarrollo de la IU.
En la patogenia de la IU no complicada recurrente en la mujer joven parece importante la expresión, en las membranas de sus células epiteliales, de dos globósidos: sialosil-galglobósido (SGG) y disialosil-galglobósido (DSGG), que actúan como receptores de E. coli uropatógenos7. En estas mujeres, la mayoría de recurrencias están producidas por la misma cepa de E. coli, que entre episodios podría acantonarse o bien en el intestino o bien en el interior de las células superficiales de la vejiga formando “biofilms” o “pods”8. En mujeres posmenopáusicas, la falta de estrógenos condiciona la predisposición a las IU recurrentes; en ellas la administración de estradiol disminuye significativamente el número de IU, a la vez que aumenta la población vaginal de Lactobacillus9.
En el paciente sondado, los microorganismos pueden entrar en el aparato urinario durante la inserción de la sonda, lo que ocurre en el 1% en personas jóvenes sanas y en el 30% en ancianos, o mientras el paciente está sondado. Muchas de las características de la IU en el paciente sondado se deben a que los microorganismos construyen en la sonda un biofilm, intra y/o extraluminal, en el que quedan secuestrados10.
El uso de probióticos para el reestablecimiento de la ecología vaginal y la prevención de la IU está ganando aceptación como una alternativa a la terapia antibiótica convencional. Lactobacillus protege a la vagina frente a la colonización por uropatógenos, fundamentalmente porque interfiere la adherencia de los mismos al epitelio vaginal al bloquear sus receptores y porque inhibe su multiplicación mediante la producción y excreción H2O2, ácido láctico y bacteriocinas. No todos los Lactobacillus expresan estas propiedades con la misma intensidad, sino que existen enormes diferencias entre especies e incluso entre cepas de una misma especie11. Por ello, para que un probiótico sea eficaz debe estar constituido por cepas de Lactobacillus que expresen estas propiedades. Hasta hoy han sido realizados muy pocos ensayos clínicos con cepas bien caracterizadas y todavía no se ha llegado a resultados concluyentes.
Recogida, transporte y conservación de la muestraLa orina en la vejiga es estéril. Sin embargo, es fácil su contaminación durante la micción con flora del periné, uretra o vagina. Por ello es muy importante dar instrucciones claras al paciente para realizar una recogida adecuada de la muestra12. Estas instrucciones variarán según la orina sea obtenida por micción media espontánea, sondaje o cateterismo vesical, por punción de la sonda permanente, mediante bolsa adhesiva en niños sin control de esfínteres o por punción suprapúbica.
El transporte al laboratorio debe realizarse lo antes posible13. Si no es posible realizarlo transcurridas dos horas desde su recogida, debe conservarse a 4°C. Alternativamente pueden utilizarse tubos de transporte con conservantes (ácido bórico con glicerol o ácido bórico sódico liofilizado). No deben utilizarse conservantes si se requiere cultivo de micobacterias, virus u hongos, o para detección de parásitos.
Procesamiento de la muestraEl diagnóstico microbiológico de la IU debe sustentarse en tres pilares: 1) El urocultivo, que permite cuantificar e identificar los agentes causales y estudiar su sensibilidad a los antibióticos. 2) El examen de los elementos formes de la orina, que informa de la presencia de leucocitos polimorfonucleares que traducen daño tisular y/o de células del epitelio escamoso y microorganismos de la flora periuretral y vaginal que indican malas condiciones en la recogida de la orina. 3) La sintomatología clínica, mucho más sensible y específica en jóvenes sin factores predisponentes que en ancianos; actualmente, el diagnóstico y el motivo de la solicitud del urocultivo pueden ser captados de la historia informatizada.
Sin embargo, en laboratorios con un alto número de muestras es imposible el cultivo de cada una de ellas, por lo que se impone descartar las orinas negativas mediante sistemas automatizados y cultivar solo aquellas positivas. Se entiende por orina negativa y que por tanto no precisa de cultivo posterior, aquella que carece de bacteriuria y de leucocituria. Consecuentemente o bien hay que utilizar un sistema que mida ambos parámetros o dos sistemas que se complementen.
Actualmente existe una amplia variedad de métodos con capacidad de detectar bacteriuria y/o piuria.21 Algunos como la detección de la bacteriuria o la piuria por microscopía o la detección de la bacteriuria basada en la actividad de la nitrato reductasa presentan una baja sensibilidad o un gran consumo de tiempo, invalidándoles como método de cribado. El sistema automatizado Coral UTI Screen14, fundamentado en la capacidad del ATP bacteriano de emitir luz en presencia del enzima luciferin-luciferasa, o la plataforma Seegene UTI ACE que asocia una PCR múltiplex a un sistema de hibridación en fase sólida, tampoco serán considerados ya que solo miden la bacteriuria.
Detección simultánea de la actividad de la nitrato reductasa y esterasa leucocitariaMuchos sistemas comerciales son capaces de detectar simultáneamente estos dos parámetros, como indicadores de la presencia de bacteriuria y piuria. Existen numerosas evaluaciones sobre su capacidad para detectar una IU, pero en conjunto son poco comparables por su poca homogeneidad. La detección simultánea de nitritos y esterasa leucocitaria sirve principalmente para descartar una IU en base a un resultado negativo, ya que su sensibilidad es baja, pero su especificidad alta, con alto valor predictivo negativo.
Detección de bacteriuria y piuria mediante sistemas automáticosEl sistema Iris iQ200 asocia la citometría de flujo a un sistema de captura de imágenes digitales y posterior reconocimiento mediante un software basado en redes neuronales15. El sistema Sysmex UF-100016 también utiliza la citometría de flujo, clasificando las partículas presentes en la orina en función de su intensidad de fluorescencia previa tinción con dos colorantes: fenantridina y carbocianina, impedancia eléctrica y ángulo de dispersión tras incidencia de un haz de luz láser. El sistema Cellenium 160US17 utiliza sondas fluorescentes altamente específicas capaces de unirse a bacterias, levaduras y leucocitos acoplado a un sistema de análisis computerizado de imagen.
Estos sistemas presentan una sensibilidad del 68 al 99%, una especificidad del 77 al 94%, un valor predictivo positivo del 60 al 82% y un valor predictivo negativo del 86 al 98% respecto al cultivo convencional. En general, la sensibilidad y especificidad dependen de los puntos de corte empleados y este aspecto debe ser localmente determinado en base a la población a estudiar. Dado el buen valor predictivo negativo, su utilidad principal es la discriminación entre las orinas negativas y las consideradas positivas y el envío de estas últimas a cultivo convencional (aproximadamente el 30-40% de las recibidas).
CultivoEl cultivo de orina sigue siendo la técnica de elección para el diagnóstico de la IU. Debe realizarse de forma semicuantitativa usando asas calibradas de 0,01 o 0,001ml. Con este método se obtiene información sobre el número de ufc/ml del microorganismo presente en la muestra y además proporciona colonias bien aisladas para su identificación y realización de pruebas de sensibilidad antibiótica18. Los medios de cultivo empleados pueden ser de tres tipos: medios no selectivos asociados a medios selectivos (agar sangre y agar MacConkey), medios diferenciales adaptados al aislamiento de uropatógenos como el CLED (medio cistina lactosa electrolito deficiente) y medios diferenciales no selectivos cromogénicos. Cada uno tiene ventajas e inconvenientes y su utilización debe ser valorada por cada laboratorio. Los medios cromogénicos permiten la identificación de E. coli y P. mirabilis (con la realización simultanea de una prueba rápida de indol), lo que posibilita obviar la identificación de más del 50% de los aislamientos urinarios. La identificación de las otras bacterias debe ser confirmada, de lo contrario especies como Enterobacter cloacae o Citrobacter spp. podrían ser identificadas como E. coli.
La mayoría de bacterias causantes de IU pueden ser puestas en evidencia después de 18-24 horas de incubación, a 35-37°C en atmósfera aeróbica (aspecto importante para orinas sembradas durante la tarde o noche). En casos determinados como en orinas obtenidas por punción suprapúbica, cuando se haya especificado cultivo de levaduras, cuando aparezcan colonias muy pequeñas o cuando el cultivo sea negativo y se haya documentado bacteriuria, podría extenderse la incubación a 48 horas. La causa principal de piuria y cultivos negativos es el tratamiento antibiótico previo. Ante pacientes sin antibioticoterapia previa, síntomas urinarios, piuria y orina estéril, puede indicarse la repetición del urocultivo inoculando un mayor volumen o indicarse investigación de micobacterias, C. trachomatis y N. gonorrhoeae.
Criterios para interpretación de resultadosLos criterios clásicos descritos por Kass en los que se consideran significativos recuentos de ≥ 105 ufc/ml pueden ser aplicados a la mayoría de las muestras18. Sin embargo, en determinadas circunstancias, se admite la existencia de IU con recuentos inferiores: 1) En orinas obtenidas por punción suprapúbica o que proceden del riñón, cualquier recuento es indicativo de infección. 2) En mujeres jóvenes con síndrome miccional y leucocituria, se considera significativo el hallazgo de ≥ 102 ufc/mL. 3) En varones en los que la obtención de orina es menos susceptible de contaminarse, son significativos recuentos de ≥ 103 ufc/mL. 4) En orinas obtenidas por sondaje vesical, se consideran significativos recuentos ≥ 103 ufc/mL de cualquier microorganismo en cultivo puro.
En situaciones diferentes a las anteriormente descritas, un recuento ≤104 ufc/mL se considera como no significativo. Los cultivos de crecimiento mixto en pacientes con IU no complicada adquirida en la comunidad, probablemente indican contaminación por flora fecal; sin embargo, estos cultivos mixtos en pacientes sondados, hospitalizados o > 65 años deben ser valorados con cautela y en algunas ocasiones requieren contactar con el clínico para realizar una correcta interpretación.
Estudio de la resistencia antimicrobianaPueden utilizarse diferentes métodos, entre los que destacan la difusión con discos y la microdilución. La difusión con disco (Kirby-Bauer) es un método cualitativo bien estandarizado que presenta las ventajas de una gran flexibilidad en la elección de los antibióticos, bajo coste y fácil realización; su principal problema es que la lectura e interpretación de los resultados es lenta, lo que en la actualidad se puede mejorar con la utilización de sistemas de lectura digital mediante ordenador. La aparición de sistemas automatizados o semiautomatizados ha incrementado el uso de las técnicas de microdilución, cuya principal ventaja es la de ofrecer valores de CIM y su inconveniente es la obligatoriedad de adaptarse al estudio del panel de antibióticos que decide el fabricante. La elección del método en cada laboratorio depende de criterios organizativos, económicos y de necesidad de determinar valores de CIM. Con cualquiera de las técnicas, la información que se genera se traduce en categorías clínicas (sensible, intermedio o resistente) que predicen la eficacia clínica de un antimicrobiano, siguiendo criterios establecidos por diferentes comités.
El incremento, tanto en las tasas de resistencia como en la diversidad de los mecanismos que las condicionan, hace aconsejable el estudio de un número suficiente de antimicrobianos, que incluya antibióticos de interés clínico y antibióticos necesarios para una lectura interpretada del antibiograma, que permitan inferir los posibles mecanismos de resistencia. Con respecto a los antibióticos con utilidad clínica, deben incluirse aquellos específicos para la IU y otros de utilidad general en cualquier tipo de infección, seleccionados según el tipo de microorganismo. El estudio de un número elevado de antibióticos no implica que deba transmitirse información de todos ellos.
En el antibiograma de difusión en disco es importante establecer un orden adecuado en la colocación de los antibióticos, especialmente en los betalactámicos, que permita evidenciar interacciones entre ellos características de distintos mecanismos de resistencia. Para los sistemas automáticos y semiautomáticos, se ha elaborado un consenso entre el Grupo de Estudio de los Mecanismos de Acción y Resistencia a los Antimicrobianos (GEMARA) y la Mesa Española de Normalización de la Sensibilidad y Resistencia a los Antimicrobianos (MENSURA)19, sobre las características y prestaciones generales mínimas que deben tener para realizar la lectura interpretada del antibiograma y la inferencia de los mecanismos de resistencia. A pesar de estas premisas, en ocasiones, es necesario recurrir a pruebas fenotípicas específicas para la detección de algunos mecanismos de resistencia.
Información de resultadosSi se utilizan sistemas de cribado y ha sido negativo, se informará del resultado del mismo y se añadirá que no procede el cultivo y que si los síntomas persisten o recurren se debe remitir nueva muestra indicando la necesidad del cultivo.
Si no se utilizan sistemas de cribado o este ha sido positivo, se informará del número de PMN y de hematíes por mL (y del rango de normalidad de los mismos) y de la presencia de células epiteliales. Opcionalmente pueden informarse otros elementos como bacterias, levaduras, etc., aunque ello puede causar confusión con los resultados del cultivo. Posteriormente se informará de los resultados del cultivo y si es el caso de la identificación de la bacteria/as y su sensibilidad a los antibióticos.
Procedimientos adicionales a realizar en situaciones especialesProstatitis, epididimitis y orquitisLas infecciones de próstata, epidídimo y testículos son frecuentes, y plantean dificultades tanto en su diagnóstico como en su tratamiento. Los microorganismos infectantes suelen provenir del tracto urinario inferior y por tanto son los causantes de las IU o las infecciones de transmisión sexual. Las orquitis suelen ser causadas por virus, que llegan por vía hematógena. Es muy importante un correcto diagnóstico microbiológico para evitar recidivas, aunque este solo se alcanza en una minoría de los casos.
ProstatitisEs la enfermedad urológica mas frecuente en varones menores de 50 años y la tercera en mayores de esta edad. Se estima que afecta a un 5-10% de varones. En 1995 se propuso una revisión de la clasificación de Stamey y Meares (1968) y Drach (1978), consistente en clasificarla en 4 categorías20: prostatitis bacteriana aguda, prostatitis bacteriana crónica, síndrome de dolor pélvico crónico y prostatitis inflamatoria asintomática. Sólo a las 2 primeras entidades se les reconoce etiología infecciosa.
Prostatitis bacteriana agudaEn más del 80% de los casos, E. coli es el agente causal, seguido de Klebsiella, Proteus y otros uropatógenos. En pacientes intervenidos quirúrgicamente, portadores de sonda urinaria, etc. hay que considerar a P. aeruginosa, S. aureus y Candida spp. N. gonorrhoeae y C. trachomatis, son también causa de prostatitis aguda, aunque en estos casos suele haber el antecedente de uretritis y con frecuencia existe una orquiepididimitis concomitante. El diagnóstico microbiológico se realiza mediante el cultivo del chorro medio de orina y un hemocultivo. El masaje prostático está contraindicado. Si se sospecha N. gonorrhoeae o C. trachomatis debe obtenerse secreción uretral o un primer chorro de orina. Para evitar recidivas, se recomienda administrar tratamiento antibiótico durante 4-6 semanas cuando se trata de un uropatógeno o durante 10 días en caso de un agente de transmisión sexual.
Prostatitis bacteriana crónicaE. coli causa aproximadamente el 75-80% de los episodios. Otros bacilos Gram negativos, enterococos y C. trachomatis han sido asociados a infección crónica. U. urealyticum se detecta en el 13% de los pacientes. Alrededor de un 30% de prostatitis crónicas recidivan, incluso tras tratamientos antibióticos adecuados. Estas recidivas generalmente están causadas por la misma cepa bacteriana que suele conservar su sensibilidad antibiótica inicial. El diagnóstico microbiológico se basa en el Test de Meares y Stamey, que consiste en la obtención de 4 muestras: primer chorro de orina, chorro medio, secreción prostática emitida tras un masaje prostático por vía transrectal y orina postmasaje. La realización de este masaje supone muchos inconvenientes que para el paciente y con frecuencia es difícil obtener secreción prostática. Algunos especialistas proponen substituirla por semen obtenido por el propio paciente tras masturbación. En la actualidad tiende a utilizarse el método simplificado de Nikel, que consiste en obtener dos muestras de orina, una premasaje y otra después de un masaje prostático vigoroso. Se considera que existe una prostatitis cuando la cantidad de ufc/mL es diez veces superior en secreción prostática, semen o orina postmasaje que en primer o en el chorro medio de orina. Además el recuento de leucocitos debe también estar incrementado en las muestras posteriores al masaje o masturbación.
EpididimitisFrecuente en varones jóvenes, especialmente la causada por N. gonorrhoeae y C. trachomatis. En pacientes mayores la causa más frecuente son las enterobacterias y Pseudomonas y excepcionalmente M. tuberculosis. El diagnóstico microbiológico es igual al de la prostatitis crónica.
OrquitisLa mayoría son de etiología vírica, siendo el virus más frecuente el de la parotiditis, seguido de lejos por el Coxsackie B. En otras ocasiones están causadas por uropatógenos como E. coli, Klebsiella spp., P. aeruginosa, etc. y con menor frecuencia por N. gonorrhoeae o C. trachomatis. El diagnóstico microbiológico dependerá de la sospecha etiológica. Cuando se sospeche origen vírico puede realizarse cultivo celular o PCR en orina y exudado faríngeo y serología. Cuando se sospeche origen urinario o de transmisión sexual el diagnóstico microbiológico será igual al de la prostatitis crónica al que se añadirá un hemocultivo ante la presencia de fiebre.
Infección urinaria por micoplasmas y clamidiasM. hominis puede ser recuperado con frecuencia del tracto genital inferior de hombres y mujeres, pero se cree que no causa cistitis, epididimitis o prostatitis. U. urealyticum puede ser causa de prostatitis crónica. M. hominis y U. urealyticum ocasionalmente pueden causar pielonefritis. El diagnóstico microbiológico se realiza mediante cultivo de las muestras en medios líquidos o sólidos apropiados para su aislamiento.
C. trachomatis es causa del síndrome uretral agudo en mujeres y de prostatitis aguda, epididimitis y orquiepididimitis en hombres; en estos casos suele haber el antecedente de uretritis. Menos claro es si C. trachomatis es causa de prostatitis crónica, aunque se ha evidenciado su presencia en tejido prostático. Actualmente se considera a las técnicas de amplificación de ácidos nucleicos el patrón de referencia para su diagnóstico. Alternativamente pueden utilizarse técnicas de detección de antígenos.
Infección urinaria por micobacteriasPara su diagnóstico es aconsejable recoger tres muestras de orina a primera hora de la mañana, de al menos 40mL, durante tres días consecutivos. La microscopía es poco sensible ya que la concentración bacteriana necesaria para su positividad es elevada (104-105 bacterias/mL). Las técnicas de amplificación de ácidos nucleicos directa de la muestra constituyen una herramienta prometedora, con una sensibilidad establecida entre el 50 y 100% según autores, aunque la FDA solo ha aprobado su uso para muestras respiratorias, y debe realizarse siempre como complemento de la metodología convencional (baciloscopia y cultivo).
Otras infecciones que se diagnostican con el examen de orinaLa orina, por su fácil disponibilidad y alta concentración de microorganismos y/o de fragmentos de los mismos, es una muestra adecuada para el diagnóstico de un gran número de infecciones sistémicas, como leptospirosis, esquistosomiasis, infecciones virales por adenovirus, citomegalovirus, poliomavirus humanos (BK y JC) y neumonías por Streptococcus pneumoniae y Legionella pneumophila. Las metodologías para el estudio de estos patógenos en orina son la microscopia, el cultivo (convencional o celular), detección de antígenos o la amplificación de ácidos nucleicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.