La inmigración ha introducido en nuestra sociedad nuevas patologías como es la enfermedad de Chagas. Mujeres jóvenes en edad fértil y niños infectados por Trypanosoma cruzi procedentes de áreas endémicas pueden manifestar la enfermedad años más tarde, con riesgo, por parte de las gestantes, de transmitirla a sus descendientes.
MétodosDurante 5años (2003-2008) se realizó un cribado serológico de anticuerpos anti-T.cruzi mediante 2técnicas ELISA (Bioelisa Chagas Biokit® antígenos recombinantes y un ELISA «in house» con antígeno completo), y se investigó la presencia de ADN de T.cruzi en sangre, mediante PCR anidada (TCZ3/Z4), a niños menores de 18años procedentes de Latinoamérica, y a recién nacidos en nuestro país hijos de gestantes seropositivas para T.cruzi.
ResultadosSe evaluaron 202niños de entre 1día y 14años de edad, diagnosticándose 22 (10,8%) infecciones asintomáticas, 5de ellas congénitas, por tener constancia de que habían nacido en nuestro país. Todos los pacientes infectados recibieron tratamiento con beznidazol, demostrándose, hasta el momento, la curación en 3, por negativización de la serología.
ConclusiónLa enfermedad de Chagas es una nueva enfermedad pediátrica importada que puede afectar a niños procedentes de países endémicos, pero también puede ser adquirida en nuestro país por transmisión vertical. Por ello, consideramos imprescindible hacer un cribado serológico a todos los niños procedentes de áreas endémicas en la consulta pediátrica y también a las gestantes en la consulta prenatal, y ofrecer tratamiento específico a los infectados, dados los buenos resultados observados en la población pediátrica
Immigration has introduced new diseases into Spanish society, one of which is Chagas disease. Young women of childbearing age and children infected with Trypanosoma cruzi from endemic areas are at risk of developing the disease years later, and pregnant women can transmit the infection through the placenta.
MethodsSerological screening for anti-T.cruzi antibodies was performed on all immigrant children coming from a Chagas endemic area and seen in our Pathology Unit between 2003 and 2008, as well as on newborns of T.cruzi positive infected pregnant women coming from Latin America. Two ELISA tests were used (bioelisa Chagas Biokit® with recombinant antigens, and an ‘in house’ ELISA with crude antigen). Patients with sufficient sample were also screened by nested PCR (TCZ3/Z4).
ResultsA total of 202children, aged 1day to 14years old were included in the study, of whom 22 (10.8%) were diagnosed with asymptomatic infection, 5 of which were congenital as they were born in this country. All infected patients received treatment with benznidazole, with three of them currently with a serologically negative result after treatment.
ConclusionChagas disease is a new imported paediatric disease that can affect children from endemic countries, but can also be acquired in our country by vertical transmission. Therefore, we believe that it is essential to perform serological screening on all children and pregnant women in the prenatal care from endemic areas, and provide specific treatment for those infected patients, given the good results observed in the paediatric population.
La enfermedad de Chagas, descrita hace 100años por el Dr. Carlos Chagas, afecta a unos 8-10millones de personas en áreas endémicas. Según la OMS, es la tercera enfermedad tropical en importancia a nivel mundial en cuanto a morbimortalidad1. Se trata de una enfermedad relacionada con la pobreza y que supone un gran problema de salud pública en muchos países latinoamericanos, del sur de Estados Unidos hasta el sur de Chile y Argentina, sin afectar al Caribe. La principal vía de transmisión en las áreas endémicas es la vectorial a través de chinches redúvidos (triatomas) que viven en las grietas de las paredes y techos de las casas de adobe. La picadura del insecto desencadena una cascada liberadora de histamina que ocasiona el prurito cutáneo y, tras la erosión o rascado de la capa superficial de la piel, las heces depositadas al defecar el insecto penetran en el cuerpo humano. Recientemente también se han descrito brotes epidémicos por transmisión oral2,3.
Otras vías de infección, como la transfusional4,5, la vertical6 o por trasplante de órganos7, hacen que la infección también sea posible en áreas no endémicas. En Europa, Estados Unidos y Canadá ha adquirido relevancia debido a los cambios sociales acontecidos en los últimos años y que conllevan desplazamientos poblacionales de unas áreas endémicas a otras libres de Chagas (inmigración y adopciones internacionales).
Las manifestaciones clínicas en las formas graves pueden ser indistinguibles de otras infecciones congénitas causadas por otros agentes etiológicos, como toxoplasma, rubéola, citomegalovirus o herpes, y pueden ir acompañadas de prematuridad, bajo peso y otros síntomas, como hepatoesplenomegalia, ictericia, lesiones cutáneas y neurológicas8.
El objetivo de este trabajo es describir una serie de casos pediátricos con infección por Trypanosoma cruzi en un área no endémica, así como la tolerancia del tratamiento en niños infectados y tratados.
Pacientes y métodosDurante 5años (de marzo de 2003 a septiembre de 2008) se realizó un cribado serológico de anticuerpos específicos anti-T.cruzi y se investigó la presencia de ADN de T.cruzi en sangre en niños menores de 18años procedentes de países endémicos atendidos en la unidad de Medicina Importada del Hospital Sant Joan de Déu de Barcelona. También se estudiaron los hijos de gestantes infectadas por T.cruzi. El cribado serológico se realizó con 2técnicas de ELISA: una comercial, que utiliza antígenos recombinantes (BioELISA Chagas; Biokit S.A.), y un ELISA convencional «in house», en el que el antígeno es una suspensión de epimastigotes sonicados de T.cruzi (cepa Maracay), fijado en la placa de microtitulación9,10. Se consideraron seropositivos todos los pacientes con resultados positivos para ambas técnicas de ELISA. La primera técnica se utilizó para hacer el seguimiento serológico en los controles sucesivos, y la segunda solo como confirmatoria en el cribado inicial.
Para la detección de ADN en sangre se utilizó una PCR anidada con 2cebadores externos (TCZ1 y TCZ2) y 2 internos (TCZ3 y TCZ4), que amplifican un fragmento de 149pb de una secuencia repetitiva del ADN nuclear del T.cruzi de 195pb11.
Durante el período de estudio se evaluaron 202niños de edades comprendidas entre 1día y 14años, de los cuáles 45 habían nacido en España y 157 en sus países de origen. Siete de ellos eran menores de 1año que llegaron a nuestro país por adopción, y 150 tenían entre 1 y 14años. Procedían, en orden de frecuencia, de Bolivia (45,5%), Colombia (18,3%), Ecuador (6%), Brasil (4,9%), Argentina (4,6%), Perú (2%), y el 18,7% restante, de otras zonas endémicas.
A todos los recién nacidos se les efectuó un primer control durante las 2 primeras semanas de vida, y otro posterior, entre los 9 y 12meses, para comprobar si la presencia de anticuerpos podía atribuirse a una transmisión pasiva transplacentaria o demostraba infección congénita.
El criterio de infección para los pacientes de más de 9meses de vida fue la positividad de la serología confirmada por los 2métodos anteriormente descritos, y para los recién nacidos fue: a)detección de ADN del parásito a través de la PCR en al menos 2muestras de sangre diferentes, una realizada al nacimiento y la segunda como mínimo 3semanas después12, y/o b)serología positiva a partir de los 9meses de vida.
A todos los niños con diagnóstico de infección se les realizó un examen físico completo y una analítica que incluía un hemograma, un estudio de función renal y hepática, y se les derivó al servicio de cardiología para la realización de una ecocardiografía y un electrocardiograma (ECG).
Todos los pacientes infectados recibieron tratamiento con benznidazol a dosis de 8-10mg/kg/día, administrado cada 12h, durante 60días. En los pacientes menores de 3años, al no existir presentación pediátrica en suspensión, se utilizaron comprimidos de 100mg, que fueron divididos según dosis por kg de peso y posteriormente diluidos en 2cc de agua para su administración.
Durante el tratamiento se realizaron controles clínicos y analíticos cada 15días, que incluían: examen físico, control de peso y talla, hemograma, bioquímica renal y hepática. Entre los 12 y 24meses de completar el tratamiento se realizaron serologías y PCR de control.
Se consideró criterio de curación la negativización serológica en los controles postratamiento.
ResultadosDe los 157 niños nacidos en áreas endémicas, 17 (10,8%) fueron diagnosticados de enfermedad de Chagas sin posibilidad de determinar la vía de transmisión, por falta de información del momento y del lugar de la infección.
De los 45 nacidos en España se diagnosticaron 5 (11%) pacientes, que se catalogaron como infecciones congénitas por tratarse de hijos de madres infectadas por T.cruzi y no haber viajado a sus países de origen antes del diagnóstico. Los progenitores de 4 de estos pacientes eran de Bolivia, y los del quinto, de Argentina.
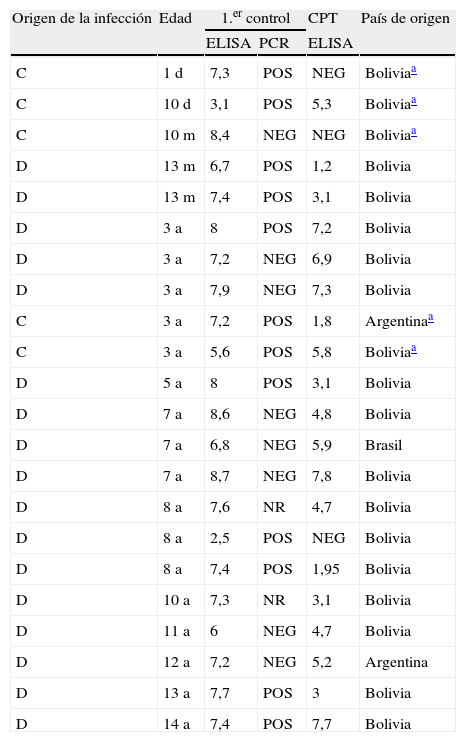
Del total de 22pacientes infectados, a 20 se les realizó una PCR junto con la primera determinación serológica, siendo positiva en 12 (60%). En 9 de ellos se les realizó una segunda PCR en el control postratamiento (CPT), siendo negativa en todos los casos.
En dicho CPT se negativizó la serología en 3pacientes (13,6%), en 6 (27,3%) se observó un descenso del título de anticuerpos superior al 50% respecto al nivel basal, mientras que en 13 (59%) los títulos se mantuvieron estables (tabla 1).
Comparación de los niveles de anticuerpos de la muestra diagnóstica con la del control realizado 2-3años después del tratamiento, resultados de la PCR y países de origen de los pacientes infectados
| Origen de la infección | Edad | 1.er control | CPT | País de origen | |
| ELISA | PCR | ELISA | |||
| C | 1 d | 7,3 | POS | NEG | Boliviaa |
| C | 10 d | 3,1 | POS | 5,3 | Boliviaa |
| C | 10 m | 8,4 | NEG | NEG | Boliviaa |
| D | 13 m | 6,7 | POS | 1,2 | Bolivia |
| D | 13 m | 7,4 | POS | 3,1 | Bolivia |
| D | 3 a | 8 | POS | 7,2 | Bolivia |
| D | 3 a | 7,2 | NEG | 6,9 | Bolivia |
| D | 3 a | 7,9 | NEG | 7,3 | Bolivia |
| C | 3 a | 7,2 | POS | 1,8 | Argentinaa |
| C | 3 a | 5,6 | POS | 5,8 | Boliviaa |
| D | 5 a | 8 | POS | 3,1 | Bolivia |
| D | 7 a | 8,6 | NEG | 4,8 | Bolivia |
| D | 7 a | 6,8 | NEG | 5,9 | Brasil |
| D | 7 a | 8,7 | NEG | 7,8 | Bolivia |
| D | 8 a | 7,6 | NR | 4,7 | Bolivia |
| D | 8 a | 2,5 | POS | NEG | Bolivia |
| D | 8 a | 7,4 | POS | 1,95 | Bolivia |
| D | 10 a | 7,3 | NR | 3,1 | Bolivia |
| D | 11 a | 6 | NEG | 4,7 | Bolivia |
| D | 12 a | 7,2 | NEG | 5,2 | Argentina |
| D | 13 a | 7,7 | POS | 3 | Bolivia |
| D | 14 a | 7,4 | POS | 7,7 | Bolivia |
a: años; C: congénito; CPT: control postratamiento; d: días; D: desconocido; ELISA: ELISA con antígeno recombinante; m: meses; NEG: negativo; POS: positivo; NR: no realizado.
Todos los pacientes con infección por T.cruzi estaban asintomáticos en el momento del diagnóstico, siendo el ECG y la ecocardiografía también normales.
Los efectos adversos durante el tratamiento con benznidazol fueron escasos, del 18% (4/22). Se detectó anemia leve en 2pacientes, y en otros 2 se objetivó un exantema pruriginoso que no precisó retirada de la medicación pero sí la reducción de la dosis a la mitad y el uso de antihistamínico durante una semana. En ambos casos se prolongó el tratamiento hasta completar la dosis total. En los menores de un año se manifestó un estancamiento ponderal durante el tratamiento que se recuperó una vez finalizado.
DiscusiónDebido al flujo migratorio y a los reagrupamientos familiares, no es raro que en países no endémicos sean diagnosticados casos de Chagas congénito o Chagas pediátrico13. Sin embargo, existen pocas publicaciones de Chagas pediátrico en países no endémicos. En esta serie se confirma que el colectivo boliviano es el más afectado por la enfermedad de Chagas, tal como ya han demostrado otros estudios efectuados en España11,14.
Entre el 60 y el 90% de las infecciones congénitas son asintomáticas, sin que haya un patrón clínico definido en casos sintomáticos12; este depende del momento de la infección, de la respuesta inmunitaria del paciente y de la virulencia del parásito.
En este trabajo presentamos 22casos de pacientes pediátricos asintomáticos con enfermedad de Chagas, 5 de ellos con infección congénita.
Durante la fase aguda de la enfermedad, incluyendo el Chagas congénito, puede detectarse una concentración elevada de parásitos en sangre, por lo que las técnicas parasitológicas, como la técnica de Strout o el microhematocrito, son a priori de gran utilidad. Sin embargo, en algunos estudios se cuestiona la sensibilidad del microhematocrito en presencia de bajas parasitemias en los primeros días de vida15. Algunos autores preconizan la repetición del microhematocrito al mes del nacimiento, si este previamente ha sido negativo16. Esta técnica no se utilizó para el diagnóstico de nuestros pacientes por problemas logísticos: las muestras no podían ser procesadas en un período breve después de la extracción por no disponer de personal experimentado para la realización e interpretación de la técnica en el momento del parto17.
A pesar de la sensibilidad de la PCR, un resultado negativo no excluye la infección por T.cruzi. En nuestra casuística la prueba fue negativa en 8 (40%) de los 20 a los que se les había realizado, uno de ellos diagnosticado de infección congénita a los 10meses de vida. Por contra, una PCR positiva durante el primer mes de vida puede significar un resultado falsamente positivo, por detectar fragmentos no viables del parásito; por ello es necesario confirmar el resultado con una nueva muestra de sangre tomada unas semanas más tarde18,19; se trata de una técnica con un rendimiento no homogéneo en función del momento evolutivo de la enfermedad. La positividad de la PCR de los 2neonatos de esta serie, en 2muestras de sangre tomadas con un intervalo de aproximadamente un mes, permitió instaurar tratamiento de una forma precoz, antes de los 9meses de vida.
Por todas estas consideraciones, en nuestra serie, para el diagnóstico de enfermedad de Chagas se recurrió a técnicas serológicas y moleculares, siguiendo las recomendaciones de la OMS20. En 8 de nuestros pacientes fue solo la serología la que confirmó el diagnóstico.
A pesar de que la PCR puede ser también útil en el seguimiento postratamiento, tal como describen algunos autores17,21, consideramos que es un parámetro que no puede utilizarse como único indicador de curación en una zona no endémica como la nuestra. Yun et al.22 describen la variabilidad de sus resultados en distintas áreas endémicas. En nuestra casuística todos los controles de PCR postratamiento fueron negativos, mientras que tan solo se demostró seronegativización en 3 pacientes: 2lactantes con infección congénita y un niño de 8años.
Por los resultados obtenidos comprobamos que los controles serológicos postratamiento para demostrar la curación han de prolongarse a más largo plazo, aunque en el 27,3% de los casos observamos, a los 2años de haber finalizado el tratamiento, un descenso de más del 50% del nivel basal de anticuerpos.
La buena tolerancia al tratamiento con benznidazol23-25, los escasos efectos adversos y la posibilidad de curación total son puntos primordiales para reforzar el diagnóstico en la edad pediátrica.
La transmisión vertical de la infección no puede prevenirse durante el embarazo, pero el cribado en las mujeres embarazadas y el control de sus hijos permiten la detección precoz de la infección y un tratamiento temprano, con excelentes resultados terapéuticos.
En Cataluña, en el año 2010 se instauró un programa de cribado en mujeres embarazadas provenientes de áreas endémicas y control de sus descendientes, con la finalidad de detectar los casos de Chagas congénito para instaurar tratamiento y evitar las graves secuelas tardías de la enfermedad26. El tratamiento precoz de los neonatos es la mejor prevención de los casos crónicos cardíacos y/o digestivos, que se dan en la edad adulta. Sicuri et al. demostraron, además, que los programas de control de la transmisión vertical en países noendémicos son coste-beneficio positivos, por lo que la prevención resulta la medida más económica de tratamiento de la enfermedad, enfatizando que la extensión de estos programas de control en países donde la enfermedad de Chagas es emergente es un reto de salud pública27,28.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.