La incidencia de infecciones fúngicas nosocomiales aumentó significativamente en la última década. La detección de Candida en muestras clínicas puede representar una colonización, infección local (muguet) o infección invasiva (candidemia). Conocer las especies aisladas facilita la elección del mejor tratamiento. El objetivo de este trabajo es determinar la frecuencia y la distribución de especies de Candida spp. detectadas en muestras clínicas, analizar las características clínicas de la población involucrada y determinar los factores de riesgo para especies Candida no albicans.
MétodosEstudio retrospectivo, observacional, de 2006 a 2010, que incluye las detecciones de Candida en muestras clínicas de pacientes internados al menos 48h en un centro neurológico. Se analizaron características epidemiológicas, comorbilidades, factores de riesgo, factores asociados a la detección de especies no albicans, tratamiento antifúngico, episodios adversos y mortalidad.
ResultadosSe detectaron 321 Candida spp. de muestras clínicas: C. albicans 139 (43,3%) y Candida no albicans 182 (56,7%). La distribución de las muestras fue orina 122 (Candida no albicans 67,2%), vía aérea 81 y fauces 45 (C. albicans 58 y 66,6%, respectivamente), candidemia 40 (Candida no albicans 75%: C. tropicalis 11, C. parapsilosis 9). La comorbilidad más usual fue el tumor sólido (35,5%). Los factores de riesgo hallados más frecuentes fueron el tratamiento antibiótico (85,5%), el tratamiento con esteroides (61,7%) y los pacientes internados en la UCI al diagnóstico (61,6%). El análisis de los factores de riesgo y el aislamiento de Candida no albicans muestra que la quimioterapia, la cirugía previa y el tratamiento con aminopenicilinas, carbapenems y glucopéptidos fueron estadísticamente significativos (p<0,05). Se observa una tendencia en pacientes neutropénicos (p=0,055) y UCI al diagnóstico (p=0,076). Supervivencia total: 71%.
ConclusionesLa distribución de especies de Candida varía según el tipo de muestra analizada. Las especies no albicans constituyen la mayoría de las detecciones. La identificación de las especies involucradas por muestra contribuye a optimizar el tratamiento. Se debe considerar la alta frecuencia de aislamientos de Candida en pacientes bajo tratamiento corticoideo y antibiótico e internados en la UCI. En los pacientes con cirugía previa, bajo tratamientos antibióticos o quimioterapia, se puede diseñar una estrategia que recomiende el uso de antifúngicos no azólicos al iniciarse una terapéutica empírica.
Nosocomial fungal infections have increased significantly in the last decade. Candida detection in clinical specimens can mean either colonization or an infection which can be local (muguet) or invasive. Knowledge of the species helps in choosing the best treatment. The aims of this study were to determine the frequency and distribution of Candida species detected in clinical samples, to analyze the clinical characteristics of the involved population and to determine the risk factors for Candida non-albicans species.
MethodsRetrospective, observational. Period: 2006-2010. Inclusion criteria: all isolates of Candida in clinical specimens from patients hospitalized —at least 48hours in a neurological center. We analyzed epidemiological characteristics, co morbidities, risk factors, factors associated with Candida non-albicans detection, antifungal treatment, development of adverse events and mortality.
ResultsCandida spp. was isolated from 321 clinical specimens: 139 (43.3%) were C. albicans and 182 (56.7%) Candida non-albicans. The distribution of the sample was: urine 122 (Candida non-albicans 67.2%), airway 81, oropharynx 45 (C. albicans) and candidemia 40 (Candida non-albicans 75%). The most frequent co-morbidity was solid tumor (35.5%). The main risk factors were antibiotic therapy (85.5%), steroid therapy (61.7%) and in ICU at diagnosis (61.6%). The analysis of risk factors and the isolation of Candida non-albicans shows that chemotherapy, previous surgery, treatment with aminopenicillins, carbapenems and glycopeptides were statistically significant (P<.05). There is a trend in neutropenic patients (P=.055) and in ICU at diagnosis (P=.076). Overall survival was 71%.
ConclusionsCandida species distribution varies with the type of sample analyzed. Non-albicans species make up the majority of the isolates. The identification of the species involved per sample helps to optimize treatment. The high frequency of isolation of Candida in patients on steroids and antibiotics and admitted to ICU, is worth pointing out. Patients with previous surgery, treated with the aforementioned antibiotics or chemotherapy, could receive non-azole antifungals in the initial empirical treatment strategy.
En los últimos 30 años hemos asistido a un notable incremento en la incidencia de candidiasis invasiva1. Aunque globalmente C. albicans sigue siendo la especie más importante, se observa un aumento de especies de Candida no albicans2,3, algunas de ellas resistentes a fluconazol, por lo que es preciso conocer de forma periódica la epidemiología en nuestro medio.
La emergencia de especies de Candida está relacionada con factores bien definidos, como neutropenia, hospitalización prolongada, cirugía abdominal, tratamientos invasivos y uso de antibióticos de amplio espectro4–6.
Las infecciones fúngicas más frecuentes en pacientes gravemente enfermos son las producidas por Candida spp. en sus diversas manifestaciones que requieren tratamiento acorde con el sitio de infección y las características de los pacientes5,7.
Las candidemias aumentan el riesgo de muerte, prolongan la estancia hospitalaria y aumentan los costes, generando un problema importante de salud pública5,8.
La detección de Candida en sitios diferentes a la sangre9 constituye un desafío, ya que puede ser considerado como una colonización, una infección local (muguet) o una infección invasiva. La importancia de la detección radica en la selección de los pacientes que se beneficiarían con un tratamiento antifúngico evitando la progresión a enfermedad invasiva y disminuyendo la mortalidad asociada.
Actualmente hay programas de vigilancia que fueron diseñados para estudiar candidiasis invasivas y la susceptibilidad a los antifúngicos5,10–12. Sin embargo, está poco definida la prevalencia de las diferentes especies en otras localizaciones.
Diversos estudios intentan establecer factores predictores de candidemias por especies no albicans13–15, aunque se desconoce si estos factores influyen en la aparición de estas especies en otras localizaciones.
El reconocimiento de los factores de riesgo para especies asociadas a resistencia antifúngica en diferentes sitios permitiría definir el mejor tratamiento en los pacientes que son susceptibles a recibirlo, con fármacos menos tóxicos y con mayor efectividad16–18.
El objetivo de este trabajo es determinar la frecuencia y la distribución de especies de Candida spp. detectadas en diferentes muestras clínicas y analizar las características clínicas de la población involucrada y los factores de riesgo para especies no albicans.
Materiales y métodosEl estudio se realizó en la Fundación para la Lucha de las Enfermedades Neurológicas de la Infancia (FLENI) sede Ciudad Autónoma de Buenos Aires, centro neurológico que cuenta con 80 camas (30 de cuidados críticos). Se incluyeron solo los pacientes con detección de Candida internados al menos 48h desde el 1 de enero de 2006 al 30 de junio de 2010. Se excluyeron los pacientes con aislamiento de Candida en piel y faneras; internados en FLENI sede Escobar (centro de rehabilitación) y pacientes de consultorio externo o guardia que no permanecieron internados.
En las muestras se identificaron las especies involucradas y el sitio de detección. De la población se analizaron: edad, sexo, comorbilidades (diabetes, enfermedad hematológica maligna, tumor sólido, infección por VIH, cirugía, trasplante de médula ósea, trasplante de órganos sólidos, enfermedad metabólica/autoinmune), uso de dispositivos (catéter venoso, catéter de derivación ventricular, sonda vesical, ARM), factores de riesgo (nutrición parenteral total, diálisis, neutropenia [PMN<500células/mm3], tratamiento esteroideo [prednisona>10mg/día por al menos 14días o equivalentes], quimioterapia en el último mes, internación en unidad de cuidados intensivos al momento del diagnóstico, infección concomitante, uso de antibióticos), antifúngicos (historia de exposición a antifúngicos previa y luego del aislamiento, efectos adversos asociados al antifúngico) y mortalidad a las 12 semanas. Se analizaron las diferencias epidemiológicas entre las distintas especies.
El punto de corte considerado para muestras de orina fue 103 UFC/ml6. En las muestras con desarrollo de levaduras se repicó cada morfotipo en agar cromogénico CHROMagarTM candida (Laboratorio Medica-Tec). Se realizaron pruebas bioquímicas de rutina para la identificación de levaduras de acuerdo con la guía del taller de identificación presuntiva de levaduras de interés médico del departamento de Micología del Centro Nacional de referencia INEI-ANLIS Dr. Carlos G. Malbrán.
En las especies no identificables con el esquema mencionado se completó la identificación con equipo comercial ID32C (bioMerieux, Marcy Etoile, Francia). La detección de levaduras sin relevancia clínica se identificó solo hasta el nivel de género. Al momento del estudio no se realizaban pruebas de sensibilidad antifúngica de rutina. Por cada episodio de fungemia solo se incluyó la primera detección identificada12. Todo episodio de fungemia que ocurrió luego de 30 días después de la detección inicial en un mismo paciente fue considerado como nuevo episodio.
Se realizó estadística descriptiva expresada en media, desviación estándar y frecuencia según la variable. La descripción estadística de las variables continuas es en media±DE y de las variables categóricas es en frecuencia y porcentaje. Las diferencias entre variables categóricas se analizaron con test de Chi cuadrado o Fisher, según correspondiera. Las diferencias entre variables continuas se evaluaron con t-test o Wilcoxon, como resultara apropiado. Todos los test estadísticos tuvieron un α=0,05. El análisis estadístico se realizó con Intercooled Stata 8.2 (StataCorp LP, Texas, EE.UU.).
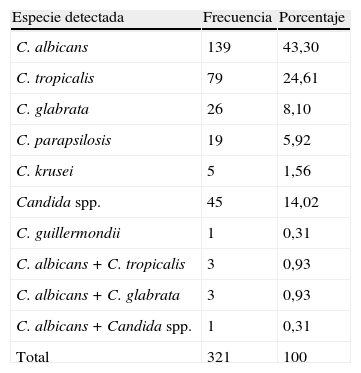
ResultadosDe enero de 2006 a junio de 2010 se detectaron 321 Candida spp. de muestras clínicas: C. albicans 139 (43,3%) y Candida no albicans 182 (56,7%) (tabla 1).
Distribución según la especie de Candida
| Especie detectada | Frecuencia | Porcentaje |
| C. albicans | 139 | 43,30 |
| C. tropicalis | 79 | 24,61 |
| C. glabrata | 26 | 8,10 |
| C. parapsilosis | 19 | 5,92 |
| C. krusei | 5 | 1,56 |
| Candida spp. | 45 | 14,02 |
| C. guillermondii | 1 | 0,31 |
| C. albicans + C. tropicalis | 3 | 0,93 |
| C. albicans + C. glabrata | 3 | 0,93 |
| C. albicans + Candida spp. | 1 | 0,31 |
| Total | 321 | 100 |
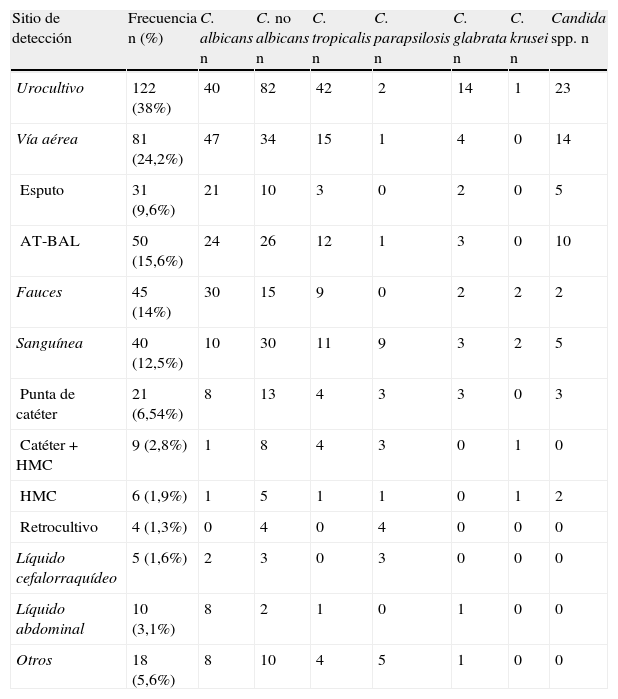
La distribución de las muestras y especies de Candida se describe en la tabla 2.
Muestras clínicas con detección de diferentes especies de Candida
| Sitio de detección | Frecuencia n (%) | C. albicans n | C. no albicans n | C. tropicalis n | C. parapsilosis n | C. glabrata n | C. krusei n | Candida spp. n |
| Urocultivo | 122 (38%) | 40 | 82 | 42 | 2 | 14 | 1 | 23 |
| Vía aérea | 81 (24,2%) | 47 | 34 | 15 | 1 | 4 | 0 | 14 |
| Esputo | 31 (9,6%) | 21 | 10 | 3 | 0 | 2 | 0 | 5 |
| AT-BAL | 50 (15,6%) | 24 | 26 | 12 | 1 | 3 | 0 | 10 |
| Fauces | 45 (14%) | 30 | 15 | 9 | 0 | 2 | 2 | 2 |
| Sanguínea | 40 (12,5%) | 10 | 30 | 11 | 9 | 3 | 2 | 5 |
| Punta de catéter | 21 (6,54%) | 8 | 13 | 4 | 3 | 3 | 0 | 3 |
| Catéter + HMC | 9 (2,8%) | 1 | 8 | 4 | 3 | 0 | 1 | 0 |
| HMC | 6 (1,9%) | 1 | 5 | 1 | 1 | 0 | 1 | 2 |
| Retrocultivo | 4 (1,3%) | 0 | 4 | 0 | 4 | 0 | 0 | 0 |
| Líquido cefalorraquídeo | 5 (1,6%) | 2 | 3 | 0 | 3 | 0 | 0 | 0 |
| Líquido abdominal | 10 (3,1%) | 8 | 2 | 1 | 0 | 1 | 0 | 0 |
| Otros | 18 (5,6%) | 8 | 10 | 4 | 5 | 1 | 0 | 0 |
AT: aspirado traqueal; BAL: lavado brocoalveolar; HMC: hemocultivos.
Se observó candidemia en el 12,5% (40) de los pacientes, de las cuales en 34 (10,6%) el catéter fue la fuente. Las detecciones de líquido abdominal fueron 10; todos monomicrobianos. Los provenientes de LCR fueron 5 y se asociaron a catéteres de derivación ventricular. El resto de las detecciones provienen de muestras de orina (122), la mayor parte instrumentados (99) y vías aéreas (126). En el 2,2% de las muestras (6 de vías aéreas y 3 de orina) se observó la presencia de más de una especie de Candida, asociándose C. albicans con C. glabrata (4), con C. tropicalis (2) y con Candida spp. (1).
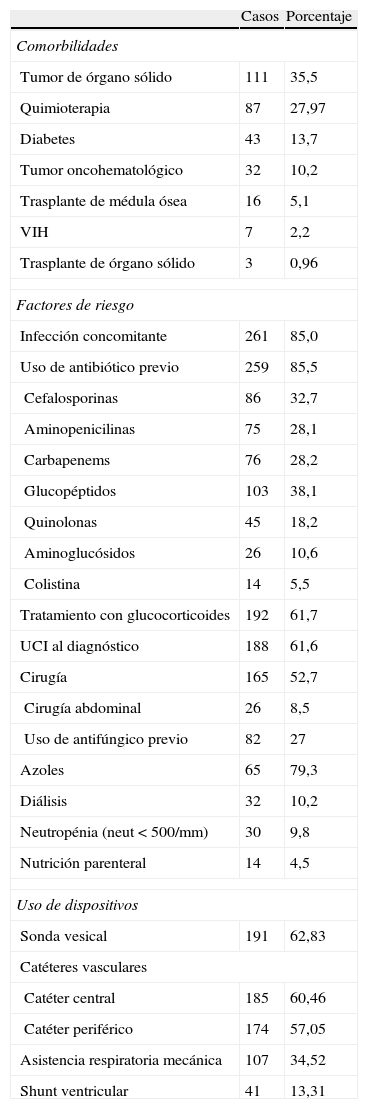
La distribución de las detecciones por sexo fue: hombres 187 (58,2%), mujeres 134 (41,7%), con una edad media de 51 años (desviación estándar, 20,6; PC25-75 37-66). La distribución de las condiciones clínicas predisponentes, los factores de riesgo y el uso de dispositivos se muestran en la tabla 3.
Condiciones y factores de riesgo para la detección de muestras con Candida
| Casos | Porcentaje | |
| Comorbilidades | ||
| Tumor de órgano sólido | 111 | 35,5 |
| Quimioterapia | 87 | 27,97 |
| Diabetes | 43 | 13,7 |
| Tumor oncohematológico | 32 | 10,2 |
| Trasplante de médula ósea | 16 | 5,1 |
| VIH | 7 | 2,2 |
| Trasplante de órgano sólido | 3 | 0,96 |
| Factores de riesgo | ||
| Infección concomitante | 261 | 85,0 |
| Uso de antibiótico previo | 259 | 85,5 |
| Cefalosporinas | 86 | 32,7 |
| Aminopenicilinas | 75 | 28,1 |
| Carbapenems | 76 | 28,2 |
| Glucopéptidos | 103 | 38,1 |
| Quinolonas | 45 | 18,2 |
| Aminoglucósidos | 26 | 10,6 |
| Colistina | 14 | 5,5 |
| Tratamiento con glucocorticoides | 192 | 61,7 |
| UCI al diagnóstico | 188 | 61,6 |
| Cirugía | 165 | 52,7 |
| Cirugía abdominal | 26 | 8,5 |
| Uso de antifúngico previo | 82 | 27 |
| Azoles | 65 | 79,3 |
| Diálisis | 32 | 10,2 |
| Neutropénia (neut < 500/mm) | 30 | 9,8 |
| Nutrición parenteral | 14 | 4,5 |
| Uso de dispositivos | ||
| Sonda vesical | 191 | 62,83 |
| Catéteres vasculares | ||
| Catéter central | 185 | 60,46 |
| Catéter periférico | 174 | 57,05 |
| Asistencia respiratoria mecánica | 107 | 34,52 |
| Shunt ventricular | 41 | 13,31 |
Tras la identificación de una muestra de Candida con significación clínica, ya sea como infección o como colonización, en un paciente con otros factores de riesgo de desarrollar candidemia, se inició tratamiento antifúngico en 217 casos (67,6%). El tratamiento de elección fue fluconazol (71,9%).
Se observaron 14 (6,45%) pacientes con episodios adversos relacionados con el tratamiento antifúngico: insuficiencia renal 6 (42,86%), hepatotoxicidad 4 (28,57%), hipocalemia 3 (21,43%) y leucopenia 1 (7,14%).La supervivencia global fue del 71% a las 12 semanas.
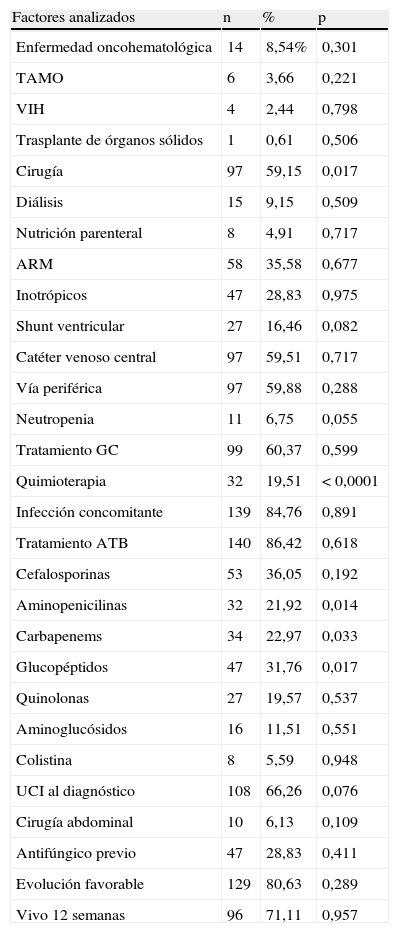
El análisis de las detecciones de Candida no albicans con los diferentes factores de riesgo muestra una relación estadísticamente significativa (p<0,05) en los pacientes que recibieron tratamiento inmunosupresor el mes previo y antibióticos como aminopenicilinas (p=0,014), carbapenems (p=0,033) y glucopéptidos (p=0,017) (tabla 4). Se observó asociación con Candida no albicans en los pacientes neutropénicos (p=0,055) e internados en la UCI (p=0,076).
Candida no albicans y factores analizados
| Factores analizados | n | % | p |
| Enfermedad oncohematológica | 14 | 8,54% | 0,301 |
| TAMO | 6 | 3,66 | 0,221 |
| VIH | 4 | 2,44 | 0,798 |
| Trasplante de órganos sólidos | 1 | 0,61 | 0,506 |
| Cirugía | 97 | 59,15 | 0,017 |
| Diálisis | 15 | 9,15 | 0,509 |
| Nutrición parenteral | 8 | 4,91 | 0,717 |
| ARM | 58 | 35,58 | 0,677 |
| Inotrópicos | 47 | 28,83 | 0,975 |
| Shunt ventricular | 27 | 16,46 | 0,082 |
| Catéter venoso central | 97 | 59,51 | 0,717 |
| Vía periférica | 97 | 59,88 | 0,288 |
| Neutropenia | 11 | 6,75 | 0,055 |
| Tratamiento GC | 99 | 60,37 | 0,599 |
| Quimioterapia | 32 | 19,51 | < 0,0001 |
| Infección concomitante | 139 | 84,76 | 0,891 |
| Tratamiento ATB | 140 | 86,42 | 0,618 |
| Cefalosporinas | 53 | 36,05 | 0,192 |
| Aminopenicilinas | 32 | 21,92 | 0,014 |
| Carbapenems | 34 | 22,97 | 0,033 |
| Glucopéptidos | 47 | 31,76 | 0,017 |
| Quinolonas | 27 | 19,57 | 0,537 |
| Aminoglucósidos | 16 | 11,51 | 0,551 |
| Colistina | 8 | 5,59 | 0,948 |
| UCI al diagnóstico | 108 | 66,26 | 0,076 |
| Cirugía abdominal | 10 | 6,13 | 0,109 |
| Antifúngico previo | 47 | 28,83 | 0,411 |
| Evolución favorable | 129 | 80,63 | 0,289 |
| Vivo 12 semanas | 96 | 71,11 | 0,957 |
ARM: asistencia respiratoria mecánica; ATB: antibiótico; GC: glucocorticoide; HIV: virus de inmunodeficiencia humana; TAMO: trasplante autólogo de médula ósea; UCI: unidad de cuidados intensivos.
En los últimos años, Candida se ha transformado en un microorganismo emergente hospitalario y es la causa más común de infecciones fúngicas invasivas (70-90% de todas las micosis invasivas)3.
Conocer la epidemiología local contribuye a elegir el antifúngico empírico adecuado, evitar su uso excesivo y evaluar efectos adversos y la mortalidad de nuestros pacientes.
En nuestro trabajo se consideraron las detecciones de Candida spp. de muestras clínicas, ya que la colonización constituye un factor de riesgo para la infección fúngica invasiva, principalmente en los pacientes críticos e inmunodeprimidos, que constituyen la mayoría de nuestra población.
La prevalencia de especies de Candida no albicans fue mayor que la de C. albicans (54,52 vs 43,3%). No obstante, la frecuencia de especies que en la literatura11 se relacionan con resistencia a antifúngicos azólicos fue menor del 10% (C. glabrata 8,10%; C. krusei 1,56%). C. glabrata fue más frecuente que C. parapsilosis (5,92%), y en el 2,2% de las muestras se detectó más de una especie; en 3 de ellas C. albicans coexistía con C. glabrata.
Las especies de Candida no albicans fueron las más frecuentemente detectadas en orina: C. tropicalis 51%, Candida spp. 28% y C. glabrata 17%. Si bien la detección de Candida en orina no es considerada por sí sola diagnóstico de infección urinaria, conocer la frecuencia de especies en esta muestra contribuye a elegir el mejor tratamiento antifúngico en los pacientes que lo requieran. En nuestro trabajo solo el 23% se consideró infección urinaria, y todos los casos estaban relacionados con sonda vesical.
Considerando que el grupo de Candida no albicans incluye especies naturalmente resistentes, sería útil disponer de datos de sensibilidad antifúngica para disminuir las probabilidades de fallo terapéutico, hecho limitante de este trabajo.
El número de detecciones de Candida en muestras respiratorias fue elevado (24%), si bien la neumonía es una entidad sumamente rara. Candida se puede detectar de muestras de esputo en el 20% del personal de salud y en el 55% de los pacientes hospitalizados que reciben antibiótico. El valor predictivo positivo del cultivo de esputo o BAL es muy bajo19. En nuestro trabajo las detecciones respiratorias correspondieron a colonización, considerándose «factor de riesgo» y no como una enfermedad en sí misma.
Barenfanger et al. describieron la práctica de limitar la identificación del crecimiento rápido de levaduras en secreciones respiratorias y su impacto en el paciente20. Esta estrategia no tuvo impacto negativo en el manejo del paciente. El beneficio potencial de no reportar Candida spp. en secreciones respiratorias es la disminución de la presión de selección de resistencia a antifúngicos. En nuestras muestras respiratorias, en la distribución de especies predominó C. albicans, seguida de C. tropicalis y Candida spp. La jerarquización de las detecciones respiratorias en nuestra población se basa en el riesgo potencial de progresar de colonización a enfermedad invasiva.
En la mitad de los pacientes con candidemia pudimos identificar al catéter como la fuente, a pesar de que todos fueron retirados durante los episodios compatibles con infección del torrente sanguíneo. Las especies detectadas en orden de frecuencia fueron C. tropicalis, C. albicans y C. parapsilosis. Estas especies de Candida no albicans ocupan el segundo y tercer lugar, después de C. albicans, en el último informe de fungemias publicado en Argentina2, y difiere con lo reportado en otros trabajos mundiales5,11,12. Sin embargo, resultados similares al nuestro fueron observados por Nucci et al.15 al analizar las infecciones fúngicas en Latinoamérica, con una incidencia global de 3 a 15 veces mayor que lo reportada en Europa y Norteamérica. Por otro lado, el estudio FUNGEMYCA publica la gran variación de la epidemiología de las fungemias en diferentes áreas geográficas de un mismo país, permaneciendo C. albicans en primer lugar, seguida de C. parapsilosis y C. glabrata. En nuestro trabajo, la mayoría de las candidemias fueron por especies que en la literatura se describen como sensibles a azólicos, razón por la cual se podría continuar con dicho antifúngico para el tratamiento inicial, si bien se deberá vigilar la aparición de resistencia a los mismos.
Los pacientes que presentaron muestras clínicas con Candida se encontraban bajo tratamiento con glucocorticoides (61,7%), internados en unidades críticas (61,6%), con dispositivos invasivos (60,5%) y cursando postoperatorio de tumor de SNC (52,7%); solo el 8,52% fueron cirugías abdominales. El amplio uso de corticoides y el tipo de cirugía corresponden al tratamiento de neoplasias de SNC, patología prevalente en nuestra institución. Estos datos son similares a los reportados por otros autores3,13,14,21.
Cuando analizamos las detecciones de Candida no albicans y los factores de riesgo descritos, observamos que el tratamiento quimioterápico previo, el uso de algunos antibióticos y la cirugía previa presentaron una asociación estadísticamente significativa. Los pacientes bajo tratamiento quimioterápico presentan alto uso de antifúngicos ambulatorios e ingresos hospitalarios, ya descrito por otros autores13, que podría justificar su asociación con especies no albicans. Cabe mencionar que recientemente se publicó un estudio que analiza la exposición a antibióticos como factor de riesgo para candidemias por especies resistentes a azólicos22. En nuestro trabajo, el uso de antibióticos como aminopenicilinas, carbapenems y glucopéptidos demostró una asociación estadísticamente significativa con la detección de especies no albicans. El uso de aquellos responde a la epidemiología bacteriana local produciendo desplazamiento de la flora microbiana habitual, que constituye un factor de riesgo conocido de infección micótica3. La intervención en el uso apropiado de los mismos es una estrategia a jerarquizar en centros donde Candida es prevalente.
En nuestro trabajo, las cirugías corresponden en su mayoría a neurocirugías debido a la especialidad de nuestro centro. Sin embargo, estas se asociaron a detecciones de Candida no albicans.
Es de destacar que se observó una tendencia cercana a ser significativa por especies Candida no albicans en pacientes neutropénicos e internados en la UCI. Esto podría constituir un sesgo, ya que se trata de la población prevalente en nuestra institución, de gravedad, con requerimiento de antifúngicos empíricos y alto uso de antibióticos. Sin embargo, esta observación nos alerta a considerar a las especies Candida no albicans dentro del esquema antifúngico inicial y evaluar la necesidad de pruebas de sensibilidad antifúngica.
Se indicó tratamiento antifúngico en el 67,6%, en su mayoría con fluconazol. Esto responde a la alta población de pacientes inmunosuprimidos que atendemos y a la difícil tarea de interpretar la detección de Candida en pacientes con factores de riesgo para enfermedad invasiva. Dada nuestra epidemiología, el fluconazol sigue siendo el tratamiento de elección. Sin embargo, debemos continuar con la vigilancia de especies y efectos adversos a la medicación a fin de elegir otros antifúngicos, como las equinocandinas.
Observamos baja frecuencia de efectos adversos (6,45%), principalmente insuficiencia renal secundaria a anfotericina B y hepatotoxicidad por fluconazol. Ambos efectos adversos fueron reversibles sin secuelas con la suspensión del tratamiento.
Si bien se describen factores asociados a muerte en pacientes con infecciones invasivas por Candida21, se desconoce la tasa de mortalidad en pacientes con aislamiento de Candida en diferentes muestras clínicas. En nuestro trabajo, la mortalidad fue del 29%, comparativamente menor que en las candidemias (33-54%)23 pero incierta con respecto a otras localizaciones.
Algunas limitaciones del estudio fueron el tamaño de la muestra, las características de la población, la realización en un solo centro y la falta de pruebas de sensibilidad antifúngica. De todos modos, el trabajo refleja la distribución de Candida en esta población, como así también los factores de riesgo relacionados.
En resumen, la distribución de especies de Candida varía según el tipo de muestra analizada. Las especies no albicans constituyen la mayoría de las detecciones. La identificación de las especies involucradas por muestra contribuye a optimizar el tratamiento. Se debe considerar la alta frecuencia de detecciones de Candida en pacientes bajo tratamiento corticoideo y antibiótico e internados en la UCI. En los pacientes con cirugía previa, en tratamiento con aminopenicilinas, carbapenems y glucopéptidos o quimioterapia, se puede diseñar una estrategia que recomiende el uso de antifúngicos no azólicos al iniciarse una terapéutica empírica.
Conflicto de interesesLa Dra Wanda Cornistein es oradora y ha participado en las conferencias educacionales y/o científicas organizadas o auspiciadas por Pfizer en el área de Ecalta, Vfend, Tygacil y Zyvox desde el 1 de noviembre de 2011 al 31 de octubre de 2012.