Existe controversia en la literatura médica sobre la bacteriemia por anaerobios: algunos autores detectaron en las últimas décadas un aumento de su incidencia, y otros, una franca disminución, e incluso se ha propuesto el no hacer de forma habitual hemocultivos para anaerobios. Presentamos un análisis prospectivo de los casos de bacteriemia por anaerobios diagnosticados en nuestro centro entre enero de 2003 y mayo de 2008.
ResultadosSe identificaron 68 pacientes con bacteriemia verdadera por anaerobios estrictos. La edad media fue de 64±19 años. La mayoría (63,2%) tenía al menos una comorbilidad, en el 20,6% de los casos fue una neoplasia sólida frecuentemente relacionada con el tracto digestivo. El foco principal de la bacteriemia fue abdominal (42,6%). Los gérmenes más frecuentemente aislados fueron diversas especies del grupo Bacteroides fragilis (36,7%), Clostridium spp. (17,6%), Peptostreptococcus spp. (16,1%) y Prevotella spp. (16,1%). El tratamiento antibiótico empírico más utilizado fue un carbapenémico en el 35,3% de los casos y se utilizó biterapia en el 30,9%. En la mayoría de los casos el tratamiento antibiótico empírico fue adecuado. La mortalidad bruta fue del 23,5% y directamente relacionada con la bacteriemia (9,2%). La presencia de sepsis, shock séptico o un score de Pitt mayor de 4 fueron predictores de mortalidad.
ConclusionesLa incidencia de bacteriemia por anaerobios en nuestro centro se cifra en 0,89 casos/1.000 ingresos hospitalarios. Los pacientes de mayor riesgo son los ancianos con diferentes comorbilidades o con procesos oncológicos; la mortalidad fue elevada.
There is some controversy regarding the current rates of anaerobic bacteremia. Some authors have described an increasing incidence in recent years, whereas others report declining rates. There is even debate over whether to routinely perform anaerobic blood cultures. We present a prospective analysis of anaerobic bloodstream infections diagnosed at our medical center from January 2003 to May 2008.
ResultsSixty-eight patients had bloodstream infection caused exclusively by anaerobic bacteria. Median age was 64±19 years and 63.2% had at least one comorbid condition, including 20.6% with a solid neoplasm, often related to the gastrointestinal tract. The main focus of anaerobic bacteremia was the abdomen (42.6%). The most common isolates were several species from the Bacteroides fragilis group (36.7%), Clostridium spp. (17.6%), Peptostreptococcus spp. (16.1%), and Prevotella spp. (16.1%). Empirical antimicrobial treatment was adequate in 69.1%. Overall mortality was 23.5%, and bacteremia-related mortality was 9.2%. Sepsis, septic shock, and a Pitt score >4 were independent predictors of mortality.
ConclusionsThe incidence of anaerobic bacteremia in our hospital was 0.89 cases per 1000 hospital admissions. Patients at high risk were elderly persons with associated underlying diseases including malignant disease. Mortality was high.
La bacteriemia por anaerobios representa un 0,5–12% del total de las bacteriemias1–5. En España, los estudios sobre bacteriemias por anaerobios son limitados6,7,8. Los microorganismos aislados con mayor frecuencia en estos procesos son bacilos gramnegativos, especialmente del grupo Bacteroides fragilis. El origen más común de la infección es intraabdominal en el 50–70% de los casos2. La mortalidad de la bacteriemia por anaerobios es alta, oscila entre un 25 y un 44%3–5,9–10 y se incrementa hasta un 60% en aquellos casos en los que el tratamiento antibiótico empírico no es el adecuado, cifra preocupante si se tiene en cuenta que con frecuencia no se sospecha inicialmente la presencia de anaerobios y no se realiza una cobertura antibiótica activa frente a anaerobios (amoxicilina-clavulánico, piperacilina/tazobactam, carbapenémicos, etc.). En las últimas décadas, diferentes trabajos han comunicado un descenso en la incidencia de la bacteriemia por anaerobios y se ha propuesto incluso excluir el procesamiento habitual de los hemocultivos para gérmenes anaerobios11, aunque esta propuesta no se ha llevado a cabo debido, en parte, a la controversia existente en la literatura médica sobre la verdadera incidencia de la bacteriemia por anaerobios12, y también porque la botella de siembra para anaerobios permite recuperar, además de anaerobios estrictos, otros microorganismos anaerobios facultativos y microaerófilos, enterobacterias e incluso Staphylococcus aureus que, en ocasiones, se detecta de forma más precoz o incluso exclusivamente en la botella de anaerobios13.
En el presente trabajo se analizan de forma prospectiva los episodios de bacteriemia verdadera por anaerobios estrictos detectados entre el 1 de enero de 2003 y el 31 de mayo de 2008 en el Hospital Son Llàtzer de Palma de Mallorca.
Material y métodosDiseño y ámbitoEstudio prospectivo de todos los episodios significativos de bacteriemia por anaerobios detectados desde el 1 de enero 2003 al 31 de mayo de 2008 en los pacientes atendidos en las plantas de hospitalización o en el Servicio de Urgencias del Hospital Son Llàtzer, hospital de 2.o nivel con 350 camas que dispone de servicios médicos (incluyendo Oncología y Hematología), servicios quirúrgicos (excepto Neurocirugía, Cirugía Torácica y Cirugía Cardiovascular) y Unidad de Cuidados Intensivos.
Para el diagnóstico de bacteriemia se siguieron globalmente las recomendaciones de las guías clínicas de la SEIMC en su última edición14. Se incluyeron sólo las bacteriemias por anaerobios consideradas significativas, definiendo como tales aquéllas en las que se aisló una bacteria anaerobia verdadera en al menos un hemocultivo obtenido por venopunción estéril procedente de un paciente con signos y síntomas clínicos de infección.
La metodología empleada para la extracción de los hemocultivos, así como la identificación de los microorganismos, se realizó por métodos estándares según la rutina del laboratorio de microbiología del centro: a cada paciente se le realizaron 2 extracciones de 10ml de sangre cada una y siempre de lugares de venopunción diferentes, y posteriormente se inocularon 5ml de sangre primeramente en un frasco anaerobio y posteriormente los 5ml restantes en un frasco aerobio. Los frascos de hemocultivos se incubaron en el sistema automático colorimétrico BacT/ALERT 3D (Organon Teknika) a 35–37°C durante 5–7 días. La identificación de los aislados se realizó con la galería manual Api ANA (BioMérieux, Marcy L′Etoile, Francia).
La bacteriemia se clasificó como de origen comunitario cuando se detectó en el momento del ingreso hospitalario o en las primeras 48h de éste, y de origen nosocomial cuando el episodio tuvo lugar pasadas las primeras 48h de la hospitalización. En la categoría de bacteriemia asociada a cuidados sanitarios se incluyeron las bacteriemias secundarias a un procedimiento diagnóstico o terapéutico realizado de forma ambulatoria, las bacteriemias en pacientes ambulatorios portadores de sondas urinarias y catéteres intravenosos, las bacteriemias en pacientes en hemodiálisis crónica y en diálisis peritoneal y las bacteriemias en pacientes ingresados en residencias de ancianos y en centros de larga estancia15.
La bacteriemia se consideró monomicrobiana cuando únicamente se aisló un microorganismo y polimicrobiana cuando en el proceso participaron 2 o más patógenos. En cuanto al foco de la bacteriemia, se definió como bacteriemia primaria aquélla en la que por los datos clínicos, microbiológicos y exploraciones complementarias no se pudo evidenciar ningún foco infeccioso. Cuando con todos estos parámetros se pudo poner de manifiesto el origen de la infección, se consideró secundaria. Según el foco, las bacteriemias se clasificaron como de origen respiratorio, abdominal, urinario, de piel y partes blandas, ginecológico, otorrinolaringológico, por herida quirúrgica y por catéter. En este último caso sólo se consideraron bacteriemias por catéter aquellas que cursaron con signos locales de infección o con existencia de un cultivo positivo, tanto del punto de inserción como del propio catéter; en caso contrario, se clasificó como bacteriemia primaria.
La enfermedad de base se clasificó según los criterios de McCabe y Jackson16 y se consideraron 3 posibilidades: no fatal, finalmente fatal y rápidamente fatal. Se incluyeron como factores de comorbilidad la presencia de diabetes mellitus, la inmunosupresión, la cardiopatía, la enfermedad respiratoria crónica, la neoplasia, la insuficiencia renal, la hepatopatía, la adicción a drogas por vía parenteral y el enolismo, entre otras.
En cuanto a la clínica y complicaciones se registraron los siguientes parámetros: fiebre (definida como temperatura axilar mayor de 38,3°C), presencia de sepsis o shock séptico y el índice de valoración de la gravedad de la bacteriemia de Pitt17.
Se recogieron datos del tratamiento antibiótico empírico administrado en el momento de la hospitalización. Se consideró que este tratamiento fue apropiado cuando al menos uno de los antibióticos incluidos en la pauta empírica fue activo, según datos del antibiograma, frente al microorganismo o a los microorganismos aislados en los hemocultivos.
La concentración mínima inhibitoria se determinó por el método de E-test (AB Biodisk, Solna, Suecia) en Agar Schaedler suplementado con 5μg/ml de hemina, 1μg/ml de vitamina K1 y un 5% de sangre de cordero (BioMérieux, Marcy L’Etoile, Francia). Las placas se incubaron a 35°C durante 48h en condiciones de anaerobiosis y, pasado ese tiempo, se procedió a su lectura. Los puntos de corte (μg/ml) utilizados para definir una cepa como sensible o resistente fueron los recomendados por el Clinical and Laboratory Standards Institute (CLSI)18.
Se analizó la mortalidad global y relacionada con la bacteriemia. Se consideró sólo la mortalidad durante el mismo ingreso hospitalario, que valoraron 2 clínicos teniendo en cuenta no sólo el criterio temporal (mortalidad dentro de los primeros días desde el diagnóstico de la bacteriemia), sino también la mortalidad relacionada con las complicaciones de ésta (endocarditis, metástasis sépticas, fallo orgánico secundario, etc.).
Análisis estadísticoSe realizó un análisis descriptivo de las características clínicas y microbiológicas de las bacteriemias por anaerobios estrictos mediante el cálculo de frecuencias para las variables cualitativas, y mediante medias con desviación estándar para las variables cuantitativas. Para la comparación de las variables cualitativas se utilizó la prueba de chi cuadrado y para la comparación de las variables cuantitativas se realizó la comparación de medias mediante la t de Student. Cuando estuvo indicado se utilizó el test exacto de Fisher. Como base de datos y para el análisis estadístico se utilizó el programa SPSS 12.0 para Windows.
ResultadosEn el período de tiempo analizado se identificaron 68 pacientes con bacteriemia por anaerobios, lo que representa una incidencia en nuestro hospital de 0,89 casos/1.000 ingresos (12,4 casos/100.000 pacientes/día de seguimiento). La edad media de los pacientes fue de 64,1±19,1, 39 varones y 29 mujeres (tabla 1). En 43 pacientes (63,2%) se observó la presencia de algún tipo de comorbilidad, y 18 de ellos (26,4%) presentaron 2 o más comorbilidades. La enfermedad más frecuente fue la neoplasia sólida, presente en 14 de los 68 casos (20,5%) (tabla 1). De los 14 procesos neoplásicos, 11 estuvieron relacionados con el tubo digestivo (neoplasia de colon en 6 casos, de esófago en 2 casos, y gástrica, de recto y de vesícula biliar en un caso cada uno); 2 casos fueron de origen ginecológico y uno prostático. En 14 pacientes (20,5%) se identificó alguna causa de inmunosupresión, 8 pacientes habían recibido quimioterapia o radioterapia, 2 seguían tratamiento con corticoides, 2 presentaban infección por el virus de la inmunodeficiencia humana, uno recibía tratamiento con inmunosupresores y otro presentaba neutropenia.
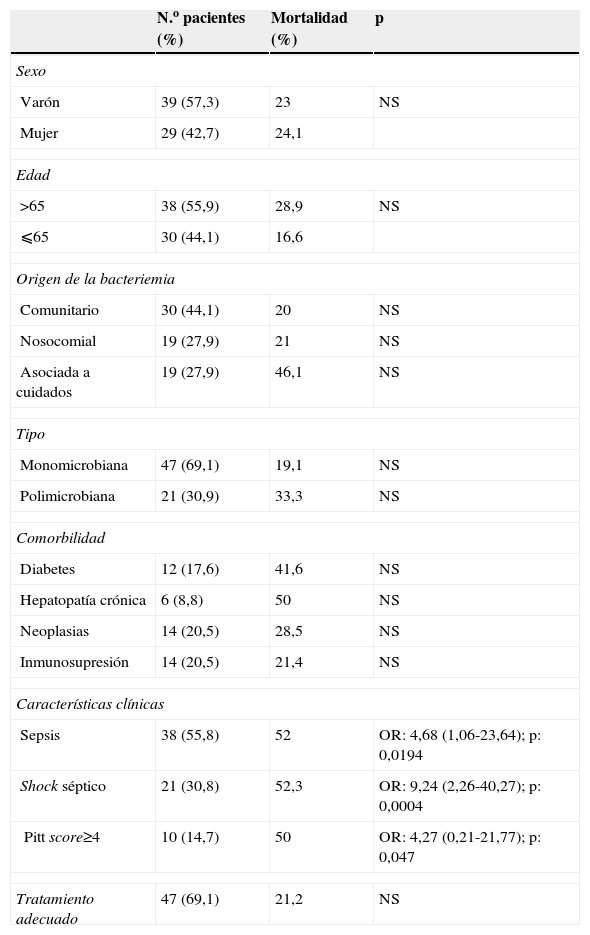
Características clínicas y análisis de mortalidad en 68 pacientes con bacteriemia por anaerobios
| N.o pacientes (%) | Mortalidad (%) | p | |
| Sexo | |||
| Varón | 39 (57,3) | 23 | NS |
| Mujer | 29 (42,7) | 24,1 | |
| Edad | |||
| >65 | 38 (55,9) | 28,9 | NS |
| ⩽65 | 30 (44,1) | 16,6 | |
| Origen de la bacteriemia | |||
| Comunitario | 30 (44,1) | 20 | NS |
| Nosocomial | 19 (27,9) | 21 | NS |
| Asociada a cuidados | 19 (27,9) | 46,1 | NS |
| Tipo | |||
| Monomicrobiana | 47 (69,1) | 19,1 | NS |
| Polimicrobiana | 21 (30,9) | 33,3 | NS |
| Comorbilidad | |||
| Diabetes | 12 (17,6) | 41,6 | NS |
| Hepatopatía crónica | 6 (8,8) | 50 | NS |
| Neoplasias | 14 (20,5) | 28,5 | NS |
| Inmunosupresión | 14 (20,5) | 21,4 | NS |
| Características clínicas | |||
| Sepsis | 38 (55,8) | 52 | OR: 4,68 (1,06-23,64); p: 0,0194 |
| Shock séptico | 21 (30,8) | 52,3 | OR: 9,24 (2,26-40,27); p: 0,0004 |
| Pitt score≥4 | 10 (14,7) | 50 | OR: 4,27 (0,21-21,77); p: 0,047 |
| Tratamiento adecuado | 47 (69,1) | 21,2 | NS |
NS: no significativo; OR: odds ratio.
La clasificación de la enfermedad de base según los criterios de McCabe fue ausencia de enfermedad de base o enfermedad de base no fatal en 51 pacientes (75%), finalmente fatal en 15 pacientes (22,1%) y rápidamente fatal en 2 pacientes (2,9%).
A 14 pacientes (20,5%) se les había realizado cirugía previa en el último mes; destacaron cirugía abdominal en 9 casos, ortopédica en 2 casos y otros tipos de cirugía en 3 casos. En 33 pacientes (48,5%) se había realizado algún tipo de manipulación o técnica invasiva: 14 pacientes eran portadores de catéteres intravenosos, en 5 se había practicado una endoscopia digestiva, 2 eran portadores de catéter urinario y en 12 se había practicado algún otro tipo de manipulación.
El origen de la bacteriemia fue comunitario en 30 casos (44,1%), nosocomial en 19 casos (27,9%) y asociado a cuidados sanitarios en 19 casos (27,9%). Dieciséis pacientes presentaron un total de 37 ingresos hospitalarios en los 12 meses previos a la bacteriemia. La media entre el último ingreso previo y el episodio de bacteriemia por anaerobios fue de 28,9±45,8 días.
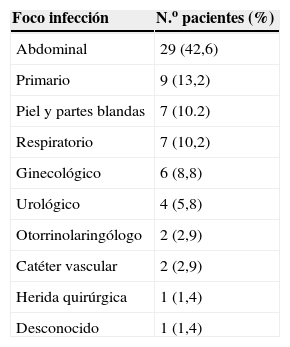
El principal foco de la bacteriemia fue el abdominal (tabla 2), y destacó la presencia de peritonitis y colecistitis en 5 casos cada una, seguidos de diverticulitis y oclusión intestinal en 3 casos cada una. Los anaerobios más frecuentemente aislados en las 29 bacteriemias de foco abdominal fueron B. fragilis en 13 casos (44,8%), Clostridium spp. en 5 casos (17,2%), Prevotella spp. en 4 casos (13,7%) y Peptostreptococcus spp. en 3 casos (10,3%). De los 5 pacientes que en nuestra serie presentaban neoplasia de colon asociada a la bacteriemia por anaerobios, en 4 se aisló B. fragilis. El número de casos de nuestra serie no permite sacar conclusiones que relacionen determinados subgrupos, como abscesos abdominales, pie diabético o sinusitis, con el aislamiento de un anaerobio en concreto.
Foco de infección en 68 pacientes con bacteriemia por anaerobios
| Foco infección | N.o pacientes (%) |
| Abdominal | 29 (42,6) |
| Primario | 9 (13,2) |
| Piel y partes blandas | 7 (10.2) |
| Respiratorio | 7 (10,2) |
| Ginecológico | 6 (8,8) |
| Urológico | 4 (5,8) |
| Otorrinolaringólogo | 2 (2,9) |
| Catéter vascular | 2 (2,9) |
| Herida quirúrgica | 1 (1,4) |
| Desconocido | 1 (1,4) |
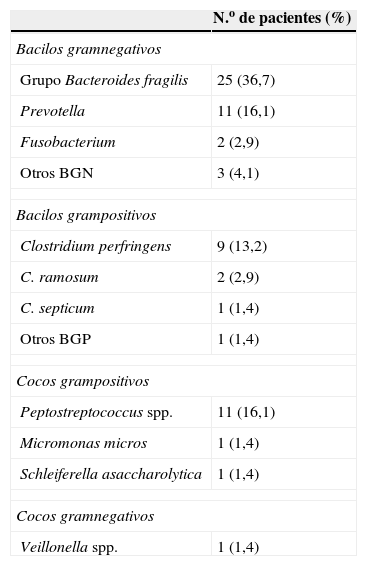
En cuanto a la presentación clínica, 38 pacientes (55,9%) tuvieron fiebre, 38 (55,9%) presentaron criterios clínicos de sepsis y 21 (30,9%) cumplieron criterios clínicos de shock séptico. En todos los pacientes se calculó el score de Pitt, que fue menor o igual a 3 en 58 casos (85,2%) y mayor de 4 en los 10 casos restantes (14,7%) (tabla 1). Los gérmenes más frecuentemente aislados fueron diversas especies del grupo B. fragilis en 25 casos (22 Bacteroides fragilis y 3 Bacteroides ovatus), Clostridium spp., Peptostreptococcus spp. y Prevotella spp. (tabla 3). En 47 casos (69,1%) la bacteriemia fue monomicrobiana y en 21 (30,9%) fue polimicrobiana. La Escherichia coli fue el microorganismo no anaerobio que más frecuentemente participó en los procesos polimicrobianos (8 casos).
Especies de anaerobios aislados en los 68 episodios de bacteriemia
| N.o de pacientes (%) | |
| Bacilos gramnegativos | |
| Grupo Bacteroides fragilis | 25 (36,7) |
| Prevotella | 11 (16,1) |
| Fusobacterium | 2 (2,9) |
| Otros BGN | 3 (4,1) |
| Bacilos grampositivos | |
| Clostridium perfringens | 9 (13,2) |
| C. ramosum | 2 (2,9) |
| C. septicum | 1 (1,4) |
| Otros BGP | 1 (1,4) |
| Cocos grampositivos | |
| Peptostreptococcus spp. | 11 (16,1) |
| Micromonas micros | 1 (1,4) |
| Schleiferella asaccharolytica | 1 (1,4) |
| Cocos gramnegativos | |
| Veillonella spp. | 1 (1,4) |
BGN: bacilos gramnegativos; BGP: bacilos grampositivos.
Se realizó el estudio de sensibilidad in vitro de 22 cepas de B. fragilis, 13 cepas de Peptostreptococcus spp., 9 cepas de Prevotella spp. y 6 cepas de Clostridium spp. Todos los aislados de B. fragilis fueron resistentes a la ampicilina; los porcentajes de sensibilidad a los demás antibióticos testados fueron amoxicilina-clavulánico (95,2%), piperacilina/tazobactam (100%), clindamicina (77,2%) y metronidazol (100%). Peptostreptococcus spp. mostró una sensibilidad del 100% a ampicilina, amoxicilina-clavulánico, piperacilina/tazobactam y clindamicina, y del 92,3% al metronidazol. Las 9 cepas de Prevotella tuvieron una sensibilidad del 100% a piperacilina/tazobactam y metronidazol, del 88,8% a amoxicilina-clavulánico, del 77% a clindamicina y del 33% a ampicilina. En cuanto a las cepas de Clostridium spp. estudiadas, la sensibilidad fue del 100% a ampicilina, amoxicilina-clavulánico y metronidazol, del 85,7% a piperacilina/tazobactam y 28,5% a clindamicina.
Al realizar un análisis global de todos los casos, piperacilina/tazobactam y metronidazol serían efectivos en el 98% de los casos, amoxicilina-clavulánico en el 96% y clindamicina en el 80,3%.
En cuanto al tratamiento antibiótico empírico, 41 pacientes (60,3%) recibieron monoterapia, 21 (30,9%) recibieron biterapia y 6 (8,8%) no recibieron tratamiento empírico. Los antibióticos más utilizados fueron los carbapenémicos en 24 casos, seguido de la penicilina y derivados en 16 casos (amoxicilina–clavulánico en 11 casos, cloxacilina en 2 casos y piperazilina/tazobactam en 3 casos), cefalosporinas en 13 casos (de 3.a generación en 11 casos, de 4.a generación en 2 casos), quinolonas (levofloxacino o ciprofloxacino) también en 13 casos. Se utilizó empíricamente metronidazol en 4 casos, siempre en biterapia. En 47 pacientes (69,1%) el tratamiento antibiótico empírico se consideró adecuado y en 21 (30,9%) se consideró inadecuado al no ser activo frente al microorganismo aislado (tabla 1).
En 12 pacientes (17,6%) la bacteriemia por anaerobios se asoció a un proceso agudo que precisó tratamiento quirúrgico. En 3 casos se relacionó con la presencia de abscesos intraabdominales que precisaron cirugía mayor para el drenaje de éstos. Otros 3 casos presentaron una peritonitis aguda (2 casos por perforación de colon y un caso por perforación gástrica). Dos pacientes presentaron una apendicitis aguda gangrenosa, y se practicó apendicetomía en ambos casos; en otros 2 casos se practicó colecistectomía por presentar colecistitis aguda. En un caso de endometritis aguda se retiró el DIU y en un caso de celulitis gangrenosa en una pierna se practicó desbridamiento quirúrgico de ésta.
La evolución clínica fue satisfactoria en 52 pacientes (76,4%). Fallecieron 16 pacientes, lo que supone una mortalidad bruta del 23,5%. Esta mortalidad estuvo directamente relacionada con el episodio de la bacteriemia en 6 casos (8,2%). En el análisis bivariante no se encontró relación significativa con la mortalidad para las variables de sexo, edad, origen de la bacteriemia, tipo de bacteriemia (monomicrobiana o polimicrobiana), con ninguna de las comorbilidades analizadas ni con si el tratamiento empírico pautado fue adecuado o no. De los 47 pacientes con tratamiento antibiótico empírico considerado adecuado fallecieron 10 (21,2%) y fallecieron 6 de 21 pacientes con tratamiento inadecuado (28,5%). Los factores predisponentes de mortalidad que alcanzaron significación estadística fueron la presencia de sepsis, shock séptico o un score de Pitt mayor de 4 (tabla 1). Este último se encontraba muy cerca del límite de significación estadística (p=0,047). Cuando estas 3 variables se introdujeron en un modelo multivariante no alcanzaron significación estadística de forma conjunta en este modelo.
DiscusiónLa bacteriemia por anaerobios no es infrecuente en nuestro hospital; hemos observado una frecuencia de ésta de 0,89 episodios por/1.000 ingresos, similar a la obtenida en una serie española importante6, en la que se observa una frecuencia media de un episodio/1.000 ingresos, con tendencia a aumentar de forma progresiva en los últimos 20 años. Hemos podido estimar en el 2,9% el porcentaje de bacteriemias por anaerobios respecto al número total de bacteriemias verdaderas de nuestro centro en el período de enero de 2003 a abril de 2005, del que disponemos de datos, además de los referidos de bacteriemias por anaerobios, de todas las bacteriemias verdaderas.
Los pacientes eran de edad media avanzada (64 años) y la presencia de comorbilidades, antecedentes de manipulaciones o cirugía previa fue habitual, como se ha descrito en otros estudios19–21. El origen abdominal es el predominante en toda la bibliografía relacionada con bacteriemias por anaerobios; B. fragilis es el microorganismo aislado con mayor frecuencia en las series revisadas, y también en la nuestra; el origen fue abdominal en el 42,6% de los casos y se aisló B. Fragilis en el 37.7% del global de las bacteriemias por anaerobios; si se consideran únicamente las bacteriemias por anaerobios de origen abdominal, se observa que la proporción de aislamientos de B. fragilis es todavía mayor: (12/29 episodios) el 42,6% de los casos.
Es frecuente que las bacteriemias por anaerobios sean polimicrobianas, en nuestro estudio lo fueron en el 30,9% de los episodios, cifra similar a la de otros autores, que oscilan entre el 34 y el 43% de los casos5,6,21, y E. coli fue la bacteria no anaerobia estricta recuperada con mayor frecuencia en las infecciones polimicrobianas, tanto en los trabajos referidos como en el nuestro.
Se ha detectado una mayor incidencia de bacteriemia por anaerobios en pacientes con tumores sólidos y hematológicos y en receptores de trasplante de médula ósea23,24, y también se ha observado un progresivo aumento en los últimos años en la frecuencia de neoplasia subyacente, sobre todo digestiva y antecedente de trasplante de médula ósea en grandes series de bacteriemias por anaerobios2. En una serie de 45 pacientes con enfermedad neoplásica de base que presentaron una bacteriemia por anaerobios, el 71,1% de los pacientes presentaba tumores sólidos, sobre todo de localización gastrointestinal, y el 28,9% presentaba procesos oncohematológicos23. En otro trabajo que incluyó 117 pacientes con bacteriemia por anaerobios, 45 (39%) tenían el antecedente de cáncer previo o reciente22. En nuestro estudio 14 (20,5%) de los pacientes con bacteriemia por anaerobios presentaron un proceso neoplásico de base; de éstos, 11 (78,5%) estaban localizados a nivel gastrointestinal.
Algunos autores han puesto en duda la necesidad de realizar hemocultivos para anaerobios de manera sistemática, y se ha propuesto realizarlos únicamente ante una sospecha clínica, en pacientes inmunodeprimidos y cuando la fuente de la bacteriemia no puede identificarse después de una correcta evaluación clínica25. Sin embargo, otras muchas publicaciones no apoyan esta propuesta5,12.
En las últimas décadas se han publicado diferentes estudios, unos que apoyan un aumento en la prevalencia de la bacteriemia por anaerobios y otros que no constatan este hecho. En la Clínica Mayo de Rochester se han analizado períodos diferentes: 1974–198826, 1984–199212, 1993–96 y 2001–20042, y se ha demostrado una elevada incidencia de hemocultivos positivos para anaerobios en la década de 1970, que ha llegado a representar hasta un 27% del total, y se ha observado un drástico descenso del 45% de la incidencia en la década de 1980 respecto a la década anterior, que atribuyeron a la utilización de profilaxis antimicrobiana previa a la cirugía, y una reemergencia en años posteriores; al analizar 2 períodos comprendidos entre los años 1993–1996 y 2001–2004, observaron un incremento del 30% en el número de hemocultivos positivos para anaerobios por 1.000 hemocultivos realizados en menos de una década. Sin embargo, un estudio realizado en Europa que analiza los resultados de 114.000 hemocultivos en un período de 10 años constata que el número de hemocultivos positivos para anaerobios entre 1997–2001 fue de 12,6/1.000 hemocultivos y descendió a 7/1.000 hemocultivos durante el período 2002–2006; la proporción de cultivos positivos para microorganismos del grupo B. frailis y cocos grampositivos aerobios se mantuvo estable27. Estudios realizados en otros centros de España no han demostrado una disminución de la incidencia de ésta8 e incluso se ha observado un aumento significativo en los últimos años7. En nuestra institución no evidenciamos cambios significativos en la incidencia de bacteriemia por anaerobios durante el período estudiado, probablemente debido al breve espacio de tiempo analizado: entre 2003 y 2007 la incidencia de bacteriemia por anaerobios fue de 0,93; 1,19; 1,02, y 1,21 casos por 1.000 altas hospitalarias, respectivamente, y la tasa de bacteriemia por anaerobios fue de 15,47 casos/100.000 pacientes/día, muy inferior a la comunicada en grandes centros de referencia2.
A pesar de que la incidencia de bacteriemia por anaerobios es relativamente baja y de que la patogenicidad y virulencia de estas bacterias ha sido tema de debate, llama la atención la elevada mortalidad con la que se asocian en diferentes centros hospitalarios3,5,21. En nuestro centro la tasa bruta de mortalidad fue del 23,5%, directamente relacionada con la bacteriemia en el 8,2%, concordante con la de otros estudios5,10. El análisis bivariante relacionó la mortalidad con la presencia de sepsis, shock séptico o la presencia de un score de Pitt mayor de 4, aunque este último se situó en el límite de la significación estadística. No encontramos relación de la mortalidad con la edad, el sexo, el origen de la bacteriemia, el tipo de bacteriemia (monomicrobiana o polimicrobiana) ni con la presencia de alguna comorbilidad determinada, aunque otros autores sí han descrito una mayor mortalidad relacionada con la edad10 o con la presencia de neoplasia subyacente22. La mayoría de los estudios sobre la bacteriemia por anaerobios han incluido un número limitado de pacientes, lo que dificulta la realización de análisis multivariantes imprescindibles para identificar todos los factores de riesgo asociados a mortalidad de las bacteriemias por anaerobios.
El tratamiento antibiótico empírico adecuado se considera de suma importancia en los casos de bacteriemia; en muestro estudio se consideró que éste había sido adecuado en el 69,1% de los casos. Al hacer el análisis bivariante el tratamiento empírico inadecuado no se asoció a una mayor mortalidad, a diferencia de otros estudios, en los que incluso el tratamiento antibiótico inadecuado es el factor de riesgo más importante para una mayor mortalidad22.
En conclusión, la incidencia de bacteriemia por anaerobios en nuestro centro fue de 0,89 casos/1.000 ingresos hospitalarios en el período del estudio, se asoció con mayor probabilidad a pacientes ancianos con enfermedades subyacentes, especialmente procesos oncohematológicos, e inmunodeprimidos, y la mortalidad relacionada fue elevada. En nuestro estudio no hemos encontrado una relación significativa entre tratamiento empírico inadecuado y mortalidad, a diferencia de otras series en las que se demuestra que la ausencia de un tratamiento empírico efectivo frente a bacterias anaerobias se asocia de manera fuerte e independiente con la mortalidad.
Un elevado porcentaje de los pacientes que ingresan actualmente en los hospitales se caracteriza por tener una edad elevada, una mayor frecuencia de comorbilidades asociadas y por presentar algún tipo de inmunosupresión; todos estos factores podrían estar incrementando la frecuencia de gérmenes anaerobios en los hemocultivos. Es además difícil sobre la base de datos de la exploración clínica predecir si se está ante una bacteriemia por anaerobios y un tratamiento inadecuado puede asociarse a una elevada mortalidad. Por lo tanto, parece más lógico argumentar a favor de la necesidad de realizar hemocultivos sistemáticos para anaerobios hasta que trabajos con mayor número de pacientes permitan establecer si es seguro obviar su realización en determinadas situaciones.