La presencia de actividad de la enfermedad inflamatoria intestinal durante la gestación puede afectar el curso del embarazo. Por ello el mejor consejo es que la concepción se produzca cuando la enfermedad esté en remisión. Ante un brote de actividad durante el embarazo, es necesario iniciar tratamiento lo más rápido posible para inducir la remisión y así evitar cualquier complicación.
Presentamos el caso de una mujer, que estando en tratamiento con adalimumab queda embarazada, y que presenta un brote de la enfermedad que precisa de intensificación del tratamiento hasta finalizar la gestación. El final del embarazo así como el parto se desarrollan sin complicaciones maternas ni fetales.
The presence of activity of inflammatory bowel disease during pregnancy can affect the course of the pregnancy. Therefore, the best advice is that conception occurs when the disease is in remission. A flare-up during pregnancy requires treatment as quickly as possible to induce remission and thus avoid any complications.
We report the case of a woman, who being treated with adalimumab, becomes pregnant and presents with a flare-up that requires a scale-up of treatment until the end of pregnancy. The end of pregnancy and childbirth occur without maternal and foetal complications.
Mujer de 38 años, fumadora y sin antecedentes médicos de interés, a quien se diagnostica enfermedad de Crohn (EC) ileocolónica a los 26 años tras cuadro abdominal agudo que se interviene de forma urgente por sospecha de apendicitis, realizándose apendicectomía laparoscópica. En el postoperatorio presenta perforación intestinal que requiere de reintervención, practicándose entonces resección ileocólica y anastomosis ileotransversa. El estudio de la pieza quirúrgica mediante anatomía patológa resulta específico de EC.
Años después del diagnóstico y estando la paciente sin seguimiento, ingresa por brote agudo grave precisando corticoides sistémicos endovenosos, antibióticos y nutrición parenteral; presenta buena evolución y recibe el alta, con pauta descendente de corticoides y azatioprina a dosis de 2,5mg/kg/día. Dada la severidad del brote, por el riesgo que ello supone, se pospone la colonoscopia a realizarla ambulante.
Tras un año de tratamiento con azatioprina, persiste la clínica de cuadros suboclusivos que precisa de nuevas pautas cortas de corticoides de acción local, desarrollando corticodependencia.
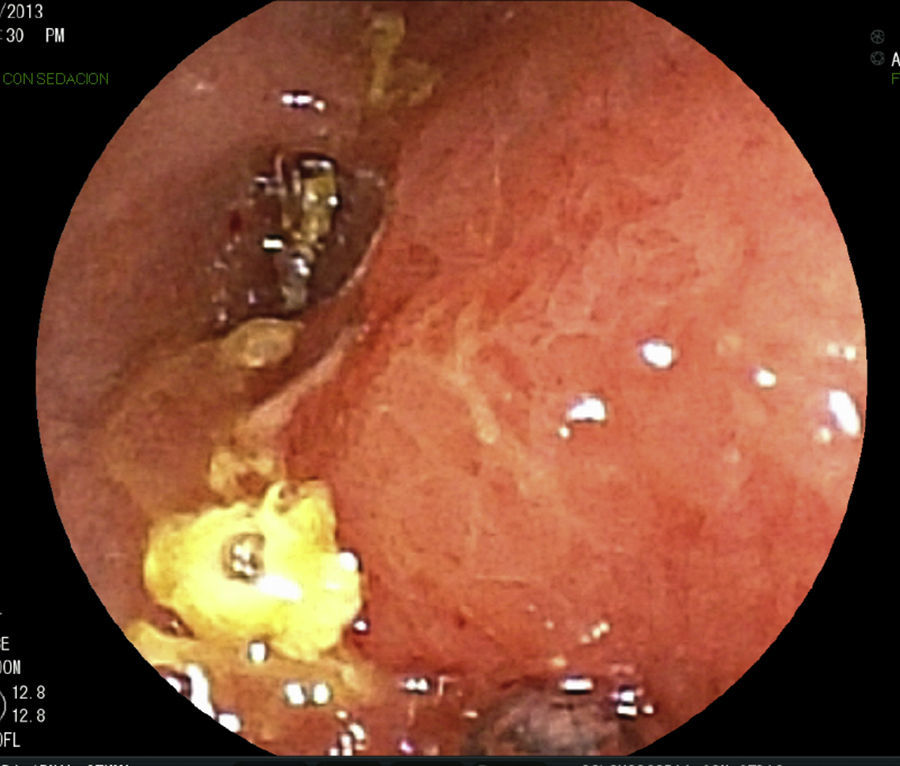
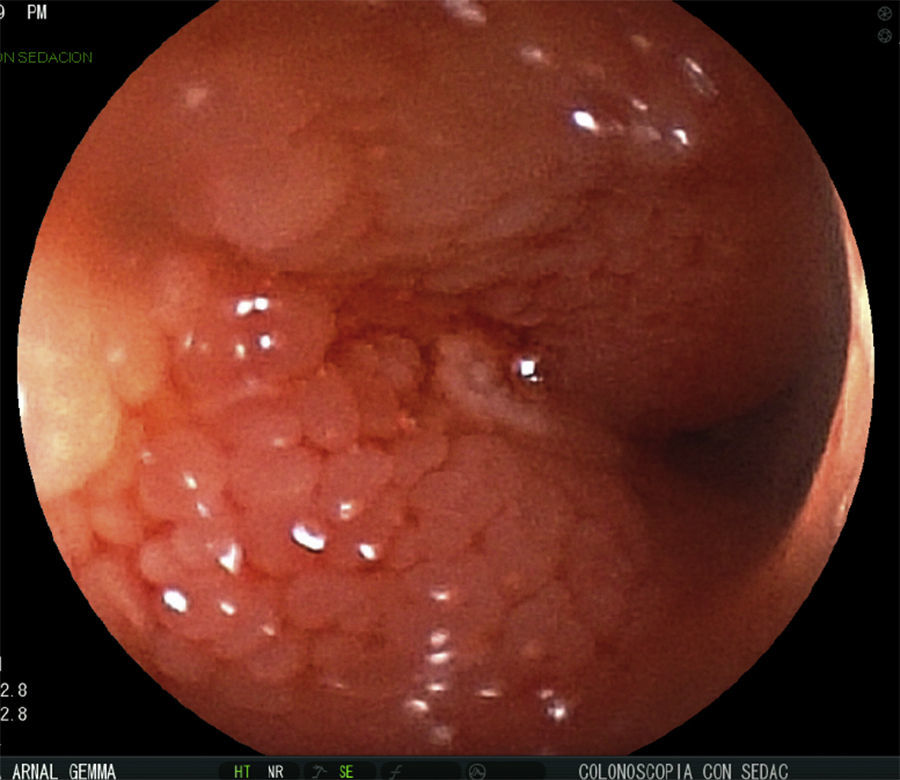
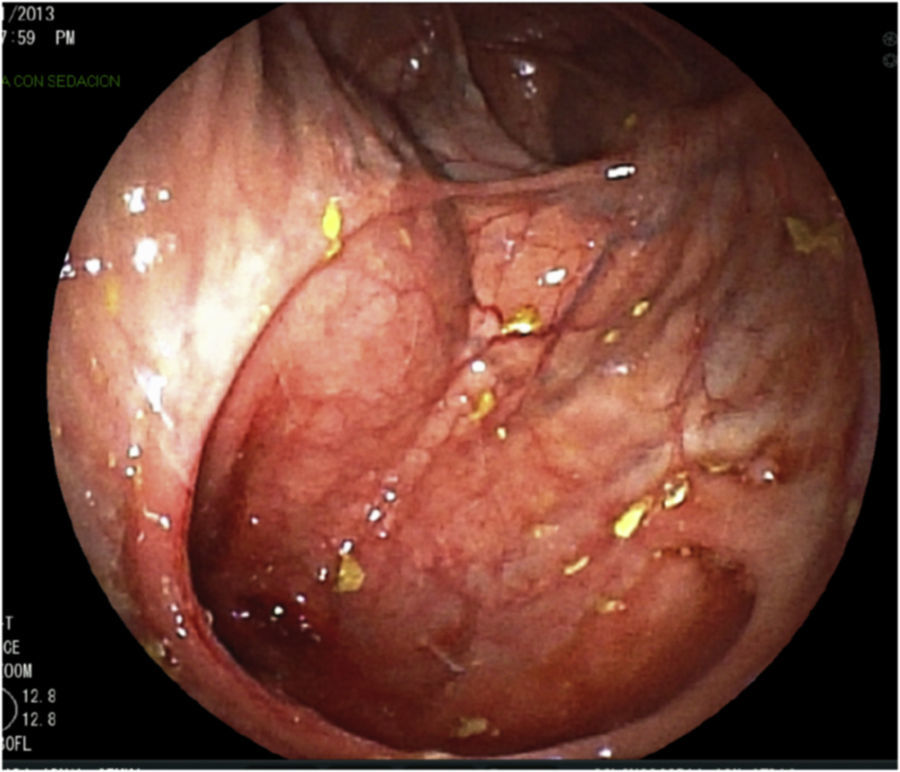
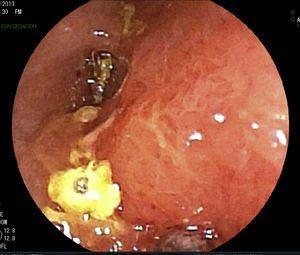
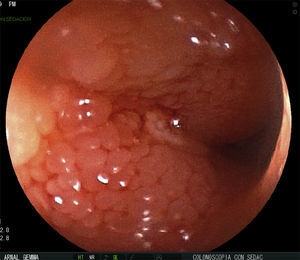
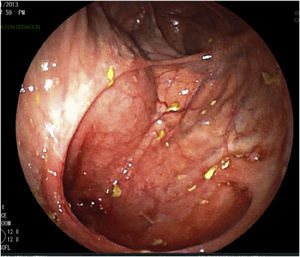
Se realizan pruebas complementarias, entre ellas ecografía abdominal y colonoscopia, en la que se visualizan más de 5 lesiones aftosas y mucosa inflamada de forma difusa (índice de Rutgeerts I3) (figs. 1-3). Por todo ello se decide inicio de adalimumab, siguiendo esquema de inducción habitual, adalimumab 160/80mg; y posteriormente 40mg cada 2 semanas.
Un año después de haber iniciado el tratamiento con adalimumab y en curso de tratamiento, la paciente queda embarazada, presentando en la semana 17 de gestación un nuevo brote que precisa intensificación del tratamiento con adalimumab 40mg semanal junto con corticoides orales. Durante las siguientes semanas, dada la mejoría clínica, se decide mantener la misma dosis de adalimumab, 40mg semanal, hasta el final de la gestación, que se realiza a término sin complicaciones fetales ni maternas. Tampoco hubo incidencias durante los primeros 12 meses de vida del recién nacido.
DiscusiónLa enfermedad inflamatoria crónica intestinal (EICI) se diagnostica con frecuencia en adultos en edad reproductiva con voluntad de gestación. El diagnóstico, los fármacos y la cirugía utilizados en la enfermedad generan dudas sobre cómo afectarán a un posible embarazo, por lo que es necesario informar y proporcionar consejo médico.
Las principales preocupaciones de las mujeres con EICI incluyen: el riesgo de transmisión de la enfermedad a la descendencia, la afectación de la fertilidad, el efecto del embarazo sobre la evolución de la enfermedad y los posibles efectos de la medicación sobre el feto.
En cuanto al riesgo de transmisión, la etiopatogenia de la EICI es multifactorial. Se hereda una cierta predisposición a padecer la enfermedad; sin embargo, el factor genético no es el único determinante y existen otros factores ambientales, muchos por determinar y otros, como el tabaco, que también tienen un papel importante en el desarrollo de la EICI1.
En general, las mujeres con EICI tienen similares tasas de fertilidad que la población general. Las mujeres con EC, como en nuestro caso, pueden tener disminución en las tasas de fertilidad cuando su enfermedad está activa, o si han tenido cirugías previas.
La mayoría de las mujeres con EICI tendrán un embarazo y parto normales. La enfermedad activa en el momento de la concepción y durante el embarazo aumenta el riesgo de complicaciones como parto prematuro y aborto espontáneo. Por ello, es recomendable que el embarazo sea programado, intentando que la concepción se produzca en un periodo de remisión de al menos 3-6 meses2.
Además, es crucial que en mujeres que precisan de tratamiento de mantenimiento de la remisión de la enfermedad, lo continúen durante la gestación para evitar el brote y con ello las complicaciones citadas.
La paciente embarazada con enfermedad activa debe ser tratada de manera contundente con medicación y hospitalización si es necesario, dado que la enfermedad mal controlada es el mayor factor de riesgo para una evolución desfavorable del embarazo3.
La mayoría de fármacos utilizados en EICI son seguros durante el embarazo y la lactancia (tabla 1), a excepción del metotrexato, que debe ser suspendido al menos 3-6 meses antes de la concepción y siempre bajo control médico.
Seguridad de los fármacos en la enfermedad inflamatoria intestinal crónica (EIIC) en el embarazo
| Fármaco | Categoría FDAa | Primer trimestre | Segundo trimestre | Tercer trimestre | Lactancia |
|---|---|---|---|---|---|
| Aminosalicilatos Mesalazina | B | + | + | + | + |
| Corticoide clásico | C | + | + | + | + |
| Corticoide acción tópica | B | + | + | + | ¿? |
| Inmunosupresores Azatioprina Metotrexato | D X | + | + | + | + – |
| Biológicos Infliximab Adalimumab | B B | + + | + + | (+)* (+)* | + + |
| Antibióticos Ciprofloxacino Metronidazol | C B | – – | (+) – | (+) – | – – |
+: seguro; –: no debe administrarse; (+): probablemente seguro pero hay poca evidencia en pacientes con enfermedad inflamatoria crónica intestinal; (+)*: infliximab y adalimumab atraviesan la placenta en el tercer trimestre; T1: primer trimestre; T2: segundo trimestre; T3: tercer trimestre.
Categorías de riesgo en el embarazo según la FDA. A: los estudios controlados en mujeres no evidencian riesgo para el feto durante el primer trimestre y la posibilidad de daño fetal aparece remota; B: los estudios en animales no indican riesgo para el feto, pero en estudios bien controlados con mujeres gestantes no se ha demostrado riesgo fetal; C: los estudios en animales han demostrado que el medicamento ejerce efectos teratogénicos, pero no existen estudios controlados con mujeres o no se dispone de estudio ni en animales ni en mujeres; D: existe evidencia positiva de riesgo fetal en humanos, pero los beneficios pueden hacer el medicamento aceptable a pesar de sus riesgos; X: los estudios en animales o en humanos han demostrado anormalidades fetales.
En cuanto a la terapia biológica, esta parece segura durante el embarazo, tal y como se refleja en los datos preliminares del estudio PIANO. En este estudio multicéntrico, prospectivo, se evaluaron embarazadas con EICI expuestas a tiopurinas en monoterapia, agente anti-TNF en monoterapia y a tratamiento combinado. Se compararon con un grupo control de pacientes con EICI sin medicación inmunosupresora ni anti-TNF. No se encontraron diferencias en la tasa de malformaciones congénitas ni resultados adversos del embarazo a corto plazo entre los embarazos expuestos a tiopurinas o anti-TNF en monoterapia y el grupo control4.
En un metaanálisis reciente que incluyó mujeres embarazadas con EICI que recibieron terapia anti-TNF, no hubo diferencias significativas en las tasas de efectos adversos en el embarazo (OR: 1,00; IC 95%: 0,72-1,41), aborto (OR: 1,53; IC 95%: 0,97-2,41), parto prematuro (OR: 1,00; IC 95%: 0,62-1,62), bajo peso al nacer (OR: 1,05; IC 95%: 0,62-1,78), o malformaciones congénitas (OR: 1,10; IC 95%: 0,58-2,09) en comparación con las mujeres que no fueron expuestas a anti-TNF5.
Un estudio español detectó mejores resultados entre las mujeres con EICI que continuaron la terapia anti-TNF durante los 3 trimestres en comparación con aquellas que suspendieron el tratamiento durante el primer trimestre, incluyendo una menor frecuencia de efectos desfavorables (25% vs. 69%, p<0,05) y una menor frecuencia de aborto espontáneo (0% vs. 46%, p=0,001)6.
Dado el bajo riesgo de efectos adversos del embarazo asociados a anti-TNF y la importancia de mantener la remisión, el beneficio de mantener el fármaco probablemente sea mayor que los riesgos para el feto. Así pues, en las mujeres embarazadas con EICI en terapia de mantenimiento con anti-TNF, se recomienda la continuación con este para mantener la remisión clínica.
En las guías europeas se sugiere la suspensión de la terapia en las semanas 22 a 24 para reducir al mínimo los riesgos de la transferencia placentaria y los efectos hipotéticos a largo plazo en el recién nacido, pero hay poca evidencia al respecto7.
La estrategia de interrupción temprana de la terapia anti-TNF solo se debe considerar en casos que tienen riesgo bajo de recaídas: pacientes con remisión sostenida durante los 12 meses antes de la concepción, sin enfermedad activa en la endoscopia previa a la concepción, sin resecciones intestinales previas, y sin hospitalizaciones en los últimos 36 meses8.
Infliximab y adalimumab son anticuerpos monoclonales IgG1, que tienen un transporte activo a través de la placenta, produciéndose la transferencia al feto sobre todo en el segundo y tercer trimestres. Los niveles sanguíneos fetales pueden ser detectados en los lactantes hasta los 6 meses, por ello no se recomienda la administración de vacunas vivas durante este periodo9.
En cambio, certolizumab es un fragmento de anticuerpo humanizado anti-TNF alfa. Esta diferencia en su estructura hace que la transferencia a través de la placenta sea por difusión pasiva, siendo la concentración del fármaco en el feto más baja. Este hecho se ha demostrado en estudios experimentales con animales y en humanos mostrando niveles muy bajos (menos de 2mg/ml) e indetectables en sangre de cordón umbilical10,11. La experiencia durante el embarazo es más escasa, pero dado que los datos experimentales no revelan teratogenicidad y la transferencia placentaria está limitada, este agente puede utilizarse en la iniciación de anti-TNF durante el embarazo.
Para adalimumab la información es más escasa que con infliximab; en el estudio PIANO no se documenta aumento de la tasa de efectos adversos en los embarazos para ninguno de los 2 fármacos4.
La Organización Especialista en Información sobre Teratogenicidad concluyó, tras un estudio prospectivo y una serie de casos sobre el uso de adalimumab durante el embarazo, que las tasas de malformaciones congénitas, parto prematuro, aborto espontáneo y muerte fetal fueron similares a la población general12.
En nuestro caso, la paciente queda embarazada de forma espontánea durante el tratamiento con adalimumab. Se planteó retirar adalimumab en el tercer trimestre, tal y como se recomienda en las guías. No obstante, al no alcanzarse la remisión completa y presentar brote durante la gestación, se decidió mantenerlo e incluso intensificarlo en el último trimestre.
Sobre la intensificación en el embarazo, como ocurre en nuestro caso, hacen falta más estudios sobre la seguridad para detectar probables efectos a largo plazo. En nuestra experiencia no hemos detectado complicaciones inmediatas en el embarazo, ni en el posparto ni en el recién nacido.
La clave para el manejo adecuado de la EICI durante el embarazo se basa en la calidad de la atención y en el trabajo en equipo multidisciplinar. La paciente debe recibir la información adecuada, animándola a mantener el tratamiento. Entre los fármacos más utilizados en la actualidad podemos concluir que los anti-TNF son seguros durante la gestación, tal y como se demuestra en nuestro caso, incluso durante el tercer trimestre y a dosis de intensificación. A pesar de que en la ficha técnica se desaconseja su uso durante la gestación, existe suficiente experiencia clínica, respaldada por los ensayos clínicos, que demuestran su seguridad durante el embarazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.