Infliximab ha demostrado su eficacia en evitar la colectomía a corto y medio plazo en los pacientes con colitis ulcerosa corticorrefractarios (CUCR). No obstante, existen pocos datos acerca del tratamiento de mantenimiento más adecuado en los pacientes con CUCR que han respondido al tratamiento de inducción a infliximab. El objetivo del estudio es comparar la evolución a largo plazo de los pacientes corticorrefractarios que han respondido al tratamiento de inducción a infliximab según hayan seguido tratamiento de mantenimiento con azatioprina en monoterapia o infliximab.
Pacientes y métodosSe seleccionaron los pacientes ingresados en 3 centros entre enero de 2005 y diciembre de 2011 por un brote moderado-grave de CUCR que habían respondido a las 3 dosis de inducción de infliximab sin necesidad de colectomía antes de la semana 22 después de la primera infusión.
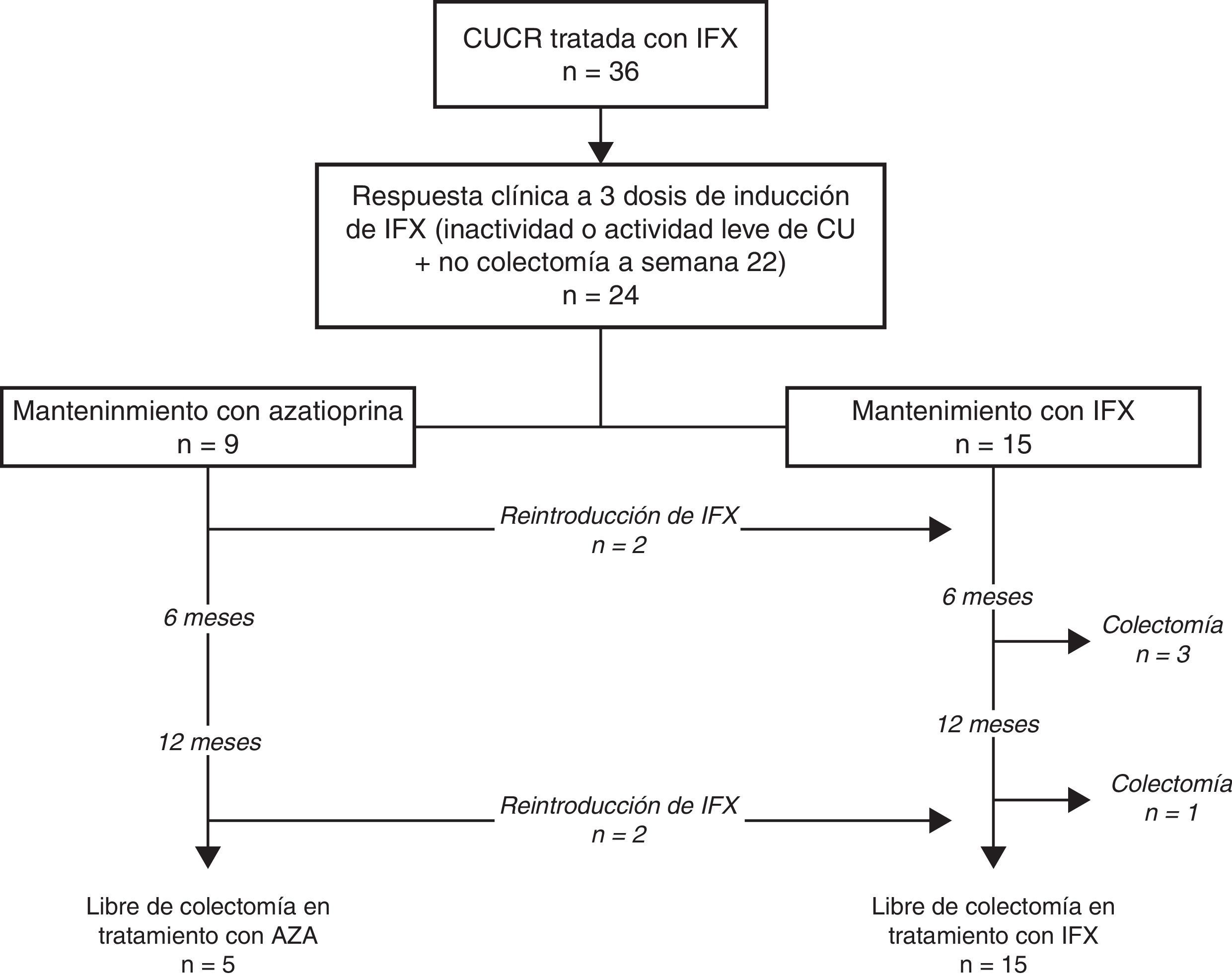
ResultadosSe incluyeron 22 pacientes, 9 (37%) siguieron tratamiento con azatioprina y 15 (63%) con infliximab. Después de una mediana de 18 meses de seguimiento, los corticoides se pudieron retirar en todos. De los que siguieron tratamiento con azatioprina, infliximab tuvo que ser reintroducido en 4 (44%). No hubo ninguna colectomía. De los 15 pacientes que siguieron tratamiento con infliximab, este requirió ser intensificado en el 53%, aunque en 9 (65%) pudo retirarse por remisión clínica. Cuatro pacientes (16%) requirieron colectomía.
ConclusionesSegún los resultados del estudio parece recomendable seguir tratamiento con infliximab, incluso en los pacientes no expuestos previamente a tiopurinas, dada la necesidad de reintroducción de infliximab si se sigue tratamiento con azatioprina en monoterapia.
Infliximab has demonstrated its efficacy in the avoidance of colectomy in the short-medium term in patients with steroid-refractory ulcerative colitis (SRUC). Scarce data are available concerning the best maintenance treatment for patients successfully treated with infliximab induction regimens. The aim of this study is to compare the long-term outcomes of steroid-refractory patients responding to a 3-infusion with infliximab who have followed maintenance therapy with azathioprine monotherapy or infliximab.
Patients and methodsAll patients admitted in 3 centres between January 2005 and December 2011 for moderate-to-severe steroid-refractory flare and who responded to a 3-infusion with infliximab and did not undergo colectomy before week 22 from the first infliximab administration were selected.
ResultsTwenty-four patients were included. Maintenance treatment consisted of azathioprine monotherapy in 9 (37%), infliximab in 15 (63%). After a median follow-up of 18 months, corticosteroids were completely withdrawn in all patients. Among those patients who followed azathioprine maintenance monotherapy, infliximab had to be reintroduced in 4 (44%). No colectomies were registered in this group. Among 15 patients who were maintained with infliximab, treatment had to be dose-escalated in 53%. However, infliximab was discontinued because of clinical remission in 9 (65%). Colectomy was required in 4 (16%).
ConclusionsIn patients with steroid-refractory who avoid early colectomy with a 3-infusion infliximab, infliximab seems to be the best maintenance treatment (even in azathioprine-naïve patients) due to the high proportion of patients who require infliximab reintroduction in case of azathioprine monotherapy maintenance.
Infliximab (IFX) fue el primer fármaco anti-TNF que demostró su eficacia en el tratamiento de la colitis ulcerosa (CU) activa1,2. En los brotes moderados-graves de CU, el tratamiento de primera línea siguen siendo los corticoides intravenosos, debido a su bajo coste y su elevada eficacia3. No obstante, la tasa de respuesta a los corticoides se ha mantenido estable desde el inicio de su utilización en el tratamiento de la CU4 y, como se ha demostrado recientemente, cerca del 40% de los pacientes no responderá al tratamiento y precisará de un tratamiento de rescate5. En este escenario clínico, IFX ha demostrado su eficacia en evitar la colectomía e inducir la remisión clínica en una proporción significativa de pacientes, pero los ensayos clínicos aleatorios han evaluado solamente la eficacia de los regímenes de inducción con una6 o 3 infusiones7. Una serie amplia italiana demostró que en los pacientes con colitis ulcerosa corticorrefractaria (CUCR), la infusión de 2 o más dosis de inducción de IFX era más eficaz para evitar la colectomía a corto y medio plazo que una infusión única8. Por otra parte, existen pocos datos acerca del tratamiento de mantenimiento más adecuado en los pacientes con CUCR que han respondido satisfactoriamente al tratamiento de inducción a IFX.
Por otro lado, los fármacos anti-TNF se asocian a un elevado coste económico y a la posibilidad de efectos adversos severos, por lo que la suspensión del tratamiento con IFX una vez alcanzada la remisión supone una alternativa. En la práctica clínica habitual existen además otros motivos para considerar la suspensión del tratamiento con IFX, como son las preferencias del paciente, el embarazo o diferencias en políticas sanitarias9, aunque no existen guías clínicas al respeto. A pesar de no disponer todavía de evidencia sólida ni de guías establecidas, en los pacientes bajo tratamiento con azatioprina (AZA) en el momento de iniciar IFX normalmente se recomienda seguir tratamiento de mantenimiento con IFX (solo o en combinación con AZA). En cambio, en los pacientes sin exposición previa a AZA (AZA-naïve), existe la opción de continuar tratamiento de mantenimiento con IFX (solo o en combinación con AZA) o seguir con AZA en monoterapia.
El objetivo del presente estudio es comparar la evolución a largo plazo de los pacientes con CUCR que responden a la pauta convencional de inducción con 3 infusiones de IFX, según hayan seguido tratamiento de mantenimiento con AZA en monoterapia o IFX (solo o en combinación con AZA).
Pacientes y métodosA partir del registro electrónico de 3 centros de referencia para enfermedad inflamatoria intestinal del área de Barcelona (Hospital Universitari Germans Trias i Pujol –Badalona–, Hospital de la Santa Creu i Sant Pau –Barcelona–, y Hospital Universitari de Bellvitge –L’Hospitalet de Llobregat–) se identificaron todos aquellos pacientes ingresados entre enero de 2005 y diciembre de 2011 por un brote de CU que requirieron tratamiento de rescate con IFX por falta de respuesta a corticoides intravenosos. Todos los pacientes fueron inicialmente tratados con corticoides intravenosos a la dosis de 1mg/kg/día de prednisolona o equivalente y todos recibieron tratamiento de rescate con IFX (Remicade©) a dosis de 5mg/kg administrado en las semanas 0, 2 y 6 (pauta de inducción). En todos los casos, la primera infusión de IFX se administró durante la hospitalización. Solamente se incluyeron en el estudio aquellos pacientes que respondieron a las 3 dosis de inducción de IFX (considerándose como «respuesta» la existencia de actividad leve o sin actividad según la clasificación de Montreal10) y que no habían requerido colectomía antes de la semana 22 después de la primera infusión de IFX (con el tratamiento de mantenimiento con AZA o IFX claramente establecido después de las 3 de infusión de inducción). Se excluyeron los pacientes con afectación limitada al recto. Una vez completada la pauta de inducción y alcanzada la respuesta clínica, el tratamiento de mantenimiento quedaba a criterio del médico responsable, con IFX 5mg/kg cada 8 semanas en monoterapia, AZA 2,5mg/kg/día, o ambos. El tratamiento con AZA fue iniciado antes o al mismo tiempo que la primera infusión de IFX en todos los casos.
Se registraron datos epidemiológicos (sexo, edad, hábito tabáquico, historia familiar de enfermedad inflamatoria intestinal), clínicos (tiempo de evolución de la CU, extensión, cursos previos de esteroides, manifestaciones extraintestinales, falta de respuesta a corticoides orales en el brote índice y colectomía en el seguimiento), del tratamiento (tratamiento de mantenimiento previo al ingreso, tratamiento previo de rescate con ciclosporina, tratamiento de mantenimiento con AZA, IFX o ambos) y la evolución (necesidad de reintroducción de IFX en los pacientes en mantenimiento con AZA en monoterapia, necesidad de intensificación de IFX, suspensión de IFX por remisión prologada). Los pacientes se siguieron evolutivamente hasta la colectomía, muerte o momento de la recogida de datos.
El estudio fue aprobado por el comité ético del centro coordinador (Hospital Universitari Germans Trias i Pujol).
El análisis estadístico se realizó con SPSS12.0 de Windows (SPSS Inc., Chicago, IL, EE. UU.). Los datos se expresan como mediana y rango intercuartílico o números absolutos y frecuencias, según se requiera. Se realizaron análisis Chi-cuadrado y t-Student para comparar variables cualitativas y cuantitativas respectivamente.
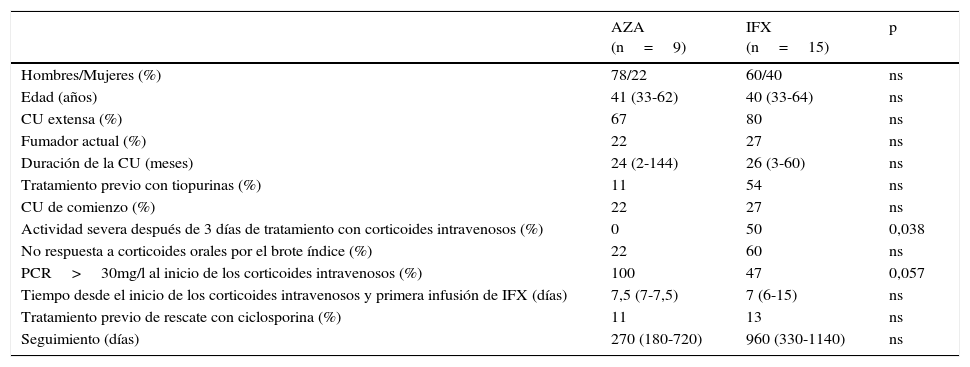
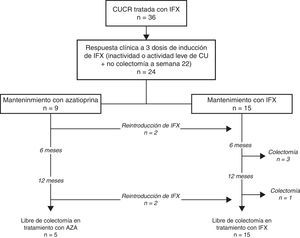
ResultadosEn total se incluyeron 24 pacientes con un brote moderado-grave de CUCR, todos ellos respondedores a las 3 infusiones de inducción de IFX. IFX se inició después una mediana de 7 días de tratamiento con corticoides intravenosos y en 3 pacientes se comenzó como tratamiento de rescate de segunda línea después del fracaso previo de ciclosporina. El tratamiento de mantenimiento después de la inducción con IFX fue AZA en monoterapia en 9 (37%) e IFX en 15 (63%) (12 en combinación con AZA –50%– y 3 con IFX monoterapia –13%–). Las características principales de los pacientes incluidos en el estudio se resumen en la tabla 1. Como era de esperar, la mayoría de los pacientes sufrían una CU extensa (75%), no eran fumadores activos (75%) y en un 54% de los casos presentaban actividad grave en el momento del ingreso. Destacar que en una cuarta parte de los pacientes se trataba del brote de inicio, un tercio había sido diagnosticado de CU en los últimos 12 meses y un tercio estaba en tratamiento de mantenimiento con tiopurinas en el momento del ingreso. No se observaron diferencias clínicas ni epidemiológicas entre los 2 grupos a estudio, a excepción de una proteína C reactiva (PCR) significativamente más elevada al inicio de los corticoides intravenosos en el grupo de pacientes que siguieron tratamiento de mantenimiento con AZA en monoterapia (139±65 vs. 71±59mg/l, p=0,022) y una mayor proporción de pacientes con actividad grave a los 3 días de corticoides intravenosos en el grupo de pacientes en tratamiento de mantenimiento con IFX (50 vs. 0%, p=0,038). A pesar que había una mayor proporción de pacientes con tratamiento previo con tiopurinas en el grupo de IFX, este hecho no alcanzó la significación estadística.
Características basales de los pacientes
| AZA (n=9) | IFX (n=15) | p | |
|---|---|---|---|
| Hombres/Mujeres (%) | 78/22 | 60/40 | ns |
| Edad (años) | 41 (33-62) | 40 (33-64) | ns |
| CU extensa (%) | 67 | 80 | ns |
| Fumador actual (%) | 22 | 27 | ns |
| Duración de la CU (meses) | 24 (2-144) | 26 (3-60) | ns |
| Tratamiento previo con tiopurinas (%) | 11 | 54 | ns |
| CU de comienzo (%) | 22 | 27 | ns |
| Actividad severa después de 3 días de tratamiento con corticoides intravenosos (%) | 0 | 50 | 0,038 |
| No respuesta a corticoides orales por el brote índice (%) | 22 | 60 | ns |
| PCR>30mg/l al inicio de los corticoides intravenosos (%) | 100 | 47 | 0,057 |
| Tiempo desde el inicio de los corticoides intravenosos y primera infusión de IFX (días) | 7,5 (7-7,5) | 7 (6-15) | ns |
| Tratamiento previo de rescate con ciclosporina (%) | 11 | 13 | ns |
| Seguimiento (días) | 270 (180-720) | 960 (330-1140) | ns |
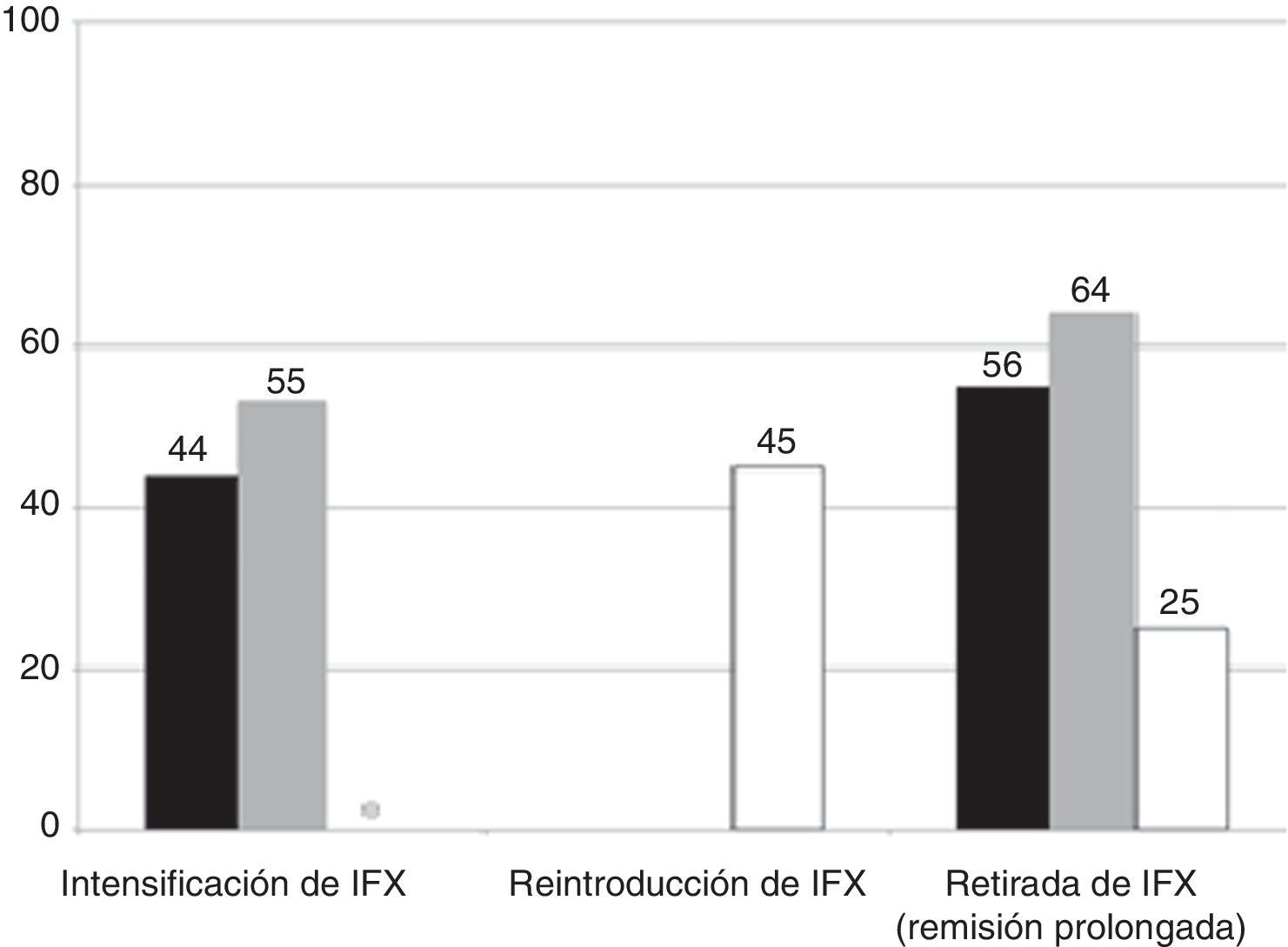
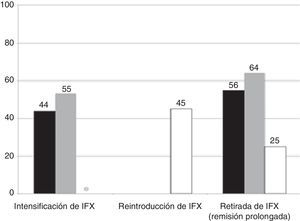
La evolución de la cohorte se muestra en la figura 1. Después de una mediana de seguimiento de 18 meses (intervalo intercuartílico, 7-35), los corticoides se retiraron en todos los pacientes. De los 9 pacientes que inicialmente siguieron tratamiento con AZA en monoterapia, en 4 (44%) tuvo que reintroducirse IFX, aunque ninguno de ellos requirió intensificación posterior; más aún, en un paciente IFX pudo suspenderse posteriormente por remisión prolongada. No se registraron colectomías en este grupo.
De los 15 pacientes que siguieron tratamiento de mantenimiento con IFX, este se debió intensificar en el 53% por pérdida secundaria de respuesta y en uno de los pacientes con tratamiento con IFX en monoterapia se le añadió posteriormente tratamiento con AZA. Durante el seguimiento, IFX se retiró por remisión sostenida en 9 pacientes (65%), después de una mediana de tiempo de 360 días desde la retirada de los esteroides (intervalo intercuartílico, 196-720). Cuatro pacientes de este grupo (16%) requirieron colectomía después de una mediana de tiempo de 203 días (intervalo intercuartílico, 196-401). La figura 2 muestra la necesidad de reintroducción de IFX, intensificación y/o retirada de IFX en los 2 grupos.
No se hallaron factores de riesgo asociados a colectomía (ni la exposición previa a tiopurinas, hábito tabáquico, gravedad de la actividad de la enfermedad al ingreso o al tercer día de corticoides intravenosos, el valor de PCR al ingreso o al tercer día de corticoides intravenosos, ser CU de inicio, tiempo de tratamiento con corticoides intravenosos o fracaso previo de corticoides orales). No se registró ninguna muerte en el período de estudio.
DiscusiónEn los pacientes con CU, la respuesta inadecuada a corticoides sigue siendo la principal indicación de colectomía, sobre todo en los 2 primeros años tras el diagnóstico de la enfermedad11. Esto puede deberse a 2 situaciones clínicas diferentes: CU corticodependiente que no responde a tiopurinas o brote agudo grave refractario a corticoides. En este contexto, en los brotes graves de CUCR, la ciclosporina fue la primera alternativa médica a la colectomía12. Más de una década más tarde, Järnerot y sus colaboradores demostraron que una sola infusión de IFX era superior al placebo para evitar la colectomía a corto plazo (3 meses), mostrando que podía ser una alternativa a la ciclosporina como tratamiento de rescate en los brotes graves corticorrefractarios. Los mismos autores publicaron posteriormente la evolución de los pacientes asignados a tratamiento con IFX y que habían evitado la colectomía a corto plazo, mostrando que hasta el 50% de los pacientes requerían colectomía en los 3 años posteriores13. Posteriormente, 2 cohortes independientes y de práctica clínica, mostraron que los regímenes de inducción de IFX con 2 o 3 dosis eran superiores a una dosis única de IFX para evitar la colectomía a medio plazo8,14. Finalmente, un estudio del grupo francés GETAID mostró que en los brotes graves de CUCR el tratamiento de inducción con 3 dosis de IFX era igual de eficaz que ciclosporina intravenosa para evitar la colectomía a corto plazo7. Sin embargo, la necesidad de administración intravenosa durante al menos 7 días consecutivos y de monitorización de los niveles de fármaco cada 48h, así como el riesgo de hipertensión arterial, hiperglucemia o alteraciones renales, hacen menos cómodo el tratamiento con ciclosporina y que la utilización de IFX en este contexto clínico sea más frecuente5.
En la práctica clínica habitual, el uso de ciclosporina suele restringirse a aquellos pacientes con un brote grave de CUCR no tratados previamente con tiopurinas, mientras que IFX suele usarse de forma indistinta en pacientes expuestos previamente o no a tiopurinas. No obstante, no existen estudios controlados sobre la mejor pauta de tratamiento de mantenimiento para los pacientes con brote grave de CUCR que responden a las 3 infusiones de inducción de IFX. En este grupo de pacientes «respondedores» nuestro estudio demostró una tasa de colectomía del 16%, realizándose todas las colectomías dentro del primer año de seguimiento. Nuestros resultados concuerdan con datos publicados recientemente de una serie danesa muy parecida (25% de colectomía en un total de 24 pacientes que habían recibido 3 o más infusiones de IFX para un brote grave corticorrefractario)14. De forma similar, un estudio italiano multicéntrico observó una tasa acumulada de colectomía del 9 y 15% a los 12 y 24 meses en pacientes con brote grave de CUCR que habían evitado la colectomía a corto plazo después de la inducción con 3 dosis de IFX15. Sin embargo, en los estudios mencionados no es posible identificar qué pacientes siguieron tratamiento de mantenimiento con AZA o con IFX y la tasa de colectomía en relación con el tratamiento de mantenimiento posterior no se halla disponible. En un estudio retrospectivo danés que incluyó un total de 211 pacientes con brote grave de CUCR, la tasa de colectomía era inferior en aquellos pacientes que siguieron tratamiento de mantenimiento con IFX comparado con aquellos pacientes en mantenimiento con tiopurinas o salicilatos (5, 10 y 15%, respectivamente), pero solamente el 31% de los pacientes había recibido las 3 dosis de inducción de IFX, sin poderse identificar el grupo al que pertenecían16. Contrariamente, en nuestro estudio, todas las colectomías se produjeron en el grupo de tratamiento de mantenimiento con IFX, pudiéndose explicar por diferentes motivos. En primer lugar, los pacientes que se mantuvieron con tratamiento con IFX probablemente era una población más refractaria como refleja el hecho de que tuvieran una mayor proporción de pacientes con actividad grave de la enfermedad en el momento de iniciar el tratamiento de rescate y una mayor proporción de pacientes en tratamiento previo con tiopurinas. En segundo lugar, el tratamiento de mantenimiento fue prescrito según el criterio del médico responsable, por lo que probablemente aquellos pacientes que presentaron una respuesta inicial parcial o más lenta siguieron con IFX tras la inducción. Finalmente, los pacientes que siguieron tratamiento de mantenimiento con AZA tuvieron la opción de reintroducción de IFX en caso de recaída o respuesta incompleta, mientras que los pacientes con IFX tuvieron menos (o no tuvieron) alternativas terapéuticas a la colectomía.
El objetivo principal de nuestro estudio era comparar el tratamiento de mantenimiento con AZA o IFX en pacientes respondedores a la inducción con IFX en términos de necesidad de tratamientos de rescate. Por ello, no solamente evaluamos la tasa de colectomía, sino también la necesidad de reintroducción de IFX en aquellos pacientes en los que se retiró después de responder a las 3 infusiones de inducción. Para ello, seleccionamos cuidadosamente nuestra población: pacientes que evitaron la colectomía precoz a los 3 meses (22 semanas después de la primera infusión de IFX) y en los que IFX se había iniciado como tratamiento de mantenimiento (primera infusión de mantenimiento administrada a la semana 14) o bien se había retirado y habían seguido tratamiento de mantenimiento con AZA en monoterapia. Lamentablemente, el diseño retrospectivo y el hecho de que el tratamiento de mantenimiento fuese prescrito a criterio del médico responsable, pueden producir un sesgo en nuestros resultados. De hecho, los pacientes que siguieron tratamiento de mantenimiento con IFX tenían una actividad grave de la enfermedad a los 3 días de corticoides intravenosos en una mayor proporción de casos que los pacientes que siguieron tratamiento con AZA en monoterapia. A pesar de esto, IFX debió reintroducirse durante el seguimiento en casi la mitad de los pacientes en tratamiento con AZA en monoterapia. Los resultados de nuestro estudio son difíciles de comparar con otros estudios previos porque habitualmente faltan datos respecto el tratamiento de mantenimiento seguido15–17. Gustavsson et al., en el estudio de seguimiento de los pacientes que no habían requerido colectomía a los 3 meses en el estudio inicial de Järnerot, mostraron que IFX tuvo que reintroducirse en 7 de 13 pacientes (54%) que iniciaron AZA después de una infusión única de IFX13. De forma similar, Mortensen et al. comunicaron la necesidad de reintroducción de IFX en 16 de 34 pacientes con brote severo de CUCR (47%) que evitaron la colectomía a corto plazo con una o 3 infusiones de IFX y que mantuvieron posteriormente tratamiento de mantenimiento con AZA o salicilatos14. A pesar de que existen claras diferencias entre las poblaciones de estos estudios y la nuestra, los datos parecen indicar que aproximadamente la mitad de los pacientes tratados con 3 infusiones de inducción de IFX tendrán que reintroducir IFX en el seguimiento. Por otro lado, los pacientes en mantenimiento con IFX necesitarán tratamiento de recate (por ejemplo colectomía) en solamente un 16% de los casos, a pesar de que inicialmente la respuesta a las 3 infusiones de inducción con IFX no sea espectacular y que presenten mayor actividad inflamatoria si se comparan con aquellos pacientes en tratamiento con AZA.
En conclusión, a pesar de que nuestro estudio presenta limitaciones importantes como su diseño restrospectivo, el pequeño tamaño de la muestra, la falta de datos endoscópicos o niveles de IFX, nuestros datos muestran que en pacientes con CUCR que evitan la colectomía a corto plazo con la pauta convencional de inducción de IFX (3 infusiones) parece recomendable seguir tratamiento de mantenimiento con IFX, incluso en los pacientes no expuestos previamente a tiopurinas, dada la necesidad de reintroducción de IFX si se sigue tratamiento con AZA en monoterapia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónE.D. ha recibido una beca de investigación (Beca d’intensificació 2013) de la Societat Catalana de Digestologia, que parcialmente ha subvencionado este estudio.
Conflicto de interesesM.M., T.L., E.C., E.G-P, J.G. y E.D. han trabajado como asesores, conferenciantes y han obtenido becas de MSD y AbbVie.