Un porcentaje importante de los pacientes con enfermedad inflamatoria intestinal requerirán tratamiento quirúrgico en un momento determinado de su evolución. Pese a los avances tecnológicos en el ámbito quirúrgico y anestésico, las cifras de morbilidad postoperatoria siguen siendo elevadas. Ello obliga a una profunda revisión de los protocolos perioperatorios que propicien unos mejores resultados quirúrgicos.
ObjetivoRealizar una puesta al día de todas las medidas tanto organizativas como terapéuticas que han demostrado ser eficaces a la hora de optimizar el periodo perioperatorio.
MétodosRevisión de la literatura relativa a morbilidad posquirúrgica, inmunosupresión, radiología, nutrición, equipos multidisciplinarios y protocolos de rehabilitación multimodal.
ResultadosEl manejo de la enfermedad inflamatoria intestinal, especialmente en el periodo perioperatorio, requiere de la acción coordinada de un equipo multidisciplinar con dedicación especial a esta dolencia. La decisión quirúrgica se debe consensuar con base en criterios clínicos reforzados con modernas técnicas de imagen. La sepsis, la desnutrición y el tratamiento prolongado con corticoides han demostrado ser los principales factores determinantes de morbimortalidad tras la cirugía. La presencia de un absceso requiere drenaje percutáneo seguido de cirugía. Los estados de desnutrición requieren una terapia nutricional intensiva antes de la cirugía y, en la medida de lo posible, se debe propiciar una reducción de la pauta de corticoides. La aplicación de los actuales protocolos de rehabilitación multimodal (ERAS) puede acortar el periodo de hospitalización tras la cirugía y ofrece una alternativa eficaz y factible de cara a mejorar el periodo postoperatorio y la calidad de vida de los pacientes.
An important percentage of patients with inflammatory bowel disease will require surgical treatment at some point. Despite technological progress in the surgical and anaesthetic fields, figures for postoperative morbidity are still high. This alone requires a comprehensive review of perioperative protocols that will allow better surgical results.
ObjectiveTo update all organisational and therapeutic measures that have proven to be effective when it comes to optimising the perioperative period.
MethodsReview of literature related to postoperative morbidity, immunosupression, radiology, nutrition, multidisciplinary teams and multimodal rehabilitation protocols.
ResultsManagement of inflammatory bowel disease, especially during the perioperative period, requires the coordinated action of a multidisciplinary team with a specific dedication to this condition. The surgical decision must be agreed upon clinical criteria and reinforced by means of modern imaging techniques. Sepsis, malnutrition and prolonged corticoid therapy have shown to be the principal determining factors for morbimortality after surgery. The presence of an abscess requires percutaneous drainage followed by surgery. Malnutrition states require aggressive nutritional therapy before the surgery and, whenever possible, the corticoid dosage should be reduced. Compliance with the current ERAS multimodal rehabilitation protocols can help shorten the admission period after surgery and offer an efficient and viable alternative for improving the postoperative period and the quality of life for patients.
Más de la mitad de los pacientes con enfermedad de Crohn (EC) requerirán una intervención quirúrgica en los 10 primeros años de la enfermedad, mientras que un 10-15% de los pacientes con colitis ulcerosa (CU) precisarán una colectomía a lo largo de su vida1. El escenario quirúrgico de estos pacientes se ha visto mejorado en los últimos años gracias a un notable desarrollo de las técnicas de imagen y a la aplicación de modernas tecnologías enfocadas a minimizar el impacto del traumatismo quirúrgico en el paciente con enfermedad inflamatoria intestinal (EII). Pese a todo, hoy en día las cifras de morbilidad postoperatoria siguen siendo elevadas. Mientras que la EC presenta un índice de complicaciones posquirúrgicas de entre un 5 y un 50% en función de los factores de riesgo2, en la CU, la colectomía total con ileostomía terminal está gravada con una morbilidad cercana al 40%3. La especial vulnerabilidad de estos pacientes a la agresión quirúrgica impone la necesidad de aplicar nuevos protocolos multidisciplinarios basados en evidencias científicas que permitan optimizar su estado clínico antes de la intervención quirúrgica. El objetivo de este artículo es revisar las medidas más eficaces que están dirigidas específicamente a reducir los factores que condicionan la morbilidad postoperatoria y que contribuyen a mejorar el pronóstico de los pacientes y, en definitiva, su calidad de vida.
Optimizar el escenario prequirúrgicoEl ámbito donde va a ser acogido el paciente tendrá un impacto decisivo en la evolución de su enfermedad. Existen evidencias de que en los centros hospitalarios de gran volumen donde se dispone de facultativos y enfermeras con especial dedicación a la EII se obtienen mejores resultados en el manejo clínico de los pacientes4,5.
La necesidad de un equipo multidisciplinarLa EII, y en especial la EC, tiene con frecuencia presentaciones clínicas complejas que incluyen fístulas, abscesos, estenosis, enfermedad perianal y afección extraintestinal, todo ello agravado en ocasiones por estadios de anemia, ferropenia, inmunosupresión y desnutrición. Esta complejidad requiere de un enfoque terapéutico multidisciplinar que agrupe todas las perspectivas en un plan individualizado para cada paciente, pero basado en un consenso y en evidencias clínicas. La transversalidad que ofrece un equipo multidisciplinar contribuye notablemente a optimizar los planes terapéuticos, a mejorar los resultados clínicos y a promover un mayor desarrollo científico del equipo.
Un equipo multidisciplinar debe estar constituido por especialistas en gastroenterología, cirugía y radiología, y personal de enfermería, todos ellos con especial dedicación a la EII. El equipo puede complementarse puntualmente con la colaboración de reumatólogos, dermatólogos, nutricionistas e investigadores básicos o clínicos con interés en la EII. De entre todos los mencionados destacamos el papel del personal de enfermería. Disponer de una enfermera con dedicación exclusiva a la EII constituye, sin duda, uno de los grandes avances en el enfoque multidisciplinar de esta enfermedad. La posibilidad de que el paciente se ponga en contacto telefónico con dicha persona facilita su acceso fácil y ordenado a los diversos especialistas y a las pruebas diagnósticas, posibilita un control más real de la adherencia del paciente a su tratamiento, contribuye a la correcta adaptación del enfermo a la metodología de los ensayos clínicos y, sobre todo, le ofrece una cercanía que facilita poder transmitir en confianza los aspectos sociales y familiares que se han visto alterados por la enfermedad.
Un equipo multidisciplinar debe reunirse al menos una vez por semana para presentar los casos que requieren mayor atención por su complejidad o porque en un momento determinado de su evolución precisan tratamiento quirúrgico. Las sesiones clínicas favorecen la agilidad del proceso terapéutico, garantizan al paciente un tratamiento consensuado y enriquecen la experiencia de sus asistentes.
La importancia de la informaciónEl carácter crónico de la EII, la diversidad en sus presentaciones clínicas, la variabilidad en las respuestas a la medicación y, concretamente, la irrupción de la cirugía en un momento evolutivo de la enfermedad refuerzan la importancia que tiene la información y la discusión conjunta de las opciones terapéuticas en el grado de adherencia del paciente a su tratamiento6. Junto a la evidente erradicación de los síntomas que le proporcionará la cirugía subyace el temor a un daño en su imagen corporal o a la irrupción de nuevas situaciones que comprometan su calidad de vida, como la incontinencia o la necesidad de convivir con una ostomía. En este contexto, el diálogo con el cirujano debe ser claro y franco. El paciente debe conocer que el riesgo de fallo de sutura en la cirugía de la EC oscila entre un 2 y un 6%2,7, y que con una media de deposiciones de entre 5 y 7, las complicaciones más frecuentes de los reservorios ileonales son la reservoritis (40-50%), los fallos de sutura (7%), la obstrucción (13-25%), la fístula reservorio-vaginal (3-15%) y la estenosis de la sutura (16%)8. En el caso particular de mujeres jóvenes portadoras de un reservorio, la información debe ser lo suficientemente clara como para ayudarlas a tomar la decisión de afrontar un embarazo. Cuando la probabilidad de realizar una ostomía en el acto quirúrgico es elevada, el asesoramiento por parte de enfermeras estomaterapeutas es determinante para ofertar seguridad al paciente.
La trascendencia del diagnóstico por imagenEl objetivo de las técnicas de imagen es confirmar el diagnóstico de la EII, localizar las lesiones, evaluar su extensión y severidad, definir la presencia de actividad inflamatoria y también evaluar las posibles complicaciones extraintestinales, contribuyendo en aquellas situaciones en que sea necesario asentar la indicación quirúrgica. Por tanto, las técnicas de imagen son necesarias no solo para en el diagnóstico inicial, sino también para el seguimiento de la enfermedad.
Disponemos en la práctica clínica de 3 técnicas radiológicas: la ecografía, la enterotomografía computarizada y la enterorresonancia magnética.
Las principales ventajas de la ecografía son su disponibilidad en todos los hospitales, su bajo costo y la información que proporciona en tiempo real. Sin embargo, tiene una serie de limitaciones, como son la obesidad (poco habitual en estos enfermos), la dificultad de valorar la afectación del intestino proximal y de la región anorrectal, y, finalmente, que se trata de una técnica dependiente del explorador y que precisa cierta curva de aprendizaje. La ecografía permite detectar y valorar el engrosamiento mural. El doppler permite diferenciar entre engrosamiento mural agudo y engrosamiento mural crónico, y, por tanto, es una herramienta útil para la valoración de la respuesta al tratamiento. Además, con sondas de alta frecuencia es posible observar complicaciones transmurales como las fístulas (trayectos hiperecogénicos o hipoecoicos lineales que atraviesan las capas en profundidad), la afectación de la grasa mesentérica, la estenosis y los abscesos.
Las técnicas enterográficas con tomografía computarizada (TC) o resonancia magnética (RM) han demostrado ser muy superiores para la valoración global de todas las asas intestinales y del colon, por aportar información fundamental de la enfermedad transmural y extramural y de las complicaciones que pueden condicionar un tratamiento quirúrgico (obstrucciones, fístulas, abscesos)9.
En los últimos años, las técnicas enterográficas por RM han demostrado una precisión diagnóstica similar a la de la TC, con la ventaja de evitar el uso de radiaciones ionizantes, factor muy importante por tratarse de pacientes habitualmente muy jóvenes.
La valoración mediante TC/RM de la enfermedad intestinal activa puede influir significativamente en el manejo del paciente. Ambas técnicas permiten valorar tanto alteraciones parietales como extramurales (tabla 1).
Signos y hallazgos de tomografía computarizada/resonancia magnética en la enfermedad inflamatoria intestinal
| Signos parietales | Hallazgos extramurales |
|---|---|
| Engrosamiento mural | Alteraciones en el tejido fibrograso mesentérico |
| Alteraciones de la mucosa | Vascularización mesentérica (signo del peine) |
| Patrón de realce | Ganglios linfáticos locales |
| Abscesos o fístulas |
Todos estos hallazgos nos permiten clasificar la enfermedad en subtipos: inflamatorio-activo, penetrante-fistulizante, estenosante-fibroestenótico y reparativo-regenerativo10.
La clasificación por subtipos es útil para determinar si el paciente se beneficiará de tratamiento médico o quirúrgico.
La combinación de todas las técnicas (TC/RM/ecografía) nos permite una correcta valoración inicial y de las complicaciones, así como de la respuesta al tratamiento.
El informe radiológico debe incluir la descripción de la localización y la extensión de los segmentos intestinales afectados, la distribución parcheada o continua, y la presencia de complicaciones extraparietales que pueden alterar el tratamiento.
Reducir la sepsis preoperatoriaEn la literatura la presencia de un absceso complicando la EC oscila entre un 10 y un 30%11. Aunque históricamente el tratamiento de elección de los abscesos era eminentemente quirúrgico, con la introducción del drenaje percutáneo mediante control radiológico se ha conseguido evitar la cirugía en un 14 a un 85% de los casos12. La falta de estudios prospectivos y aleatorizados comparando la cirugía inmediata con el drenaje percutáneo hace que la literatura ofrezca resultados muy controvertidos13,14. Ante la disparidad de datos, hoy en día se tiende a considerar el drenaje por punción como un puente hacia la cirugía y no como un tratamiento definitivo. Ello permitiría, una vez reducido el foco séptico, optimizar el estado del paciente mediante antibióticos y la retirada progresiva de los corticoides y la nutrición parenteral. Mediante esta pauta preoperatoria se consiguen cifras de morbilidad total de 18% y de complicaciones con grado>3 (Clavien-Dindo) de alrededor del 5%15.
Junto a la punción percutánea, el tratamiento antibiótico es esencial en el manejo de la sepsis preoperatoria. El uso de antibióticos de amplio espectro, en función del resultado del cultivo, es obligatorio, y en ausencia del mismo, el tratamiento debe cubrir gérmenes gramnegativos y anaerobios.
Tratamiento intensivo de la desnutrición preoperatoriaLa EC conlleva, de por sí, un alto índice de desnutrición en pacientes no hospitalizados, entre los cuales un 20-40% refieren pérdidas de peso. Dicho porcentaje se eleva al 70-80% en los pacientes hospitalizados16. Cuando el curso de la enfermedad impone el tratamiento quirúrgico, generalmente el paciente ha empeorado su estado nutricional. Hoy en día existen evidencias suficientes acerca del impacto negativo que conlleva la desnutrición en el curso postoperatorio. Un índice de masa corporal inferior a 18Kg/m2 o unas cifras de albúmina inferiores a 30g/L conllevan un aumento sustancial del riesgo de complicaciones quirúrgicas4,17. De entre ellas, la sepsis (fallo de sutura, abscesos y fístulas enterocutáneas) constituye el escenario más frecuente y el que mayor impacto tiene en la evolución del paciente. En un estudio retrospectivo sobre 566 intervenciones quirúrgicas en las que se practicaron más de 1.000 anastomosis, las cifras preoperatorias de albúmina inferiores a 30g/L se asociaron de forma significativa a un mayor índice de sepsis postoperatoria en comparación con niveles superiores2. Existe un consenso generalizado acerca de la necesidad de un soporte nutricional preoperatorio, bien en forma de nutrición enteral, cuando ello sea posible, bien en forma de nutrición parenteral total en pacientes con EC que refieran una pérdida de peso superior al 10% en los últimos 6 meses o un índice de masa corporal inferior a 18Kg/m2 y/o cifras de albúmina sérica inferiores a 30g/L18. Por lo que respecta a la CU, existen escasos datos en la literatura que hagan referencia al impacto del soporte nutricional preoperatorio. Ello puede deberse al hecho de que la mayor parte de los pacientes con CU que requieren cirugía se enmarcan en situaciones de urgencia.
¿Es importante la inmunosupresión antes de la cirugía?La mayor parte de los pacientes llegan a la cirugía con una pauta variable de inmunosupresión. El impacto de los diferentes fármacos (aminosalicilatos, corticoides, inmunomoduladores y biológicos) en la morbimortalidad posquirúrgica ha sido objeto de numerosos estudios, algunos de ellos con resultados controvertidos. El uso de corticoides ha demostrado ser un factor predictivo de mortalidad y de complicaciones infecciosas en pacientes con EII19. En el escenario postoperatorio, un metaanálisis publicado en 2008 evidenció de forma contundente que los corticoides están asociados con un incremento de las complicaciones generales e infecciosas y que dicho riesgo aumenta cuando el paciente está recibiendo dosis superiores a 40mg de corticoides al día20. Durante la cirugía se produce un sobreestímulo del eje hipotálamo-hipófisis-adrenocortical que se traduce en un aumento del cortisol circulante. Cuando dicho eje queda suprimido por un tratamiento prolongado (3 semanas) con corticoides a dosis de 40mg/día, se precisará la administración de una pauta de estrés postoperatoria que evite la insuficiencia adrenal. Es en este aspecto donde existe cierta controversia acerca de la necesidad de administrar altas dosis o dosis medianas. Lo cierto es que si el paciente ha estado recibiendo dosis de entre 5 y 10mg/día, no requerirá terapia sustitutiva postoperatoria. La duda existe en aquellos enfermos cuya dosis preoperatoria se sitúa entre 10 y 30mg/día21.
Con los datos de los que se dispone en la actualidad no existe evidencia firme de que el uso de fármacos anti-TNF conlleve un aumento de la morbimortalidad postoperatoria21,22.
Los pacientes tratados con aminosalicilatos requieren la interrupción del tratamiento un día antes de la cirugía, y por lo que respecta a los fármacos tiopurínicos, no existen evidencias de que su uso aumente la morbilidad posquirúrgica, pese a existir un riesgo innegable de mielotoxicidad. Tampoco existen evidencias con el uso de metotrexato, si bien en pacientes con sepsis previa es recomendable suspender el tratamiento una semana antes de la cirugía.
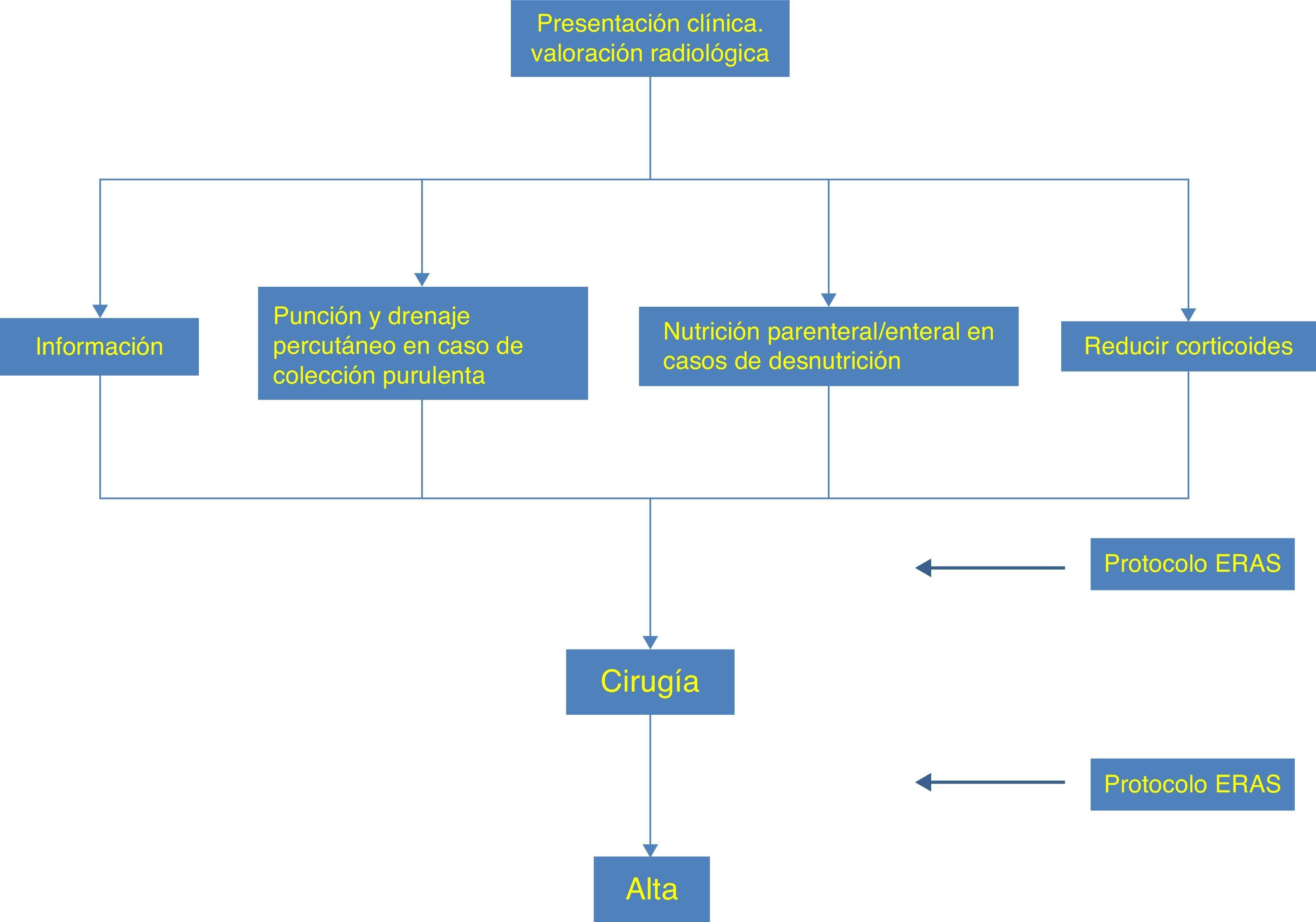
Optimizar el escenario quirúrgico (fig. 1)La expresión enhanced recovery after surgery (ERAS) hace referencia a un programa de «rehabilitación multimodal postoperatoria», también conocido en la literatura científica con el término anglosajón fast track surgery, que fue acuñado y puesto en escena de forma pionera en Dinamarca a principios de esta década. Conceptualmente se trata de la aplicación de una serie de normas basadas en evidencias que persiguen reducir la respuesta del paciente al estrés quirúrgico, acelerar su recuperación, reducir las complicaciones postoperatorias, acortar el tiempo de hospitalización, disminuir los costos sanitarios y todo ello sin comprometer la seguridad del paciente. Durante los últimos años diversos ensayos clínicos y estudios de cohorte han empleado diferentes protocolos ERAS evaluando su impacto en términos de días de hospitalización, morbimortalidad postoperatoria e índice de readmisiones. En la actualidad se dispone de diversas guías de práctica clínica para la aplicación del ERAS en diversos ámbitos de la cirugía digestiva. De todas ellas, la que hace referencia a la cirugía colorrectal23 es la que contiene más elementos aplicables a la cirugía de la EII y que enumeramos a continuación (fig. 1):
1. Una correcta información acerca del procedimiento quirúrgico contribuye a reducir el miedo y la ansiedad del paciente y facilita su recuperación, acortando el periodo de hospitalización.
2. Los pacientes adictos al tabaco deberían abandonarlo al menos 4 semanas antes de la cirugía24.
3. Los pacientes con EC candidatos a resección ileocecal no precisan preparación intestinal alguna y, por lo que respecta a la cirugía de la colitis de Crohn, no existen evidencias que avalen dicha práctica.
4. La mayor parte de las guías anestésicas recomiendan hoy en día respetar un ayuno de líquidos de 2h y de 6 para los sólidos. La ingesta preoperatoria de hidratos de carbono en forma de una solución de maltodextrinas (12,5%) contribuye a frenar la resistencia postoperatoria a la insulina, mejora el balance nitrogenado, preserva la masa muscular magra y facilita la recuperación postoperatoria, a la vez que reduce la sensación de hambre y ansiedad antes de la cirugía25.
5. La clásica premedicación anestésica en forma de sedante y ansiolíticos se considera hoy en día en desuso.
6. Los pacientes con EII tienen un aumento del riesgo de trombosis venosa profunda y tromboembolismo pulmonar. La propia enfermedad induce un estado de hipercoagulabilidad, que se exacerba por el uso de corticoides, la desnutrición, la inmovilidad y las sucesivas reintervenciones en la cavidad abdominal. La profilaxis tromboembólica comprende el uso de medias compresivas, la compresión neumática intermitente y una dosis diaria de heparina de bajo peso molecular extendida 28 días tras la cirugía26,27.
7. La profilaxis antiinfecciosa comprende, por una parte, la asepsia del campo quirúrgico mediante solución alcohólica de clorhexidina, y por otra, una única dosis de antibiótico que cubra gérmenes anaerobios y gramnegativos, administrada 30min antes de la cirugía y repetida cada 2h en caso de que se prolongue la intervención.
8. El protocolo anestésico debe tener como objetivos, en primer lugar, el control hemodinámico del paciente mediante una terapia dirigida de fluidos que incorpora el uso de coloides y restringe el exceso de cristaloides28; en segundo lugar, el control del estrés quirúrgico mediante un control efectivo del dolor que incluye un bloqueo regional minimizando la dosis de opioides; finalmente, una correcta ventilación del paciente23. Así mismo, el mantenimiento de la temperatura corporal por encima de 36°C es imperativo, puesto que mejora el umbral de dolor postoperatorio y previene infecciones de la herida, hemorragias, escalofríos y complicaciones cardiacas.
9. Cirugía mínimamente invasiva. El diferente grado de complejidad de los pacientes con EII cuando llegan a la cirugía hace que los escasos estudios comparativos entre la cirugía abierta y laparoscópica se ciñan a pacientes candidatos en su mayoría a resecciones ileocecales de baja complejidad. A tenor de los resultados que aporta la literatura, se puede afirmar que la cirugía laparoscópica puede reducir la estancia hospitalaria y los requerimientos analgésicos, mejorando a corto y largo plazo la imagen corporal del paciente29–32. En cuanto a la morbilidad posquirúrgica, los resultados comparativos que aporta la literatura son muy dispares. En resumen, la cirugía laparoscópica se puede considerar una opción segura y viable, que en el contexto de un adecuado programa de rehabilitación multimodal podría proporcionar excelentes resultados.
10. Se debe evitar el uso de sonda nasogástrica de descompresión. De igual forma, y a excepción de las situaciones que precisan el drenaje de la cavidad séptica, el uso rutinario de drenajes en la cirugía colorrectal no aporta ningún beneficio. Por lo que respecta a la sonda urinaria, se recomienda su retirada entre el primer y segundo día del postoperatorio.
11. El íleo postoperatorio constituye una de las complicaciones más frecuentes de la cirugía intestinal. Los sistemas de prevención hoy en día incluyen el uso preferencial del bloqueo epidural, evitar la sobrecarga hídrica en las pautas de fluidoterapia postoperatoria, evitar la sonda nasogástrica y favorecer el peristaltismo con fármacos como Alvimopan o aconsejando al paciente que mastique chicles33,34.
12. Por lo que respecta a la analgesia postoperatoria, el catéter epidural con dosis bajas de anestésicos y opioides proporciona excelentes resultados en la cirugía abierta.
13. Se debe reiniciar la ingesta oral inmediatamente después de la recuperación anestésica y estimular al paciente para iniciar una movilización precoz desde el primer día postoperatorio.
14. Los resultados de estos protocolos deben ser auditados periódicamente.
Constituyen contraindicaciones para la aplicación del fast track la edad avanzada, la cirugía de urgencia, los trastornos psiquiátricos, la inmovilidad, la falta de soporte social y el alcoholismo.
Prevención de la recurrencia postoperatoria de la enfermedad de CrohnLa recidiva tras la resección quirúrgica de la EC es casi universal. Sin embargo, la gravedad de la recidiva es muy variable. Por ello, se han considerado diferentes estrategias para prevenir la recurrencia postoperatoria basadas en aquellos factores de riesgo que de forma más consistente se han relacionado con su aparición. Entre ellos cabe destacar el mantenimiento del hábito tabáquico, el patrón fistulizante, la resección quirúrgica previa y la plexitis mientérica35. Para que se produzca la recidiva endoscópica es preciso el tránsito fecal, por lo que los pacientes portadores de una ileostomía terminal tienen un menor riesgo de recidiva36.
Se considera que el tratamiento farmacológico debería iniciarse precozmente, dentro de las 2 semanas posteriores a la cirugía, y debería mantenerse al menos 2 años26. Los fármacos que han demostrado superioridad frente a placebo en la prevención de la recurrencia postoperatoria de la EC son la mesalazina, los nitroimidazoles, las tiopurinas y los anti-TNF. Un reciente metaanálisis evaluó diferentes estrategias de prevención de mesalazina (RR 0,60; IC 95% 0,37-0,88), antibióticos (RR 0,26; IC 95% 0,08-0,61), inmunosupresores (RR 0,36; IC 95% 0,17-0,63), combinación de inmunosupresores con antibióticos (RR 0,11; IC 95% 0,02-0,51) y anti-TNF (RR 0,04; IC 95% 0,00-0,14). En cuanto al riesgo de recidiva endoscópica, la mesalazina no fue superior a placebo37.
Así pues, los fármacos más eficaces en reducir el riesgo de recidiva son los anti-TNF, cuyo uso está condicionado por un mayor coste. Por ello, se aconseja reservar el tratamiento anti-TNF para pacientes con factores de alto riesgo de recidiva postoperatoria. En cambio, en aquellos de bajo riesgo, debería considerarse el tratamiento con tiopurínicos (superiores a mesalazina) con o sin nitroimidazólicos, realizando una vigilancia endoscópica estrecha (primer control a los 6 meses)26.
ConclusiónLa fase perioperatoria de la EII requiere la acción conjunta de un equipo multidisciplinar que implemente protocolos terapéuticos enfocados a optimizar el estado general del paciente y a minimizar el impacto que determinados factores, como la desnutrición, la sepsis y la corticodependencia, ejercen en la morbilidad postoperatoria. A falta de evidencias científicas, se hace necesario evaluar prospectivamente la eficacia de los procesos de rehabilitación multimodal (ERAS) en el curso postoperatorio de los pacientes con EII.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.