Presentamos el caso de un varón de 24 años con clínica de 2 meses de evolución de deposiciones diarreicas con sangre y moco, asociado a tenesmo y urgencia, así como proctalgia, dolor abdominal y cuadro de poliartralgias. Orientado inicialmente como brote de colitis ulcerosa, se pautó tratamiento con corticoides y mesalazina. Un mes más tarde acudió a nuestra consulta por persistencia de dicha sintomatología a pesar del tratamiento y tras una exhaustiva anamnesis el paciente confirmó relaciones anales sin protección, por lo que se solicitaron serologías y se repitió la colonoscopia con toma de muestras para microbiología y anatomía patológica, que confirmaron el diagnóstico de proctitis por Chlamydia trachomatis.
We report the case of a 24-year old male with a 2-month history of diarrheal stools with blood and mucus, urgency associated with tenesmus, anal pain, abdominal pain and polyarthralgia. Initially targeted as a flare-up of ulcerative colitis, the patient was prescribed treatment with corticosteroids and mesalazine. A month later he came to our clinic due to the persistence of such symptoms despite treatment, and after a thorough anamnesis the patient confirmed unprotected anal sexual contact, so serological tests were requested and a colonoscopy was repeated with sampling for microbiology and histology. This confirmed the diagnosis of Chlamydia trachomatis proctitis.
La proctitis es un proceso inflamatorio que afecta a la mucosa del recto, asociándose muy frecuentemente con la enfermedad inflamatoria intestinal (EII). No obstante, puede ser secundaria a otras causas, como proctitis por radioterapia, proctitis isquémica e infecciones, que pueden afectar de forma global a todo el colon, como Escherichia coli, Shigella, Campylobacter y Clostridium difficile, o más localmente al recto, como Neisseria gonorrhoeae (N. gonorrhoeae), Chlamydia trachomatis (C. trachomatis), Treponema pallidum o virus del herpes simple. Estas últimas se incluyen entre las enfermedades de transmisión sexual (ETS). De estos, C. trachomatis es el segundo agente bacteriano que causa proctitis con más frecuencia, seguido de N. gonorrhoeae. La infección rectal por C. trachomatis suele darse en pacientes homosexuales, secundario al sexo anal receptivo, y en estos casos es mandatorio realizar un despistaje para el virus de la inmunodeficiencia humana (VIH), ya que la presencia de proctitis aumenta la posibilidad de infección por VIH1. Dado que la presentación clínica y las características endoscópicas de la proctitis por C. trachomatis son similares a la afectación rectal en la EII, ambos diagnósticos se pueden confundir2.
Caso clínicoExponemos el caso de un varón de 23 años, con antecedentes de diabetes mellitus tipo i. Presentaba una historia de 2 meses de evolución de deposiciones diarreicas con sangre y moco asociado a tenesmo y urgencia defecatoria, así como dolor anal, dolor abdominal y cuadro de poliartralgias. Ante sospecha inicial de EII se realizó una colonoscopia, hallando una lesión mamelonada de aspecto inflamatorio, con ulceraciones superficiales cubiertas por fibrina en recto, con el resto de la exploración hasta ciego sin nuevas lesiones. Ante estos hallazgos, se orientó el caso como probable proctitis ulcerosa y se inició tratamiento con corticoides orales y mesalazina tópica.
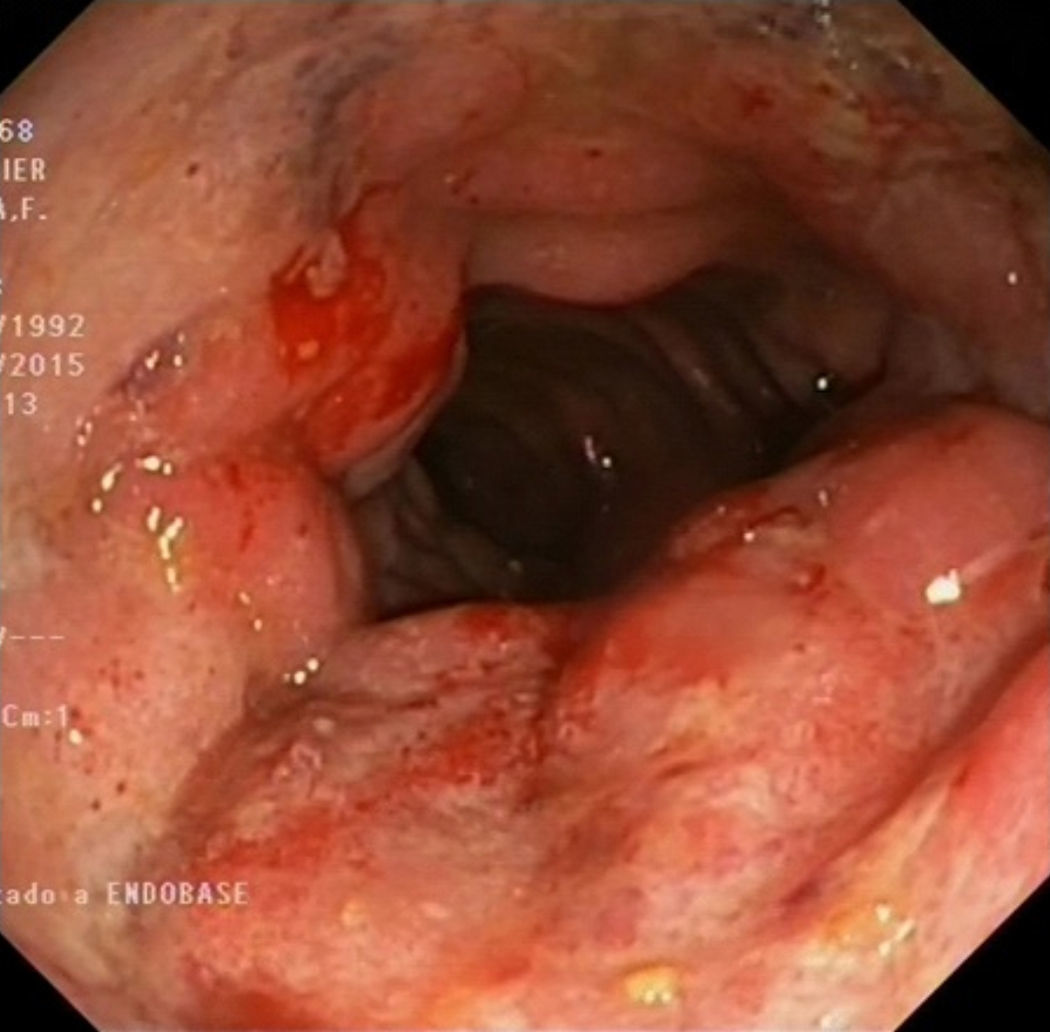
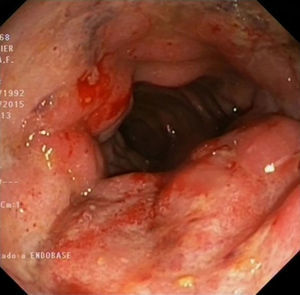
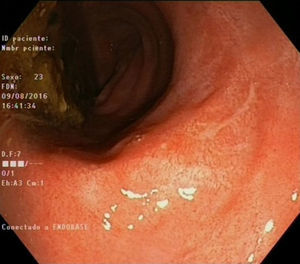
Un mes más tarde el paciente acudió a nuestra consulta con persistencia de la sintomatología y pérdida de 8kg de peso, y tras una exhaustiva anamnesis el paciente confirmó mantener relaciones anales sin protección, con inicio de la sintomatología 3 meses después del último contacto sexual de riesgo. La exploración abdominal era anodina, aunque en el tacto rectal destacaba una lesión de consistencia elástica, dolorosa a la palpación, sin signos de sangrado. Con esta información se realizó analítica con serologías para ETS y nueva rectoscopia con biopsias para anatomía patológica y muestras para microbiología. La rectoscopia reveló una úlcera extensa con fondo muy fibrótico y márgenes mamelonados, que abarcaba 2 tercios de la circunferencia de la ampolla rectal (fig. 1), indicativa de proceso infeccioso por ETS, que se confirmó con ADN positivo para C. trachomatis en exudado rectal y serología con IgM e IgG positivos para dicho agente. El resto de las serologías, incluido el VIH, fueron negativas. El resultado de la anatomía patológica fue de proctitis inespecífica, hallando alteración arquitectural en la mucosa rectal a expensas de un intenso infiltrado inflamatorio linfoplasmocitario, con disminución de la mucosecreción y presencia de neutrófilos afectando al epitelio críptico, con ausencia de granulomas.
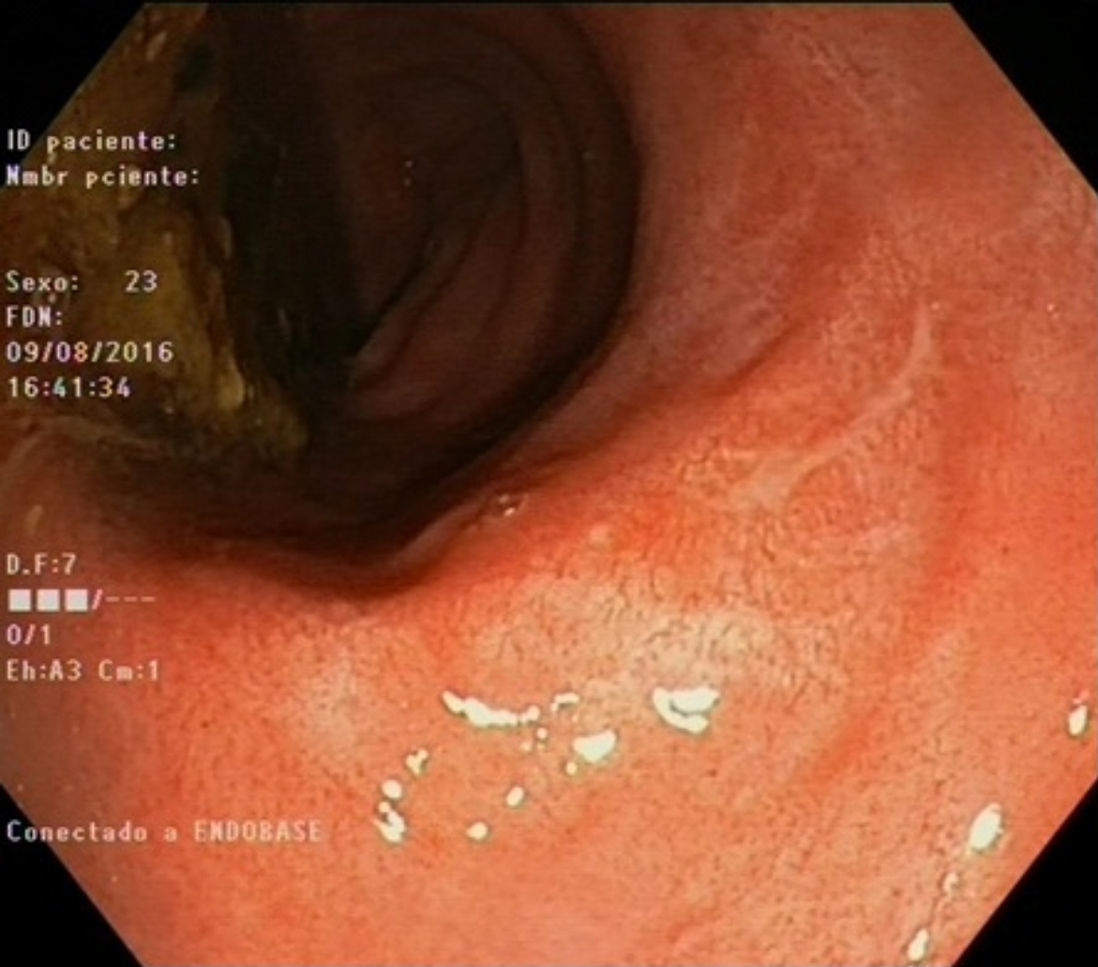
Ante el diagnóstico de probable linfogranuloma venéreo (LGV), se suspendió el tratamiento instaurado y se inició antibioticoterapia con doxiciclina 100mg/12h durante 21 días, pauta antibiótica de elección para el tratamiento de dicha infección. Asimismo se invitó a que los contactos sexuales del paciente acudieran a una evaluación médica para despistaje y tratamiento de una posible infección. A pesar de una mejoría clínica inicial, el paciente presentó recidiva de los síntomas tras la finalización del antibiótico, con persistencia de una úlcera superficial de 30mm en la rectoscopia de control, por lo que precisó 2 ciclos más de tratamiento: el primero con la misma pauta y el segundo con eritromicina 500mg/6h durante 21 días por falta de mejoría previa, con cese sintomático posterior. La rectoscopia realizada 4 semanas después de finalizar la última tanda de tratamiento reveló una lesión anal longitudinal, compatible con cicatriz, sin datos de inflamación (fig. 2), confirmada por histología.
DiscusiónC. trachomatis es una bacteria gramnegativa, parásito intracelular obligado, con varios genotipos que pueden causar distintos tipos de proctitis. El genotipo A-K es la forma más habitual de infección y suele cursar de forma asintomática o con un cuadro clínico leve, con prurito anal, emisión de moco y dolor perianal. La rectoscopia en estos casos solo evidencia leve eritema, edema y friabilidad de la mucosa rectal. En cambio, el genotipo L o LGV (serotipos L1, L2 y L3) produce más clínica, causando brotes de proctitis en Europa en los últimos años, en especial entre población homosexual, principalmente con VIH. Clásicamente, la clínica se ha descrito en 3 estadios: la lesión primaria, frecuentemente úlcera anal, tiene lugar en el sitio de inoculación entre 3 y 12 días después del contacto sexual en forma de erosión o reacción inflamatoria no dolorosa, que suele pasar desapercibida. El segundo estadio ocurre, generalmente, tras la curación de la úlcera inicial, entre 2 y 6 semanas después del contacto sexual, y puede manifestarse como un síndrome inguinal, forma típica de presentación, con adenopatías inguinales dolorosas que pueden ulcerarse, o como un síndrome rectal, con presencia de exudado mucopurulento y rectorragia, con tenesmo y proctalgia intensa, asociado a síntomas sistémicos como fiebre, anorexia y poliartralgias, lo que complica el diagnóstico diferencial con la EII. Si no se realiza un correcto diagnóstico y tratamiento, en el tercer estadio se producen cambios inflamatorios crónicos y destrucción tisular que pueden provocar estenosis o fístulas, mimetizando una enfermedad de Crohn3,4.
La proctitis y proctocolitis son actualmente las manifestaciones clínicas más frecuentes en la infección por LGV, especialmente en pacientes homosexuales, con síntomas que recuerdan a los de la EII, siendo su afectación inguinal clásica cada vez más infrecuente. La poliartritis, asociada o no a conjuntivitis, se ha descrito en varios casos, afectando principalmente a muñecas, tobillos, codos y rodillas, lo que también coincide con la EII4,5.
Las imágenes endoscópicas de la proctitis por C. trachomatis presentan una gran variedad de lesiones rectales, desde una mucosa indurada, edematosa, eritematosa y friable hasta úlceras profundas o granulomas con exudado mucopurulento. Estos hallazgos son inespecíficos y difíciles de diferenciar de la EII. En estadios avanzados la proctitis por LGV puede desarrollar inflamación transmural con fístulas y zonas estenóticas, indistinguibles de la enfermedad de Crohn2,5. El estudio histológico, aunque también puede ser inespecífico, permite encontrar características que pueden ayudar a diferenciar ambas entidades. Así, en las proctitis producidas por ETS es frecuente un mínimo daño inflamatorio en las criptas, asociado a ausencia de eosinofilia en la mucosa. En cambio, en la EII predominan los datos inflamatorios crónicos activos en las criptas, asociados a una importante alteración estructural, así como aumento en el recuento de células de Paneth y eosinofilia en la capa mucosa6. No obstante, la mejor técnica diagnóstica es la identificación directa de C. trachomatis en tejido o en los fluidos del paciente o técnicas de biología molecular mediante PCR. La serología también puede ser de ayuda en los casos en que no se han podido conseguir muestras o no se dispone de técnicas de PCR5.
El tratamiento de elección es la doxiciclina por vía oral, a dosis de 100mg cada 12 h durante 21 días. La duración del tratamiento de 3 semanas se debe a que la infección por LGV es más invasiva y con mayor dificultad para su erradicación con respecto a infecciones genitales no complicadas, que suelen responder a una semana de tratamiento. Otras alternativas posibles son azitromicina 1g en dosis única semanal durante 3 semanas o eritromicina 500mg cada 6 h durante 21 días. La respuesta al tratamiento antibiótico suele ser completa en 3-6 semanas, con desaparición de las lesiones en la gran mayoría de los pacientes, aunque algunos casos pueden tener una resolución tardía de los síntomas y pueden beneficiarse de ciclos prolongados de tratamiento. En caso de enfermedad complicada con fístulas o estenosis anales, tras el tratamiento antibiótico se podría valorar la necesidad de intervención quirúrgica o de drenaje y aspiración de los ganglios linfáticos4,7.
En conclusión, la proctitis por C. trachomatis puede confundirse clínica y endoscópicamente con una EII. Los clínicos deben recordar este agente como posible causante de proctitis o proctocolitis, en especial en varones homosexuales, incidiendo en una correcta anamnesis sobre posibles factores de riesgo sexuales. El diagnóstico y el tratamiento son importantes, ya que la falta de un adecuado tratamiento puede conducir a la formación de granulomas, estenosis, fístulas y abscesos perirrectales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesSe declara que no han existido conflictos de interés por parte de ningún autor en la elaboración de este documento.