La deficiencia de yodo en mujeres gestantes puede tener repercusiones importantes e irreversibles en el desarrollo y la maduración del cerebro fetal, incluso desde las primeras semanas del embarazo.
ObjetivoEl objetivo de nuestro estudio es conocer el estado nutricional de yodo de las mujeres gestantes de nuestra área sanitaria, establecer posibles relaciones con factores alimentarios, conocer su repercusión en la función tiroidea y establecer pautas y recomendaciones de tratamiento.
Pacientes y métodoSe estudió a 164 mujeres gestantes en sus primeras semanas de gestación. Se determinó la yoduria en muestras de orina de 24 h y se recogieron datos antropométricos, de función tiroidea y dietéticos mediante una encuesta alimentaria en forma de recordatorio semanal, todo ello antes del inicio de suplementación con preparados farmacológicos de sales de yodo.
ResultadosLa mediana [intervalo intercuartílico] de yoduria obtenida fue de 92 [71-139] μg/l. El 78% de los valores de yoduria se halla por debajo de los 150 μg/l. Hubo mayor proporción de mujeres yodosuficientes entre las que consumían sal yodada.
ConclusionesNos encontramos en un área sanitaria con yododeficiencia en el 78% de las mujeres embarazadas. El consumo de sal yodada se asocia a suficiencia de yodo e incrementa los valores de yoduria. Se deberían implementar medidas para aumentar el consumo de sal yodada en la población. La pauta de suplementos farmacológicos de yodo en gestantes desde el inicio del embarazo debería ser una medida sistemática.
Iodine deficiency in pregnant women may result in substantial and irreversible impairment in fetal brain development, even from the first few weeks of pregnancy.
ObjectiveTo assess the nutritional iodine status of pregnant women in our health area and its relationship with dietary factors and thyroid function and to suggest treatment guidelines.
Patients and methodA study in 164 pregnant women in early pregnancy was carried out. Data on urinary iodine concentrations were gathered from 24-hour urine samples. Data on anthropometric parameters and thyroid function were included. Information on dietary habits in the previous week was collected using a nutritional questionnaire. All data were obtained before iodine supplements were administered.
ResultsThe median urinary iodine concentration was 92 [p25-p75 range, 71-139] μg/l. Seventy-eight percent of urinary iodine values were under 150 μg/l. Women who took iodized salt had higher levels of urinary iodine concentrations than women without iodized salt intake.
ConclusionsSeventy-eight percent of pregnant women in our health area were iodine deficient. Iodized salt intake is related to iodine sufficiency and to increased urinary iodine concentrations. Measures to increase intake of iodized salt among the population should be implemented. Iodized salt supplements should be systematically prescribed in women from the beginning of pregnancy.
La importancia de las hormonas tiroideas en el desarrollo cerebral del ser humano, ya desde las fases de embrión, es una cuestión demostrada por múltiples estudios. Dichas hormonas desempeñan un papel trascendente en intrincados procesos de diferenciación y organización neuronal en zonas como el hipocampo o el cerebelo1, 2. El hecho de detectar T4 (tiroxina), T3 (triyodotironina) y rT3 (triyodotironina inversa) en los líquidos celómico y amniótico a partir de la tercera semana de gestación, mucho antes de que el tiroides fetal sea capaz de sintetizar por sí mismo estas sustancias, evidencia la existencia del paso de hormonas tiroideas, fundamentalmente T4, a través de la membrana placentaria3. Parte de la T4 es transformada en rT3, hormona funcionalmente inactiva, mediante la desyodasa tipo 3 (D3). Sin embargo, otra parte de la T4 atraviesa la membrana placentaria y se transforma en T3 en los propios tejidos cerebrales embrionarios, y es la forma biológicamente activa en éstos. Por ello, es vital la presencia de T4 en cantidades suficientes en la sangre materna que aseguren un sustrato suficiente a partir del cual formar T3 en los tejidos cerebrales del embrión4.
Los valores de tiroxinemia, a su vez, están directamente determinados por la disponibilidad de yodo del tiroides materno. Normalmente el tiroides de la madre sintetiza una cantidad mayor de T4 que de T3. Cuando hay déficit de yodo, la síntesis hormonal de T4 disminuye y aumenta la de T3, lo que constituye una situación de hipotiroxinemia materna sin hipotiroidismo5, 6. En el embarazo, esto puede tener una gran trascendencia clínica, ya que estudios clínicos demuestran la relación entre el estado de yododeficiencia materno durante el embarazo y la afectación, con distintos niveles de significación clínica, del desarrollo neurocognitivo, funciones de coordinación motriz y visuomotriz y funciones de integración como la manipulación, la imitación y el desarrollo del lenguaje precoz7-9. Recientemente, se ha relacionado también la hipotiroxinemia materna con el síndrome de hiperactividad infantil10.
Vista la importancia de mantener adecuadas las concentraciones de T4 desde las primeras semanas del embarazo y lo determinante que para ello es una adecuada disponibilidad de yodo, adquiere gran importancia valorar el estado nutricional de yodo de las mujeres embarazadas. Hay que tener en cuenta, además, que durante la gestación se incrementa la concentración de globulina transportadora de hormonas tiroideas, parte de la tiroxina se degrada por la D3, hay un paso neto de yodo de la sangre materna al feto y se produce un aumento del filtrado glomerular, que produce un incremento en la eliminación de yodo11. Todo ello en conjunto produce un aumento de las necesidades de yodo de la madre que, si no se compensa, puede acentuar un estado previo de yododeficiencia.
El equilibrio existente entre la ingesta de yodo y su eliminación hace de la yoduria un buen indicador de la ingesta reciente de yodo. La biodisponibilidad del yodo se estima en un 92%12, por lo que conociendo la yoduria de 24 h (aunque variable, se la presume estable por largos periodos) se puede calcular de una manera muy aproximada la ingesta de yodo. Por otro lado, ajustando la concentración de yodo en función de la concentración de creatinina en orina o presumiendo diuresis medias constantes por grupos de edad (1.500 ml/día en el caso de las gestantes), se puede estimar el consumo medio poblacional a partir de muestras aisladas de orina de una cohorte representativa13. Actualmente se recomienda una ingesta de 250–300 μg/día a embarazadas y mujeres lactantes14. La cantidad recomendada de yodo para las gestantes está basada en diversos estudios que demuestran un incremento significativo del tamaño de la glándula tiroidea o deterioro de su función cuando la ingesta es inferior al límite adecuado15-18. Según las últimas recomendaciones de expertos y de distintos organismos internacionales, dicha ingesta recomendada varía entre los 220 y los 300 μg/día, y se acepta como óptima nutrición poblacional unos límites de medianas de yoduria de 150–249 μg/l12, 15, 19. En España, la legislación establece desde 1983 que el contenido de yodo de la sal de mesa yodada sea de 60 mg/kg de sal20. Sin embargo, es difícil que una mujer embarazada alcance un consumo diario de yodo acorde con las recomendaciones actuales sólo con sal yodada.
Numerosos estudios realizados en distintas áreas geográficas de España en los últimos 10 años han puesto de manifiesto que el problema de la yododeficiencia en las mujeres embarazadas sigue teniendo una gran prevalencia21. Sin embargo, la suplementación sistemática con sales de yodo de las mujeres gestantes presenta irregularidades en cuanto a su cumplimiento y dudas en la forma de actuar ante múltiples situaciones clínicas asociadas. En este sentido, recientemente el Grupo de Trabajo en Trastornos por Deficiencia de Yodo de la SEEN ha publicado un documento de consenso que viene a recalcar la importancia de este tipo de suplementación22.
Vistos los antecedentes expuestos y dado que no existían estudios en el ámbito geográfico del Área de Salud de Palencia que permitieran confirmar o descartar la yododeficiencia en nuestra zona ni conocer su intensidad, se propuso realizar un estudio que permitiera calcular el valor medio de yoduria para así estimar el estado de yododeficiencia de la población de mujeres gestantes de nuestra área sanitaria, con la finalidad de poder establecer las recomendaciones oportunas. Se tomó como criterio de yodosuficiencia poblacional una mediana de yoduria≥230 μg/día o 150 μg/l14.
MATERIAL Y MÉTODOEl estudio se realizó, previa aprobación por la Comisión de Ensayos Clínicos del Complejo Asistencial de Palencia, reclutando a las gestantes en las consultas de las matronas de los centros de salud del área sanitaria. Se fijó un periodo de recogida de muestras de orina y los cuestionarios alimentarios a las gestantes que aceptaron colaborar de 6 meses, del 1 de octubre de 2006 al 31 de mayo de 2007.
Asumiendo una desviación típica poblacional de 70 μg/l21 y deseando una imprecisión máxima de ±10 μg/l con un nivel de confianza del 95%, se calculó un tamaño muestral aproximado de 189 gestantes. Estimándose unas pérdidas del 5%, se seleccionó en la primera visita realizada a su matrona a 200 mujeres gestantes en su primer trimestre de embarazo, mayores de 18 años, residentes en el Área Sanitaria de Palencia al menos en los últimos 12 meses, sin antecedentes de afección tiroidea ni de administración de productos yodados orales ni en otros preparados como contrastes radiológicos o desinfectantes tópicos en cantidades importantes.
Debido a la distribución poblacional del área sanitaria, se definió como zona norte todas las poblaciones ubicadas al norte de una línea imaginaria que pasara por las poblaciones de Osorno y Carrión de los Condes. El resto correspondería a la zona sur, de mayor población, que incluiría la capital. De los 1.300 partos acaecidos el año anterior, 1/4 mujeres provenía de la zona norte; por ello, para nuestro estudio, se seleccionó a una mujer de la zona norte de la provincia por cada 4 de la zona sur.
En la primera visita programada que la gestante realizaba a su matrona, se le pasaba un cuestionario sobre alimentación (no validado), centrado en la ingesta de alimentos ricos en yodo en forma de cuestionario de frecuencia de consumo semanal. La determinación de yoduria de 24 h y hormonas tiroideas se realizó junto con la primera determinación analítica sistemática de control del embarazo, previamente al inicio de la toma de suplementos yodados. Más tarde un endocrinólogo comprobaba la recogida de todos los datos antropométricos y se realizaba una palpación cervical para descartar la presencia de bocio.
Se elaboró un registro específico para cada participante, con el que se confeccionó una base de datos antropométricos y bioquímicos para su posterior estudio estadístico.
En cada extracción se recogieron 5 ml de sangre en tubos de vacío siliconados con filtro de gel de sílice sin anticoagulante para la obtención de suero. Todos los tubos de vacío utilizados fueron tubos VACUTAINER-SST II® (Vacutainer Systems, preanalytical Solutions; Belliver Industrial State, Plymouth, Reino Unido). La orina de 24 h se recogió en envases de polipropileno específicos para ello, facilitados en el propio centro de salud. Todas las muestras se enviaron en la misma mañana de su recogida al Laboratorio de Análisis Clínicos del Complejo Asistencial de Palencia. Allí, se cuantificó el volumen de orina recogido por cada mujer y se envió una alícuota al laboratorio de referencia, donde fueron procesadas para la determinación de concentración de yodo mediante la técnica de espectrometría de emisión atómica/espectrómetro de masas (ICP-MS) de Perkin Elmer modelo ELAN DRC II. La gama de linealidad de la técnica está entre 0 y 5.000 μg/l. Valores superiores deben diluirse. La sensibilidad de la técnica es de 5 μg/l. El coeficiente de variación interanalítica es de un 11%. El coeficiente de variación intraanalítica es del 3,5%.
Las determinaciones analíticas sistemáticas de hormonas tiroideastirotropina (TSH) y T4Lse realizaron en el Laboratorio de Análisis Clínicos del Complejo Asistencial de Palencia de forma automatizada en el analizador ARCHITECT (Abbott Ireland Diagnostic Division; Linamuck, Longford, Irlanda): TSH mediante un inmunoanálisis de micropartículas quimioluminiscente en dos pasos con una sensibilidad<0,01 |UI/ml y T4L mediante un inmunoanálisis de micropartículas quimioluminiscente competitivo, en dos pasos. El coeficientes de variación para valores bajos de TSH (media objetivo, 0,65 mU/l) es del 8,8%; para valores límite-altos (media objetivo, 5,65 mU/l), del 8,5%. El coeficiente de variación para la T4L en el rango de los valores hallados en el estudio (media objetivo, 1,01 ng/ml) es del 4,8%.
Para el análisis estadístico, los datos obtenidos se procesaron en el paquete estadístico SPSS 7.0. En primer lugar se estudió mediante el test de Kolmogorov-Smirnov si la distribución de las variables analizadas era paramétrica o no. Las variables continuas -concentraciones de las hormonas tiroideas y yoduriase describen como media±desviación estándar o, si no siguen una distribución normal, como mediana [intervalo intercuartílico]. Las variables categóricas (ingesta de sal yodada) se describen mediante distribución de frecuencias. Se realizaron análisis bivariables y de regresión logística para controlar las posibles variables confusoras.
RESULTADOSDurante los 6 meses que duró el estudio, se obtuvieron muestras válidas de 154 gestantes. Los datos de las variables analizadas se exponen en la tabla 1.
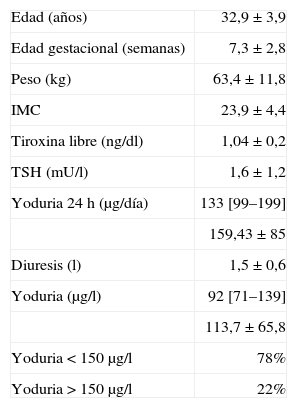
Características de la población del estudio
| Edad (años) | 32,9±3,9 |
| Edad gestacional (semanas) | 7,3±2,8 |
| Peso (kg) | 63,4±11,8 |
| IMC | 23,9±4,4 |
| Tiroxina libre (ng/dl) | 1,04±0,2 |
| TSH (mU/l) | 1,6±1,2 |
| Yoduria 24 h (μg/día) | 133 [99–199] |
| 159,43±85 | |
| Diuresis (l) | 1,5±0,6 |
| Yoduria (μg/l) | 92 [71–139] |
| 113,7±65,8 | |
| Yoduria<150 μg/l | 78% |
| Yoduria>150 μg/l | 22% |
DE: desviación estándar; IMC: índice de masa corporal; TSH: tirotropina. Los datos expresan media±DE o mediana [intervalo intercuartílico] salvo otra indicación.
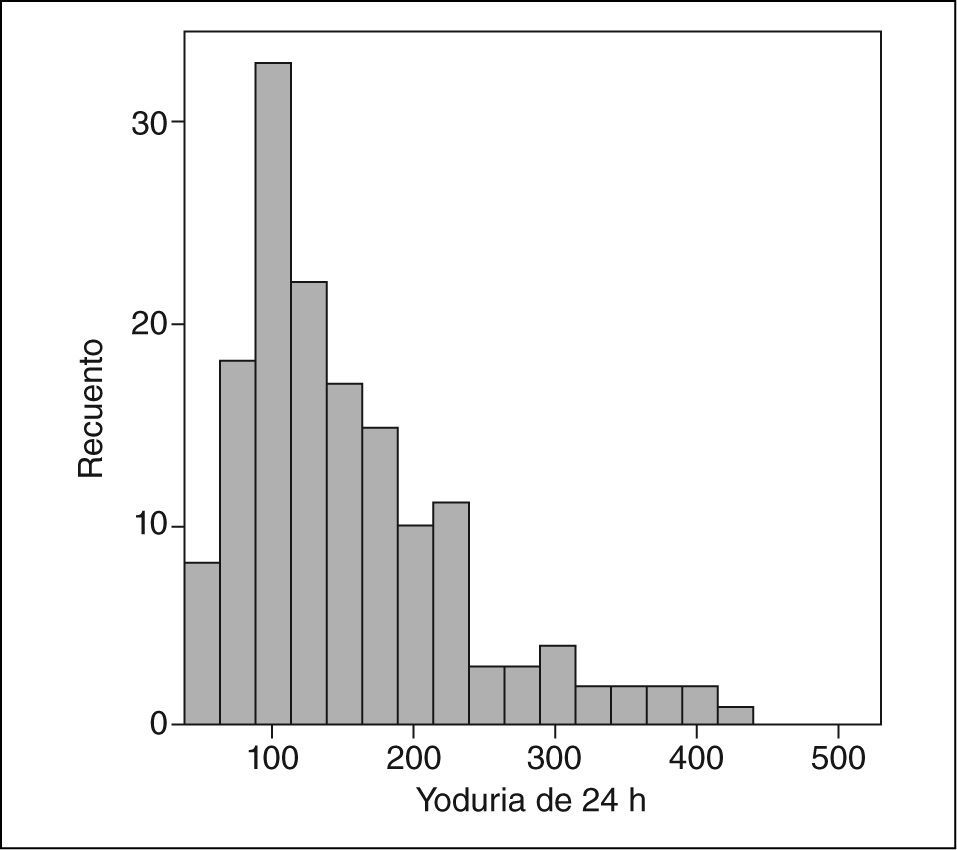
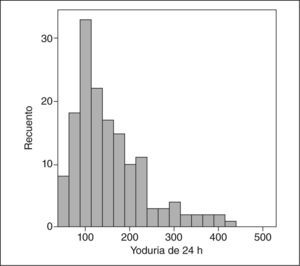
La distribución de yodurias de 24 h obtenida sigue una distribución no paramétrica (fig. 1). La mediana de yoduria de 24 h fue 133 μg/día, lo que presumiendo una biodisponibilidad del yodo del 92%12 permite inferir una ingesta de yodo poblacional media de 144,56 μg/día. Sólo el 20,1% de las mujeres presentaban una ingesta diaria de yodo, calculada a partir de la yoduria de 24 h, > 250 μg/día, como aconseja la OMS.
Al disponer de los resultados de diuresis, se transformaron los valores de yoduria de 24 h (μg/día) en valores de concentración (μg/l), habitualmente utilizados en estudios poblacionales realizados con muestras de orina aisladas. Los resultados fueron similares: una mediana de la yoduria de 92 [71–139] μg/l. El valor de yodo en orina de 150 μg/l se halla en el percentil 79, es decir sólo el 21% de las gestantes presentaban una yoduria>150 μg/l. Había un 8,4% de gestantes con yodurias<50 μg/l.
No se observan diferencias antropométricas entre el grupo yodosuficiente y el yododeficiente. Únicamente se observaron diferencias significativas en la edad, ligeramente mayor en el grupo yodosuficiente (33,7 frente a 31,8 años; p=0,035).
Respecto a la media de los valores de T4L, los obtenidos en el grupo de gestantes con yoduria>150 μg/l fueron de 1,06±0,28 ng/dl y en el grupo deficiente en yodo, 1,03±0,21 ng/dl. No hubo diferencias significativas entre los grupos (p=0,61). Tampoco se hallaron diferencias en los valores de TSH entre el grupo yodosuficiente (1,60±1,02 mU/l) y el yododeficiente (1,62±1,01 mU/l).
De las 102 respuestas obtenidas acerca del consumo habitual de sal yodada, sólo el 46% eran afirmativas. No se hallaron diferencias significativas entre los valores de yoduria de 24 h del grupo que sí respondió a la pregunta referente al consumo de sal yodada y los del grupo que no respondió (158±85 μg/día en el grupo respondedor frente a 162±86 μg/día en el de no respondedoras; p=0,89), y tampoco al transformar esos valores en yoduria/l (108±59 frente a 124±77 μg/l; p=0,20). En las consumidoras de sal yodada, la mediana de yoduria fue de 170 [108–218] μg/día −110,8 [75–168] μg/día-, lo que equivale a una ingesta de 184,78 μg/día. En no consumidoras de sal yodada, la mediana alcanzó sólo 120 [93–177] μg/día −75 [60118] μg/l-, lo que equivale a una ingesta de yodo de 130 μg/día. El análisis confirma una asociación estadísticamente significativa entre los valores de yoduria y el consumo de sal yodada (p=0,004) (tabla 2). Entre las que afirmaban tomar sal yodada, eran yodosuficientes el 34% (16/47) frente al 12,7% (7/55) que no la tomaba (p=0,016).
Se observó bocio en el 36,9% de las mujeres, sin diferencias en cuanto a la identificación por zona geogáfica (p=0,17) o por ingesta de sal yodada (p=0,48). Tampoco se encontró relación con los valores de yoduria.
Aunque había diferencias estadísticamente significativas (p=0,038) en cuanto al consumo de sal yodada (la población de la zona sur es la que más consume: el 24 frente al 48,8%), no se encontraron diferencias respecto a la variable yoduria, el consumo de sal yodada o la prevalencia de bocio entre las poblaciones de ambas zonas, como tampoco se hallaron diferencias atendiendo a si las mujeres residían en la capital o en zonas rurales de la provincia.
Finalmente, realizamos un análisis de regresión logística binaria para el control de las potenciales variables confusoras de los distintos alimentos. Como variable dependiente se utilizó la yoduria>150 μg/l y como variables independientes, consumo de sal yodada y las cantidades ingeridas de los siguientes alimentos: leche, huevos, ahumados, pescado, marisco, conservas, coles, acelgas y judías verdes. El modelo elegido (p=0,007) constaba de dos variables: para el consumo de sal yodada se obtuvo odds ratio (OR)=3,3 (intervalo de confianza [IC] del 95%, 1,2-9; p=0,02) y para el consumo de acelgas, OR=1,9 (IC del 95%, 0,9-3,8; sin significación, p=0,08).
DISCUSIÓNDados la mediana poblacional de yoduria hallada en nuestro estudio y el consumo diario de yodo estimado a partir de ella, podemos afirmar que la población de mujeres gestantes de nuestra área sanitaria es yododeficiente, pues sus yodurias no se acercan al valor de 230 μg/ día indicativo de una ingesta de yodo mínima de 250 μg/día. En nuestro caso, el hecho de disponer de las muestras de orina de 24 h de todas las mujeres participantes nos permitió transformar los datos de yoduria de 24 h obtenidos a yoduria por litro, con lo que se obtuvo una mediana de 92 μg/l. Con uno u otro cálculo, el 79% de las gestantes de nuestro estudio presentaban situación de yododeficiencia, con una excreción<50 μg/l en el 8,4% de ellas, cifra que no debe superar el 20% según la Organización Mundial de la Salud (OMS)23.
El porcentaje de gestantes con yododeficiencia, aunque elevado, está en valores similares a los de otros estudios nacionales y europeos. En Europa, Delange et al24 refieren yodurias<100 μg/l en numerosos países (Bélgica, Dinamarca, Francia, Alemania, Grecia, Hungría, Irlanda, Italia, Rumanía, Eslovenia, Yugoslavia, Austria y Turquía). En Australia, Travers et al25, en un estudio de 835 gestantes, presentan una mediana de yoduria de 85 μg/l, con sólo el 12% de las mujeres con yodurias>150 μg/l (el 88%, deficitarias). Concretamente, en España hay varios estudios que evidencian también una situación de yododeficiencia en poblaciones de mujeres gestantes (tabla 3). Especial relevancia para nuestro estudio, debido a la cercanía geográfica, tienen los datos obtenidos en una zona con una clásica endemia de bocio, como es el Bierzo leonés33. Allí, el 96% de las gestantes sanas en el primer trimestre presentan yodurias<200 μg/l. En el 74% de los casos no superaban los 100 μg/l, con una media de yoduria de 71,4 μg/l. La prevalencia de bocio hallada fue del 57%, frente al 37% de nuestra área.
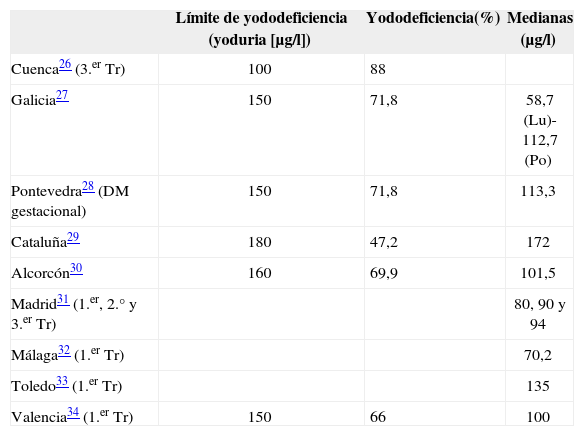
Estudios de yododeficiencia en gestantes en España
| Límite de yododeficiencia (yoduria [μg/l]) | Yododeficiencia(%) | Medianas (μg/l) | |
| Cuenca26 (3.er Tr) | 100 | 88 | |
| Galicia27 | 150 | 71,8 | 58,7 (Lu)-112,7 (Po) |
| Pontevedra28 (DM gestacional) | 150 | 71,8 | 113,3 |
| Cataluña29 | 180 | 47,2 | 172 |
| Alcorcón30 | 160 | 69,9 | 101,5 |
| Madrid31 (1.er, 2.° y 3.er Tr) | 80, 90 y 94 | ||
| Málaga32 (1.er Tr) | 70,2 | ||
| Toledo33 (1.er Tr) | 135 | ||
| Valencia34 (1.er Tr) | 150 | 66 | 100 |
Hay una clara relación entre la ingesta de sal yodada y una situación más favorable de yodosuficiencia. Los valores de yoduria del grupo de mujeres que no contestaron a la pregunta sobre el consumo de sal yodada no presentaban diferencias respecto a las del grupo que sí contestó. Asumimos que la falta de respuesta es por desconocimiento del tipo de sal que se consume y que éste mostraría en cuanto a la yodación una distribución similar a la del grupo que sí respondió a esta pregunta. Aunque el consumo de sal yodada era mayor en la zona sur (el 48,8 frente al 24% de la zona norte de la provincia), no encontramos diferencia significativa entre las yodurias de ambos grupos de gestantes, probablemente por otros aportes de yodo en la alimentación. Así, no se puede establecer una zona de especial riesgo, y la situación de yododeficiencia es homogénea en toda el área.
Además de la sal yodada, analizamos la encuesta alimentaria referida a los productos consumidos en la semana previa al estudio, y aunque hemos encontrado asociación estadística entre la yoduria y la cantidad consumida de conservas, acelgas y judías verdes, mostró una intensidad demasiado débil para considerarla de relevancia clínica en los valores de los diversos coeficientes utilizados.
No se han encontrado diferencias alimentarias entre las gestantes yodosuficientes y las yododeficientes en los análisis bivariables ni tampoco en el análisis multivariable de regresión logística. Nuestros resultados indican que la ingesta de yodo adecuada se debe fundamentalmente al consumo de sal yodada en la alimentación; el consumo de sal yodada multiplicaba por 3,3 la posibilidad de una yoduria>150 μg/l -OR=3,3 (IC del 95%, 1,2-9)-. Estos hallazgos corroboran otros publicados previamente35.
La prevalencia de bocio es más alta de lo esperado respecto a otros estudios similares. Aunque el método exploratorio, por palpación cervical, no es el más exacto, la alta tasa hallada nos hace plantearnos la necesidad de profundizar en este aspecto de salud pública, ante el riesgo de encontrarnos con un problema de magnitud mayor de lo estimado.
En conclusión, el 79% de las gestantes de nuestro estudio tenían una yoduria indicativa de una ingesta de yodo por debajo de los límites recomendados, sin relación clara con otros factores alimentarios distintos del consumo de sal yodada, la ubicación geográfica o el carácter rural o urbano del lugar de residencia. Esta yododeficiencia podría conllevar importantes repercusiones en el desarrollo neurológico fetal durante el embarazo.
Por ello, se debería fomentar en la población, de forma generalizada y desde todas las instituciones con responsabilidades sanitarias, la sustitución de sal común por sal yodada, especialmente en mujeres gestantes, y añadir desde los primeros días del embarazo un fármaco con suplementos de yodo de al menos 150200 μg diarios.
Queremos hacer constar de manera explícita nuestro agradecimiento al conjunto de matronas de los centros de salud del Área Sanitaria de Palencia, cuya labor desinteresada en el reclutamiento de las mujeres gestantes y la obtención de las muestras de orina ha resultado imprescindible para la realización del estudio.
Esta investigación fue subvencionada con fondos para la investigación de la Junta de Castilla y León.