La diabetes mellitus (DM) es una de las enfermedades crónicas más prevalentes en nuestro medio. Puede afectar del 6 al 18% de la población según los grupos de edad estudiados1, y conlleva una elevada morbimortalidad y elevados costes económicos y sociales. Es la tercera causa de muerte entre las mujeres españolas y la séptima entre los varones. El riesgo relativo de padecer ceguera es 20 veces mayor entre la población con diabetes2. En 2003 el 10% de los ingresos hospitalarios en España fueron debidos a la DM y el cálculo del coste oscila entre 381 y 4.348 euros por persona y año3.
La perspectiva de la morbimortalidad y del coste se complica ante los estudios que indican un creciente aumento de la prevalencia de DM en los próximos años, y se estima que en el año 2025 el número de población mundial con diabetes puede duplicarse4.
A finales de los años ochenta, entendiendo el gran problema que la diabetes suponía para Europa, representantes de departamentos de salud de todos los países europeos, asociaciones de pacientes y expertos en diabetes, bajo los auspicios de la International Diabetes Federation y de la oficina regional de la Organización Mundial de la Salud (OMS), reunidos en Saint Vincent en 1989, acordaron elaborar una serie de recomendaciones para que el problema de la diabetes fuera reconocido institucionalmente y que se destinaran los medios suficientes para avanzar hacia su resolución5. Gracias a la Declaración de Saint Vincent distintas zonas de Europa desarrollaron planes para la identificación, la prevención y el tratamiento de la DM, haciendo especial hincapié en sus complicaciones: ceguera, insuficiencia renal, amputaciones, enfermedad coronaria y cerebrovascular. Los objetivos que se plantearon fundamentalmente estaban dirigidos a mejorar la salud de las personas con DM y a aproximar la esperanza de vida, en calidad y años, a la de la población sin diabetes. En concreto, se suscribieron una serie de objetivos, de entre los que destacaban: garantizar un adecuado control de la diabetes, establecer planes para la prevención y detección precoz de complicaciones, concienciar a la población con DM y a los profesionales de la importancia de prevenir las complicaciones, entrenar y educar a los pacientes para su autocuidado, promover la investigación de calidad en diabetes, crear sistemas de monitorización para asegurar la calidad de la atención de la diabetes y promover la colaboración europea para el desarrollo de programas de investigación y de desarrollo.
Respecto a la enfermedad ocular, el objetivo que se planteó para el quinquenio después de la declaración fue disminuir en un tercio la ceguera por DM.
¿Desde entonces (1989), cómo han evolucionado las complicaciones oculares de la diabetes (COD) desde el punto de vista epidemiológico, de la prevención y de la detección precoz? En el momento actual la OMS se propone eliminar los casos de ceguera por causas evitables para el año 2020. La relevancia de cada una de éstas es distinta según la zona del mundo que se observe. En África, por ejemplo, las causas que deberán controlarse en un futuro inmediato son las cataratas, el tracoma y la oncocerciasis. En cambio, en Europa y Norteamérica las primeras causas evitables son la retinopatía diabética y el glaucoma6.
EPIDEMIOLOGIA DE LAS CODLas COD, además de disminuir la calidad de vida de las personas con DM7, suponen un elevado coste económico8. En Alemania se ha estimado que su coste puede suponer el 1,5% del gasto sanitario9. Además, la retinopatía diabética conlleva un aumento de la mortalidad10.
CegueraEn el año 2002, la OMS estimaba que en el mundo había unos 161 millones de personas con deficiencia visual y de éstas, 37 millones que sufrían ceguera, de la que el 4,8% se debía a la retinopatía diabética11. La incidencia de ceguera entre la población general puede ser muy variable según los estudios. En una zona de Alemania se observó que la incidencia de ceguera global era de 11,6/105/año y las causas más frecuentes eran la degeneración macular (3,92/105/año) y la retinopatía diabética (2,01/105/año)12. También en Alemania, en el distrito de Wurttemberg, la incidencia de ceguera entre la población no diabética fue de 13,5/105/año y entre la diabética, marcadamente superior, que llegaba a 60,6/105/año (riesgo relativo de 5,2)13. En Estados Unidos, la DM causa el 8% de los casos de ceguera y el 12% de los nuevos casos diagnosticados cada año14. Estos datos son similares a los mostrados en el estudio de Turín, en el que la retinopatía aparecía como la segunda causa de ceguera (13%) precedida por catarata (26,7%)15, y también muy similares a los de Israel donde la retinopatía también ocupa el segundo lugar (11%)16. En Inglaterra y Gales, la retinopatía diabética es la tercera causa (años 1999-2000) con un 5,9% del total de los casos de ceguera17, cifra por detrás de la degeneración macular (57,2%) y el glaucoma (10,9%). También en Irlanda el porcentaje de personas ciegas por retinopatía diabética es de sólo el 3%18. En una zona de Alemania la incidencia estandarizada de ceguera por 100.000 perso-nas-año era de 5,29 para la degeneración macular, 3,32 para la catarata, 2,86 para la atrofia del nervio óptico, 2,43 para el glaucoma y 2,13 para la retinopatía diabética19.
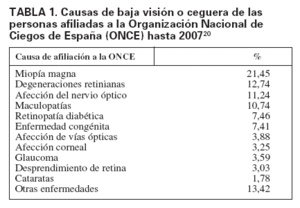
En España, según la Organización Nacional de Ciegos (ONCE), entre el total de sus afiliados el 7,6% tiene retinopatía diabética, que ocupa el quinto lugar entre las causas más frecuentes de ceguera o disminución de la visión (tabla 1)20.
TABLA 1. Causas de baja visión o ceguera de las personas afiliadas a la Organización Nacional de Ciegos de España (ONCE) hasta 200720
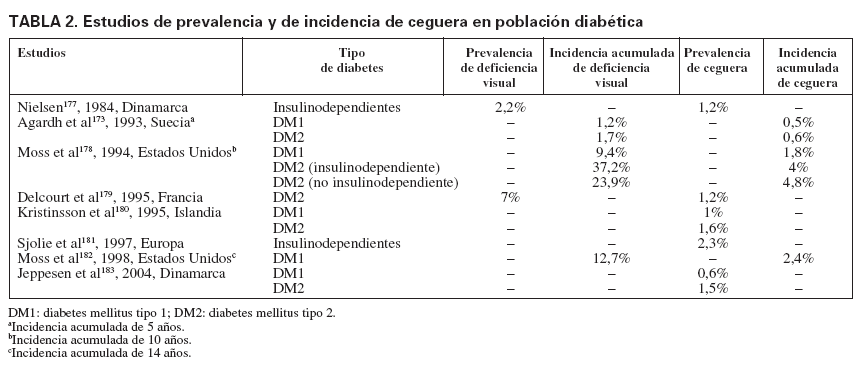
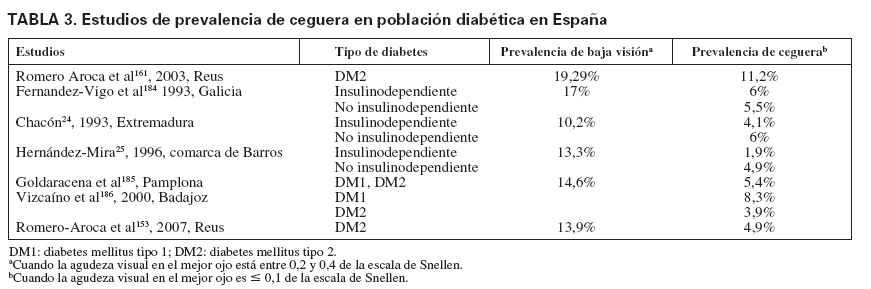
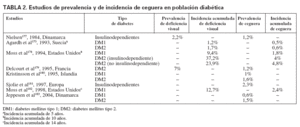
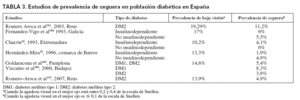
En distintos estudios, la prevalencia y la incidencia de retinopatía y ceguera entre las personas con diabetes oscilan en función del tipo de DM, edad, años de evolución y técnica empleada para su diagnóstico. También la denominación de insulinodependiente o no ha sido un factor de confusión cuando se quiere identificar la penetración del problema entre la DM tipo 1 o 2, sobre todo en algunos estudios de los años noventa. La prevalencia de ceguera entre la población diabética, como final de las COD, oscila según los estudios entre el 0,5 y el 2,4% (tabla 2). Los estudios realizados en España muestran una prevalencia más elevada, entre el 4,6 y el 5,8% (tabla 3); la mayoría de los estudios se centran en Extremadura y Galicia. La incidencia de ceguera, entre la población con DM, puede oscilar entre 11/105/año21, 53/105/año22 y 60,6/105/año13.
TABLA 2. Estudios de prevalencia y de incidencia de ceguera en población diabética
TABLA 3. Estudios de prevalencia de ceguera en población diabética en España
La principal causa de ceguera entre la población con DM es la retinopatía diabética, aunque también son importantes las cataratas, el glaucoma y otras causas no relacionadas con la diabetes, como la degeneración macular asociada a la edad. Un estudio realizado en Badajoz, en una muestra aleatoria de 762 personas con DM (mayoría de tipo 2) y 896 controles, muestra que la causa de ceguera más frecuente entre la población con DM es la retinopatía diabética (32,2%) y en el grupo control, la degeneración macular (44,4%). En segundo lugar, la catarata (22,6%) que a su vez, como causa de ceguera, era 2,33 más frecuente en el grupo con DM que en el grupo control y le seguían la miopía (7,9%), la degeneración macular (7,3%), que era 12,5 veces más frecuente en el grupo control que en el de DM, y el glaucoma (6%)23. Otros estudios realizados en España siguen este mismo orden como causa de ceguera en la DM24,25.
Retinopatía diabéticaLa prevalencia de retinopatía diabética se relaciona fundamentalmente con los años de evolución de la DM y con el control metabólico26-32. Aunque al inicio de la DM tipo 1 (DM1) sólo entre el 0 y el 3% pueden presentar retinopatía diabética29, en el estudio Diabetes Control and Complications Trial (DCCT) se evidenció que el 67,1% de los pacientes padecían retinopatía diabética antes de los 5 años de evolución33. En la DM tipo 2 (DM2), la prevalencia de RD en el momento del diagnóstico puede oscilar entre el 6 y el 30%29. En el estudio United Kingdom Prospective Diabetes Study (UKPDS) en pacientes recién diagnosticados de DM el 39% de los varones y el 35% de las mujeres presentaban retinopatía diabética34.
En el estudio de Wisconsin, al inicio del seguimiento de casi 3.000 pacientes con DM1 y DM2, se observó que la prevalencia de retinopatía diabética entre los de más de 15 años de evolución era del 98% entre los afectos de DM1, del 85% en DM2 tratados con insulina y del 58% en los no insulinodependientes. La prevalencia de retinopatía diabética proliferativa (RDP) pasaba del 0% en los casos de DM1 con una evolución menor de 5 años al 4% entre los 9 y 10 años, el 26% entre los 15 y 20 años y llega hasta el 56% en los de más de 20 años de evolución35. El estudio EURODIAB, realizado entre 3.250 personas con DM1 de 31 centros de diversos países de Europa, detectó una prevalencia de retinopatía diabética del 46,2% con un total de RDP del 10,3%. En los casos de más de 20 años de evolución la prevalencia de retinopatía diabética alcanzaba el 82%36.
Bastantes trabajos hacen referencia a la incidencia de la retinopatía diabética29, de los que destaca el realizado en Wisconsin en el que se observó que, a los 10 años de seguimiento, la presentaban el 89% (n = 996) de los pacientes con DM1, el 79% (n = 674) de aquellos con DM2 tratados con insulina y el 67% (n = 696) de los no insulinodependientes32. A los 14 años, en el grupo de DM1 la retinopatía diabética alcanzaba el 86% y la progresión a RDP al 37%37. El estudio UKPDS observó que el 22% de la población sin retinopatía diabética al inicio la desarrollaba a los 6 años de seguimiento38. El análisis de la cohorte del ETDRS (Early Treatment Diabetic Retinopaty Study) predice que en 1 año el riesgo de evolución de una retinopatía diabética no proliferativa a proliferativa será del 1 al 45% en función de si es no proliferativa leve o muy grave, respectivamente, y del 16 al 71% a los 5 años39. En el estudio prospectivo de EURODIAB la incidencia de RDP en la DM1 con retinopatía diabética previa oscilaba entre 13,6 y 21,1 casos/1.000 pacientesaño28. En la cohorte de DM1 del estudio de Pittsburg, la incidencia de RDP era de 1,59/100 pacientes-año cuando la evolución de la enfermedad era menor de 20 años. Entre los 20 y 30 años de evolución la incidencia ascendía a 5,4/100 pacientes-año40.
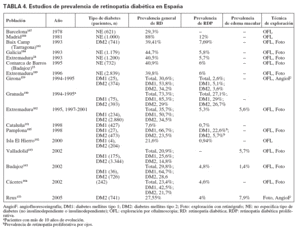
La prevalencia de retinopatía diabética en España ha sido documentada en diversos estudios (tabla 4). Aunque la metodología empleada, entre la mayoría de ellos, no ha sido estrictamente la misma (estudios poblacionales o sobre series clínicas) para que puedan establecerse comparaciones, destaca, por un lado, y al igual que en la mayoría de los estudios, que la prevalencia de RD es netamente superior entre la población con DM1 y, por otro, que entre los estudios realizados a mediados de los noventa hasta los más recientes se aprecia una disminución de la prevalencia general de retinopatía diabética, y permanece estable la de RDP (tabla 4).
TABLA 4. Estudios de prevalencia de retinopatía diabética en España
Maculopatía diabéticaLa maculopatía diabética o edema macular, aunque no es la causa principal de ceguera, es una causa frecuente de disminución de la visión central y su aparición está claramente relacionada con los años de evolución y el control metabólico41. Aparece con más frecuencia entre los pacientes con retinopatía diabética grave, pero además, al igual que en el caso de retinopatía diabética, el riesgo de maculopatía diabética también se relaciona con la hipertensión arterial (HTA), probablemente con un perfil lipídico aterogénico, la cirugía de catarata si hay retinopatía diabética previa, y existe cierta controversia con la asociación a nefropatía diabética42,43. Aunque la panfotocoagulación es de elección en el tratamiento de la RDP, supone un riesgo para la maculopatía diabética, que puede empeorar o bien iniciar su desarrollo, la fotocoagulación focal es lo más indicado en casos de maculopatía diabética39. El riesgo de reducción de la agudeza visual después de la fotocoagulación es mayor ante la presencia de exudados duros, lesión que es más frecuente en la DM244. También se ha descrito la maculopatía isquémica que se diagnostica por medio de la angiofluoresceingrafía. Un tercio de los casos tienen relación con la maculopatía diabética y contribuye al deterioro visual; sin que se conozca ninguna terapia eficaz para esta complicación42.
En el estudio de Wisconsin la prevalencia de maculopatía diabética era prácticamente inexistente en los primeros 5 años de evolución entre la población con DM1 y alrededor del 3% en DM2. La duración de 20 o más años suponía que la prevalencia de maculopatía diabética ascendiera al 29% en DM1 y al 28% en DM245. Respecto a su incidencia acumulada, los mismos autores observan que a los 10 años de evolución era del 20,1% en DM1, el 25,4% en DM2 con tratamiento de insulina y el 13,9% en otras DM232. A los 14 años de seguimiento la maculopatía diabética afectaba al 26% entre la población con DM37. En España los datos son escasos, con una prevalencia que oscila entre el 1,4 y el 7,9% (tabla 4). En la epidemiología de la maculopatía diabética también cabe considerar que una tercera parte de ésta puede tener una regresión espontánea39.
CatarataDiversos estudios poblacionales han demostrado que el riesgo de cataratas es mayor entre las mujeres, los fumadores, las personas mayores o con diabetes y en tratamiento con antagonistas del calcio y corticoterapia oral. En un estudio46 realizado en una población australiana la DM suponía un riesgo relativo de catarata posterior subcapsular de 1,7 a 5,1. Datos similares se desprenden de un estudio efectuado entre una población del sur de Francia47, con un riesgo relativo de 1,72 a 4,28. El consumo de alimentos con un elevado índice glucémico también se ha relacionado con una mayor incidencia de catarata cortical48.
La catarata, en nuestro medio, es la segunda causa de ceguera entre la población con diabetes23. En el estudio de Girona se detectó una prevalencia de cataratas del 7% entre la población con DM49. En el estudio de Wisconsin, la incidencia acumulada de 10 años de cirugía de cataratas entre personas con DM1 fue del 8,3% y con DM2, del 24,9%50.
GlaucomaAunque con una frecuencia mucho menor que la retinopatía diabética o la catarata, el glaucoma también puede ser una causa de ceguera entre la población con diabetes; alrededor de un 6% en el estudio de Badajoz23 y un 8% de deficiencia visual en Estados Unidos51.
En Estados Unidos la prevalencia de glaucoma de ángulo abierto entre la población mayor de 40 años es del 1,86%52, en Canadá del 2,7%53 y en la población de Framingham del 3,3%54. En España se ha descrito una prevalencia de glaucoma del 1,54% en una población con diabetes de Murcia y el 6,37% con hipertensión ocular sospechosa55. En Extremadura se detectó una prevalencia del 3,9%56. No hay acuerdo sobre si la DM supone un mayor riesgo de glaucoma. Algunos estudios observan el doble de riesgo entre la población con DM57,58; sin embargo, otros no han identificado esta relación59,60. En un grupo de 144 pacientes con DM2 de Alicante el glaucoma afectaba al 11%61. La incidencia acumulada de glaucoma durante 10 años en la cohorte de Wisconsin fue del 3,7% en DM1, el 11,8% en DM2 tratados con insulina y el 6,9% en las demás DM2. La edad fue el factor de riesgo más firmemente relacionado con el glaucoma62.
En la DM pueden aparecer otros tipos de glaucoma que, sin ser específicos de esta enfermedad, se presentan con mayor frecuencia. El glaucoma neovascular, también denominado glaucoma hemorrágico, consiste en un crecimiento de membranas fibrovasculares entre el iris y la córnea que podrá implicar un aumento de la presión intraocular. Hay pocos estudios epidemiológicos a este respecto. En una población con DM de Dinamarca se observó una prevalencia del 2,1%, que aumentaba hasta el 21,3% entre los afectos de RDP63. La panfotocoagulación en la RDP reduce el riesgo de glaucoma neovascular64 y la intervención de cataratas, si preexiste una RDP, aumenta el riesgo65. En la gran mayoría de los casos produce la pérdida total de visión66. Otro tipo de glaucoma es el de células fantasma. Éste se genera a partir de una hemorragia vítrea por la obstrucción de la malla trabecular producida por hematíes que han perdido su elasticidad (células fantasma). Mayoritariamente estas células se pueden observar en hemorragias de pacientes con RDP, pero también en traumatismos, tras faquectomía o desprendimiento de retina, pero en no más del 20% de los casos y de éstos, pocos presentarán glaucoma67.
FACTORES QUE INFLUYEN EN LA APARICIÓN Y EVOLUCIÓN DE LA RETINOPATÍA DIABÉTICALa aparición y la progresión de la retinopatía diabética dependen de una serie de factores clínicos, bioquímicos, genéticos y sociales, a los que se unen marcadores de riesgo de conocimiento reciente, todos ellos a tener en cuenta al abordar su prevención68-72.
Prevención y tratamiento se superponen en la retinopatía: gran parte de los medios disponibles para el tratamiento de la retinopatía se emplean para evitar su aparición o progresión.
Marshall et al73 ordenan los factores de riesgo en no modificables y modificables y cuantifican el peso de cada uno de ellos en la aparición de la enfermedad (tabla 5). Siguiendo este esquema se revisan los factores más relevantes.
TABLA 5. Factores de riesgo relacionados con las complicaciones de la diabetes según Marshall73
FACTORES NO MODIFICABLESFactores genéticosLa capacidad de la clorpropamida de producir enrojecimiento facial al asociarse con el consumo de alcohol se transmite por herencia dominante. Un estudio clásico, publicado en 1979, mostraba que en pacientes con reacción positiva a este fármaco la retinopatía diabética era menos frecuente y ésta era menos grave que en los pacientes con reacción negativa74,75. Posteriormente, Leslie et al76 publicaron en 1982 un estudio de concordancia de desarrollo de DM entre gemelos idénticos, que demostró el elevado componente genético para el desarrollo de la enfermedad, que fue marcada-mente superior en la DM2. En este estudio 35 de 37 pares de gemelos con DM2 y 21 de 31 con DM1 tenían retinopatía, en ambos casos en el mismo estadio. Concordancia similar se encuentra en un estudio de gemelos en Japón con el 83% en DM2 y el 45% en DM1. La gravedad de la afección también era similar77.
Un subgrupo del DCCT muestra que los familiares diabéticos de pacientes incluidos en el estudio tenían mayor riesgo de retinopatía si sus padres también tenían la enfermedad, y esto ocurría en los cuatro grupos de asignación inicial del estudio78.
Simmons et al79 observan una mayor prevalencia de retinopatía moderada o severa en poblaciones del Pacífico respecto a los europeos. Wong et al80 detectan una prevalencia de retinopatía del 36,7% en negros, el 37,4% en hispanos, el 24,8% en blancos y el 25,7% en chinos, mientras que West et al81 no encuentran diferencias entre población hispana y caucásica en individuos mayores de 40 años.
Diversos estudios han identificado algunos genes que pueden tener relación con la retinopatía diabética, como el de la aldosa reductasa, el de la sintetasa del óxido nítrico (NOS3), del receptor de productos avanzados de la glucosilación (AGE), genes que codifican la enzima de conversión de angiotensina y el factor de crecimiento del endotelio vascular (VEGF) y otros82,84. Algunos haplotipos de los antígenos HLA guardan relación con la RDP y podrían predecir su pronóstico: HLA-DR785, HLA-A2486, HLA-B62m, Cw4 y DQ487. Inicialmente, se había relacionado a los HLA-DR3 y DR4 con RDP, pero posteriormente no se ha confirmado88.
Duración de la enfermedad y edad de apariciónHay una amplia evidencia de la relación entre retinopatía y tiempo de evolución, aunque la prevalencia no alcanza nunca el 100%. En el apartado sobre prevalencia de retinopatía diabética se señalaban distintos estudios que evidenciaban la gran influencia que la duración de la DM tiene en el riesgo de esta complicación. Todos los estudios realizados en España (tabla 4) describen la relación entre el desarrollo de retinopatía diabética y los años de evolución de la DM.
Se ha discutido si la edad de aparición de la DM puede modificar el riesgo de retinopatía diabética, concretamente si la DM que se inicia antes de la pubertad lo reduce. El estudio de Olsen et al89 realizado con una cohorte de más de 300 jóvenes con DM1 revela que la prevalencia de retinopatía diabética eataba en relación con la glucohemoglobina (HbA1c) y los años de evolución; además se observó que el intervalo entre el inicio de la diabetes y la aparición de RD era significativamente menor cuando la DM se había iniciado en edad prepuberal.
FACTORES MODIFICABLESControl metabólicoÉste es un factor de primer orden, que aparece en el origen de todas las complicaciones de la DM, aunque no siempre con la misma intensidad, y es un objetivo prioritario en el tratamiento. En pacientes con DM1, el estudio DCCT90 demostró que el tratamiento intensivo reducía en un 76% la incidencia de retinopatía en el grupo de prevención primaria, el 56% la progresión y el 47% la evolución a grave o proliferativa en el de prevención secundaria, asociado a una reducción de la HbA1c. La mejora persistía 4 años después de terminado el estudio, a pesar del aumento de la glucemia91. Otros estudios avalan la relación entre control metabólico en DM1 y la incidencia y progresión de la retinopatía30,89,92,93.
El estudio UKPDS27 halló que una reducción del 0,9% de la HbA1c en 10 años de seguimiento en pacientes con DM2 de diagnóstico reciente disminuía en un 25% el inicio y la progresión de la retinopatía. A los 6 años de seguimiento de 1.216 pacientes que no tenían retinopatía al diagnóstico, el 22% desarrolló algún tipo de lesión y de 703 que sí las tenían al inicio, el 29% empeoró. Incidencia y progresión estaban relacionadas con el grado de control38. En un grupo de 200 pacientes con DM2 de unos 8 años de evolución, el control intensivo de la glucemia durante 2 años fue suficiente como para prevenir o retrasar la aparición o progresión de la retinopatía diabética94.
Algún otro estudio ha demostrado que la prevalencia de cualquier tipo de retinopatía diabética se relaciona con la concentración de HbA1c en los casos de diabetes diagnosticada antes de los 30 años, y que cuando el diagnóstico se realiza posteriormente la HbA1c se asocia especialmente a la RDP o al edema macular31. Por otro lado, hay evidencias de que la RDP o preproliferativa puede empeorar con la optimización rápida del control metabólico95.
Presión arterialHay acuerdo amplio, confirmado por numerosos trabajos, sobre el papel de la hipertensión arterial como importante factor en el desarrollo de retinopatía diabética. El estudio UKPDS96 demostró, en 1998, que un descenso de la presión arterial sistólica en 10 mmHg y de la diastólica en 5 mmHg disminuía un 37% el ries-go/deterioro de enfermedad ocular en pacientes con DM2, sin que guardara relación con el valor de HbA1c ni con el fármaco usado, captopril o atenolol97. La mejora se manifestaba en todos los aspectos: microaneurismas, exudados duros, exudados algodonosos, progresión de la retinopatía, necesidad de fotocoagulación y ceguera98. En un grupo de 358 pacientes de ambos tipos, seguidos durante más de 20 años, también se observa un descenso en la incidencia de retinopatía dependiente de la presión arterial99.
El estudio Hoorn100 analiza la prevalencia de retinopatía en un grupo uniforme de 626 individuos clasificados en cuatro grupos que van desde normoglucemia a DM. Se detectaron lesiones de retinopatía diabética en todos los grupos, incluso en los normoglucémicos, en relación con diferentes factores, entre los que destacaban las cifras de presión arterial. Otros estudios han observado que la incidencia y la progresión de la retinopatía diabética se relaciona con la hipertensión arterial, tanto en DM1 como en DM2101.
Si la influencia de la hipertensión arterial es ampliamente aceptada, dos cuestiones actualmente generan debate: definir cuál es la cifra óptima de presión arterial (PA) y dilucidar si los inhibidores de la enzima de conversión de angiotensina (IECA) o los antagonistas de los receptores de la angiotensina II (ARA-II) tienen un papel que va más allá que el efecto hipotensor. Schrier et al102 realizaron un estudio prospectivo y aleatorizado con 480 pacientes con DM2, normotensos (PA < 140/90 mmHg) y la mitad con retinopatía diabética. Se realizó un tratamiento con placebo frente a enalapril o nisoldipino durante 5,3 años. La disminución de 10 mmHg de PA (PA media de 128/75) fue suficiente para lograr un descenso significativo de la progresión de la enfermedad. Resultados similares obtuvo un estudio efectuado en pacientes con DM1 normotensos con lisinopril, en que se consiguió un descenso del 50% en la progresión de la enfermedad103.
Probablemente, el estudio multicéntrico DIRECT104 aportará más evidencia sobre el beneficio del tratamiento con ARA-II. Incluye a 5.200 pacientes con ambos tipos de DM, normotensos e hipertensos, y se investiga los probables efectos positivos del uso de un ARA-II (candesartán) en la incidencia de retinopatía en DM1 y la progresión en DM1 y DM2.
LípidosLa dislipemia se ha relacionado con exudados 100,105 y con la gravedad de la retinopatía diabética106, así como con la enfermedad cardiovascular105,107, pero no con la incidencia. La retinopatía diabética se ha relacionado con alteraciones de todas las fracciones lipídicas: aumento de los triglicéridos, del colesterol de las lipoproteínas de baja densidad (cLDL), de la apoproteína B, lipoproteína (a) y con el descenso del colesterol de las lipoproteínas de alta densidad (cHDL), con la oxidación y glucosilación de las lipoproteínas y sus receptores duros105-108. Se ha ensayado el tratamiento con estatinas, sin resultado en la prevención de la retinopatía109, pero sí en la reducción de la severidad de los exudados, aunque sin mejoría de la agudeza visual110,111. Recientemente, se ha observado que el tratamiento con fenofibrato de pacientes con DM2 puede reducir la necesidad de tratamiento con láser independientemente de la modificación de los lípidos plasmáticos112.
Índice de masa corporalAunque se asocia obesidad con retinopatía, no queda claro si es un factor independiente o que actúa por medio de otros factores, como el aumento de prevalencia de hipertensión arterial, hiperlipemia o peor control metabólico113-115.
Tabaco y alcoholSolberg et al116 afirman que el consumo de tabaco está asociado a la aparición de múltiples enfermedades oculares, con excepción de la retinopatía diabética y el glaucoma de ángulo abierto. De igual modo, otros estudios no han podido relacionar la retinopatía diabética con el tabaquismo117,118. Sin embargo, en el estudio DCCT119 se observó una relación entre tabaquismo y progresión de la retinopatía, y también con el aumento del consumo de grasas, alcohol, colesterol y ácidos grasos y con el descenso del consumo de fibra.
Nefropatía y retinopatía diabéticaHay cierta discordancia entre el papel predictor de la microalbuminuria y la aparición o progresión de la retinopatía diabética. En algunos estudios, como el de Wolf et al120, se observa, en un grupo de 323 pacientes con DM1, que la mayoría de los que tenían macroalbuminuria presentaban además retinopatía diabética y que la microalbuminuria se correlacionaba positivamente con ella, independientemente de la presencia o no de hipertensión. Sin embargo, Aroca et al121 y Romero et al122, en un grupo de 140 pacientes con DM1, no observaron relación entre incidencia de retinopatía y microalbuminuria a los 5 y 10 años de seguimiento; únicamente encontraron correlación con las formas más graves de retinopatía diabética93.
En el caso de la DM2, en el mismo estudio de Wolf et al120, se observó que de un grupo de 906 pacientes, casi la mitad de los hipertensos con proteinuria no tenían retinopatía diabética. Tampoco se correlacionó la microalbuminuria con la retinopatía diabética, en contraste con el estudio de Manaviat et al123, en el que encontraron que la microalbuminuria es un marcador fiable de retinopatía diabética en DM2.
En 2005, Newman et al124 publican el resultado de una revisión sistemática diseñada para valorar la microalbuminuria como signo precoz de complicaciones de la DM y el efecto de su tratamiento. Concluyeron que: a) en DM1 la microalbúmina no predice la aparición o el progreso de retinopatía simple, aunque sí de RDP, y b) en DM2 no predice la incidencia o desarrollo de retinopatía simple, mientras que es dudoso su valor predictivo de la RDP. Sí hay mayor acuerdo en que la macroalbuminuria se correlaciona con la retinopatía proliferativa69,105,125.
Se podría concluir que la microalbuminuria no es un marcador de riesgo para retinopatía, aunque la asociación de ambas afecciones es frecuente30 y que probablemente la macroproteinuria tendría más relación con los tipos más graves de retinopatía diabética.
Nuevos marcadores y nuevas opciones terapéuticasOtros factores se han relacionado con el desarrollo y la evolución de la retinopatía diabética. Entre otros, destacan la proteína C cinasa, los AGE, la inflamación, el aumento del VEGF, el factor de crecimiento insulínico tipo 1 (IGF-1) y la disminución de la expresión del gen del factor derivado del epitelio pigmentario (PRDF)41. Diversos fármacos se han propuesto tanto para el tratamiento como para evitar la progresión de la retinopatía (prevención secundaria).
Bonnefont-Rousselot126 revisa el papel de los antioxidantes, así como de fármacos inhibidores de la formación de productos de glucosilación avanzada. Genuth et al127 encuentran correlación entre la glucosilación del colágeno de la piel y los valores de AGE con el riesgo de retinopatía en 211 pacientes del estudio DCCT. La administración de amoniguanidina, inhibidor de la formación de AGE, previene el desarrollo de retinopatía en ratas128, hecho no confirmado en humanos.
La activación de la proteína cinasa (PCK) es uno de los mecanismos que contribuye a la aparición de las complicaciones de la DM. El estudio PKC-DRS129 evaluó la eficacia de ruboxistaurina, un inhibidor de la PCK, en pacientes con retinopatía leve o moderada, concluyendo que efectivamente reduce el riesgo de pérdida visual, la necesidad de tratamiento con láser y la progresión del edema macular, aunque no impide el desarrollo de retinopatía, al igual que PKC 412130, que reduce el edema y mejora la agudeza visual.
El VEGF contribuye al engrosamiento de la membrana basal en la retina del diabético mediante la inducción de expresión de factores prefibróticos, promueve la proliferación capilar en la retina y desempeña un importante papel en el desarrollo del edema macular131. Se están ensayando 3 fármacos anti-VEGF, pegaptanid, ranibizumab y bevacizumab, en retinopatía proliferativa, con resultados esperanzadores111.
El efecto de la IGF-1 en la retina y en la evolución de la retinopatía diabética se ha discutido desde que, en 1953, se publicara una observación en que la progresión de una RDP se había resuelto espontáneamente tras la aparición de un panhipopituitarismo132. Mucho más recientemente se ha detectado una disminución de ARNm de somatostatina en la neurorretina y en el epitelio pigmentario de ojos procedentes de donantes post mortem con DM2 respecto a sin DM, así como un mayor grado de apoptosis en la retina de ojos procedentes de donantes con DM2133. Estos resultados abren interesantes perspectivas. El tratamiento con octeotrida en pacientes con RDNP grave prevenía su evolución a RDP134, mientras que el tratamiento con pegvisomant no produjo una regresión de la proliferación vascular en RDP135.
CRIBADO DE RETINOPATÍA DIABÉTICALas claves para prevenir la pérdida de agudeza visual por retinopatía son: la detección precoz, basada en medios que proporcionen una especificidad y una sensibilidad que la British Diabetic Association establece en el 80% o mayor, el seguimiento especializado en pacientes ya afectados y el tratamiento con láser en el momento apropiado136, sin olvidar el cociente cos-to/beneficio, que debe ser realista y permitir el estudio periódico de la mayor parte de la población con DM. Las técnicas más comunes son:
– Oftalmoscopia directa:su especificidad y sensibilidad no alcanzan el límite marcado por la British Diabetic Association137.
– Oftalmoscopia indirecta/biomicroscopia con lámpara de hendidura: tiene una sensibilidad y una especificidad mayores del 80%, con buena relación coste/beneficio. Útil para el diagnóstico, pero no para monitorizar los cambios. Debe ser realizado por personal muy experto.
– Fotografía digital midriática de varios campos, con sensibilidad y especificidad mayores del 85%. Considerada como el estándar, precisa instrumental complejo, caro y de personal especializado; obliga al paciente a desplazarse al centro especializado; minusvalora lesiones periféricas si el campo es insuficiente y pierde sensibilidad si la imagen no es lo bastante nítida (frecuente en personas mayores)137,138. Al igual que otras técnicas, es menos eficaz que la fluoresceingrafía en la detección de las zonas sin perfusión (útil en la maculopatía) y del escape de líquido por aumento de permeabilidad capilar71.
– La combinación de las últimas dos técnicas aumen-ta su eficacia con un coste económico y social mayor.
– Fotografía no midriática y fotografías digitales. Las imágenes se pueden almacenar o incorporar a la historia del paciente. Su sensibilidad y especificidad son mayores del 80%, con el mejor cociente coste/be-neficio de entre las técnicas habituales139-141. Puede ser realizada por personal técnico no médico y hay medios portátiles, con lo que se evita el desplazamiento de los pacientes y se descongestionan las consultas de oftalmología.
– Teleoftalmología: soporte de las técnicas fotográficas digitales, posibilita la lectura de imágenes a distancia por un experto142.
¿Cuándo y cómo realizar el cribado de la retinopatía diabética?
Si bien hay acuerdo unánime en la necesidad de un cribado precoz, en cuanto a la frecuencia y los medios necesarios las opiniones son dispares. A continuación se enumeran las propuestas de distintas guías.
La guía escocesa del 2003 indica143:
– Fotografía simple de la región macular, sin midriasis, dilatando la pupila si la foto no tuviera suficiente calidad.
– Si persisten las dudas,realizar biomicroscopia con lámpara de hendidura.
– La agudeza visual debe medirse en cada ojo.
La Sociedad Americana de Diabetes recomienda144:
En el País Vasco145 las recomendaciones para un cribado de alto riesgo en pacientes sin retinopatía conocida, el estudio con cámara no midriática debe efectuarse cada 3 años en DM2 y cada 4 años en DM1, que se reduce a 2 años en los diabéticos con retinopatía leve.
En Andalucía, según el Plan Integral de Diabetes 2003-2007146, se aconseja:
Se hace hincapié en las ventajas que proporciona la telemedicina, insistiendo en la necesidad de medir la agudeza visual junto con la retinografía.
El Grupo de Estudio de la Diabetes en Atención Primaria de la Salud (GEDAPS)147:
En Cataluña148, se aconseja cribado bianual en los casos sin retinopatía diabética, con cámara no midriática, además de la medición de agudeza visual y tonometría. La fotografía se efectúa en la atención primaria y la lectura por un oftalmólogo o por un médico de atención primaria entrenado.
EVOLUCIÓN DE LOS INDICADORES DE CALIDADCribadoAdemás del buen control metabólico, la prevención de la ceguera o de la deficiencia visual en la diabetes se relaciona con la detección precoz y los programas de revisión149. El cribado sistemático de la retinopatía diabética es un criterio que se utiliza como indicador de calidad del proceso asistencial. La detección precoz de la retinopatía diabética y su pronto tratamiento pueden disminuir la incidencia de la pérdida de visión grave en más del 50% en casos de edema macular y del 90% cuando se trata de una retinopatía proliferativa150. En Inglaterra y Gales, un programa destinado a la prevención de la ceguera que se basaba en el cribado sistemático logró prevenir la aparición de 260 nuevos casos de ceguera por año en pacientes diabéticos de menos de 70 años, y el 10% de los casos de ceguera del adulto por todos los conceptos151. Además, la prevención reduce significativamente el coste de la diabetes152. La evidencia que la aplicación precoz de la fotocoagulación en el tratamiento de la retinopatía diabética puede prevenir la pérdida moderada de visión y la evolución a ceguera, también obliga a considerar esta práctica como un instrumento muy importante en la prevención terciaria en los casos de RDP o maculopatía diabética39. En este sentido, algunos estudios confirman que la práctica de la fotocoagulación se ha incrementado significativa-mente entre los portadores de retinopatía diabética, como en el trabajo de Romero-Aroca et al153 que muestra que en 1993 la panfotocoagulación se había realizado en el 9,58% y en 2005 en el 29,5% entre los pacientes con retinopatía diabética153.
La importancia del cribado periódico de la retinopatía diabética se pone de manifiesto en el estudio realizado en la ciudad sueca de Laxa, que tras haber iniciado en 1983 un programa de diagnóstico precoz de la DM2 y otro de revisión oftalmológica periódica, en un corte transversal entre 1996 y 1998 no se detectaron diferencias en la prevalencia de déficit de visión y de ceguera entre esta población con DM y una de control apareada por edad y sexo154.
A pesar de que hay suficiente evidencia y de que las recomendaciones de muchas guías de manejo de la DM aconsejan el cribado sistemático155,156, algunos estudios todavía señalan un bajo cumplimiento de esta recomendación, que no alcanza en muchos casos ni el 50% de los pacientes con el fondo de ojo revisado en el período de 1 año150.
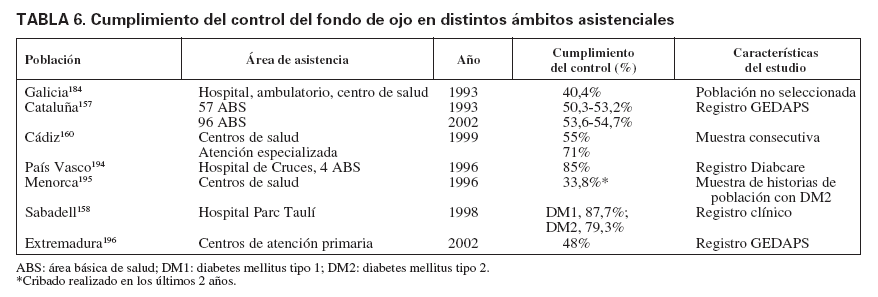
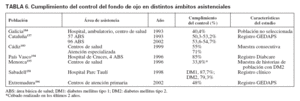
En la actualidad hay pocos registros en España que permitan valorar la evolución de los indicadores de calidad, que se incluían en los objetivos de Saint Vincent, tales como que se realice el cribado para la detección precoz de retinopatía diabética o la reducción a un tercio de la ceguera causada por la diabetes. No obstante, algunos grupos de algunas comunidades han seguido planes de control de calidad que han permitido conocer el resultado y la evolución de algunos de estos indicadores. El porcentaje de pacientes a quienes se ha revisado el fondo de ojo es un indicador de proceso que se incluye en el paquete de indicadores para realizar el control de calidad asistencial en diabetes. Los pocos datos disponibles muestran una gran variabilidad (tabla 6), aunque los resultados parecen mejores cuanto más especializada es el área de control. Como se puede observar, las cifras de población a la que se le ha realizado el control oftalmológico en 1-2 años oscilan entre menos del 25%146, el 50%157 y, en los mejores casos, hasta el 87%158. Destaca el análisis realizado a los 10 años en el registro de GEDAPS de Cataluña en el que no se había observado un aumento en el porcentaje de cribado de retinopatía en ese período157. También en el estudio realizado en Girona en 1994, en una muestra de su población con diabetes, sólo el 16,7% conocía tener retinopatía diabética, cuando el 30,3% la presentaba. Es decir, que probablemente casi la mitad de los portadores de retinopatía diabética no habían sido diagnosticados159.
TABLA 6. Cumplimiento del control del fondo de ojo en distintos ámbitos asistenciales
En Andalucía, algunas evaluaciones indicaban que en el año 2000 la mayoría de las áreas básicas de salud no llegaban al 25% de cumplimiento en el control del fondo de ojo, y alcanzaba casi el 40% cuando se trataba de unidades clínicas de atención primaria. Otra evaluación realizada en la provincia de Cádiz mostraba que en atención primaria el cumplimiento era del 55% y en la atención especializada, del 71%160.
Cambios en la incidencia de las CODCambios en la retinopatía diabética
Los indicadores de resultado final contribuyen a evaluar si el proceso asistencial ha sido efectivo y, por lo tanto, si se ha logrado reducir o eliminar, en este caso, la incidencia de retinopatía o de la disminución de agudeza visual. ¿Realmente en los últimos años hay evidencias sobre si hay cambios en la incidencia de las COD? No hay referencias epidemiológicas en España que den una visión general de la evolución de la retinopatía diabética en los últimos años. Los estudios realizados más recientemente muestran una disminución en su prevalencia, respecto a los que se hicieron en los años noventa, y no son tan evidentes los cambios en la prevalencia de RDP (tabla 4), ceguera y baja visión (tabla 2). Sin embargo, no se dispone de estudios de cohortes que analicen los cambios de incidencia y hay muy pocos estudios de carácter transversal que realicen cortes, en distintos períodos, entre la población con diabetes de la misma zona que permitan apreciar con mayor certeza los cambios en la prevalencia de retinopatía diabética en España. De los estudios revisados, destacan los realizados entre población con DM2 de la comarca del Baix Camp en los que, con una metodología similar, la prevalencia general de retinopatía pasó del 39,4% en 1993161 al 27,5% en 2005153. La RDP pasó del 7,7 al 4%. En los estudios llevados a cabo entre la población con diabetes de Extremadura la prevalencia general de retinopatía diabética disminuyó discretamente; pasó del 40,5% (año 1993)24 al 35,7% (1997-2001)162. No obstante en 2002, en poblaciones afectas de diabetes en Badajoz163 y Cáceres164, se aprecia una marcada disminución de la retinopatía diabética si se compara con los datos de Extremadura de los estudios previos.
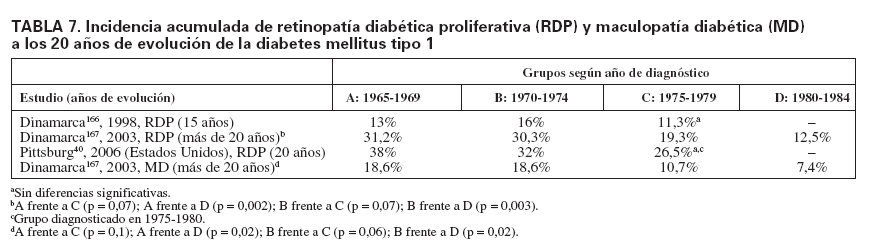
En otros países, diversos estudios observan cambios en la incidencia de retinopatía diabética a lo largo de los años, pero no siempre significativos. En Pittsburg, se estudiaron diferentes cohortes en función del año de diagnóstico de la DM1. Cuando la cohorte diagnosticada entre los años 1965 y 1970 se comparaba con el grupo diagnosticado entre 1975 y 1980, a los 20 años de evolución la incidencia acumulada de RDP disminuía claramente (el 38 frente al 26,5%), aún sin alcanzar la significación estadística40. Datos muy similares se muestran en los estudios realizados en Wisconsin, donde se observó una disminución de la incidencia acumulada de RDP a los 15 años de evolución en la población con DM1 analizada en 1984 (50%)165 y la estudiada en 1998 (37%)37. Rossing et al166, en Dinamarca, en cohortes analizadas según el año de diagnóstico, a los 15 años de evolución evidenciaron una significativa mejoría de la agudeza visual en la cohorte de diagnóstico más reciente respecto a las de años previos, pero no encontraron cambios significativos en la incidencia acumulada de retinopatía diabética, RDP ni maculopatía diabética. Sin embargo, estas mismas cohortes estudiadas a los 20 años presentaban un descenso significativo de la incidencia acumulada tanto de RDP como de maculopatía diabética, que fue muy evidente en la última cohorte (tabla 7). También fue muy significativo el descenso en la incidencia de nefropatía167. Resultados similares obtuvo un estudio realizado en Suecia, en cohortes según el año de diagnóstico, empezando en el período 1961-1965 y seguido por quinquenios hasta el último grupo diagnosticado entre 1981 y 1985. La retinopatía diabética grave se iniciaba a partir de los 10 años del diagnóstico, y la incidencia acumulada por cada cohorte, en los primeros años de estudio (15 años), no mostró diferencias significativas168. Sin embargo, las mismas cohortes analizadas a los 25 años de evolución de la diabetes presentaron una significativa disminución de la incidencia acumulada de retinopatía diabética grave entre la cohorte de 1961-1965 y la de 1971-1975 (el 47,3 frente al 23,6%), sin ningún cambio relevante en la incidencia de RDNP, y se observó un 80% de pacientes afectados cuando la duración era de más de 25 años169. Respecto a cambios en la DM2 hay pocos estudios; destaca el realizado en Indianápolis que comparaba la prevalencia de retinopatía diabética en 19971998 en una población de casi 7.000 pacientes con DM2 y otra estudiada en el período 1980-1982. Los resultados indicaban que la prevalencia de RDNP se había reducido significativamente pero no así la RDP y la maculopatía diabética170.
TABLA 7. Incidencia acumulada de retinopatía diabética proliferativa (RDP) y maculopatía diabética (MD) a los 20 años de evolución de la diabetes mellitus tipo 1
En estos estudios de cohortes, en los que se observa una disminución de la incidencia de retinopatía diabética y microangiopatía en general, el cambio se ha atribuido a un mejor control metabólico, de la presión arterial, a una menor prevalencia de tabaquismo entre las cohortes de diagnóstico más reciente169 y también al empleo de fármacos, como los IECA103,171. Por otro lado, los cambios positivos en cuanto a la disminución de la microangiopatía se hacen más evidentes cuando se estudian grupos de DM de larga evolución. La disminución de la prevalencia de retinopatía diabética en el estudio de Indianápolis se relaciona indudablemente con la mejora en el control metabólico (HbA1c,el 10,37% del grupo 1980-1982 frente al 7,84% del grupo 1997-1998), pero los autores también argumentan que en el grupo de estudio más reciente el diagnóstico de la diabetes había sido más precoz170.
Cambios en la ceguera
Tampoco hay en España estudios de cohortes para conocer el posible cambio de la incidencia de ceguera en la población con diabetes. Utilizando como referente la base de datos de la ONCE, puede observarse que el porcentaje anual de nuevos afiliados a esta organización con el diagnóstico de retinopatía diabética apenas se ha modificado en los últimos 10 años, que oscila entre el 9 y el 12%, sin que se observe una tendencia a la disminución20. Aunque obviamente no son datos representativos de la población, éstos irían a favor de que en España la ceguera o el déficit visual por retinopatía diabética no ha disminuido. En este sentido, los estudios de prevalencia de ceguera que se presentan en la tabla 2 no muestran que ésta se haya reducido entre los realizados hace más de 10 años y los más recientes, a excepción de los dos estudios efectuados en la población del Baix Camp (Tarragona) en los que se aprecia una disminución de la prevalencia entre la muestra estudiada en 1993 y la de 2005 (el 11,2 frente al 4,9%)153,161. En el mismo estudio también se muestra una disminución de la prevalencia de ceguera entre los pacientes ya afectos de retinopatía (el 28,4 frente al 17,5%). En Cataluña, los datos de GEDAPS obtenidos de la atención primaria no mostraron ningún cambio en la prevalencia de amaurosis en DM2, que era de un 2% en 1993 y un 2,1% en 2002172.
En otros países los cambios son más evidentes. En Suecia, algunos estudios han demostrado un descenso de la ceguera entre la población con diabetes173; destaca el de Backlund et al174 que muestra que la incidencia descendió en un 47% entre 1981 y 1995. Datos parecidos se obtuvieron de una zona de Polonia donde la incidencia por 100.000 habitantes/año disminuyó del 3,9 (período 1989-1994) al 0,7% (período 2000-2004)175. Estos cambios positivos se relacionan, obviamente, con un mejor control metabólico, pero también con los programas de cribado y la fotocoagulación precoz.
En resumen, contrariamente a lo observado en otros estudios de Europa o Estados Unidos, la contribución de la diabetes a la ceguera en nuestro país no parece que se haya reducido, aunque sí hay datos que indicanque la retinopatía diabética está disminuyendo. Únicamente el diagnóstico precoz de la DM2, el cribado periódico del fondo de ojo para descartar retinopatía diabética, el estricto control de la glucemia y de la presión arterial han demostrado ser eficaces para reducir la incidencia de retinopatía diabética y maculopatía diabética y, así, de la deficiencia visual y la ceguera176.
Algunas comunidades autónomas, como Cataluña, Andalucía, País Vasco, entre otras, están apostando por facilitar el cribado sistemático en las áreas básicas de salud, aumentando la disponibilidad de cámaras no midriáticas en muchos centros. Esta medida podrá mejorar el diagnóstico precoz de la retinopatía diabética y así permitir el tratamiento más adecuado a tiempo para reducir el riesgo de su progresión y el de ceguera.
AGRADECIMIENTOSLos autores agradecen al Sr. Xavier Grau, Director General Adjunto de Servicios Sociales para Afiliados de la ONCE y a la Dra. Elvira Martín su amabilidad para acceder a los datos de su Organización.
Correspondencia: Dr. L. Vila. Servicio de Endocrinología y Nutrición. Hospital Dos de Maig. Dos de Maig, 301. 08025 Barcelona. España. Correo electrónico: lluis.vila@sanitatintegral.org
Manuscrito recibido el 11-12-2007 y aceptado para su publicación el 30-7-2008.