La detección precoz de la hipercolesterolemia familiar heterocigota (HFH) es necesaria para prevenir eventos cardiovasculares prematuros. Nuestro objetivo es describir el desarrollo de una jornada de detección de HF (JHF) en el Área de Gestión Sanitaria Norte de Cádiz (AGSNC) para su cribado en España, así como analizar los datos obtenidos.
Pacientes y métodosEstudio transversal de una JHF en cascada a la que acudieron los casos índices (CI) diagnosticados genéticamente y sus familiares de primer y segundo grado subsidiarios de presentar HFH. Se analizaron variables clínicas, sociodemográficas y se recogieron muestras biológicas para estudio genético.
ResultadosSe estudiaron 132 sujetos: 21 CI y 111 familiares; 16 eran menores de 18años, con una edad media de 11,4años (DE: 4,57). De los mayores de 18años, el 56% (n=65) fueron mujeres, con una edad media de 45,2años (DE: 15,9). Noventa familiares eran portadores de una mutación. La edad media de diagnóstico de los familiares fue de 25años (DE: 17,7), y la de los CI, de 36,4años (DE: 17,2); p=0,01. El tabaquismo activo fue mayor en los familiares que en los CI (26,3% vs 4,8%; p=0,02) y la presencia de arco corneal en menores de 45años era más frecuente en los CI (47,6% vs 12,6%; p<0,001). El 14,3% de CI habían presentado un infarto de miocardio vs el 4,2% de los familiares; p=0,07. El 43,1% estaban con máximo tratamiento hipolipemiante oral.
ConclusionesLa estrategia de detección en cribado identificó al 4% de la población estimada con HF del AGSNC. Esta búsqueda activa de HF en los familiares anticipa su diagnóstico en 11,4años.
Early detection of heterozygous familial hypercholesterolemia (HFH) is needed to prevent premature cardiovascular events. Our aim isto describe the course of an HFH screening detection day in the Northern Cadiz Health Area in Spain and to analyze the data recorded.
Subjects and methodsDescriptive study of an FH cascade screening program. Index cases (ICs) and their 1st and 2nd grade relatives were appointed during a weekend by the FH Foundation. Venous blood samples were taken from the subjects for genetic, blood, and chemistry tests; specialized medical consultation and physical examination were performed.
ResultsThe study sample consisted of 132 subjects: 21 ICs and 111 relatives (16 under 18years old), with a mean age of 11.4years (SD4.57). Mean age of subjects over 18years was 45.2years. A gene mutation was found in 90 relatives. Mean age at diagnosis was 25years (SD17.7) for relatives and for 36.4years (SD17.2; P=.01) for ICs. Smoking rate was higher in relatives than in ICs (26.3% vs 4.8%; P=.02) and corneal arcus was more common in ICs as compared to relatives (47.6% vs 12.6%; P<.001). Prior myocardial infarction was recorded in 14.3% of ICs and 4.2% of relatives respectively (P=.07). Maximum lipid lowering treatment was being administered to 43.1%.
ConclusionsThe screening detection approach identified the estimated 4% population with HFH in the area, and allows for diagnosing HFH 11.4years earlier.
La hipercolesterolemia familiar (HF) heterocigota (HFH) es la causa genética más frecuente de enfermedad coronaria precoz, y hasta el 10% de los sujetos con eventos coronarios prematuros presentan HFH1,2. En España aproximadamente el 15% de la población con HFH ha presentado un evento cardiovascular aterosclerótico3,4. Por lo tanto, la HFH es un problema de salud pública y su diagnóstico y tratamiento son obligatorios. Su herencia es autosómica dominante y se presenta en aproximadamente el 50% de la descendencia de la persona afectada5,6. La prevalencia de la HFH está aumentando a medida que se van instaurando programas de detección de la enfermedad, desde 1/500 a 1/200 individuos en los últimos estudios realizados7, por otra parte la HF homocigota tiene una prevalencia mucho menor, de aproximadamente 1/450.000 individuos8. La presencia de la enfermedad ateroesclerótica cardiovascular en la HFH se puede prevenir con el tratamiento hipolipemiante disponible: estatinas, ezetimiba9-11 y/o los inhibidores de la PCSK9 que producen una eficaz reducción en los niveles de colesterol LDL (cLDL), contribuyendo a conseguir los objetivos en cLDL9-15 y a reducir los eventos cardiovasculares en estos sujetos. También se dispone de una herramienta precisa que de forma cuantitativa predice el riesgo de un nuevo evento cardiovascular en esta población16, pero existe una necesidad médica no cubierta en el diagnóstico precoz de esta enfermedad. Para ello, existen diferentes estrategias, como por ejemplo la utilizada en los Países Bajos17, o bien otra que, en ausencia de un plan similar en nuestro país, es un programa de detección de fin de semana como el realizado por la Fundación Hipercolesterolemia Familiar (FHF)18,19, que contribuye al diagnóstico y tratamiento para prevenir el desarrollo de enfermedad cardiovascular (ECV) prematura20. En los últimos años se han realizado estudios económicos que han demostrado el coste-efectividad de la implementación del cribado genético en cascada familiar21-23. Sin embargo, el cribado familiar se suele realizar en las familias donde ya existen antecedentes de ECV y no a nivel general de la población con HF. Por tanto, se necesita un programa de detección en nuestro sistema de salud.
El objetivo de nuestro trabajo es describir cómo se desarrolla una Jornada de detección en cascada familiar para el cribado poblacional de HF (JHF) en un área sanitaria de Cádiz, así como analizar los datos clínicos y analíticos para su inclusión en el estudio Spanish Familial Hypercholesterolemia Cohort Study (SAFEHEART).
Material y métodosSe estudiaron familias con HFH del Área de Gestión Sanitaria Norte de Cádiz (AGSNC) que incluye a más de 450.000 usuarios. Las JHF constituyen un estudio descriptivo, transversal, dentro del estudio SAFEHEART, descrito anteriormente19, desarrollado en el Hospital de Jerez de la Frontera por la U.G.C de Medicina Interna y la FHF. Inicialmente se identificó a 32 sujetos con una puntuación de 6 o más puntos siguiendo los criterios clínicos de las redes de las Unidades de Lípidos de Holanda (DLCN) como probables casos índices (CI; sujetos con mayor probabilidad de presentar HFH), y posteriormente se les realizó el estudio genético, que confirmó el diagnóstico de HFH en 22 sujetos (68,7%).
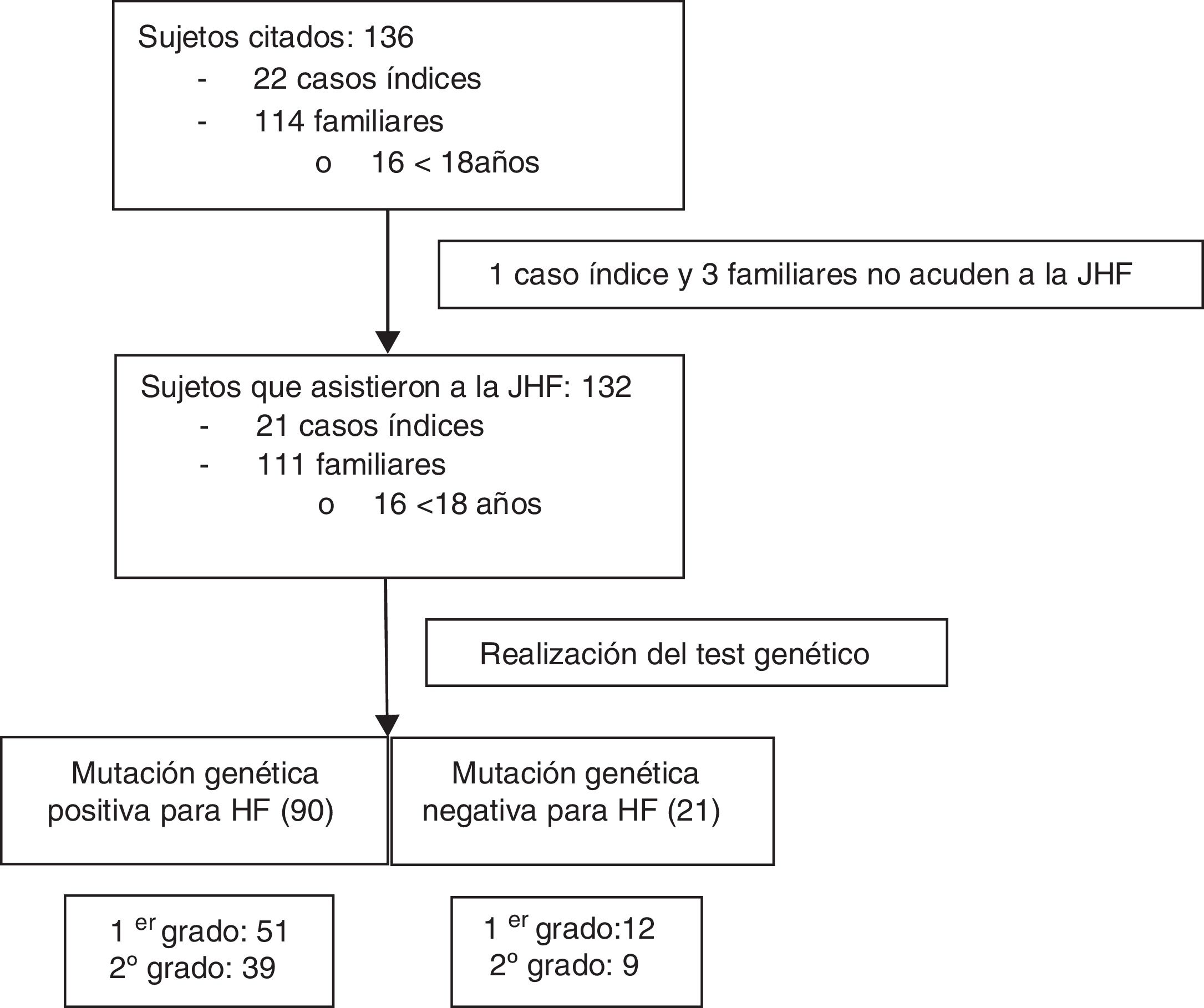
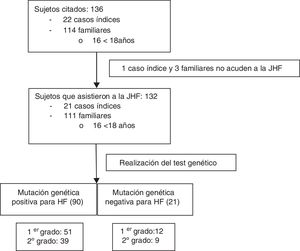
Una vez obtenido el consentimiento informado del CI, la FHF inició el proceso de contacto e información telefónica tanto a CI como a sus familiares de primer y segundo grado compatibles de presentar una HF: colesterol total (CT)>250mg/dl y/o cLDL>190mg/dl en mayores de 18años o CT>220mg/dl y/o cLDL>150mg/dl en menores de 18años (fig. 1). A todos ellos se les citó para asistir a la JHF que se desarrolló durante los días 20 y 21 de febrero de 2016 y en la que participaron seis médicos, dos enfermeras, dos técnicos de laboratorio, una bióloga, una nutricionista y la coordinadora de la cascada familiar. Se incluyó en el estudio a todos los sujetos que asistieron a las JHF.
La JHF se realizó en cuatro fases: recepción de los pacientes, extracción de sangre, consulta médica y realización de la encuesta dietética. Durante la recepción se difundió información sobre la HFH, así como sobre los hábitos de vida saludable. La extracción de sangre venosa se realizó tras 12h de ayuno a todos los sujetos mayores de 11años, tomando muestras en dos tubos de EDTA de 9ml, un tubo de suero con gelbond de 9ml y dos tubos de citrato de 4ml. Las muestras de suero, plasma y ADN se dividieron en alícuotas y se conservaron a −80°C en un banco biológico en el laboratorio centralizado del Instituto de Investigación Cardiovascular situado en el Hospital Sant Pau de Barcelona15. A los menores de 11años se les realizó el test genético en saliva, y los datos bioquímicos se recogieron a partir de análisis previos que aportaron los progenitores. La metodología utilizada para la detección molecular se ha descrito previamente24 y se analizaron los genes del receptor LDL, APOB y PCSK9.
Durante la consulta médica se cumplimentó con cada sujeto el cuaderno de recogida de datos y se realizó una exploración física en la que se determinaron peso, talla, perímetro de cintura, presencia de arco corneal y de xantomas tendinosos, así como la presión arterial en dos ocasiones con un aparato Omron® M3. Por último, los pacientes cumplimentaron varios cuestionarios; la actividad física se midió con la versión reducida del Cuestionario Internacional de Actividad Física (International Physical Activity Questionnaire [IPAQ])25, la calidad de vida con el EQ-5D EuroQoL Group (1990)26, el estado de salud, además de la encuesta London School of Hygiene and Tropical Medicine.
Este estudio fue aprobado por el CEIC-FJD (Fundación Jiménez Díaz) y todos los participantes dieron su consentimiento informado por escrito tanto para la realización del estudio genético como para su inclusión en el estudio SAFEHEART; en el caso de los menores de edad, fue su representante legal. Las JHF entran dentro de la campaña de identificación de nuevos casos de HFH promovidas desde la FHF y que se realizan en España desde el año 200419.
Intensidad de tratamientoLa intensidad de tratamiento se define por grupos según su potencia hipolipemiante de cLDL. Así, clasificamos como de baja potencia el tratamiento que es capaz de disminuir menos de un 30%; moderada, del 30 al 50%; alta, entre el 50 y el 60%, y muy alta si disminuye más del 60%27 (tabla 1).
Clasificación del tratamiento hipolipemiante según la intensidad de reducción del cLDL
| Baja intensidad: disminución de cLDL < 30% |
| Simvastatina 10 mg |
| Pravastatina 10-20 mg |
| Lovastatina 10-20 mg |
| Fluvastatina 40 mg |
| Pitavastatina 1 mg |
| Ezetimiba 10 mg |
| Moderada intensidad: disminución de cLDL del 30 al 50% |
| Atorvastatina 10-20 mg |
| Rosuvastatina 5-10 mg |
| Simvastatina 20-40 mg |
| Pravastatina 40 mg |
| Lovastatina 40 mg |
| Fluvastatina 80 mg |
| Pitavastatina 2-4 mg |
| Simvastatina 10mg + Ezetimiba 10 mg |
| Pravastatina 20 mg + Ezetimiba 10 mg |
| Lovastatina 20 mg + Ezetimiba 10 mg |
| Fluvastatina 40 mg + Ezetimiba 10 mg |
| Pitavastatina 1 mg + Ezetimiba 10 mg |
| Alta intensidad: disminución de cLDL del 50 al 60% |
| Atorvastatina 40-80 mg |
| Rosuvastatina 20-40 mg |
| Simvastatina 20-40 mg + Ezetimiba 10 mg |
| Pravastatina 40 mg + Ezetimiba 10 mg |
| Lovastatina 40 mg + Ezetimiba 10 mg |
| Fluvastatina 80 mg + Ezetimiba 10 mg |
| Pitavastatina 2-4 mg + Ezetimiba 10 mg |
| Atorvastatina 20-40 mg + Ezetimiba 10 mg |
| Rosuvastatina 5-10 mg + Ezetimiba 10 mg |
| Muy alta intensidad: disminución de cLDL > 60% |
| Atorvastatina 40-80 mg + Ezetimiba 10 mg |
| Rosuvastatina 10-20 mg + Ezetimiba 10 mg |
El análisis estadístico se ha realizado con el paquete SPSS v.23 (Chicago, IL, EE.UU.). Para el estudio descriptivo de las variables cualitativas se han utilizado el número de casos y porcentajes; para las cuantitativas con distribución normal, la media y la desviación estándar, y para las que no siguen una distribución normal se ha utilizado la mediana y el rango intercuartílico. Se ha utilizado el test chi-cuadrado para comparar características generales cualitativas y el test t de Student para las cuantitativas. La magnitud de la asociación ha sido estimada usando la odds ratio (OR), con un intervalo de confianza (IC) del 95%; además, se ha realizado un análisis multivariante. La relación entre variables se considerará estadísticamente significativa con un valor de p<0,05.
ResultadosSe citaron 136 sujetos procedentes del AGSNC. Veintidós eran CI y 114 eran familiares, con una media aproximada de cinco familiares por CI. Cuatro personas citadas no acudieron a las JHF y fueron excluidas (un CI y tres familiares) (fig. 1). De los 132 sujetos que asistieron, 16 eran menores de 18años, con una edad media de 11,4años (DE:4,57), de los cuales 12 eran varones (75%). Dentro de los mayores de 18años, el 56% (n=65) fueron mujeres, y su edad media JHF fue de 45,2años (DE:15,9).
La edad media de diagnóstico para los familiares fue de 25años (DE:17,7), y la de los CI, de 36,4años (DE:17,2); p=0,01. En el 41,4% de los mayores de 18años el diagnóstico clínico de HFH fue realizado por el médico especialista (DLCN≥6); sin embargo, el control posterior se realizaba por el médico de atención primaria en el 53,4% de los casos. El 44,7% (n=59) tenían antecedentes familiares de ECV precoz (antes de los 55años en hombres y de los 60años en mujeres), el 71,2% (n=42) eran eventos coronarios, el 45,8% (n=27) cerebrales (10 de ellos también con afectación coronaria) y el 1,7% (n=1) afectación periférica.
En las JHF se detectó en 90 familiares (81%) una mutación positiva para HFH; el 56,7% de primer grado (n=51). En 21 familiares no se detectaron mutaciones. De entre los 111 casos positivos (84%), se detectó una mutación para RLDL en el 83,8% (n=93), el 63% corresponden a mutaciones de alelo defectuoso y el 32% de alelo nulo, describiéndose una nueva mutación del gen (c.899G>C) de significado incierto en dos sujetos. El 16,2% tenía una mutación en el gen de la APOB (n=18), siendo el 100% defectuosas (7 de ellos además presentaban simultáneamente otra mutación en el gen RLDL).
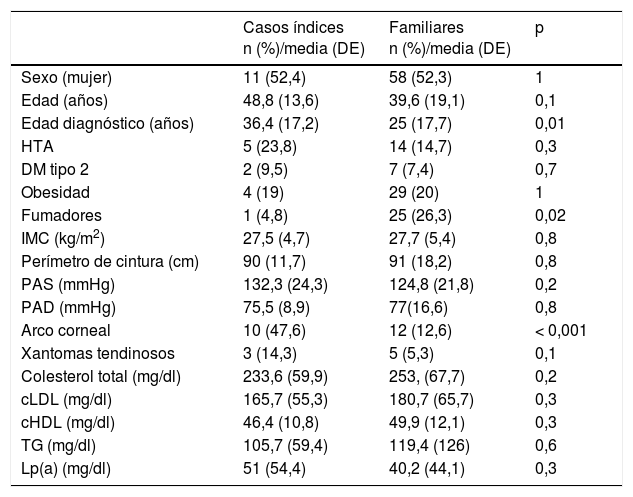
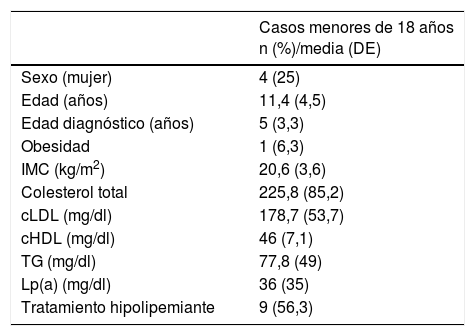
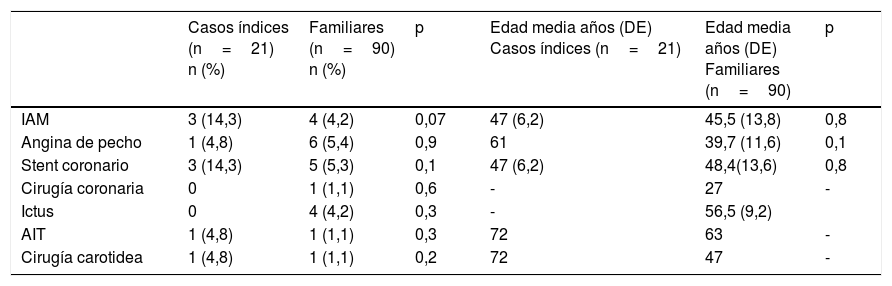
En los sujetos mayores de 18años, el 19% tenían arco corneal antes de los 45años (n=22) y el 6,9% (n=8) xantomas tendinosos, el 16,4% (n=19) tenían hipertensión arterial y el 7,8% (n=9) eran diabéticos. Las características generales de los CI y de los familiares se muestran en las tablas 2 y 3 (menores de 18años). Los antecedentes personales de ECV y la edad de aparición de los eventos se muestran en la tabla 4.
Características generales y perfil lipídico de los pacientes incluidos en el estudio
| Casos índices n (%)/media (DE) | Familiares n (%)/media (DE) | p | |
|---|---|---|---|
| Sexo (mujer) | 11 (52,4) | 58 (52,3) | 1 |
| Edad (años) | 48,8 (13,6) | 39,6 (19,1) | 0,1 |
| Edad diagnóstico (años) | 36,4 (17,2) | 25 (17,7) | 0,01 |
| HTA | 5 (23,8) | 14 (14,7) | 0,3 |
| DM tipo 2 | 2 (9,5) | 7 (7,4) | 0,7 |
| Obesidad | 4 (19) | 29 (20) | 1 |
| Fumadores | 1 (4,8) | 25 (26,3) | 0,02 |
| IMC (kg/m2) | 27,5 (4,7) | 27,7 (5,4) | 0,8 |
| Perímetro de cintura (cm) | 90 (11,7) | 91 (18,2) | 0,8 |
| PAS (mmHg) | 132,3 (24,3) | 124,8 (21,8) | 0,2 |
| PAD (mmHg) | 75,5 (8,9) | 77(16,6) | 0,8 |
| Arco corneal | 10 (47,6) | 12 (12,6) | < 0,001 |
| Xantomas tendinosos | 3 (14,3) | 5 (5,3) | 0,1 |
| Colesterol total (mg/dl) | 233,6 (59,9) | 253, (67,7) | 0,2 |
| cLDL (mg/dl) | 165,7 (55,3) | 180,7 (65,7) | 0,3 |
| cHDL (mg/dl) | 46,4 (10,8) | 49,9 (12,1) | 0,3 |
| TG (mg/dl) | 105,7 (59,4) | 119,4 (126) | 0,6 |
| Lp(a) (mg/dl) | 51 (54,4) | 40,2 (44,1) | 0,3 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; Lp(a): lipoproteína (a); PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos.
En la edad y el sexo se incluyen sujetos mayores y menores de 18 años.
Características generales y perfil lipídico de los pacientes menores de 18 años
| Casos menores de 18 años n (%)/media (DE) | |
|---|---|
| Sexo (mujer) | 4 (25) |
| Edad (años) | 11,4 (4,5) |
| Edad diagnóstico (años) | 5 (3,3) |
| Obesidad | 1 (6,3) |
| IMC (kg/m2) | 20,6 (3,6) |
| Colesterol total | 225,8 (85,2) |
| cLDL (mg/dl) | 178,7 (53,7) |
| cHDL (mg/dl) | 46 (7,1) |
| TG (mg/dl) | 77,8 (49) |
| Lp(a) (mg/dl) | 36 (35) |
| Tratamiento hipolipemiante | 9 (56,3) |
cLDL: colesterol unido a lipoproteínas de baja densidad; cHDL: colesterol unido a lipoproteínas de alta densidad; IMC: índice de masa corporal; Lp(a): lipoproteína (a); TG: triglicéridos.
Antecedentes personales de enfermedad cardiovascular en pacientes con hipercolesterolemia familiar heterocigota
| Casos índices (n=21) n (%) | Familiares (n=90) n (%) | p | Edad media años (DE) Casos índices (n=21) | Edad media años (DE) Familiares (n=90) | p | |
|---|---|---|---|---|---|---|
| IAM | 3 (14,3) | 4 (4,2) | 0,07 | 47 (6,2) | 45,5 (13,8) | 0,8 |
| Angina de pecho | 1 (4,8) | 6 (5,4) | 0,9 | 61 | 39,7 (11,6) | 0,1 |
| Stent coronario | 3 (14,3) | 5 (5,3) | 0,1 | 47 (6,2) | 48,4(13,6) | 0,8 |
| Cirugía coronaria | 0 | 1 (1,1) | 0,6 | - | 27 | - |
| Ictus | 0 | 4 (4,2) | 0,3 | - | 56,5 (9,2) | |
| AIT | 1 (4,8) | 1 (1,1) | 0,3 | 72 | 63 | - |
| Cirugía carotidea | 1 (4,8) | 1 (1,1) | 0,2 | 72 | 47 | - |
AIT: accidente isquémico transitorio; IAM: infarto agudo de miocardio; Ictus: accidente cerebrovascular.
El 88,8% de los pacientes mayores de 18años (n=103) habían recibido recomendaciones higiénico-dietéticas, pero solo el 31% (n=36) afirmaban cumplirlas siempre y el 50% (n=58) algunas veces. El 81% (n=94) recibían tratamiento farmacológico con estatinas para reducir el colesterol. El 27,6% estaban además en tratamiento con ezetimiba 10mg (n=32), existiendo una diferencia significativa entre el uso de ezetimiba entre CI y familiares (OR:4,9; IC95%: 1,8-13,3; p=0,001). En un análisis multivariante se comparó el perfil lipídico de los familiares positivos y los negativos según la intensidad de tratamiento, sin hallarse diferencias significativas. El 43,1% estaban con el máximo tratamiento hipolipemiante disponible para reducir el cLDL>50% en el momento del reclutamiento, 16 eran CI con una OR del 5,7 (IC95%: 1,9-17; p<0,001) con respecto a los familiares. En la tabla 5 se muestra la potencia hipolipemiante del tratamiento que recibían los casos mayores de 18años del estudio. En cuanto al tratamiento hipolipemiante en los menores de 18años, seis de ellos estaba en tratamiento (37,5%): cinco con estatinas y uno con resinas.
Tratamiento hipolipemiante en los casos índices y sus familiares según la potencia hipolipemiante (ver tabla 1)
| Potencia del tratamiento hipolipemiante | Casos índices (n=21) n (%) | Familiares (n=94) n (%) | p |
|---|---|---|---|
| Sin tratamiento | 3 (14,3) | 34 (36,2) | 0,05 |
| Moderada | 2 (9,5) | 26 (27,7) | 0,08 |
| Alta | 10 (47,6) | 21 (22,3) | 0,01 |
| Muy alta | 6 (28,6) | 13 (13,8) | 0,1 |
Solamente dos pacientes sin ECV alcanzaban los objetivos de cLDL<100mg/dl indicados por las guías, y ninguno de los que tenían antecedentes de ECV conseguían niveles de cLDL<70mg/dl.
DiscusiónLa HFH está infradiagnosticada en España, por lo que, en ausencia de un programa estatal de detección, la estrategia descrita de diagnóstico genético en cascada familiar demuestra que es un modo eficaz de incrementar la detección de pacientes con HFH. Durante la jornada de detección se diagnosticaron genéticamente 90 nuevos casos de HFH, 16 de ellos menores de 18años. Si tenemos en cuenta que la población del AGSNC consta de unos 450.000 usuarios y la prevalencia de la enfermedad es de aproximadamente un caso por cada 200 habitantes, en un fin de semana se diagnosticó el 4% de los sujetos estimados con HFH de esta área.
Por tanto, la realización de una jornada de detección supone un avance en la detección rápida y en el diagnóstico precoz de estos sujetos, siendo la detección genética en cascada familiar, como demuestra un estudio reciente, coste-eficaz21. A pesar de toda la labor que conlleva el contacto sujeto a sujeto a través de las familias, el tiempo para realizar el cribado familiar y el estudio completo de 132 pacientes, es mucho menor que si se diagnosticaran de forma casual en la consulta médica.
Similar a la población general de HFH, la edad de diagnóstico es tardía si consideramos que la indicación de iniciar tratamiento hipolipemiante en estos pacientes se puede plantear a partir de los 8-10años en función de las cifras de cLDL y otros factores de riesgo cardiovascular7. Esta búsqueda activa de HFH ha disminuido en más de 10años la edad de diagnóstico si se compara con series previas10,11, y además, con una diferencia significativa, la edad de diagnóstico de los familiares fue 11,4años inferior a la de los CI.
Por otro lado, la ECV está más presente en los CI que en sus familiares, sobre todo en el caso del infarto de miocardio con una diferencia significativa, pudiéndose explicar por el hallazgo casual de HFH en estos sujetos una vez que ya han sufrido un evento cardiovascular precoz o porque la ECV prematura es uno de los criterios utilizados para el diagnóstico. Si comparamos el perfil lipídico de los CI con respecto a sus familiares, estos presentan niveles más bajos de CT, triglicéridos, cHDL y cLDL, aunque no de manera significativa, posiblemente porque los CI estaban recibiendo un tratamiento hipolipemiante más intenso que los sujetos sin diagnosticar.
Otro dato relevante es que había significativamente menos sujetos fumadores dentro de los CI que en sus familiares diagnosticados de HFH, presumiblemente por el aumento de la ECV en los primeros y una mayor sensibilización respecto a este hábito. Un número mayor de CI con HFH presentaba arco corneal antes de los 45años comparado con sus familiares, posiblemente debido a la mayor edad.
Dentro de las limitaciones del estudio hay que destacar que la selección de los familiares se realizó en aquellos con niveles de cLDL>190mg/dl en adultos y >150mg/dl en menores de 18años. Se utilizó este punto de corte en los niveles de cLDL para rentabilizar el coste del diagnóstico en cascada, lo que puede llevar a que algunos familiares con niveles más bajos de cLDL no fuesen diagnosticados en ese momento.
ConclusiónLa detección precoz y el cribado en cascada familiar son necesarias para la prevención de la ECV prematura en estos pacientes. Esta estrategia diagnosticó aproximadamente al 4% de la población con HF del AGSNC y la búsqueda activa de casos en los familiares anticipa su diagnóstico en 11,4años, lo que contribuirá a iniciar un tratamiento más precoz.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación Hipercolesterolemia Familiar; el Instituto de Salud CarlosIII (subvención G03/181 y FIS PI12/01289) y el Centro Nacional de Investigación Cardiovascular (beca 08-2008).
AutoríaP. Rubio-Marín: concepción y diseño del manuscrito, recogida de datos, análisis e interpretación de los datos, redacción, revisión, aprobación del manuscrito remitido.
A. Michán-Doña: concepción y diseño del manuscrito, recogida de datos, redacción, revisión, aprobación del manuscrito remitido.
J. Maraver-Delgado: recogida de datos.
R. Arroyo-Olivares: recogida, análisis e interpretación de los datos.
R. Barrado Varea: recogida de datos.
L. Pérez de Isla: recogida de datos.
P. Mata: concepción y diseño del manuscrito, recogida de datos, redacción, revisión, aprobación del manuscrito remitido.
Conflicto de interesesLos autores declaran que no hay conflictos de intereses.
Agradecer a Teresa Pariente la gran labor que realiza en la FHF, ya que sin ella no sería posible la realización de estas JHF, así como a Ángela Cabrera de la Calle y a María Ángeles Muñoz-Arenillas Calbo, enfermeras de la U.G.C. de Medicina Interna del Hospital de Jerez de la Frontera, por su colaboración activa en estas JHF, y a las familias con HF por su inestimable contribución y voluntad de participación.