Evaluar de forma exploratoria un sistema de páncreas artificial durante la realización de ejercicio aeróbico (EAe) y anaeróbico (EAn).
MétodosEnsayo clínico piloto con 5 sujetos con diabetes tipo 1 (4 hombres) de 37±10,9 años, 21,2±12,2 años de evolución de la diabetes tipo 1, usuarios de infusor de insulina y una HbA1c de 7,8±0,5%. Cada uno de los pacientes realizó 3 estudios de EAe y 3 de EAn. El control de la glucemia se realizó mediante el algoritmo de páncreas artificial durante el ejercicio y las 4h posteriores al mismo. Previo al inicio del ejercicio físico se administraron 23g de hidratos de carbono.
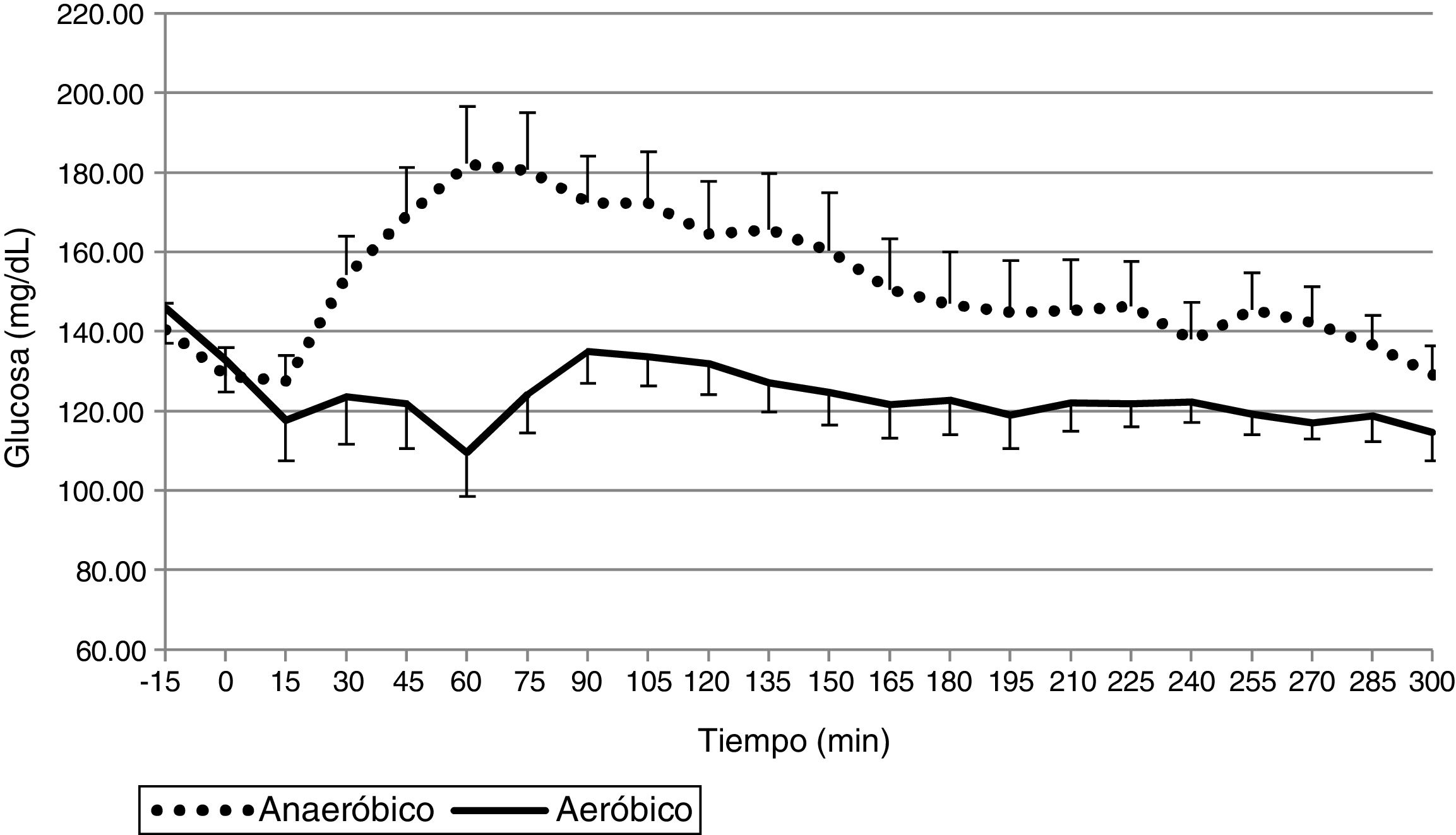
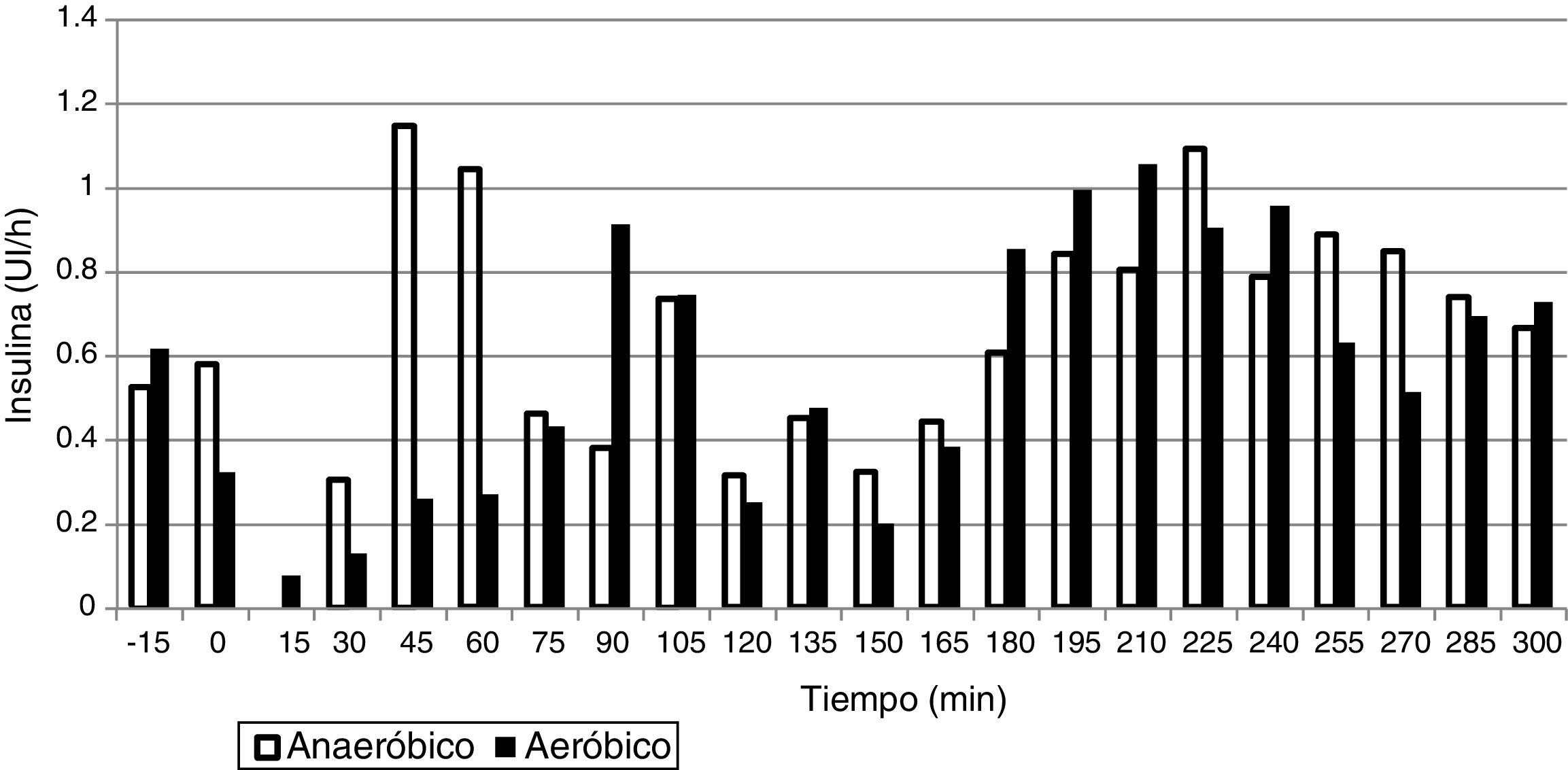
ResultadosLa media de glucosa fue de 124,0±25,1mg/dL en los estudios de EAe y de 152,1±34,1mg/dL en los de EAn. Los porcentajes de tiempo en 70-180, >180 y <70mg/dL fueron: 89,8±18,6% y 75,9±27,6%; 7,7±18,4% y 23,2±28,0%; 2,5±6,3% y 1,0±3,6% durante el EAe y EAn, respectivamente. Únicamente fueron necesarios 6 rescates con 15g de hidratos de carbono en el total de los estudios (4 en EAe y 2 en EAn). La dosis total de insulina durante las 5h de estudio en los estudios de EAe fue de 3,1±1,0UI y de 3,5±1,3UI en los EAn.
ConclusionesLa respuesta glucémica al EAe y al EAn es diferente. El sistema de páncreas artificial evaluado parece controlar de forma eficaz y segura la glucemia durante el ejercicio y las 4h posteriores al mismo, aunque es necesario el diseño de nuevas estrategias de control que minimicen la intervención del paciente.
To assess an artificial pancreas system during aerobic (AeE) and anaerobic exercise (AnE).
MethodsA pilot clinical trial on five subjects with type 1 diabetes (4 males) aged 37±10.9 years, diabetes diagnosed 21.2±12.2 years before, insulin pump users, and with a mean HbA1c level of 7.8±0.5%. Every subject did three AeE and three AnE sessions. Blood glucose levels were monitored by the artificial pancreas system during exercise and up to four hours later. Before the start of exercise, 23g of carbohydrates were administered orally.
ResultsThe mean glucose level was 124.0±25.1mg/dL in the AeE studies and 152.1±34.1mg/dL in the AnE studies. Percent times in the different glucose ranges of 70-180, >180 and <70mg/dL were 89.8±18.6% and 75.9±27.6%; 7.7±18.4% and 23.2±28.0%; and 2.5±6.3% and 1.0±3.6% during the AeE and AnE sessions, respectively. Only six rescues with carbohydrates (15g) were required during the studies (4 in AeE and 2 in AnE). Total insulin dose during the five hours of the study was 3.1±1.0IU in the AeE studies and 3.5±1.3IU in the AnE studies.
ConclusionsBlood glucose response to AeE and AnE exercise is different. The evaluated artificial pancreas system appeared to achieve effective and safe blood glucose control during exercise and up to four hours later. However, new control strategies that minimize patient intervention should be designed.
Los avances terapéuticos en el tratamiento de la diabetes tipo 1 (DT1) en las últimas décadas han incrementado significativamente la expectativa de vida de los pacientes. Sin embargo, los individuos con DT1 tienen un riesgo de 4 a 8 veces mayor de desarrollar enfermedad cardiovascular en comparación con aquellos sin diabetes.
El ejercicio físico ha demostrado múltiples beneficios asociados a reducción del riesgo cardiovascular, como son la mejoría del perfil lipídico, la reducción del peso y la grasa corporal o la presión arterial. Por ello, las guías clínicas más recientes recomiendan la realización de ejercicio físico de forma regular en los pacientes con DT11. Sin embargo, también es ampliamente conocido que el manejo de la glucemia durante y tras la realización de ejercicio físico es complejo sea cual sea la modalidad de tratamiento que el paciente utiliza dado que la administración de insulina de forma exógena es incapaz de mimetizar el complejo sistema fisiológico que interviene en la regulación de la glucemia.
Múltiples factores como el tipo de ejercicio, la duración e intensidad del mismo, la condición física del paciente, el momento del día en que se realiza o la realización de ejercicio o no los días precedentes condicionan la respuesta glucémica al ejercicio en los pacientes con DT1. La participación de esta gran cantidad de factores conlleva que sea altamente complejo predecir el comportamiento de la glucemia en respuesta a la realización de ejercicio físico y, por tanto, sea difícil estandarizar el manejo de la terapia durante y tras la realización de ejercicio. No obstante, algunas guías han sido publicadas recientemente2 con el objetivo de resumir la información obtenida de múltiples trabajos que analizan la respuesta fisiológica al ejercicio en los pacientes con DT1 y de este modo facilitar unos consejos generales para el manejo de la glucemia durante los diferentes tipos de ejercicio físico que posteriormente deberán individualizarse.
Los sistemas de páncreas artificial utilizan los valores de glucemia intersticial recogidos por un sensor de monitorización continua para calcular de forma automática mediante algoritmos matemáticos la dosis de insulina a administrar para mantener los valores de glucemia dentro de un rango objetivo. Estos sistemas han demostrado mejorar el control glucémico en pacientes con DT1 en estudios domiciliarios respecto a los sistemas convencionales en que el paciente es el encargado de tomar las decisiones en cuanto al manejo terapéutico3,4. Sin embargo, las variaciones impredecibles y rápidamente cambiantes en los requerimientos de insulina asociados a la realización de ejercicio físico en los pacientes con DT1 suponen un reto para los sistemas de páncreas artificial. Particularmente, el descenso inicial de las cifras de glucosa que se produce habitualmente tras el inicio de la realización de ejercicio aeróbico (EAe) supone un reto para los sistemas de páncreas artificial unihormonal puesto que la única acción que pueden llevar a cabo es la detención de la infusión de insulina y, si esta se realiza tras haber detectado el descenso de la glucemia, suele ser totalmente infectiva.
Nuestro grupo ha evaluado recientemente un sistema de páncreas artificial (sistema SAFE, de safe auxiliary feedback element) durante el periodo posprandial con resultados favorables5. Dado que el periodo posprandial también se asocia a cambios rápidos y poco predecibles en los niveles de glucosa, se ha querido evaluar de forma exploratoria el comportamiento de este sistema de páncreas artificial durante la realización de EAe y de ejercicio anaeróbico (EAn) de forma controlada.
Material y métodosSe llevó a cabo un ensayo clínico exploratorio que incluyó 5 pacientes con DT1. El protocolo fue aprobado por el Comité Ético del Hospital Clínic de Barcelona y los pacientes firmaron el consentimiento informado previo al inicio de su participación en el estudio. Los criterios de inclusión fueron los siguientes: pacientes de entre 18 y 60 años con DT1 de al menos un año de evolución, en tratamiento con bomba de insulina durante un mínimo de 6 meses, con HbA1c entre 6 y 8,5%. En todos ellos se excluyó hipoglucemia desapercibida mediante el test de Clarke6.
Cada sujeto realizó 6 estudios de ejercicio en entorno hospitalario con al menos una semana de diferencia entre cada uno de ellos. En 3 de los estudios el paciente realizó EAe, mientras que en los otros 3 realizó ejercicio de resistencia. La secuencia en que cada paciente realizó los diferentes tipos de ejercicios se asignó de forma aleatoria mediante programa informático.
Los pacientes fueron instruidos para utilizar un sistema de monitorización continua en tiempo real en la visita inicial del estudio y posteriormente llevaron dicho sistema durante una semana previo al inicio de los ensayos controlados de ejercicio. La información extraída de esta primera semana de monitorización fue utilizada para calcular los siguientes parámetros: ratio insulina/hidratos de carbono, factor de sensibilidad, necesidades de insulina basal y estimación de insulina a bordo basal. Dichos parámetros permitieron tanto el ajuste de la terapia habitual del paciente con bomba de insulina como el ajuste de forma individualizada del sistema de páncreas artificial5,7,8.
Tras la finalización de cada estudio el paciente evaluó la intensidad del ejercicio físico cumplimentando la escala de Borg de esfuerzo percibido9. Asimismo, los pacientes rellenaron esta escala tras la finalización de cada sesión de ejercicio realizada en su vida cotidiana durante el periodo en que estaban participando en el estudio.
Dispositivos del estudioLa infusión subcutánea continua de insulina (ISCI) se realizó mediante dispositivos Paradigm Veo® y la monitorización continua de glucosa (MCG) mediante sensores Enlite2®, ambos de Medtronic Minimed (Northridge, CA, EE.UU.). Los pacientes se colocaban 2 sensores de MCG 24h antes del estudio. Aunque el controlador únicamente utilizaba la información de uno de los 2 sensores (aquel que era elegido como principal antes de la puesta en marcha del controlador tras el análisis del MARD [mean absolute relative difference] de ambos en las horas previas) el segundo sensor tenía como objetivo informar al controlador de la glucemia únicamente en caso de fallo persistente del sensor principal (definido como ARD entre glucosa del sensor y glucosa venosa superior al 40% en una lectura o superior al 30% en 2 periodos de lectura consecutivos). La calibración de los sistemas de MCG se realizó con los glucómetros Contour Next Link® (Ascensia Diabetes Care Holdings AG, Basel, Suiza). Durante el estudio, además, se midieron las concentraciones de glucosa venosa cada 15min con el método de referencia YSI 2300 Stat Plus Glucose Analyzer (YSI 2300; YSI Incorporated Life Sciences, Yelow Springs, OH, EE.UU.).
Las características del sistema de páncreas artificial han sido descritas con detalle previamente5. Se trata de un sistema formado por un controlador principal de tipo PID (proportional-integral-derivative) diseñado para llevar los valores de glucosa a un valor objetivo definido. La particularidad del sistema evaluado es la adición de un controlador externo de tipo SMRC (sliding mode reference conditioning). Este controlador estima en cada periodo la insulina a bordo mediante un modelo farmacocinético y la compara con un límite superior de insulina calculado para cada paciente de forma individualizada a través de los datos de la semana previa de monitorización del paciente y la configuración de los parámetros de la terapia con bomba de insulina habitual del paciente. Cuando la insulina a bordo estimada supera el límite superior fijado para cada paciente, el sistema SMRC modifica el valor de glucosa objetivo del controlador principal con el objetivo de limitar la insulina administrada y evitar así la hipoglucemia secundaria a unos niveles excesivamente altos de insulina activa.
Para el ejercicio las acciones que realiza el controlador son fundamentalmente dos: (a) la glucosa objetivo aumenta de 100 a 150mg/dL desde el inicio del ejercicio durante 45min y posteriormente desciende de forma progresiva durante 2h hasta alcanzar de nuevo 100mg/dL; (b) durante el mismo periodo de tiempo la línea basal de referencia que tiene el controlador y sobre la cual computa desviaciones para calcular la dosis de insulina a administrar en cada momento pasa de ser la que tiene el paciente en terapia ISCI habitual a ser 0, reduciéndose de esta forma la dosis de insulina a administrar.
Estudios de ejercicio físicoLos pacientes llegaban a la unidad de investigación clínica a las 8h de la mañana habiendo realizado un desayuno previamente en el domicilio con administración del bolus sugerido por la bomba de insulina mediante la ratio insulina/hidratos de carbono habitual. Cada paciente realizaba el mismo desayuno en los 6 días de estudio. A su llegada se colocaban 2 vías venosas, una para la extracción de sangre venosa arterializada10 y la otra para la infusión de glucosa/insulina. Para asegurar condiciones metabólicas comparables entre estudios, los pacientes podían recibir glucosa/insulina endovenosa con el objetivo de obtener una glucemia plasmática en torno a 150mg/dL antes del momento en que se iniciaba el control glucémico mediante páncreas artificial. A las 10:45 se iniciaba el control glucémico automático de forma que cada 15min el sistema era informado del valor de glucemia del sensor y decidía la insulina a administrar durante los próximos 15min mediante la variación de la línea basal de la bomba durante ese periodo. Este control automático de la glucosa se mantenía hasta las 16h. El ejercicio físico se iniciaba a las 11h y previo al mismo el paciente tomaba 23g de hidratos de carbono (HHCC) en forma de gel (Diabalance® gel de glucosa acción rápida, Esteve, Barcelona, España) y bebida isotónica (Aquarius®,The CocaCola Company, Atlanta, GA, EE.UU.).
Los estudios de EAe consistían en 3 series de 15min de bicicleta estática al 60% de la frecuencia cardíaca máxima con 5min de descanso entre ellas. Mientras que en los estudios de ejercicio de resistencia el paciente realizaba 5 series de 8 repeticiones de 4 ejercicios de pesas implicando diferentes grupos musculares con un peso correspondiente al 70% de la capacidad máxima con periodos de 90s de descanso entre repeticiones.
Cuando la glucemia plasmática caía por debajo de 70mg/dL en 2 determinaciones consecutivas, se administraban 15g de HHCC vía oral hasta la recuperación de la hipoglucemia.
Análisis estadísticoAl tratarse de un estudio exploratorio no se realizaron comparaciones entre ambos tipos de ejercicio. Únicamente se calcularon medias y desviaciones estándar de glucemias plasmáticas e intersticiales, de porcentajes de tiempo en rango, en hipoglucemia e hiperglucemia, y de dosis de insulina administradas.
ResultadosEn el estudio participaron 5 sujetos con DT1 con las siguientes características: 4 hombres, con una edad media de 37±10,9 años, 21,2±12,2 años de evolución de la DT1, índice de masa corporal de 24,9±1kg/m2 y HbA1c de 7,8±0,5%.
La glucosa plasmática media durante el ejercicio y las 4h posteriores fue de 124,0±25,1mg/dL en los estudios de EAe y de 152,1±34,1mg/dL en los estudios de EAn. Como se puede observar en las figuras 1 y 2, el ejercicio de resistencia inducía un pico hiperglucémico inicial que era compensado posteriormente por un aumento en la administración de insulina, mientras que el EAe inducía una caída de los niveles de glucemia desde los primeros minutos de ejercicio a pesar de que el sistema de páncreas artificial dejara de administrar insulina desde el inicio del ejercicio físico. Estos datos fueron similares cuando se analizaron los datos de glucemia obtenidos del sensor de monitorización continua (EAe: 129,0±27,7; EAn: 152,1±34,1).
El porcentaje del tiempo entre 70 y 180mg/dL fue del 89,8±18,6% en los estudios de EAe y del 75,9±27,6% en los de EAn. Asimismo, el porcentaje de tiempo en hipoglucemia fue del 2,5±6,3% en los estudios de EAe y del 1±3,6% en los de EAn.
Las dosis de insulina administradas durante las 5h de estudio fueron de 3,1±1,0UI en los estudios de EAe y de 3,5±1,3UI en los estudios de EAn. La distribución de la administración de insulina está representada en la figura 2.
En cuanto a la percepción de intensidad del ejercicio, ambos tipos de ejercicio fueron percibidos como de una intensidad similar: puntuación en la Escala de Borg en estudios EAe de 11,5±1,8 y de 10,9±2,6 en EAn y también de una intensidad media similar a la reportada en las sesiones de ejercicio realizadas en domicilio durante el periodo de duración del ensayo clínico (10,6±2,1).
DiscusiónLos resultados de este estudio exploratorio corroboran que la respuesta glucémica al EAe y al ejercicio de resistencia en los individuos con DT1 bajo control automático de la glucemia mediante páncreas artificial es notablemente diferente. Mientras que el EAe induce una caída en los niveles de glucosa rápida y de mayor magnitud, el ejercicio de resistencia tiende a aumentar la glucemia inicialmente para inducir una caída menos pronunciada posteriormente.
Estudios previos de Yardley et al.11,12 en pacientes en tratamiento tanto con múltiples dosis de insulina como con ISCI demostraron que el EAn inducía una menor caída de la glucemia inicial facilitando así evitar la hipoglucemia asociada al ejercicio, que representa una de las barreras principales para la realización de actividad física en los pacientes con DT1. Asimismo, el EAn facilitaba el control glucémico durante las horas posteriores al ejercicio obteniéndose unos niveles de glucosa más estables que tras la realización de EAe. Un metaanálisis publicado posteriormente13 recogiendo las fluctuaciones glucémicas tras diversos tipos de ejercicio en diversos estudios ratifican estos datos.
Las bases fisiopatológicas de estos hallazgos no están totalmente definidas pero tanto en los estudios previamente mencionados11,12 como en otros publicados a posteriori14, en los que se han medido diversos marcadores sanguíneos, se sugiere que el mayor aumento del cortisol y de las catecolaminas durante el ejercicio de resistencia así como de lactato parecen ser los principales responsables de esta diferencia en la respuesta glucémica inicial a ambos tipos de ejercicio.
Dadas estas diferencias, las conductas a realizar deberían ser distintas en función del tipo de ejercicio que lleva a cabo el individuo. Puesto que en muchas ocasiones el ejercicio que realizan los pacientes no es únicamente aeróbico o anaeróbico y que además muchos otros factores intervienen en la respuesta glucémica (intensidad, duración, actividad física los días previos…), la construcción de recomendaciones generales para el manejo glucémico durante el ejercicio es muy compleja y finalmente el paciente deberá tener en cuenta múltiples factores para decidir la conducta a realizar. Una encuesta online realizada a más de 500 pacientes con DT115 en diversas modalidades de tratamiento mostró cómo el manejo de las cifras glucémicas durante el ejercicio es altamente variable entre los pacientes y que gran parte de los mismos refieren dificultades importantes para el control de la glucemia durante el ejercicio.
Los sistemas de páncreas artificial tienen como objetivo principal el control glucémico adecuado liberando al paciente de la toma de decisiones constantes asociadas actualmente al manejo de la DT1. Existen evidencias crecientes de que estos sistemas son capaces de mejorar el control glucémico respecto a las terapias actuales en estudios no controlados y de duración relativamente prolongada3,4. No obstante, el manejo de ciertas situaciones como puede ser el control de la glucemia en el periodo posprandial así como durante el ejercicio siguen representando retos para estos sistemas.
La principal dificultad para el control glucémico durante el ejercicio para los sistemas de páncreas artificial recae en el retraso asociado a la monitorización de la glucosa en líquido intersticial y la administración de la insulina en el tejido subcutáneo con un perfil de acción mucho más lento que la insulina endógena. De forma fisiológica en las personas sin DT1 el inicio del ejercicio produce una reducción en los niveles de insulina sanguíneos16. Dada la cinética de la inyección de análogos de insulina de forma subcutánea, no es posible mimetizar este comportamiento en los sistemas de páncreas artificial, incluso si el ejercicio es anunciado posibilitando acciones de prealimentación. Por tanto, en los últimos años se han publicado diversos trabajos utilizando diferentes estrategias para el control glucémico durante el ejercicio14,17-19.
Una de las estrategias más utilizadas es la administración de HHCC previo y/o durante el ejercicio. Patel et al.20 utilizaron esta estrategia con un sistema de páncreas artificial PID evitando la hipoglucemia en sesiones de EAe poco intenso pero a expensas de unos valores de glucemia relativamente elevados y una ingesta de 30-45g de HHCC por cada sesión de ejercicio.
Otra estrategia empleada ha sido el anuncio del ejercicio al sistema de páncreas artificial previo al inicio del mismo de forma que el algoritmo modifique ciertos parámetros para ser menos agresivo en la administración de insulina reduciendo así el riesgo de hipoglucemia. Esta estrategia ha sido utilizada en el estudio de Jayawardene et al.14, asociada a la ingesta de HHCC previamente al ejercicio en función de la glucemia previa. No obstante, el anuncio de ejercicio se realizaba 120min antes del inicio y esta estrategia parece poco factible en la vida real fuera de ensayos clínicos controlados.
Otros grupos han tratado de añadir al sistema de páncreas artificial monitores de frecuencia cardíaca y otras señales para la detección tanto de la realización de ejercicio17,21 como para la discriminación entre tipos de ejercicio22. Estos sistemas han demostrado detectar correctamente la realización de ejercicio e incluso la discriminación entre EAe y EAn pero, tal y como hemos comentado anteriormente, la realización de cambios en el sistema de páncreas artificial una vez iniciado el ejercicio parece insuficiente para evitar la caída en los niveles de glucosa asociados a la realización de EAe.
Por otra parte, los sistemas de páncreas artificial bihormonales deberían, a priori, ofrecer ventajas respecto a los unihormonales en el contexto de la realización de ejercicio físico dado que, además de la parada en la infusión de insulina, tienen la posibilidad de administrar glucagón para mitigar la tendencia a la hipoglucemia. El único trabajo publicado en que se compara un sistema unihormonal con un sistema bihormonal18 mostró una reducción en el número de hipoglucemias, aunque con un porcentaje no despreciable de sesiones de ejercicio en las que se produjo un episodio de hipoglucemia (11,8 y 6,25% de las sesiones de EAe y de intervalos, respectivamente, con el sistema bihormonal).
Finalmente, la utilización de los análogos de insulina ultrarrápidos que han demostrado un pico de acción más rápido mejorando el control glucémico posprandial en pacientes con terapia ISCI23,24 deberían aportar, teóricamente, beneficios en el control glucémico con sistemas de páncreas artificial especialmente en las situaciones en que, como durante el ejercicio, la variación de la glucemia es rápida. Sin embargo, hasta la fecha no existen estudios publicados que valoren estos nuevos compuestos en sistemas de páncreas artificial durante el ejercicio.
En nuestro estudio piloto hemos evaluado un sistema de páncreas artificial específicamente diseñado para el control de la glucemia durante el periodo posprandial frente a EAe y EAn. El protocolo incluía ingesta previa de HHCC, obteniendo un control glucémico globalmente satisfactorio durante el ejercicio y a las 3h posteriores. Consideramos que el anunciamiento del ejercicio físico puede ser una estrategia muy eficiente para evitar la hipoglucemia, aunque probablemente a nivel de la vida cotidiana el anunciamiento muy precoz es poco factible. Por otra parte, la ingesta de HHCC previa al ejercicio también es una conducta de seguridad eficaz, pero idealmente los sistemas de páncreas artificial deberían poder evitar la ingesta obligada previamente al ejercicio físico a los pacientes con DT1. Es necesario por tanto el diseño de nuevas estrategias de control más eficaces ante el ejercicio que minimicen la intervención del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.