The aim of this paper is to propose a new conceptualization of the term ‘element’ as the basis for a new representation of the periodic system. For this purpose we begin by recalling the dual sense of the concept of element. Next, we develop the ‘limits isotopes’ argument which is the basis of the new periodic chart. This task leads us both to reconceptualize the notion of element and to characterize the term ‘basic substance’. In turn, the argument is used to face the epistemological problem with hydrogen and helium in the periodic table. Finally, the Döbereiner's triads are used to calculate atomic masses in three periodic charts: the medium-long-form, the modified ‘left-step’ proposed by Scerri, and the proposed in this work. Evaluation results allows us to stand out the fruitful predictive power of our periodic system.
La filosofía de la química es una nueva subdisciplina de la filosofía de la ciencia que se ha consolidado plenamente como un campo de investigación interdisciplinario en los últimos años. Entre la amplia variedad de tópicos que se discuten en la actualidad, la tabla periódica es objeto de incesantes discusiones en el plano epistemológico.
A diferencia de la clasificación en biología, donde es continuamente debatida, la tabla periódica representa el sistema de clasificación natural más importante de la ciencia en su conjunto, si bien persisten ciertas diferencias (Scerri, 2011a). Veamos, entonces, cuál es el ordenamiento de los elementos químicos. El criterio primario está dado, de manera unánime, por la secuencia en el incremento del número atómico (Z) de los elementos. El número de electrones en la capa de valencia del átomo —es decir, la forma de agrupar los elementos en familias químicamente similares— establece el criterio secundario, aunque de manera no tan categórica como la anterior. Y el criterio terciario, por su parte, está regido por el valor de n + l (la regla de Madelung, donde n y l denotan los dos primeros números cuánticos) utilizada para diferenciar los electrones de cualquier átomo (Scerri, 2004).1 Muy recientemente se han propuesto las triadas de número atómico como un nuevo criterio secundario para reunir elementos en grupos (Scerri, 2010).
El propósito de este trabajo es reconceptualizar el término ‘elemento’ como base de una nueva representación del sistema periódico fundado en un criterio primario que, creemos, no ha sido abordado hasta el momento. Para tal fin, comenzaremos recordando la distinción de los dos sentidos del concepto de elemento, noción central de la tabla periódica.2 A continuación, presentaremos el argumento que denominamos de los ‘isótopos límites’ que constituirá la base de la nueva representación mencionada. Este argumento, a su vez, nos permitirá redefinir la noción de elemento, caracterizar la noción de ‘sustancia básica’, así como abordar el problema epistemológico de la ubicación del hidrógeno y del helio en la tabla periódica. Posteriormente, utilizaremos la triadas de Döbereiner como herramienta predictiva para el cálculo de masas atómicas comparando, de este modo, la tabla periódica propuesta con la tabla convencional o de longitud media, y con la tabla de ‘escalón izquierdo’ modificada propuesta por Scerri.
2La naturaleza dual del concepto de elementoSuele caracterizarse un elemento como “aquella sustancia que no puede descomponerse en otras más sencillas usando medios químicos”. Esta definición es la que suele encontrarse en los textos universitarios de química general. Dicha noción de elemento, como sustancia simple (es decir, los elementos tangibles y observables), es en la que hizo hincapié Antoine-Laurent de Lavoisier en el siglo XVIII. Pero existe una segunda noción de elemento en un sentido filosófico —en particular, metafísico— que proviene de la Antigüedad clásica. De acuerdo con esta concepción, el término ‘sustancia’ (del latín ‘substare’) literalmente significa aquello que ‘subyace a’, ‘lo que se encuentra debajo de’. La sustancia es aquello que sirve de soporte a las propiedades. Las propiedades pueden cambiar, la sustancia subsiste, permanece. En este sentido, entonces, un elemento es una entidad que consiste de una sustancia y que tiene como propiedad esencial su número atómico; además, puede tener propiedades contingentes que varían según el caso y que no afectan su identidad como tal. Por ejemplo, para el carbono sus propiedades contingentes son sus variedades alotrópicas: diamante, grafito y fullereno, entre otras.
El padre de la tabla periódica, Dimitri Ivanovich Mendeléiev, hacía énfasis, precisamente, en esta naturaleza dual del concepto de elemento. A los elementos concebidos en un sentido metafísico los denominaba elementos abstractos o reales, los cuales tenían, a su juicio, un estatus más fundamental que los elementos concebidos como sustancias simples. De acuerdo con este autor, los elementos como sustancias abstractas carecen de propiedades y representan la forma que los elementos toman cuando se presentan en compuestos. Mendeléiev sostuvo que los elementos reales tienen un único atributo, su peso atómico, que se conserva cuando, por ejemplo, el sodio y el cloro se combinan para formar cloruro de sodio. Asimismo, puso énfasis en señalar que su clasificación periódica tenía que ver con los elementos concebidos como sustancias abstractas y no con los elementos concebidos como sustancias simples. Recientemente se ha sugerido que esta visión más filosófica de los elementos es lo que hizo que Mendeléiev tuviera una perspectiva más abarcadora, ya que sus competidores restringieron su atención a los elementos conceptualizados como sustancias simples (Scerri, 2007).
El descubrimiento de los isótopos, en los comienzos de la física atómica, fue otro paso clave para la comprensión de la tabla periódica. Fue Frederik Soddy (1913) quien acuñó el término ‘isótopo’ para significar dos o más átomos del mismo elemento, químicamente inseparables, pero con diferentes pesos atómicos. La gran cantidad de isótopos de muchos elementos descubiertos provocó la llamada ‘crisis de los isótopos’: entendidos los elementos como sustancias simples que pueden aislarse, pareció existir una repentina multiplicación de ‘elementos’, lo cual condujo a varios químicos a proclamar la desaparición de la tabla periódica como tal y su reemplazo por la tabla de los isótopos.
Pero el radioquímico austríaco Fritz Paneth sostuvo que la tabla periódica de los químicos podía retenerse. Considerando que las propiedades químicas de los isótopos del mismo elemento son indistinguibles, con excepción del hidrógeno, el descubrimiento de nuevos isótopos representaba nuevos elementos como sustancias simples, lo que justificaba dicha hipótesis.3 Su argumento filosófico estaba basado en retomar la naturaleza dual del concepto de elemento de Mendeléiev, es decir, elemento como sustancia simple y elemento abstracto o real, reconceptualizando este último como sustancia básica (Scerri, 2012). De este modo, entonces, Paneth argumentaba que el descubrimiento de nuevos isótopos representaba el descubrimiento de elementos como sustancias simples, mientras que el sistema periódico de Mendeléiev estaba basado en los elementos como sustancias básicas. Esta distinción filósofica ejerció un papel crucial para la supervivencia de la tabla periódica como tal. Sobre la base de los trabajos de Paneth, la IUPAC modificó en 1923 la propiedad esencial del elemento del peso atómico al número atómico (Scerri, 2007).
La distinción del concepto de elemento presentada es altamente relevante en el ámbito de la educación en química. Mientras que los sistemas de educación hispanoparlante y angloparlante utilizan el término ‘elemento’ para denotar su sentido como sustancia simple, en el sistema francés de educación, por el contrario, la noción de elemento denota su sentido metafísico o abstracto (Scerri, 2009a).
3El argumento de los isótopos límites, elemento y sustancia básicaCuando en la segunda parte del siglo XIX Mendeléiev propuso la noción de peso atómico como único atributo del elemento, no sabía (no podía saber) que con dicha propiedad no designaba una cualidad unívoca, sino una serie finita de valores que refieren a un elemento. El valor de peso atómico utilizado por Mendeléiev era, considerando las posibilidades de medición de su época, un valor bastante aproximado para el isótopo más frecuente del elemento.
Si consideramos que cada elemento tiene un determinado número de isótopos, postularemos que tanto el isótopo más liviano (L) como el isótopo más pesado (P) constituyen propiedades representativas del elemento como sustancia básica, basándonos en que existe un número mínimo de neutrones necesario para estabilizar la repulsión de cargas del núcleo y un número máximo admisible para permitir la estabilidad del sistema atómico. De este modo, entonces, existe un intervalo de masas atómicas que conforman los límites ontológicos o límites de existencia del elemento. El oxígeno, por ejemplo, admite isótopos entre 12O y 28O. Estos isótopos límites serían propiedades integrantes de lo que Paneth llama sustancia básica, aunque en la naturaleza el oxígeno se presente mayoritariamente como los isótopos 16O, 17O y 18O (los más abundantes), que serían manifestaciones como sustancia simple. De esta forma, un isótopo de un elemento es representativo del mismo, si y sólo si, cumple con dos requisitos: a) tener el número atómico del elemento en cuestión, y b) poseer una masa atómica comprendida entre L y P. En el caso del oxígeno, un isótopo con Z = 8 y L ≤ 11 o bien P ≥ 29 no sería oxígeno, es decir no tendría las propiedades del oxígeno entendido como sustancia básica. Esto muestra que si bien el número de protones en un átomo denota un elemento unívocamente, resulta necesario considerar, además, que el número de neutrones no desempeña un papel menor al tener límites precisos.
A la luz de estos argumentos, proponemos, entonces, que el elemento como sustancia básica tiene como propiedad esencial su número atómico y también propiedades representativas que son sus números másicos mayor y menor posibles para el elemento dado. Estas masas están representadas por los isótopos límites. La idea remite, de forma indirecta, a la filosofía aristotélica de ‘potencia’ y ‘acto’: mientras que el número atómico y el número másico de cada isótopo se relaciona con el “acto”, con lo que el elemento ‘es siempre’, las masas atómicas límites están relacionadas con la “potencia”, con lo que el elemento ‘fue o puede ser’. Estas dos nociones nos permiten caracterizar la noción metafísica de sustancia básica: todo lo que un elemento es, fue o puede llegar a ser.4 susAsimismo, y sobre la base de lo argumentado, reconceptualizaremos entonces el término ‘elemento’: un elemento es una cierta clase de entidad que consta de una sustancia básica y que tiene dos propiedades representativas, el número atómico y los números másicos límites, y que, a su vez, puede tener propiedades contingentes que varían de caso a caso.
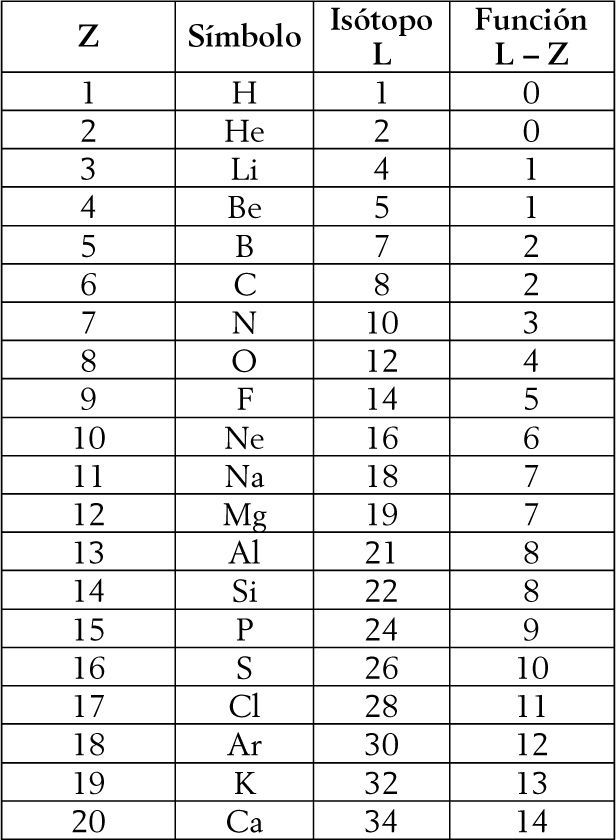
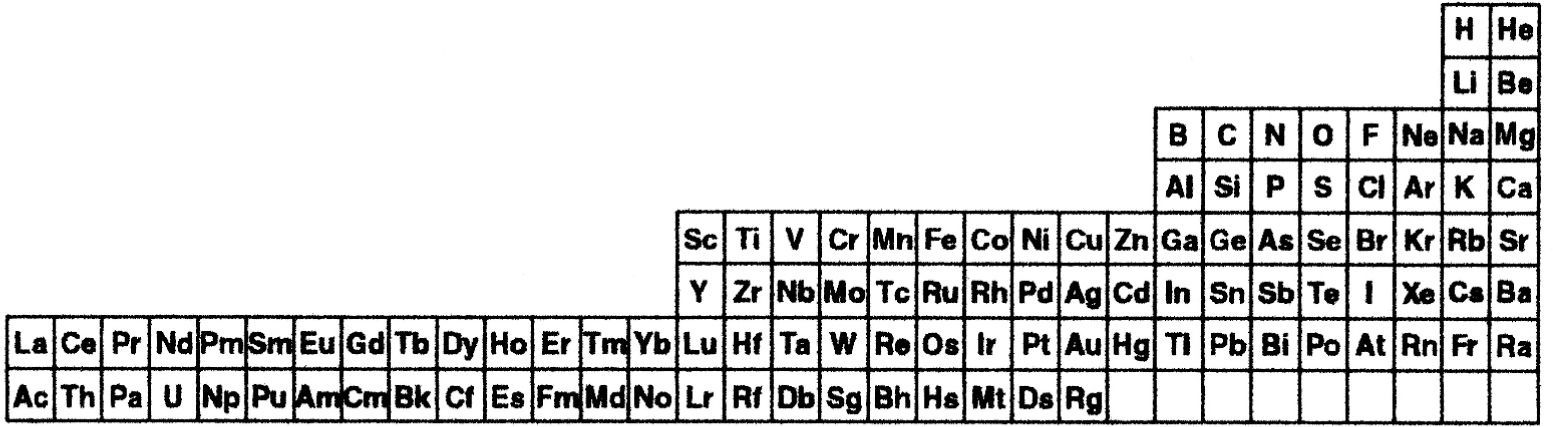
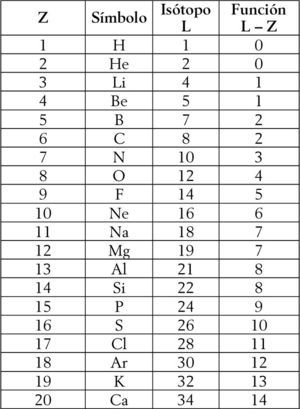
4Una nueva representación del sistema periódicoPara el diseño del nuevo sistema periódico, estableceremos que el criterio primario de ordenamiento (vertical) de los elementos está dado por la función L – Z, es decir, por el número de neutrones del isótopo más liviano. Por su parte, el número atómico creciente constituye el criterio secundario para ordenar los elementos en forma horizontal. Los valores calculados de L – Z para los primeros 20 elementos (hasta el calcio) se indican, a continuación, en la figura 1. Sobre la base de los dos criterios señalados surge la nueva tabla periódica (figura 2).
L representa el número de masa del isótopo más liviano del elemento. La función L – Z indica el número de neutrones del elemento.*
* Hemos empleado la tabla de los isótopos de Holden (2009). En el caso del He, si bien es habitual considerar que L = 3, hay evidencia empírica de la existencia del denominado ‘diprotón’ o 2He (cfr.Gómez del Campo et al., 2001, Rapisarda et al., 2007).
Nueva representación del sistema periódico. Los 46 bloques de elementos están ordenados verticalmente por el número creciente de neutrones del isótopo más liviano (criterio primario) y, horizontalmente, por el número atómico creciente (criterio secundario). El subíndice representa el valor de L – Z y el superíndice el valor de Z.*
* En el caso del elemento 117, véase Oganessian et al. (2010).
Esta representación novedosa del sistema periódico presenta particulares características.5 En primer lugar, y tal como hemos señalado, el criterio primario no es función ya de la carga nuclear, sino del número de neutrones del isótopo más liviano.6 Y el criterio secundario no se basa en la configuración electrónica sino en el número atómico. Creemos que los dos criterios empleados para la representación del sistema periódico guardan relación con el espíritu de Mendeléiev, quien repetidamente resaltaba que su clasificación tenía que ver con los elementos concebidos como sustancia básica.
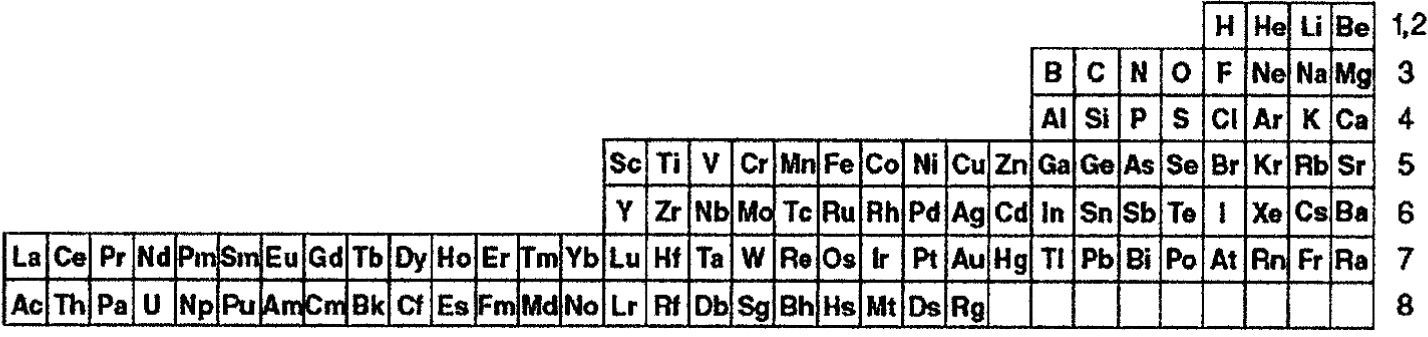
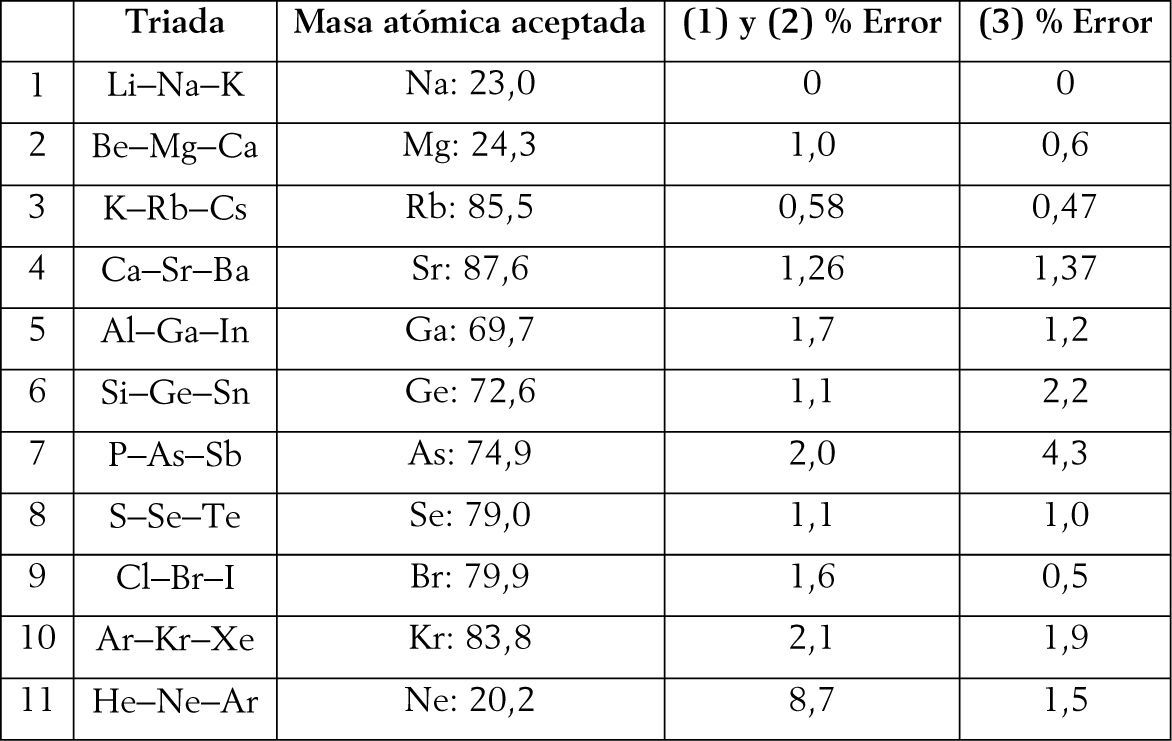
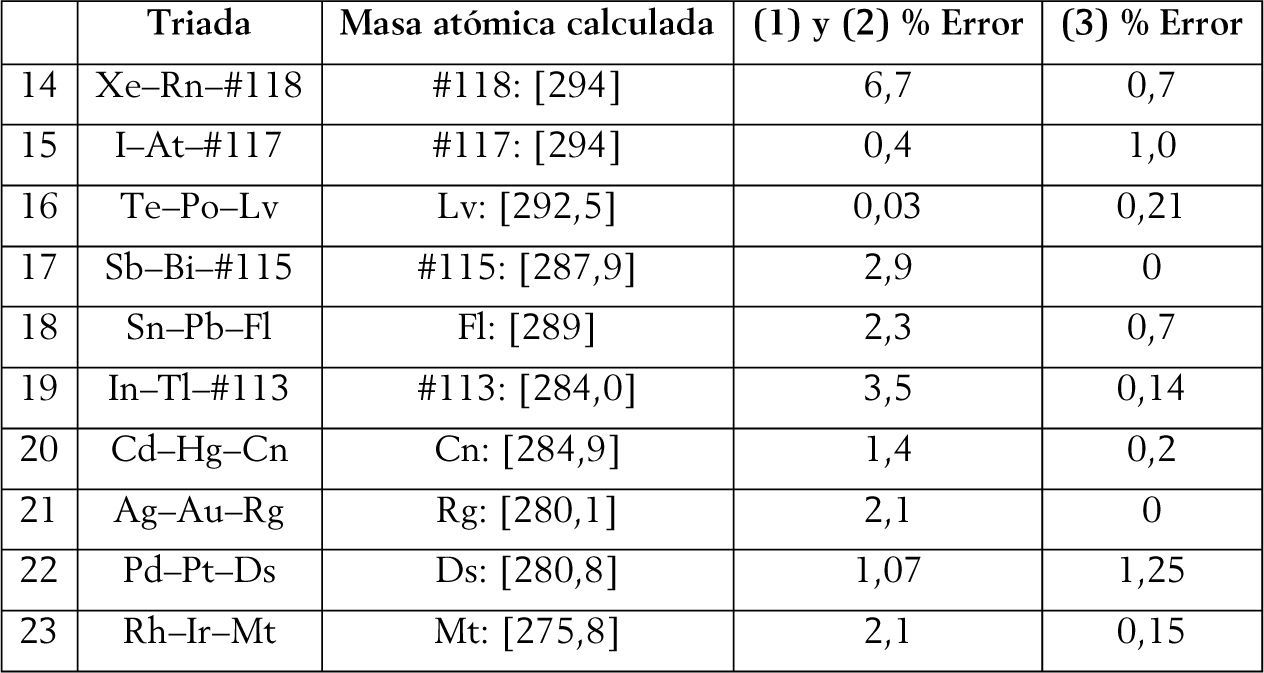
Además, este sistema periódico permite abordar un problema epistemológico contemporáneo, referente a la ubicación de los dos primeros elementos, es decir el hidrógeno y el helio, tal como veremos en la siguiente sección. Asimismo, y como analizaremos en la sección 6, la tabla propuesta maximiza las triadas de número atómico, tal como aboga Scerri (2010, 2011c) en sus últimos trabajos, y en un mayor número que en las tablas que ha propuesto. Dicha maximización de las triadas permitirá advertir que la adecuada capacidad predictiva de las masas atómicas que presenta la tabla periódica propuesta comparada tanto con la tabla de longitud media (figura 4) como con la tabla de ‘escalón izquierdo’ modificada (figura 5).
Tabla periódica de ‘escalón izquierdo’ modificada que ubica el hidrógeno en el grupo de los halógenos y deja el helio en el grupo de los gases nobles (Scerri, 2008, 2010). Los números a la derecha de la tabla representan los valores de n + l, la suma de los dos primeros números cuánticos.
A poco más de 140 años de la publicación de la primera tabla de Mendeléiev, la posición de dos elementos ciertamente controversiales de ubicar son, entre otros, el hidrógeno y el helio, dadas sus particulares propiedades.
En relación al hidrógeno, las opciones que se debaten son cuatro: a) dejarlo en el grupo 1 (metales alcalinos) debido a que posee un electrón en su capa de valencia, aunque “flotando” sobre dicho grupo; b) ubicarlo en el grupo 17 (halógenos) dado que los átomos de hidrógeno pueden formar iones negativos, al igual que los elementos de dicho grupo (Dash, 1964; Sacks, 2006; Laing, 2007) o bien, desde otro argumento, dado que forma la triada perfecta de número atómico H(1), F(9), Cl(17) (Scerri, 2008, 2010); c) ubicarlo en el grupo 14 (carbono) al poseer la mitad de su capa de valencia completa (2 electrones), al igual que el carbono (4 electrones) (Cronyn, 2003), o finalmente, d) debería removerse de la tabla y “flotar” sobre la misma debido a sus anomalías para ubicarlo en algún grupo en particular (Atkins y Kaesz, 2003).
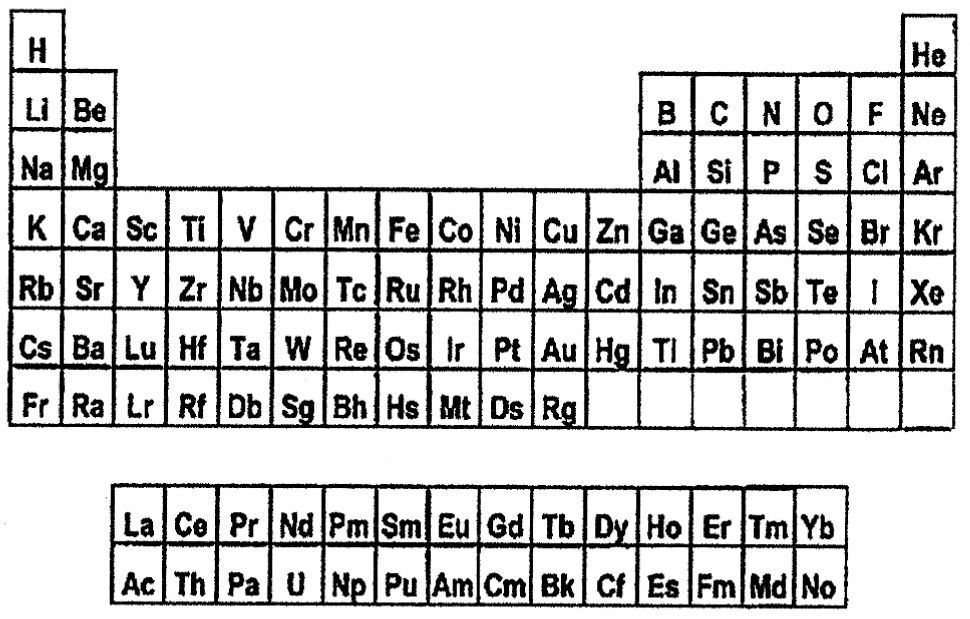
La posición del helio en la tabla ofrece similares inconvenientes. Las dos opciones que se discuten son las siguientes: a) dejarlo en el grupo 18 (gases nobles), tal como se encuentra en la tabla periódica estándar, debido a que es extremadamente inerte (Rich, 2005), o también, dado que forma la triada perfecta de número atómico He(2), Ne(10), Ar(18) (Scerri, 2008, 2010), o bien b) ubicarlo en el grupo 2 (alcalino-térreos) al poseer dos electrones en su capa de valencia, tal como se observa en la tabla periódica de Janet (1929) (figura 3).
Tabla periódica de ‘escalón izquierdo’ (Janet, 1929). La tabla refleja la regla de Madelung, es decir, la manera en que los electrones ocupan orbitales atómicos. Cada periodo comienza con un nuevo valor de n + l, la suma de los dos primeros números cuánticos. El hidrógeno encabeza el grupo de los metales alcalinos y el helio se encuentra entre los metales alcalino-térreos.
Creemos que el argumento de los isótopos límites presentado puede ser útil en esta controversia. Si observamos nuevamente la figura 1, advertiremos que la función L – Z brinda los mismos valores tanto para el hidrógeno como para el helio. En consecuencia, esto podría sugerir que ambos elementos deben ser parte de un periodo separado, lo cual es consistente con la tabla periódica clásica o de longitud media, con la tabla periódica de ‘escalón izquierdo’ (Janet, 1929), así como con una forma modificada de la llamada tabla ‘piramidal’ propuesta por el químico William Jensen en 1986 (Scerri, 2005), por citar sólo algunas de ellas. El argumento brindado es inconsistente, naturalmente, con aquellas tablas periódicas que proponen ubicaciones múltiples para el hidrógeno y el helio (cfr. por ejemplo, Laing, 2009; Rich y Laing, 2011), así como con la propuesta de Atkins y Kaesz (2003) de remover el hidrógeno de la tabla dadas sus particularidades.
6Las triadas de número atómico para formular prediccionesEn 1817 Johann Wolfgang Döbereiner informaba que algunos elementos, que podían agruparse en grupos de tres, presentaban semejanza química y una particular relación aritmética: el peso atómico (o peso equivalente) del segundo elemento en una triada dada, era casi exactamente el promedio de los otros dos elementos.
Curiosamente, Mendeléiev, a diferencia de Döbereiner, empleó predictivamente las triadas (aunque en dos dimensiones: horizontal y vertical) para determinar el peso atómico de ciertos elementos. Por ejemplo, en el caso del selenio Mendeléiev señaló que su peso atómico podía calcularse a partir de los cuatro elementos ‘vecinos’ (As, S, Br, Te). Ya en el siglo XX, y desplazada dicha propiedad como criterio unívoco para ordenar el sistema periódico, el número atómico se convirtió en la propiedad fundamental que permite caracterizar adecuadamente los elementos. Y la noción de triada —ahora de número atómico, es decir, exacta— ha sido sugerida como posible criterio categorial para representar la periodicidad química (Scerri, 2011c), si bien no hay consenso aún respecto de su estatus epistemológico (cfr. Laing, 2009; Schwarz y Rich, 2010).
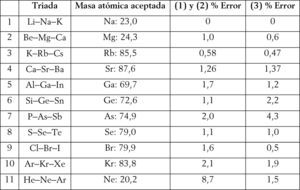
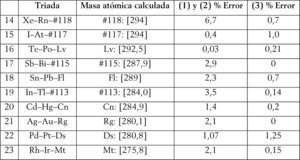
Dada la gran cantidad de tablas periódicas existentes desde la primera presentada por Mendeléiev en 1869, un posible criterio para compararlas es mediante su capacidad predictiva. Específicamente, la idea es determinar la masa atómica de algunos elementos, utilizando la noción de triadas de Döbereiner, calculando el porcentaje de error en cada caso.7 Para ello, compararemos (1) la tabla periódica convencional o estándar (figura 4), (2) la tabla de ‘escalón izquierdo’ modificada (figura 5) (Scerri, 2008, 2010)8, y (3) la tabla periódica que presentamos en este trabajo (figura 2).
La figures 6, 7 y 8 muestran resultados comparativos entre las mismas.
Triadas que involucran elementos translaurencio a partir del meitnerio (Z = 109) y hasta el elemento 118. (Las masas atómicas se calcularon en función de los isótopos y sus tiempos de vida media sobre la base de Wieser y Copler (2011).
Puede apreciarse que el sistema periódico propuesto muestra una capacidad predictiva de las masas atómicas superior (cercana al 70%) comparado con los dos restantes. Y en los casos en que presenta un mayor porcentaje de error, éste es cercano al valor menor, con excepción del As. En dicha tabla periódica apreciaremos también que los elementos forman parte, al menos, de dos triadas de número atómico con excepción del As, Ge y Ne. Por ejemplo, para el flúor y el lutecio serían las siguientes: C(6), F(9), Mg(12) o bien F(9), Na(11), Al (13); lo mismo sucede con el Lu: Tm(69), Lu(71), Ta(73), así como Lu(71), Ta (73), Re (75), o bien Ho(67), Tm(69), Lu(71).
7ConclusionesEn este trabajo hemos presentado un reconceptualización del término ‘elemento’ basado en el argumento de los ‘isótopos límites’. La definición propuesta preserva su naturaleza dual y, en ese sentido, hemos caracterizado también la noción metafísica de ‘sustancia básica’. Tal noción de ‘elemento’ da origen, entonces, a un sistema periódico basado en un nuevo criterio primario de ordenamiento.
Finalmente, creemos que la tabla periódica propuesta presenta ciertas particularidades que pueden dan lugar a interesantes debates futuros, dado que: a) preserva el espíritu de Mendeléiev al ordenar los elementos según sus propiedades como sustancia básica; b) a diferencia de las tablas más difundidas y debatidas en la actualidad no emplea la estructura electrónica como criterio de ordenamiento; c) el hidrógeno y el helio comparten el mismo valor de L - Z, lo cual podría indicar que ambos elementos deberían ser parte de un periodo separado; d) maximiza las triadas de número atómico en mayor número y más naturalmente que en la tabla de ‘escalón izquierdo’ modificada propuesta por Scerri, y e) presenta una mejor capacidad predictiva de las masas atómicas.
No es nuestra intención afirmar que la nueva representación del sistema periódico aquí presentada sea superior a otras tablas periódicas. Por el contrario, entendemos que el nuevo enfoque utilizado puede ser una herramienta útil en la enseñanza de la química con el fin de promover la argumentación en clase.9 Creemos, de igual forma, que la temática despertará la inquietud de aquellos estudiantes y docentes interesados en profundizar su conocimiento de la ciencia química desde una perspectiva de reflexión histórica y filosófica. Y ello tendrá efectos positivos, no sólo en el proceso de enseñanza-aprendizaje, sino también, en un concepción mucho más rica de la naturaleza de la química.
A Guillermo Restrepo (Universidad de Pamplona) y Juan Camilo Martínez González (Universidad Nacional de Tres de Febrero) por su detallada lectura, críticas y sugerencias. Agradecemos también a los dos árbitros anónimos de la revista. Este trabajo fue posible gracias al apoyo del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), de la Agencia Nacional de Promoción Científica y Tecnológica (FONCyT), y de la Universidad Nacional de la Patagonia San Juan Bosco de Argentina.
La tabla de ‘escalón izquierdo’, propuesta por Charles Janet en 1929 (figura 3), revivida por Gary Katz (2001) y con Henry Bent (2006) como uno de sus principales divulgadores, así como la tabla piramidal modificada (Scerri, 2004) expresan naturalmente la manera en la cual cada periodo comienza con un nuevo valor de n + l. Este criterio terciario, sin embargo, no es aceptado de manera unánime, dado que se ha sugerido que debería proveer una tercera dimensión a la tabla periódica (Magarshak y Malinsky, 1992).
Aunque el término ’sistema periódico’ representa una noción más abstracta según la cual existe una relación periódica entre los elementos, lo usaremos aquí en sentido amplio, es decir, como sinónimo de ‘tabla periódica’, tal como suele emplearse.
Needham (2008) ha sugerido que los isótopos deberían ser considerados distintos elementos, dadas las diferencias químicas existentes entre los isótopos del hidrógeno. Una fuerte crítica a esta afirmación puede verse en Scerri (2011b).
Sobre la base de las ideas de Paneth y del sistema periódico, Scerri (2012) ha reconceptualizado la noción de elemento, proponiendo que la sustancia básica subyace tanto a la sustancias simples como a las sustancias simples combinadas. El término ‘elemento’ lo reserva únicamente para denotar ‘susAsimismo tancia básica’. Si bien coincidimos en su primera apreciación, entendemos que el término ‘sustancia básica’ tiene un estatus más fundamental, tal como es expuesto en nuestra caracterización de elemento.
Los 46 bloques de la tabla tienen la misma pendiente de L – Z (por ej. en los bloques 1 y 2 la pendiente es 0, mientras que en los bloques 4, 7, 10, etc. la pendiente es 1). Empleamos el término ‘bloque’ y no ‘periodo’ dado que son conceptualmente diferentes.
Hasta donde sabemos, el único sistema periódico cuyo criterio primario no está regido por el número atómico creciente es el denominado Stowe-Janet-Scerri, el cual ordena los elementos por los valores crecientes de n + l (para detalles, véase Leach, 2012).
Un antecedente en la utilización de la noción de triadas para el cálculo de masas atómicas de elementos translaurencio puede verse en Ibrahim (2005).
Scerri (2009b) ha propuesto otra tabla que difiere en la forma y presenta algunas particularidades pero, a fines de este trabajo, son equivalentes.
Para aspectos históricos, didácticos y epistemológicos de la tabla periódica, véase Camacho González et al., 2007.