Our paper is a brief historical study of aqueous solutions of potassium iodide and iodine. It also analyzes why, in Biology and Medicine, these solutions are known as Lugol reactive. Moreover, we study their use for educational purposes to deepen in various topics such as redox reactions and the relationship between solubility and bond types.
Es un placer indicar que con la publicación de este artículo se completan los 100 escritos por autores españoles, precisamente en ésta, que es la revista Educación Química número 100.
1Historia del descubrimiento del reactivo de LugolEn los comienzos del siglo xix, debido en gran parte a las guerras napoleónicas, el nitrato potásico era una sustancia muy valorada para la obtención de pólvora. Posiblemente ese era el motivo por el que, en 1811, Bernard Courtois (1777-1838) obtenía nitrato potásico (salitre) quemando algas; al quemar las algas en las cenizas quedaba nitrato que recuperaba añadiendo ácido sulfúrico para eliminar los otros residuos. Un día añadió más ácido de lo normal y, al calentar, observó que se desprendían un vapor de color violeta (tiempo después se sabría que se trataba de un nuevo elemento: el yodo) muy llamativo, que se condensaba dejando unos pequeños cristales negros brillantes. No tenía suficiente dinero y abandonó la investigación, pero dio muestras de aquella sustancia a Nicholas Clement (1779-1841) y a Charles Bernard Desormes (1771-1862), quienes a su vez, según Partington (1964), las pasaron a Louis Joseph Gay Lussac (1778-1850) y a Humphry Davy (1778-1829) (que en esa época visitó París). Ambos reconocieron que el descubridor de esa sustancia había sido Courtois, a quien en 1831 le concedieron seis mil francos del Premio Montyon de l’Académie Royale des Sciences, por el valor medicinal del yodo. Sin embargo, moriría arruinado; su propia necrológica, publicada en el Journal de Chimie Médicale, de Pharmacie et de Toxicologie recoge el lamento de que no hubiera patentado su invención: “Bernard Courtois, auteur de la découverte de l’iode, est mort à Paris le 27 septembre 1838, laissant sa veuve sans fortune. Si lors de sa découverte, Courtois eût pris un brevet d’invention, il en eût été tout autrement”.
La investigación sobre el yodo fue uno de los varios conflictos que hubo entre Davy (1813) y Gay Lussac, porque los dos se disputaban la primacía de los descubrimientos relacionados con el comportamiento del yodo. Esto supuso que el yodo comenzara a estudiarse bastante después de su descubrimiento y que Gay Lussac (1814) destacara una nota con lo referido por Davy en el Journal of Natural Philosophy, Chemistry and the Arts (referido por Gay-Lussac como el Journal de MM. Nicholson et Tilloch), sobre qué tan mal estaba la ciencia en Francia que había tenido que ir un filósofo inglés para que una sustancia nueva no durmiera en el olvido (Figura 1).
Fragmento del trabajo de Gay Lussac (1814) donde se refiere a los comentarios de Davy.
En 1813 Gay Lussac se dedicó a estudiar aquellos vapores extraños que se formaban de una sustancia de aspecto metálico, llegando a la conclusión de que se trataba de un nuevo elemento al que llamó “yodo” (del griego ι¿δες (ioeidés), violeta, por el color de su vapor). En Annales de Chimie de 1813 (Davy, 1813) aparecen varios artículos que recogen todas las propiedades del yodo y sus derivados, y cuyo autor sin duda es Gay Lussac, aunque a veces no aparece expresamente su nombre. Pero el estudio más completo se recoge en 1814, donde hace un estudio exhaustivo de la acción del yodo sobre todos los compuestos inorgánicos, propiedades y comportamiento de los productos que se obtienen e incluso tiene un apéndice sobre la historia del descubrimiento del yodo (Gay Lussac, 1813, 1814; Courtois, 1813).
Gay Lussac (1814) especifica en la p. 40 de su trabajo (Figura 2) que ha estudiado de una forma especial la acción de la disolución de potasa sobre el yodo dando un precipitado blanco arenoso, que se descompone por el calor produciendo yoduro potásico y oxígeno, que por las características será el yodato de potasio. Continúa diciendo que el líquido contiene el “hydriodato de potasio”; sin duda, llamaba así a la disolución de yoduro potásico. Más adelante se especifica más sobre el significado del “hydriodato de potasio”. Después dice que la disolución es ligeramente amarilla cuando predomina el hidróxido potásico y rojo-marrón si predomina el yodo, lo que indica que el yodo es soluble en el “hydriodato” de potasio. Por último añade que todos los “hydriodatos” tienen la propiedad de disolver yodo en abundancia manteniendo su carácter neutro (p. 72) (Figura 3).
Fragmento del trabajo de Gay Lussac (1814) donde especifica la acción de la disolución de potasa sobre el yodo.
Fragmento del trabajo de Gay Lussac (1814) donde especifica la acción de los “hydriodatos (hoy conocidos como disoluciones de yoduros) en la disolución del yodo.
Roscoe y Schoerlemmer (1884) afirman que Stromeyer, por una parte, y J. J. Colin y H. Gaultier de Claubry (1814), por otra, comprobaron que el yodo produce una coloración azul con el almidón. En el volumen de Archives des Découvertes des Inventions Nouvelles de 1814 (Archives, 1814) se recoge que en el Laboratorio de Gay-Lussac decidieron que él estudiaría la acción del yodo sobre los cuerpos inorgánicos, y Colin y Gaultier de Glaubry lo harían sobre los cuerpos orgánicos, encontrando que producía una coloración azul muy intensa sobre el almidón, hallazgo que publicaron en 1814. En este trabajo dedican varias páginas a la acción del yodo sobre el almidón y, entre otras cosas, dicen que siempre se puede obtener un color azul más bello cuando se trata el almidón con un exceso de yodo disuelto en potasa (Figura 4).
Después hicieron un estudio del comportamiento de ese color al aumentar la temperatura, al tratarlo con agua hirviendo, con dióxido de azufre, y otros medios.
Todo lo anterior nos demuestra que la coloración del yodo con el almidón se conoció muy poco después del descubrimiento del yodo.
Muy pronto, las disoluciones de yodo se empezaron a utilizar en diversos tratamientos médicos y aunque, como hemos indicado, Gay Lussac ya se había dado cuenta de que las disoluciones acuosas de yoduros disolvían el yodo, y también Colin y Gaultier indicaron que el color azul del almidón es más bello con yodo disuelto en potasa, no había trascendido esta propiedad en el mundo de la Medicina. Fue un médico francés apellidado Lugol quien descubrió que el yodo, que es prácticamente insoluble en agua, se disuelve fácilmente añadiendo yoduro potásico. Por este motivo, la disolución de yodo con yoduro de potasio en agua se llama reactivo o líquido de Lugol, o simplemente Lugol.
La disolución acuosa de yoduro potásico y yodo se utiliza en Biología, Bioquímica, Medicina y Química; sin embargo, en los libros y en los catálogos de Química figura como disolución yodurada de yodo o disolución acuosa de yodo, mientras que en los libros de las otras ciencias citadas sí aparece como reactivo de Lugol. Suponemos que esto se explica porque el descubrimiento se debe a un médico y primero se utilizó en Medicina y en Biología.
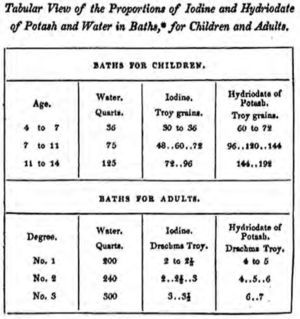
El conocido como reactivo de Lugol se debe a Jean Guillaume Auguste Lugol (Figura 5) (1786-1851), médico francés que utilizó esta disolución en el Hospital de Saint Louis de París entre 1829-1844 para tratar la escrófula (de latín scrofulae = paperas, diminutivo de scrofa = cerda preñada), que es un proceso infeccioso que afecta a los ganglios linfáticos (con frecuencia los del cuello, causado por el Mycobacterium tuberculosis). Lugol (1829,1830ab) publicó, entre 1829 y 1830, tres trabajos sobre la utilización de los baños de yodo y yoduro potásico para estos tratamientos. Estos trabajos adquirieron tanta importancia que fueron traducidos al inglés y el Hospital de Saint Louis recibió, en 1831, el Premio Montyon, establecido en pro del arte de curar, concedido ese mismo año a Courtois, como se explicó anteriormente y a Coindet por la aplicación del yodo en el tratamiento del bocio.
Como bibliografía, en nuestro trabajo hemos utilizado al respecto la edición inglesa porque nos ha sido de fácil acceso a través de libros Google y porque el traductor inglés ha añadido apéndices y comentarios interesantes (Essays, 1831).
Según cuenta en sus escritos, Lugol comenzó utilizando por vía oral, como se utilizaba en otros tratamientos, la tintura de yodo de Coindet, médico de Ginebra, y el jarabe de Henry, farmacéutico jefe del Hospital Civil de París, pero su experiencia fue que no se podía fiar de la cantidad de yodo que contenían esas preparaciones ya que variaba mucho de unas a otras. Trató de hacer las disoluciones de forma que pudiera utilizar una cantidad muy pequeña de agua porque creía que los pacientes digerían mal el agua destilada y como tenía dificultades para disolver unos gránulos de yodo le había añadido unos gránulos de cloruro de sodio para que la disolución fuera más asimilable, según él, porque así se compensaba la pérdida de aire del agua destilada. Sin embargo, seguía teniendo muchos problemas, la solubilidad no mejoraba, se había dado cuenta de que el yodo se precipitaba con facilidad y pensaba que eso sería lo que sucedía en el estómago, lo que producía ardor a los enfermos.
Tampoco los enfermos encontraban apta la tintura de yodo (yodo en alcohol) por vía oral y cuando la utilizaba en los baños se daba cuenta que al añadir unas gotas de tintura de yodo en el baño, que tenía a una temperatura entre 37 y 38°C, se producían unos vapores violeta porque parte del yodo se sublimaba y el resto precipitaba en el agua.
Intentó disolver el yodo en agua, lo cual dice es difícil porque según Gay-Lussac sólo se disuelve una parte de yodo en peso en siete mil partes de agua, y lo consiguió añadiendo yoduro de potasio, al que el llama “hydriodato” de potasio. La explicación de este nombre nos la da Turner, profesor de Química de Edimburgo, porque para obtener el yoduro potásico lo que hace es disolver el yodo en una disolución de hidróxido de potasio de acuerdo con la siguiente receta: “Para obtener el yoduro de potasio se trata el yodo con una disolución concentrada de hidróxido de potasio. El exceso de hidróxido de potasio se neutraliza con ácido yodhídrico. La mezcla de compuestos de yodo obtenidos se calienta a sequedad con cuidado por la volatilidad del yodo” (Turner, 1825). Al calentar obtenían yoduro y yodato, este último se descompone por acción del calor produciendo yoduro y oxígeno, por lo que el resultado final sería yoduro de potasio.
Según indica Lugol (Figura 6) el yoduro potásico no tendría ninguna acción desde el punto de vista médico y lo único que actuaría sería el yodo, pero añadir el yoduro potásico es la única forma adecuada de mantener el yodo en disolución.
Fragmento del texto de J. G. A. Lugol (Essays, 1831) sobre las disoluciones de yodo.
Lugol utilizaba disoluciones acuosas de yodo y yoduro potásico de varias formas: por vía oral, mezcladas con manteca, por vía externa, como ungüento, y terminó optando, como más efectivo, por baños. Específica que el tratamiento oral tiene la ventaja de que aumenta el apetito, es diurético y el único inconveniente de tener acción purgativa se da en muy pocos casos. El mayor problema que tiene es que la disolución de yodo en agua utilizando el yoduro potásico es mucho más cara y hay pacientes que por motivos económicos no la puede utilizar.
J. G. A. Lugol describe las investigaciones que hace utilizando las disoluciones de la Figura 7 y muestra los éxitos obtenidos que expone ante l’Académie Royale des Sciences avalado por una serie de académicos que conocen su trabajo. Advierte de la importancia de que el recipiente del baño no sea de cinc porque reacciona con el yodo y la concentración se hace menor. También indica que se debe tener cuidado con el tapón del frasco donde se guarda la disolución porque si es de corcho, éste es atacado si entra en contacto con la disolución. Evidentemente propone hacer disoluciones muy concentradas de yodo para después diluirlas para preparar los baños.
Fragmento del texto de J. G. A. Lugol (Essays, 1831) donde se indican las proporciones necesarias para los distintos tipos de baño.
Neuzil (2002), al reseñar la historia del reactivo de Lugol dice que, en 1939, Bouvrain (padre del famoso cardiólogo Bouvrain) les enseñó a utilizar esta disolución para reconocer la presencia de granos de almidón en los tejidos vegetales. Cuando por motivo de la guerra la Facultad de Medicina de París se trasladó a Burdeos utilizaban el Lugol para reconocer la presencia de glucógeno en el cuello del útero con vistas a realizar biopsias y, en 1940, en el laboratorio de Bacteriología, lo utilizaban en las técnicas de coloración de Gram. Más tarde, sus profesores les enseñaron las virtudes terapéuticas del yodo y del Lugol.
En la actualidad, la disolución acuosa de yodo utilizando yoduro de potasio aparece en todos los catálogos de productos químicos aunque, como ya hemos indicado, muy pocas veces aparece el nombre de Reactivo o Licor de Lugol, que sigue siendo de amplia utilización en este momento y entre los usos destacaríamos:
- –
Para el tratamiento de enfermedades relacionadas con la glándula tiroides, fundamentalmente el hipertiroidismo.
- –
Se recomendó utilizarlo como descontaminante del aguapara beber en el desastre de Chernobil (1986). Existen evidencias de que el yoduro de potasio previene del cáncer detiroides. En la actualidad se está utilizando también para contrarrestar los efectos del desastre nuclear de Fukushima (Japón).
- –
Como indicador de la presencia de almidón: amilasa y amilopectina, almidón vegetal y glucógeno animal.
- –
Para teñir el núcleo de las células y hacerlo más visible.
- –
Para la conservación del fitoplancton.
- –
Se utiliza en la biopsia para detectar cáncer en la vagina o en el cuello de útero porque varía el contenido de glucógeno (prueba de Schiller de la Colposcopia, del griego kolpos, vagina, y skopos, mirar). También se puede utilizar para hacer análisis en la mucosa alveolar de la boca e inspeccionar la situación de las encías.
- –
Se utiliza en los acuarios marinos como fuente de yodo y de yoduro.
- –
Es desinfectante por su carácter antitiséptico.
- –
Es un oxidante débil pero muy selectivo.
- –
En Química Analítica se usa en las yodometrías.
En los catálogos de productos químicos de distintas empresas como Sigma-Aldrich y Merck figuran varios tipos de disoluciones de yodo y yoduro potásico de diversas concentraciones y también figura como disolución de Lugol para la tinción de Gram estabilizada con polivinilpirrolidona (PVP), en frascos oscuros y la mayoría de las veces de vidrio. La pérdida de yodo se puede evitar con el uso de PVP en la disolución de forma un complejo con el yodo. Este complejo es más estable y tiene una vida útil más larga.
2Aplicaciones didácticas del reactivo de LugolPara trabajar experimentalmente con los estudiantes proponemos varias aplicaciones del reactivo de Lugol.
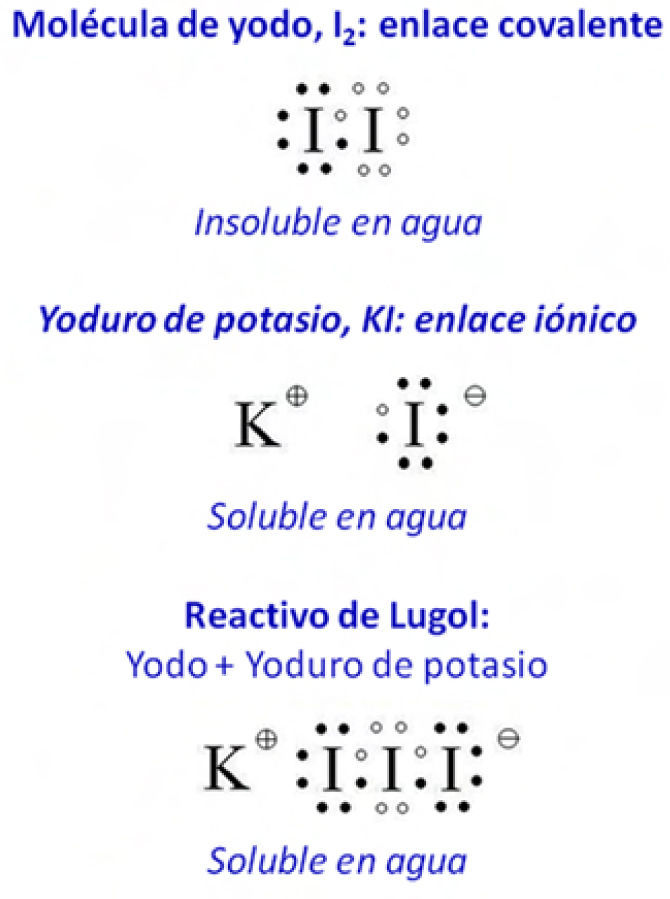
2.1Obtención del reactivo de LugolLa obtención del reactivo de Lugol nos sirve como ejemplo de solubilidad de una sustancia en agua según su enlace químico. La molécula de yodo, I2, está formada dos átomos de yodo unidos con enlace covalente y, como consecuencia de su carácter apolar, el yodo es prácticamente insoluble en agua, como ya indicaba Gay Lussac. Después de añadir agua sobre el yodo y comprobar que no se disuelve se le añade yoduro potásico que se une con el yodo formando el compuesto KI3 que ya es soluble en agua porque tiene carácter iónico (formado por el catión potasio y el anión triyoduro), y dando una disolución de coloración rojiza que es lo que se conoce como reactivo de Lugol o “disolución yodurada de yodo” y que tiene aplicaciones muy diversas. La preparación de la disolución de Lugol suele consistir en 5g de I2 y 10g de KI diluidos con 85mL de agua destilada, dando una disolución marrón con concentración total de yodo de 150 mg/mL. El yoduro del yoduro potásico hace soluble en agua al yodo diatómico molecular, por la formación de iones triyoduro, I3–. La conocida como tintura de yodo es otro preparado basado en yodo, que consiste en yodo diatómico molecular y sales de yodo diluidas en agua y etanol.
Este experimento se puede proponer incluso a alumnos de secundaria y, por supuesto, a alumnos de bachillerato, al tratar el tema de las propiedades de las sustancias derivadas del tipo de enlace químico (Figura 8).
También se puede hacer alusión a este tema cuando se trabaja experimentalmente en la electrólisis de una disolución acuosa de yoduro potásico. Deben explicar las reacciones químicas que tienen lugar en los electrodos y por qué no aparece un precipitado de yodo de color negro, si ellos saben que el yodo es sólido, insoluble en agua y de color negro.
2.2El Reactivo de Lugol para el reconocimiento de almidónEl reactivo de Lugol obtenido en el apartado anterior se puede utilizar para reconocer la presencia de almidón, porque esta sustancia adsorbe el yodo produciendo una coloración azul intensa, coloración que desaparece al calentar, porque se rompe la estructura que se ha producido, pero vuelve a aparecer al enfriar.
Nos permite reconocer la presencia de almidón en alimentos como el pan, las papas, pero también en otros como en diversos tipos de jamón de York y queso, porque se les añade papa cocida para aumentar el peso. También es frecuente encontrar almidón en el papel porque se utiliza para darle consistencia.
El reconocimiento de la presencia de almidón, si no se dispone de reactivo de Lugol, se puede hacer con medicamentos que llevan yodo como el betadine.
2.3Reactivo de Lugol como oxidanteEl reactivo de Lugol además es oxidante por tener yodo que, en presencia de reductores, pasa a ión yoduro, con un potencial de reducción estándar (I2 d 2 I–) de 0,538 V. Por eso, las disoluciones de yodo con yoduro potásico en agua se emplean ampliamente en valoraciones cuantitativas en Química Analítica. Según Partington (1964) Bunsen, en 1853, desarrolló un método volumétrico de yodometría utilizando una disolución de ácido sulfuroso y trabajó en el análisis de aguas.
Cualquier texto de Química Analítica cuantitativa tiene un capítulo dedicado a yodometrías porque, como indica Walton (1970) “el yodo es una agente oxidante débil; sin embargo, es útil en análisis volumétrico debido a su selectividad y a que son posibles puntos finales muy definidos cuando se usa almidón como indicador”.
Nosotros proponemos utilizarlo como oxidante para reconocer alimentos antioxidantes. En estos momentos que se habla tanto de alimentos antioxidantes y de su importancia se puede comprobar que el ajo es “antioxidante” (es decir, reductor) porque decolora el reactivo de Lugol.
En un matraz se coloca una disolución más bien diluida de reactivo de Lugol se añaden tres o cuatro dientes de ajo que previamente se han machacado en el mortero y se puede comprobar que al cabo de unos minutos el color rojizo de la disolución desaparece.
2.4Problema basado en textos históricosPartiendo de textos históricos, se pueden plantear problemas a estudiantes de 2° de bachillerato o de primer curso universitario. Por ejemplo, partiendo del texto recogido en The Edinburgh Medical and Surgical Journal, vol. 24, July 1825, p. 20, se propone el siguiente problema:
E. Turner, Profesor de Química de Edimburgo escribe: “Para obtener el yoduro de potasio se trata yodo con una disolución concentrada de hidróxido de potasio. El exceso de hidróxido de potasio se neutraliza con ácido yodhídrico. La mezcla de compuestos de yodo obtenidos se calienta a sequedad. De esta forma se consigue yoduro de potasio”. Se pide:
- –
Escribir todas las reacciones que tienen lugar en el proceso descrito en el texto y calcular la cantidad de yodo y de hidróxido de potasio que sería necesario para obtener 100g de yoduro potásico suponiendo que el rendimiento de la reacción es del 80%.
- –
Indicar cómo se obtiene en la actualidad el yoduro de potasio, consultando bibliografía adecuada.
Se trata de una reacción de dismutación en la que el yodo pasa en parte a yoduro y, en parte, a yodato si se hace en caliente (en frío sería KIO). El yodato calentando se descompone en yoduro y oxígeno.
Es un problema que resulta interesante para los estudiantes porque incluiría escribir las reacciones, ajustarlas y hacer cálculos.
Se agradece la ayuda recibida por la Universidad Politécnica de Madrid, a través del proyecto de innovación educativa “Enlaces múltiples: la Química en los distintos niveles educativos”.