El Premio Nobel de Química 2016 fue otorgado a Jean-Pierre Sauvage, Sir J. Fraser Stoddart y Bernard L. Feringa «por el diseño y síntesis de máquinas moleculares». Para entender a las máquinas moleculares es importante saber acerca de la química supramolecular, que fue desarrollada por Donald J. Cram, Jean-Marie Lehn y Charles J. Pedersen, también ganadores del Premio Nobel en 1987. Para las máquinas moleculares, la cuestión principal es la unión débil entre moléculas. En este trabajo se presenta una breve descripción de las máquinas moleculares.
The Nobel Prize in Chemistry 2016 was awarded to Jean-Pierre Sauvage, Sir J. Fraser Stoddart and Bernard L. Feringa ‘for the design and synthesis of molecular machines’. To understand molecular machines it is important to know about supramolecular chemistry, that was developed by Donald J. Cram, Jean-Marie Lehn and Charles J. Pedersen, also Nobel Prize winners in 1987. For molecular machines, the main issue is the bond between molecules that is very weak. In this paper, a brief description of the molecular machines is presented.
El Premio Nobel de Química 2016 fue otorgado a tres investigadores: Bernard Feringa (Países Bajos), Sir J. Fraser Stodart (Gran Bretaña) y Jean-Pierre Sauvage (Francia). Estos tres grandes científicos han realizado una labor tan brillante que el Premio Nobel se antoja pequeño para destacarla.
Para entender la gran repercusión de este acontecimiento se debe hacer un poco de historia. Quizás el acontecimiento más importante como antecedente sea la conquista de otro Premio Nobel, concedido por el desarrollo de la química supramolecular en el año 1987 a los norteamericanos Donald J. Cram y Charles J. Pedersen, y al francés Jean-Marie Lehn.
La química supramolecular va más allá de la molécula y es quizás la más nueva de las químicas. Mientras que la química tradicional describe los enlaces entre átomos para formar moléculas, la química supramolecular describe los enlaces entre las moléculas para formar agregados complejos. En la química molecular lo que importa son los enlaces relativamente fuertes. En la supramolecular lo trascendental es que sean enlaces débiles y flexibles. Estos enlaces débiles pueden ser puentes de hidrógeno, enlaces de coordinación (relativamente fuertes), interacciones coulómbicas, fuerzas de van der Waals o de London (relativamente débiles).
Esta gran cantidad de enlaces débiles da lugar a que los conjuntos moleculares adopten geometrías interesantes a las que se denominan estructuras secundarias, terciarias e inclusive cuaternarias, que de alguna forma cambian las características intrínsecas del sistema. Como ejemplo de este efecto se puede citar la estructura helicoidal de la molécula de ácido desoxirribonucleico (ADN), que es muy importante para mantener los códigos reproductivos. La forma de hélice de la molécula se debe a interacciones débiles, y por eso algunos han dicho que el ADN es la primera supramolécula.
En su momento Cram, Pedersen y Lehn establecieron las bases experimentales para la preparación de supramoléculas. Gracias a sus estrategias se han podido sintetizar muchos compuestos de estructuras elaboradas con diferentes aplicaciones, como el almacenamiento de energía, la óptica, o supramoléculas para el transporte de fármacos entre muchas otras.
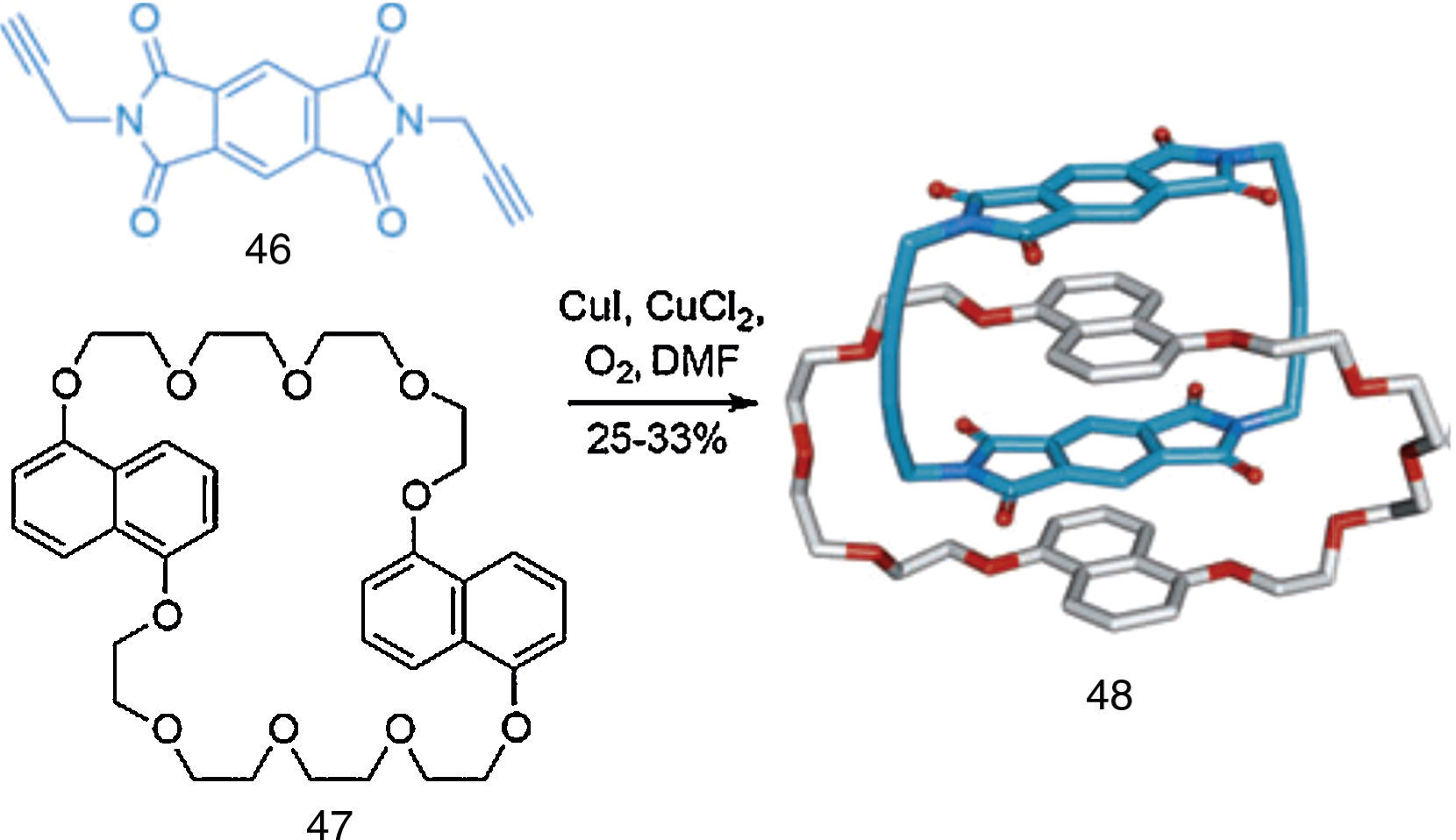
El trabajo de Jean-Pierre Sauvage consistió en la aplicación de la química supramolecular para preparar catenanos y rotaxanos. Estas supramoléculas se caracterizan por tener cadenas moleculares enlazadas por medio de una unión que se ha denominado enlace mecánico.
En los catenanos el enlace mecánico se puede visualizar si nos imaginamos una cadena con varios eslabones que están entrelazados pasando uno a través del otro sin tocarse (fig. 1). En los catenanos dos cadenas cerradas (macro-anillos) se entrelazan creando nudos, llegando a generarse comunicación entre ambas cadenas.
Ejemplo de un catenano.
Fuente: Gil-Ramírez, Leigh y Stephens (2015).
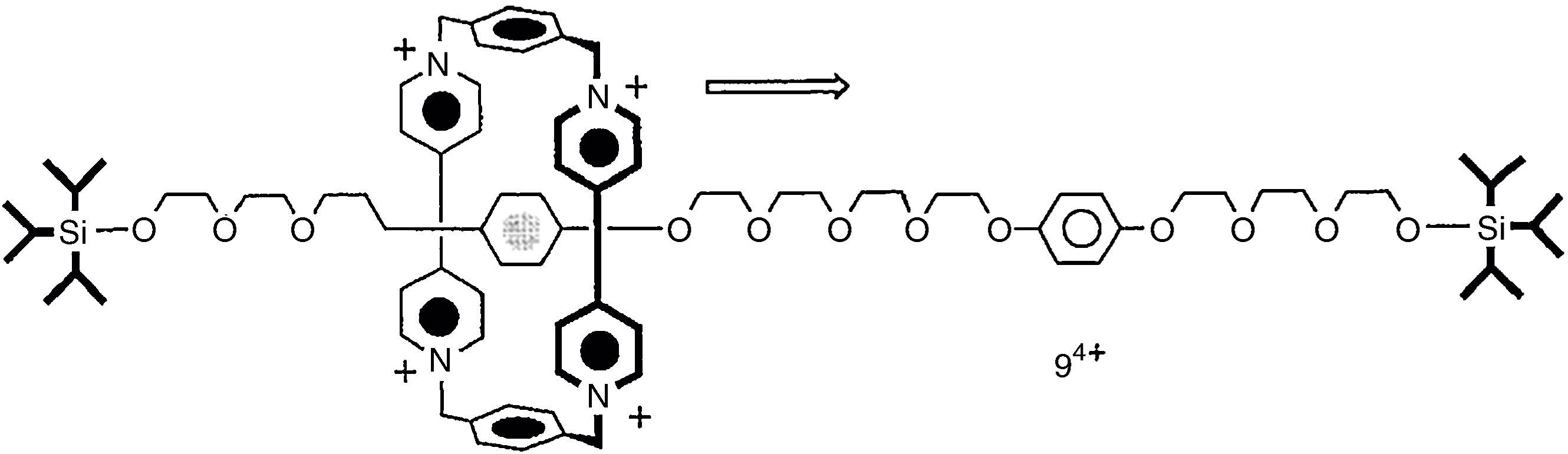
Los rotaxanos se pueden pensar como un tubo que pasa a través de un aro, sin aparentemente interaccionar (fig. 2). En los rotaxanos una cadena es abrazada por un «eslabón molecular» que en muchos casos tiene movimiento libre a lo largo de la cadena. Un compuesto que no tiene ningún impedimento para la salida del eslabón se denomina seudo-rotaxano, mientras que aquellos que tienen «stoppers» son propiamente los rotaxanos.
El movimiento de un fragmento molecular respecto a otro fue estudiado por Fraser Stoddart y su equipo. Ellos demostraron que estos movimientos dan lugar a funciones simples que convierten a algunos catenanos y rotaxanos en «máquinas moleculares», porque en su desplazamiento pueden mover de un lugar a otro cargas o moléculas pequeñas. Su funcionamiento puede ser espontáneo o depender de estímulos energéticos o luminiscentes.
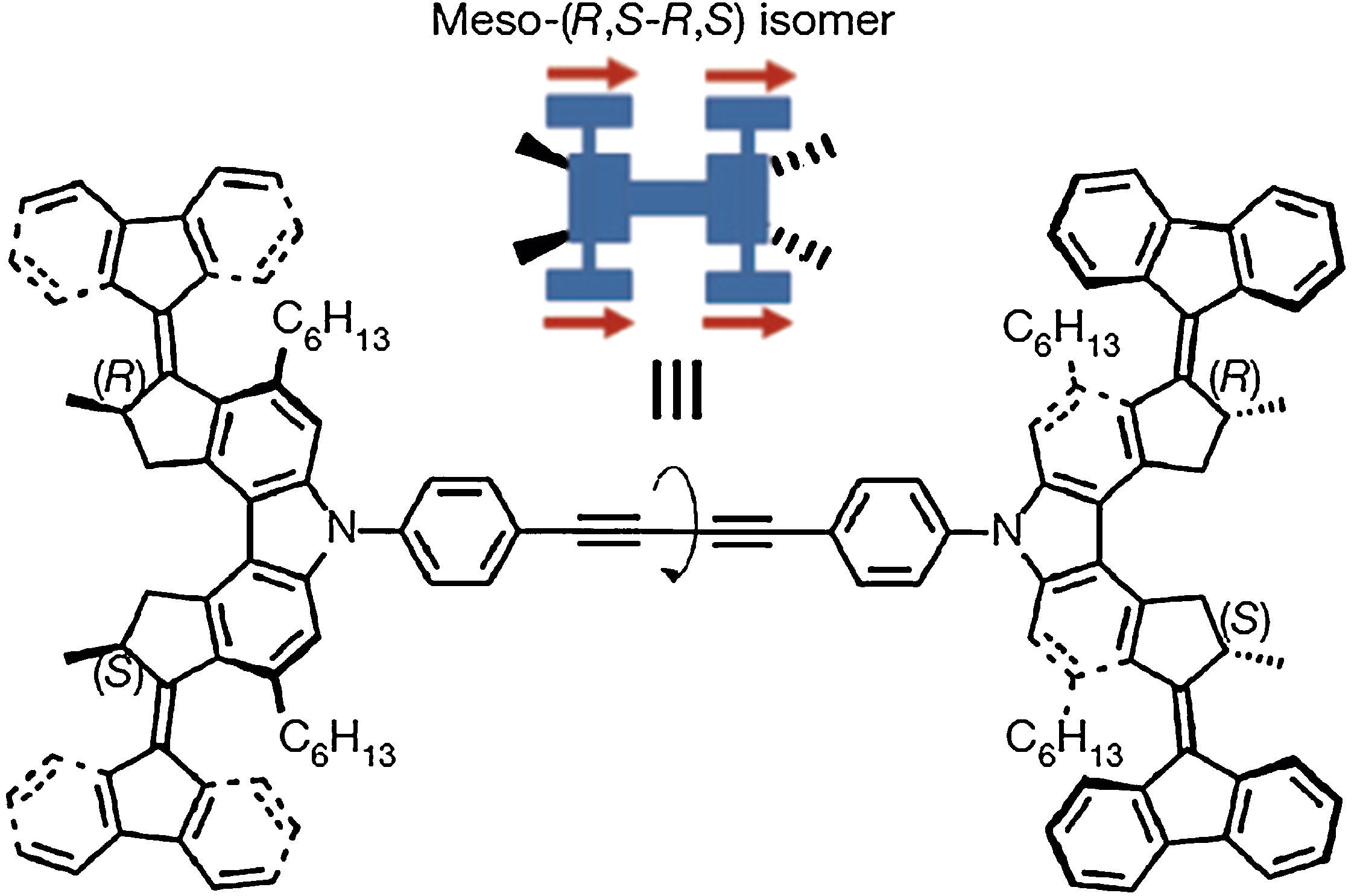
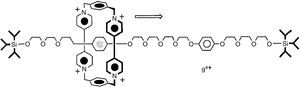
Ben Feringa junto con sus colaboradores sintetizaron el primer automóvil molecular (fig. 3). Los cuatro grupos que aparecen a cada lado de la supramolécula en la figura se pueden pensar como las «ruedas» del coche. La rotación de los enlaces centrales es la responsable del movimiento, como si fuera el eje de un automóvil. Esta nano-máquina funciona perfectamente, como lo han demostrado los estudios espectroscópicos.
El automóvil molecular diseñado por Feringa y sus colaboradores.
Fuente: Kudernac et al. (2011).
Todas las máquinas moleculares funcionan gracias a la interacción débil que aparece en las supramoléculas. Estos enlaces débiles se rompen y se forman continuamente, haciendo que haya un traslado que se puede utilizar para producir un trabajo. El Premio Nobel a estos grupos de investigación reconoce la inmensa importancia de este nuevo campo de estudio. Finalmente se reconoce a través de este galardón el descubrimiento de las ventajas de ser débil.
El futuro inmediato de estas máquinas moleculares muestra verdaderas situaciones de ciencia-ficción, ya que se puede pensar en una molécula que funciona como un elevador para llevar de un lado a otro material reactivo, o en un vehículo que transporta fármacos dentro de un organismo vivo. El límite es la imaginación y el objeto de estudio ya está con nosotros: solamente nos queda esperar las sorpresas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.