Las alteraciones del equilibrio ácido-base incumben a todas las especialidades médicas y, aunque pueden suceder con carácter primario, en la mayoría de los casos dependen de la complicación de una enfermedad preexistente. Por ello, no es raro que la identificación correcta del trastorno ácido-base primario y de los mecanismos compensatorios suponga el punto de partida para el diagnóstico de la enfermedad subyacente, a veces no sospechada hasta ese momento. La frecuencia de estos trastornos es elevada, especialmente en pacientes hospitalizados, y su aparición conlleva implicaciones pronósticas significativas.
Las alteraciones mixtas del equilibrio ácido-base, definidas por la presencia simultánea de dos o más desórdenes ácido-base, son también habituales en pacientes hospitalizados, y muy especialmente en las unidades de atención a pacientes críticos. Además, también pueden aparecer ante la coexistencia de varias enfermedades en un mismo paciente.
Con el presente trabajo, se presenta una actualización de dichos trastornos desde una visión predominantemente práctica.
Acid-base disorders are common to all medical specialties. Although these disorders may occur as a primary disturbance, they are usually a consequence of a preexisting disease. Therefore, correct identification of acid-base disorders and compensatory mechanisms not infrequently leads to diagnosis of an often unsuspected underlying disease. The frequency of acid-base disorders is high, especially in hospitalized patients, and their occurrence has significant prognostic implications. Mixed acid-base disturbances, defined as two or more acid-base disorders, are also common in hospitalized patients, especially in critical care units. These disorders can also appear because of the coexistence of several diseases in the same patient. In this article, we provide an update of these disorders from a mainly practical perspective.
Las alteraciones del equilibrio acidobásico pueden suceder con carácter primario pero, en general, derivan de la complicación de una enfermedad preexistente. Por ello, no es raro que una caracterización correcta del trastorno acidobásico sea la pista fundamental para identificar un proceso causal insospechado hasta entonces. La frecuencia de estas anomalías es elevada, especialmente en pacientes hospitalizados, y su aparición tiene claras implicaciones pronósticas1–3. Mención especial merecen, por su escaso reconocimiento en la práctica4,5, las alteraciones mixtas del equilibrio acidobásico, definidas por la presencia simultánea de dos o más trastornos. Son también muy frecuentes, especialmente en determinadas situaciones.
Regulación del equilibrio acidobásicoEl normal funcionamiento celular requiere mantener la concentración de H+ del líquido extracelular (LEC) en límites muy estrechos (el pH compatible con la vida está en torno a 6,80-7,80). Dado que los procesos metabólicos generan gran cantidad de ácidos, el organismo necesita neutralizar y eliminar los H+ para mantener constante el pH (– log [H+]) del LEC. Para ello, dispone de varios medios: 1) Los sistemas tampón intracelulares (proteínas, hemoglobina, fosfato…) o extracelulares. De estos últimos, el más importante es el sistema HCO3−/CO2 (CO2+H2O↔H2CO3↔ H++HCO3−). Según la ley de acción de masas, el pH viene definido por la ecuación de Henderson-Hasselbalch (pH=6,1×log[HCO3−]0,03×pCO2) que, en su variante no logarítmica, se expresaría: [H+]=24+pCO2[HCO3−]. 2) Eliminación del CO2 a través de la ventilación. La producción de CO2 por los tejidos es prácticamente constante y, aunque no es un ácido, en la práctica actúa como tal, al unirse con H2O y formar H2CO3. 3) Regulación renal, a través de dos mecanismos: secreción de H+ por los túbulos renales y reabsorción de bicarbonato. Por cada H+ excretado se genera un ión bicarbonato en plasma.
En definitiva, según la ley de acción de masas, la acidosis (aumento de H+) puede producirse por una disminución del bicarbonato (acidosis metabólica −AM−) o por un aumento de la PaCO2 (acidosis respiratoria −AR−); y la alcalosis (disminución de los H+) por un aumento del bicarbonato (alcalosis metabólica −AlcM−) o por una disminución de la PaCO2 (alcalosis respiratoria −AlcR−).
Así pues, la acidosis o la alcalosis son estados en los que existe un acúmulo de ácidos o de bases. Se habla de acidemia o de alcalemia cuando el pH sanguíneo está disminuido o aumentado respectivamente. En estas situaciones, los mecanismos de compensación no son suficientes para mantener el pH en los límites normales.
Por otra parte, en todo trastorno acidobásico se producen necesariamente respuestas compensatorias (renales en trastornos respiratorios y respiratorias en trastornos metabólicos) que intentan mantener normal el pH. Esta compensación es siempre del mismo signo que el trastorno metabólico que la origina, sigue fórmulas predecibles (tabla 1), y nunca tiene la suficiente potencia para llevar el pH al extremo contrario. Las compensaciones no proporcionadas, por exceso o por defecto, implican un trastorno acidobásico mixto6.
Trastornos primarios y respuestas compensadoras1
| Trastorno | Alteración primaria | Respuesta compensadora |
| Acidosis metabólica | ↓ [HCO3−] | PaCO2 desciende 1,2 mmHg por cada 1 mEq/l de descenso de la [HCO3−]* |
| Alcalosis metabólica | ↑ [HCO3−] | PaCO2 aumenta 0,7 mmHg por cada 1 mEq/l de aumento de la [HCO3−]** |
| Acidosis respiratoria | ↑ PaCO2 | Aguda: [HCO3−] aumenta 1 mEq/l por cada 10 mmHg de aumento de la PaCO2 Crónica: [HCO3−] aumenta 3,5 mEq/l por cada 10 mmHg de aumento de la PaCO2*** |
| Alcalosis respiratoria | ↓ PaCO2 | Aguda: [HCO3−] desciende 2 mEq/l por cada 10 mmHg de descenso de la PaCO2 Crónica: [HCO3−] desciende 5 mEq/l por cada 10 mmHg de aumento de la PaCO2**** |
* Es excepcional que la PaCO2 baje de 15 mmHg. ** Es excepcional que la PaCO2 exceda de 65 mmHg. *** Si [HCO3′] > 40 mEq/l, hay un componente añadido de alcalosis metabólica. **** Si [HCO3′] < 10 mEq/l, hay un componente añadido de acidosis metabólica.
Valores normales. Sangre arterial: pH: 7,36-7,44; PaCO2: 36-44 mmHg; HCO3–: 22-26 mEq/l.
Sangre venosa: pH: 7,31-7,37; PaCO2: 42-50 mmHg; HCO3–: 23-27 mEq/l
1Estas relaciones también pueden obtenerse mediante la fórmula de Albert et al. (PaCO2 = 1,54 × HCO3− + 8,36 ± 1).
pH, PaCO2y HCO3–. Se obtienen, directa o indirectamente, del autoanalizador de gases. Otras determinaciones (exceso de bases…) no aportan cuestiones relevantes. Los valores normales se detallan en la tabla 1. La PaO2, la fracción inspiratoria de oxígeno (FiO2) y el gradiente alvéolo-arterial de oxígeno (A-aPO2) son imprescindibles en el estudio de los problemas respiratorios.
Sodio (Na+), potasio (K+), cloro (Cl−) y osmolaridad. Esta última, tanto medida directamente como calculada según la fórmula 2 × [Na+] plasmático + [Glucemia]18+BUN2,8. Se detecta así la eventual existencia de un hiato osmolar (diferencia entre la osmolaridad medida y la calculada superior a 10 mOsm/kg), algo especialmente importante en casos de AM con sospecha de haber sido provocada por tóxicos.
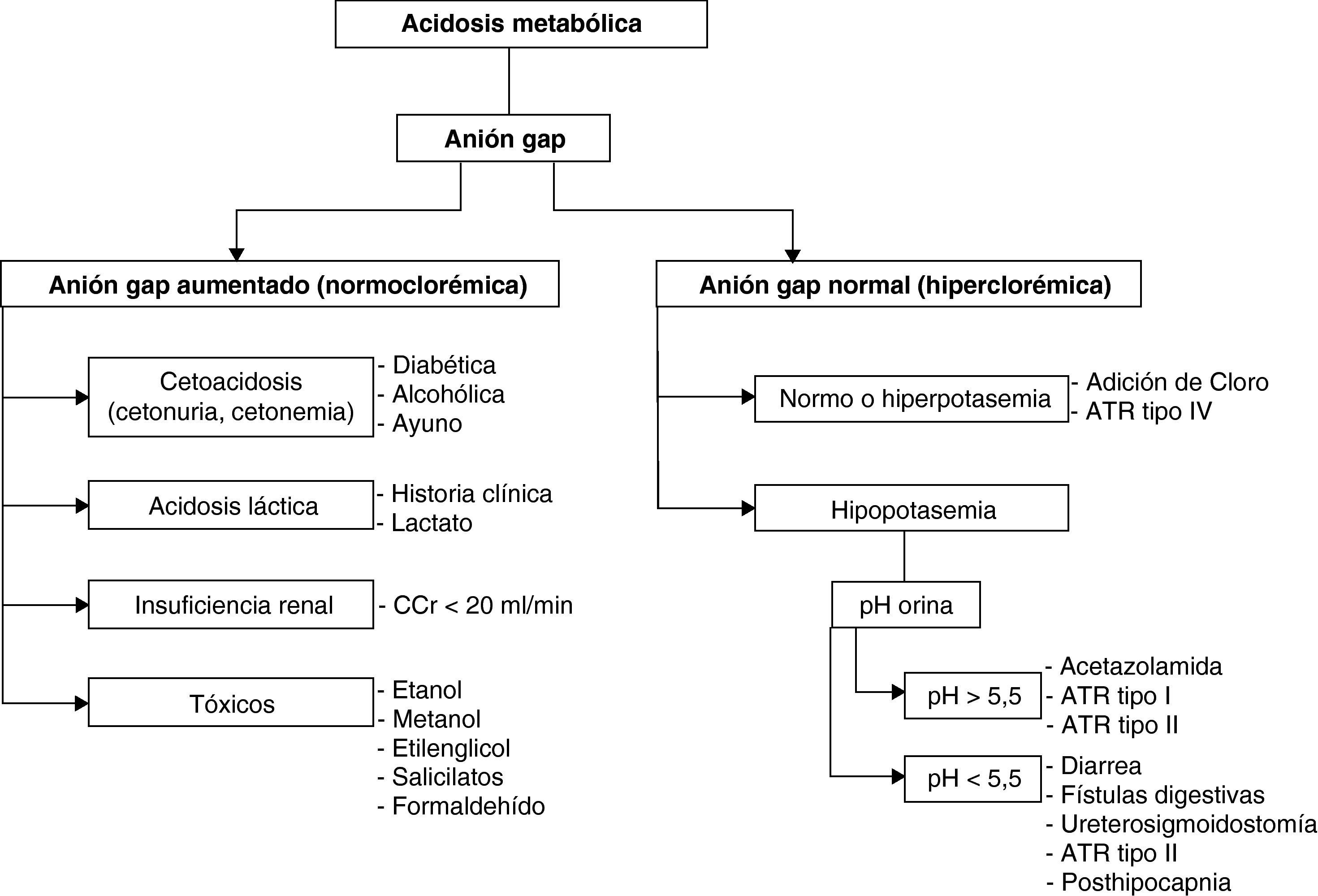
Anión gap o hiato aniónico. Representa los aniones habitualmente no medidos −proteínas, fosfatos, sulfatos…− cuyo valor (12 ± 2) se halla mediante la diferencia entre la [Na+] (principal catión) y la de los aniones medidos más abundantes −hiato aniónico (o anión gap) = [Na+]–([Cl−]+[HCO3−])−. Las AM por acúmulo de ácidos o normoclorémicas cursan con hiato aniónico aumentado, mientras que las provocadas por pérdida de bicarbonato suelen tenerlo normal.
Otras determinaciones que pueden resultar de interés, según los casos, son la urea, creatinina, glucemia, cuerpos cetónicos, lactato en sangre, pH urinario y el Cl− y Na+ urinarios (ClU y NaU).
Aproximación diagnósticaPara diagnosticar correctamente un trastorno ácido-base, es necesario7:
El conocimiento de la clínica del paciente. Ya hemos visto que los trastornos acidobásicos suelen ser consecuencia de otra enfermedad. Por ello, el conocimiento de la historia clínica (vómitos, diarrea, edema, toma de fármacos, disnea…) y la exploración física (signos de deshidratación o edema, polipnea, tetania, coma…) son condición previa imprescindible para un diagnóstico correcto. Valga el caso, por ejemplo, de un enfermo con agudización grave de asma y de otro con acidosis respiratoria crónica y diarrea, cuyos valores gasométricos pueden ser similares.
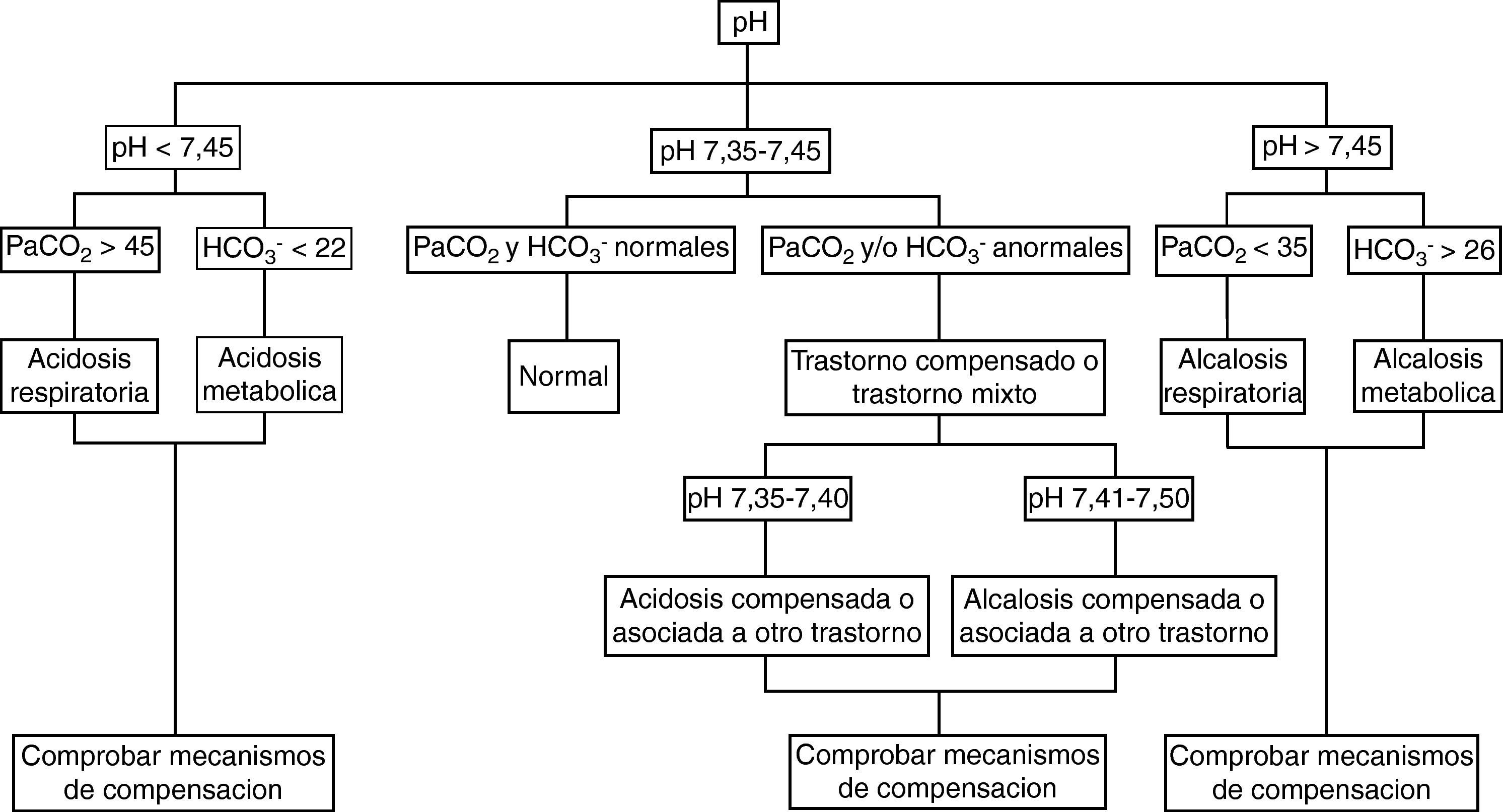
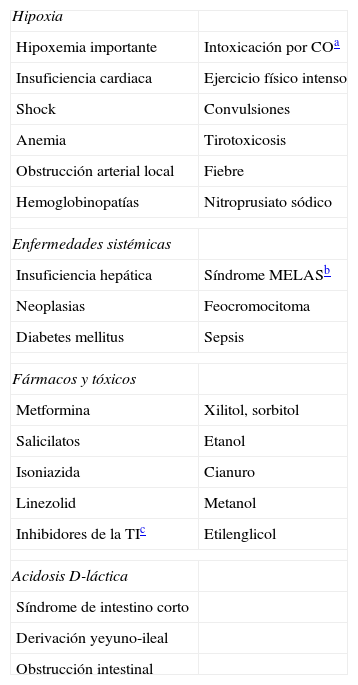
El estudio de los parámetros analíticos. Es fundamental, en este apartado, la identificación del trastorno ácido-base primario, para lo que puede ser útil el algoritmo adjunto (fig. 1).
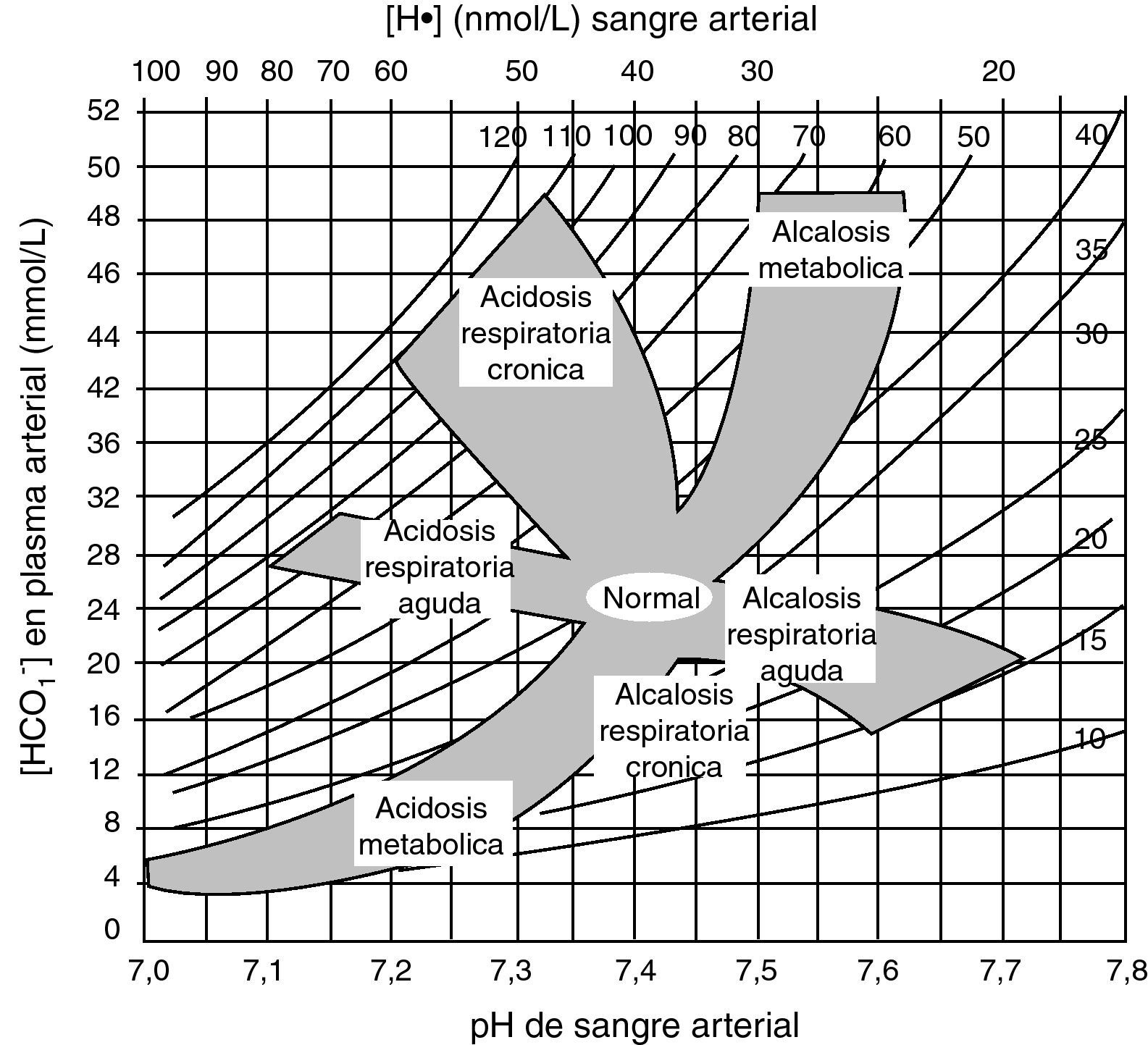
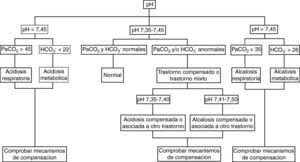
El análisis de la coherencia del mecanismo de compensación. Ya se ha insistido en que cuando éste no es congruente con la intensidad del trastorno primario, estamos ante un trastorno mixto. Con igual fin, pueden utilizarse los mapas ácido-base, donde se representan en puntos los valores gasométricos, pudiéndose identificar el tipo de trastorno según la zona del mapa en la que queden incluidos. Los trastornos mixtos quedarían entre dos zonas correspondientes a trastornos puros (fig. 2).
Acidosis metabólicaLa AM es un trastorno caracterizado primariamente por disminución de la concentración plasmática de bicarbonato, disminución de la PaCO2 por hiperventilación compensatoria, y tendencia a la disminución del pH arterial.
Además de la amortiguación del exceso de H+, la AM induce una hiperventilación por estímulo de los quimiorreceptores centrales y periféricos, que se inicia en 1-2 horas y se completa en un día. En su virtud, la PaCO2 baja 1,2 mmHg por cada 1 mEq/l que baja la concentración plasmática de bicarbonato. El efecto protector sobre el pH disminuye en unos días debido a que la hipocapnia provoca una reducción de la reabsorción renal de bicarbonato y, en consecuencia, pérdida urinaria del mismo. Además de lo anterior, el riñón elimina el exceso de H+ a través, fundamentalmente, de la excreción urinaria de NH4+.
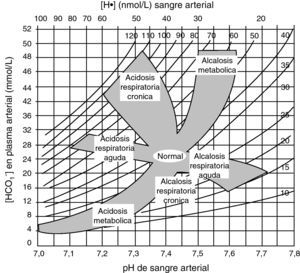
La AM se produce por acúmulo de ácidos no volátiles −debido a falta de eliminación renal, a aumento de su producción o a aporte exógeno− o por pérdidas −digestivas o renales− de bicarbonato. Se clasifica según que el hiato aniónico esté aumentado (normoclorémicas) o normal (hiperclorémicas). Mientras en el primer caso la AM se debe a acúmulo de ácidos, en el segundo se debe a pérdida de bicarbonato.
Las causas de AM se muestran en la tabla 2, y se comentan las más significativas.
Causas de acidosis metabólica
| Con anión gap elevado (normoclorémicas) |
| Cetoacidosis diabética, por ayuno o alcohólica |
| Acidosis láctica |
| Insuficiencia renal |
| Intoxicaciones |
| Salicilatos |
| Etanol |
| Etilenglicol |
| Metanol |
| Formaldehído |
| Tolueno |
| Azufre |
| Rabdomiólisis |
| Con anión gap normal (hiperclorémicas) |
| Pérdidas digestivas de bicarbonato |
| Diarrea |
| Ureterosigmoidostomía |
| Fístulas pancreáticas, biliares o intestinales |
| Pérdidas renales de bicarbonato |
| Acidosis tubulares renales |
| Hiperparatiroidismo primario |
| Fármacos |
| Acetazolamida |
| Anfotericina |
| Ciclosporina |
| Cotrimoxazol |
| Diuréticos distales |
| Topiramato |
| Administración de ácidos |
| Inhalación de gas cloro |
Cetoacidosis diabética. Es una complicación de la diabetes mellitus, muy especialmente del tipo 18, debida al déficit de insulina y al exceso de glucagón, que condicionan hiperglucemia −generalmente superior a 300 mg/dl−, hipercetonemia por lipolisis acelerada y oxidación incompleta de las grasas, cetonuria y AM con hiato aniónico elevado.
Acidosis láctica. Es un estado caracterizado por niveles de lactato plasmático superiores a 4-5 mEq/l, condicionado por hipoxia tisular (circunstancia en la que el ácido pirúvico no se metaboliza a CO2 y H2O sino a ácido láctico), disminución de su metabolismo hepático o por otros mecanismos menos conocidos. La causa más frecuente es el shock o la parada cardiorrespiratoria, aunque puede aparecer en otras circunstancias por mecanismos no siempre claros (tabla 3). La D-lactoacidosis es una forma peculiar de acidosis láctica, que se observa en pacientes con enfermedad del intestino delgado, en los que las bacterias del colon metabolizan a D-lactato la glucosa y el almidón que llegan en cantidad al intestino grueso9.
Causas de acidosis láctica
| Hipoxia | |
| Hipoxemia importante | Intoxicación por COa |
| Insuficiencia cardiaca | Ejercicio físico intenso |
| Shock | Convulsiones |
| Anemia | Tirotoxicosis |
| Obstrucción arterial local | Fiebre |
| Hemoglobinopatías | Nitroprusiato sódico |
| Enfermedades sistémicas | |
| Insuficiencia hepática | Síndrome MELASb |
| Neoplasias | Feocromocitoma |
| Diabetes mellitus | Sepsis |
| Fármacos y tóxicos | |
| Metformina | Xilitol, sorbitol |
| Salicilatos | Etanol |
| Isoniazida | Cianuro |
| Linezolid | Metanol |
| Inhibidores de la TIc | Etilenglicol |
| Acidosis D-láctica | |
| Síndrome de intestino corto | |
| Derivación yeyuno-ileal | |
| Obstrucción intestinal | |
Insuficiencia renal. La AM es una complicación frecuente de las nefropatías avanzadas (filtrado glomerular < 20 ml/minuto) debida a la incapacidad del riñón para excretar la carga ácida diaria. No suele ser importante, y cuando el bicarbonato es inferior a 10 mEq/l debe descartarse un hipoaldosteronismo u otro trastorno asociado.
Intoxicaciones. Diversos fármacos y tóxicos pueden producir AM: los salicilatos estimulan directamente el centro respiratorio y producen acúmulo de lactato y de cetoácidos, por lo que suelen ocasionar AlcR y AM. El etanol puede originar acidosis láctica y cetoacidosis. El metanol se metaboliza a ácido fórmico y, además, provoca acidosis láctica, al igual que el etilenglicol. La presencia de hiato osmolar en presencia de AM con anión gap elevado orienta precisamente hacia una intoxicación por metanol o etilenglicol, aunque puede verse también −con origen menos claro− en la cetoacidosis, acidosis láctica e insuficiencia renal crónica10.
Rabdomiólisis. Puede acompañarse de AM por la liberación de H+ y de ácidos orgánicos desde las células musculares.
Acidosis metabólica con anión gap normal (hiperclorémicas)Pérdidas digestivas de bicarbonato. La pérdida de líquidos intestinales provoca, debido a su alcalinidad, AM. Las derivaciones urinarias al tubo digestivo provocan AM por absorción del Cl− urinario y excreción de bicarbonato, y por absorción de amonio urinario.
Pérdidas renales de bicarbonato. La acidosis tubular renal (ATR) cursa con AM debido a la disminución de la secreción tubular de H+ (tipos 1 y 4) o al descenso de la reabsorción proximal de bicarbonato (tipo 2).
Fármacos. La acetazolamida inhibe la actividad de la anhidrasa carbónica en la célula tubular, con lo que disminuye la reabsorción de bicarbonato, que se elimina por la orina. Por mecanismo similar actúa el topiramato11. La anfotericina, el cotrimoxazol12 y la ciclosporina13 pueden producir, igualmente, ATR.
Administración de ácidos. La administración intravenosa de sales cloradas de aminoácidos (arginina, lisina o histidina) puede provocar, especialmente ante función renal deteriorada, AM hiperclorémica.
Clínica. Las manifestaciones de la AM, aparte de las propias del proceso causal, pueden ser respiratorias (disnea e hiperpnea −respiración de Kussmaul−), cardiovasculares (disminución de la respuesta inotrópica a las catecolaminas −pH < 7,15-7,20−, arritmias ventriculares y disminución de la contractilidad cardiaca e hipotensión arterial −pH < 7,15−), neurológicas (cefalea, disminución del nivel de conciencia, convulsiones e, incluso, coma) y óseas (especialmente en formas crónicas, que pueden condicionar, debido a la liberación de calcio y fosfato en el proceso de amortiguación ósea del exceso de H+, retraso de crecimiento o raquitismo en niños, y osteomalacia u osteoporosis en adultos). La afectación neurológica es menor que en la AR, ya que el bicarbonato atraviesa peor la barrera hematoencefálica que el CO2, y disminuye menos el pH del líquido cefalorraquídeo (LCR).
Diagnóstico. Se realiza por la historia clínica, la exploración física (hiperpnea, hipotensión, coma…) y la gasometría arterial, en la que se apreciará disminución de la concentración de bicarbonato, hipocapnia proporcional a la misma y, generalmente, pH bajo o en límites bajos. El anión gap nos permitirá discernir los dos grandes grupos de AM (fig. 3). Finalmente, los valores sanguíneos de glucosa, creatinina, potasio, creatinquinasa, cortisol, lactato, PaO2, carboxihemoglobina; o urinarios de cuerpos cetónicos, pH o tóxicos, pueden resultar definitivos para el diagnóstico. Como ya se ha dicho, la existencia de un hiato osmolar junto a AM con anión gap alto sugiere intoxicación por metanol o etilenglicol.
Tratamiento. No entramos a considerar aspectos terapéuticos de entidades específicas que, por otra parte, pueden ser suficientes para corregir el trastorno. En casos de acidemias graves, el objetivo fundamental es elevar el pH hasta 7,20 y el bicarbonato en torno a 15 mEq/l, para minimizar los efectos cardiovasculares de la acidosis. El déficit de bicarbonato se calcula teniendo en cuenta el volumen de distribución del mismo (en la AM, alrededor del 60% del peso corporal) mediante la siguiente fórmula: déficit de HCO3− = 0,6 x peso corporal (kg) × ([HCO3−] deseado – [HCO3−] medido). Aunque depende de la situación clínica, suele aconsejarse la reposición de la mitad del déficit en las primeras 12 horas. En la práctica, se dispone de bicarbonato 1 M (1 ml = 1 mEq de HCO3−) y 1/6 M (6 ml = 1 mEq de HCO3−). El uso de uno u otro estará en función de la gravedad y de la volemia.
Para finalizar, es imprescindible tener en cuenta que la AM suele acompañarse de déficit importante de K+, tanto por pérdidas digestivas (diarrea) como renales (cetoacidosis). Sin embargo, el exceso de H+ conlleva el paso del mismo al interior celular a cambio de la salida del K+ al espacio extracelular. El resultado es un aumento variable de la [K+] de 0,2 a 1,7 mEq/l por cada descenso de 0,1 en el pH arterial. Si no se tiene en cuenta, la corrección de la acidosis puede provocar hipopotasemias graves debido a la reentrada del K+ en las células. Otros problemas de la administración de bicarbonato son sobrecarga de volumen, arritmias (tras perfusión rápida), hipernatremia, tetania (especialmente en insuficiencia renal) o alcalosis, generalmente tras administración excesiva de bicarbonato e hiperventilación mantenida, por la dificultad del paso del bicarbonato a través de la barrera hematoencefálica, que condiciona persistencia de acidosis en el LCR.
Alcalosis metabólicaLa AlcM es un trastorno caracterizado primariamente por aumento de la concentración plasmática de bicarbonato, aumento de la PaCO2 por hipoventilación compensatoria, y tendencia al aumento del pH arterial.
La AlcM induce liberación de H+ por parte de los tampones intracelulares y, posteriormente, hipoventilación por inhibición del centro respiratorio debida al descenso de H+. Por ello, la PaCO2 se eleva 0,7 mmHg por cada 1 mEq/l que aumenta la concentración plasmática de bicarbonato. Al igual que ocurre en la AM, al cabo de unos días el pH arterial es igual con o sin compensación respiratoria, ya que el incremento de la PaCO2 aumenta la excreción de H+ y, en consecuencia, eleva la concentración plasmática de bicarbonato.
La AlcM se inicia generalmente con la pérdida digestiva −vómitos, aspiración nasogástrica− o renal −diuréticos− de H+. Como estos últimos proceden de la disociación del H2CO3 –según la reacción CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3− –, por cada mEq de H+ perdido, se genera otro mEq de bicarbonato. Otros procesos causantes de AlcM son la administración exógena de bicarbonato, el desplazamiento intracelular de H+ −y extracelular de K+− que tiene lugar en la hipopotasemia, y la contracción del volumen extracelular (VEC), fundamentalmente por el uso de diuréticos de asa. En estos casos, se mantiene prácticamente constante la cantidad total de bicarbonato extracelular, pero aumenta su concentración por el menor VEC14.
No obstante, la capacidad renal para excretar el exceso de bicarbonato es grande. Ello explica que la AlcM solo se perpetúe cuando coexisten circunstancias en las que esté aumentada la reabsorción renal de bicarbonato: disminución del VCE, hipocloremia, hipopotasemia o hiperaldosteronismo.
Etiología. Se pormenorizan las más habituales (tabla 4).
Causas de alcalosis metabólica
| Pérdida de H+ |
| Pérdidas digestivas |
| Vómitos o aspiración nasogástrica |
| Antiácidos orales |
| Diarreas con pérdida de cloro o hipopotasemia |
| Pérdidas renales |
| Diuréticos de asa o tiazidas |
| Hiperaldosteronismo primario o secundario |
| Alcalosis posthipercápnica |
| Dieta pobre en sal |
| Dosis altas de carbenicilina o derivados de la penicilina |
| Hipercalcemia |
| Movimiento intracelular de H+ |
| Hipopotasemia |
| Síndrome de realimentación |
| Retención/administración exógena de bicarbonato |
| Administración de bicarbonato sódico |
| Transfusiones masivas de sangre |
| Expansores de plasma con citrato, lactato o acetato |
| Síndrome de leche-alcalinos |
| Alcalosis por contracción |
| Diuréticos de asa o tiazidas |
| Pérdidas gástricas en pacientes con aclorhidria |
| Pérdidas de sudor en pacientes con fibrosis quística |
Pérdidas digestivas. Cuando el jugo gástrico (muy rico en H+) llega al duodeno, provoca una secreción equivalente de bicarbonato por parte del páncreas. En casos de vómitos o aspiración nasogástrica, ésta disminuye y se provoca AlcM, que puede mantenerse por la hipovolemia y la hipopotasemia acompañantes.
La diarrea ocasiona normalmente AM. Sin embargo, ante hipopotasemias graves, puede causar AlcM. La clorhidrorrea congénita o la diarrea del adenoma velloso (por disminución de la reabsorción del Cl− fecal y aumento de la secreción de bicarbonato) se pueden acompañar de AlcM.
Diuréticos. Los diuréticos de asa y las tiazidas pueden cursar con AlcM debido tanto a la hipovolemia como a las pérdidas urinarias de H+ y a la eventual hipopotasemia asociada.
Hiperaldosteronismo. La aldosterona provoca pérdida renal de K+ y de H+, y aumento de la reabsorción tubular renal de Na+. Por ello, el hiperaldosteronismo suele acompañarse de AlcM y, generalmente, de hipopotasemia.
Alcalosis posthipercápnica. La ventilación mecánica con disminución rápida de la PaCO2 en pacientes con acidosis respiratoria crónica, produce AlcM por persistencia de la elevación del bicarbonato plasmático.
Hipopotasemia. Aparte de que varias de las entidades causantes de AlcM provocan también hipopotasemia, ésta condiciona un desplazamiento intracelular de H+ y extracelular de K+, así como un aumento de la reabsorción renal de bicarbonato, presumiblemente por la acidosis de las células tubulares.
Síndrome de realimentación. La administración, especialmente de hidratos de carbono, tras un período prolongado de ayuno, puede inducir una AlcM probablemente porque la secreción de insulina condiciona antinatriuresis e hipopotasemia (con paso de K+ al interior y de H+ al exterior celular)15.
Retención de bicarbonato. La capacidad renal para excretar bicarbonato hace poco probable que su administración produzca AlcM, salvo que coincida una excreción renal disminuida. Es más frecuente tras el tratamiento de la acidosis láctica y de la cetoacidosis, en que los aniones orgánicos, como el lactato, pueden ser metabolizados a bicarbonato cuando se corrige la causa. Algo parecido ocurre con transfusiones masivas de sangre, por el aporte de citrato sódico y posterior metabolización a bicarbonato.
Alcalosis por contracción. En esta situación, provocada por diuréticos de asa o tiazidas, se pierde NaCl y agua, y aumenta la concentración plasmática de bicarbonato. La hipovolemia perpetúa la AlcM.
Clínica. Tanto la sintomatología como la exploración física de la AlcM suelen ser poco relevantes, salvo por los datos derivados de una eventual deshidratación o hipopotasemia. En todo caso, la afectación neurológica es menos llamativa que la de la AlcR, ya que el bicarbonato atraviesa la barrera hematoencefálica peor que el CO2. No obstante, en las formas graves puede aparecer hiperreflexia, parestesias, mareos o, incluso, tetania.
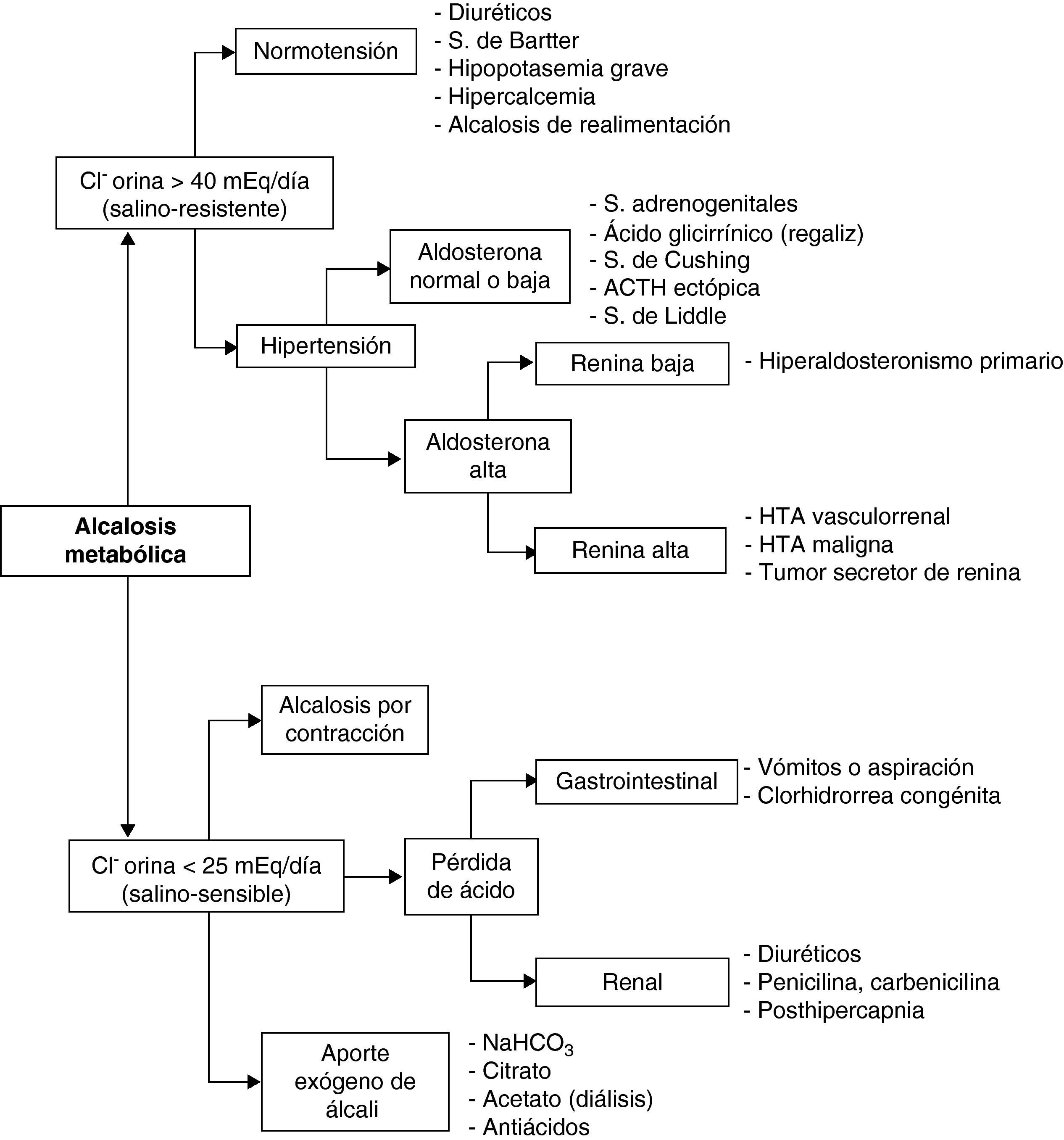
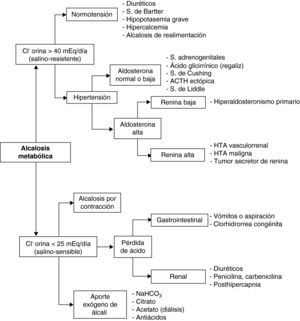
Diagnóstico. La historia clínica (vómitos, diuréticos…) y la exploración física (deshidratación, edemas, hipertensión arterial…) suelen orientar sobre la etiología. La gasometría arterial revelará elevación del bicarbonato, aumento variable de la PaCO2 y, generalmente, pH alto o en límites altos. Para estudiar el VCE en la AlcM, la determinación del ClU es más fiable que la del NaU, ya que en esta situación, el NaU se excreta junto con el exceso de bicarbonato y puede estar, por ello, elevado. En función del ClU, la AlcM se clasifica en salino-sensible (ClU < 25 mEq/día), con buena respuesta a la reposición de volumen; y salino-resistente (ClU > 40 mEq/día), sin respuesta a dicha terapia. El diagnóstico diferencial se expone en la figura 4.
Tratamiento. Cuando no existe depleción de volumen, de Cl− o de K+, la AlcM puede corregirse espontáneamente mediante la excreción renal del exceso de bicarbonato. Por tanto, es primordial solucionar estas deficiencias y tratar el proceso causal. En las formas salino-sensibles puede utilizarse suero salino al 0,9% a un ritmo que estará en función de la tensión arterial, de la diuresis y del riesgo de insuficiencia cardiaca. En casos de hipopotasemia, hay que reponer el déficit con cloruro potásico intravenoso u oral (Potasion comprimidos®) y evitar la administración de otros preparados de potasio (Potasion solución®, Boi-K®, Boi-K aspártico® o Acalka®) porque contienen o se transforman en bicarbonato. En las formas salino-resistentes asociadas a edema y tratamiento diurético se debería suspender el mismo o sustituirlo por acetazolamida, diurético suave que aumenta la excreción renal de bicarbonato. En casos resistentes, puede estar indicada la administración de HCl o la diálisis. El hiperaldosteronismo primario se trata quirúrgicamente o con diuréticos ahorradores de potasio. Los raros casos de insuficiencia renal con AlcM grave –generalmente tras vómitos o aspiración nasogástrica− pueden tratarse con HCl o con diálisis.
Acidosis respiratoriaLa AR es un trastorno caracterizado primariamente por elevación de la PaCO2 debida a hipoventilación, elevación variable de la concentración plasmática de bicarbonato como respuesta compensadora, y tendencia a la disminución del pH arterial.
En las formas agudas, el mecanismo compensatorio −poco eficaz− se limita al tamponamiento celular por proteínas y por hemoglobina. En las formas crónicas se estimula la secreción renal de H+ y, consecuentemente, aumenta la reabsorción renal de bicarbonato. Dicho proceso se completa en 3-5 días. Así, en la AR aguda la concentración plasmática de bicarbonato sube 1 mEq/l por cada 10 mmHg que sube la PaCO2; y sobre 3,5 mEq/l por cada 10 mmHg de elevación, en las formas crónicas.
Las causas de AR se relacionan en la tabla 5. Puede cursar, especialmente en formas agudas, con cefalea, agitación, temblor, flapping, somnolencia, arritmias, vasodilatación periférica, convulsiones o coma. Las formas crónicas leves o moderadas pueden ser escasamente sintomáticas.
Causas de acidosis respiratoria
| Depresión del centro respiratorio |
| Fármacos (opiáceos, anestésicos, sedantes) |
| Lesiones del sistema nervioso central (traumatismos, infecciones, ACVA*, tumores) |
| Hipoventilación alveolar primaria |
| Síndrome de las apneas/hipopneas del sueño (SAHS) |
| Oxigenoterapia a flujo alto en hipercapnia crónica |
| Parada cardiaca |
| Hipotiroismo |
| Enfermedades del aparato respiratorio |
| Obstrucción de las vías aéreas superiores (cuerpos extraños, vómito, laringoespasmo, bocio, SAHS…) |
| Neumonía, asma bronquial o EAP** graves, EPOC***, SDRA**** |
| Neumotórax |
| Derrame pleural masivo |
| Enfermedades neuromusculares y de la pared torácica |
| Síndrome de Guillain-Barré |
| Esclerosis múltiple |
| Esclerosis lateral amiotrófica |
| Crisis miasténica |
| Poliomielitis |
| Lesión medular |
| Lesiones del nervio frénico |
| Parálisis periódicas |
| Hipopotasemia o hipofosfatemia graves |
| Fármacos (curare, succinilcolina, aminoglucósidos) |
| Traumatismo torácico |
| Cifoescoliosis, espondilitis anquilosante |
| Obesidad extrema |
| Ventilación mecánica insuficiente |
*Accidente cerebro-vascular agudo. ** Edema agudo de pulmón. *** Enfermedad pulmonar obstructiva crónica. ****Sindrome de distrés respiratorio del adulto.
El diagnóstico se establece por la historia clínica y la gasometría arterial, en la que se apreciará hipercapnia, elevación variable de la concentración de bicarbonato y, generalmente, pH bajo o en límites bajos. La clínica y el grado de elevación del bicarbonato nos permitirá establecer el carácter agudo o crónico del trastorno, o la presencia de un trastorno mixto. Un A-aPO2 elevado (en jóvenes y adultos, superior a 20 mmHg; en personas mayores, superior a 30 mmHg) dirige la sospecha hacia una alteración pulmonar intrínseca, frente a las formas con A-aPO2 normal, propias de enfermedades de la caja torácica, del centro respiratorio o del sistema neuromuscular16.
Además de la terapia causal, es fundamental la administración de oxígeno a un flujo que no empeore la hipercapnia y que asegure una PaO2 superior a 60 mmHg. Puede ser necesaria la ventilación mecánica. La administración de bicarbonato está indicada cuando coexiste acidosis metabólica, en la parada cardio-respiratoria y, en general, cuando el pH está por debajo de 7,10.
Alcalosis respiratoriaLa AlcR es una entidad caracterizada primariamente por disminución de la PaCO2 debida a hiperventilación, disminución variable de la concentración plasmática de bicarbonato como respuesta compensadora, y tendencia a la elevación del pH arterial.
En las formas agudas, la compensación fundamental, efectiva en pocos minutos, se produce por el paso de H+ celulares −procedentes de tampones intracelulares− al LEC y su combinación posterior con bicarbonato para formar CO2 y H2O. En las formas crónicas, disminuye la excreción renal de H+, debida en parte a la elevación del pH en las células tubulares renales, lo que provoca aumento de la excreción de bicarbonato. Este mecanismo se inicia en pocas horas y se completa en 2-3 días17. En ambos supuestos, disminuye compensatoriamente la concentración de bicarbonato: 2 mEq/l por cada 10 mmHg que disminuye la PaCO2 en las formas agudas; y 4-5 mEq/l por cada 10 mmHg de descenso de la PaCO2 en las formas crónicas.
Las causas de AlcR se exponen en la tabla 6, y pueden derivar de la presencia de hipoxemia o hipoxia tisular −por estímulo de los quimioceptores periféricos o centrales, y de los mecanoceptores de las vías aéreas− o del estímulo directo del centro respiratorio.
Causas de alcalosis respiratoria
| Hipoxemia |
| Enfermedades pulmonares (edema pulmonar, fibrosis pulmonar, asma bronquial, neumonía, TEP*, SDRA**…) |
| Insuficiencia cardiaca congestiva |
| Hipotensión y/o anemia |
| Permanencia en grandes alturas |
| Estímulo directo del centro respiratorio |
| Hiperventilación psicógena o voluntaria |
| Ansiedad o dolor |
| Insuficiencia hepática |
| Sepsis |
| Hipertiroidismo |
| Intoxicación por fármacos (salicilatos, topiramato, teofilina, catecolaminas...) |
| Corrección excesiva de acidosis metabólica |
| Embarazo |
| Trastornos neurológicos (ACVA, infecciones, traumatismos, tumores…) |
| Ventilación mecánica excesiva |
* Tromboembolismo de pulmón. ** Sindrome de distrés respiratorio del adulto.
La sintomatología de la AlcR depende de la hiperexcitabilidad del sistema nervioso central y periférico, es más llamativa en las formas agudas, y consiste fundamentalmente en mareo, deterioro del nivel de conciencia, parestesias, calambres y espasmo carpopedal. En ocasiones, aparecen arritmias supraventriculares y ventriculares.
El diagnóstico viene dado por la historia clínica, la presencia de taquipnea, y por la gasometría arterial, en la que se apreciará hipocapnia, disminución variable de la concentración plasmática de bicarbonato y, generalmente, pH elevado o en límites altos. Se insiste en la necesidad de calcular la coherencia del descenso del bicarbonato, que nos permitirá establecer el carácter agudo o crónico del trastorno, o la presencia de un trastorno mixto.
El tratamiento de la AlcR es el del proceso causal. Ante sintomatología llamativa, generalmente en formas agudas, puede ser útil la reinhalación del aire espirado en una bolsa cerrada, con el objeto de aumentar la PaCO2.
Trastornos mixtosLas alteraciones mixtas del equilibrio acidobásico se caracterizan por la presencia simultánea de dos o más trastornos. Son habituales en pacientes hospitalizados, y muy especialmente en las unidades de atención a pacientes críticos18,19. Así, suelen verse en la parada cardiaca o respiratoria, la sepsis, las intoxicaciones, el edema pulmonar20, la insuficiencia hepática21,22, la diabetes mellitus23 o el fracaso multiorgánico24–26. Y ello, sin considerar la coincidencia de varias enfermedades en un mismo paciente, que también puede provocar alteraciones análogas. Es el caso, por citar un solo ejemplo, de los pacientes con EPOC que siguen tratamiento diurético, que tienen vómitos o diarrea, o que están sometidos a aspiración nasogástrica27. Su reconocimiento, sin embargo, no es habitual4,5,28.
El diagnóstico se establece ante la constatación de incoherencia, por exceso o por defecto, de los valores compensatorios. En este caso, los puntos resultantes en el nomograma ácido-base se sitúan en las zonas intermedias, fuera de las correspondientes a los trastornos simples. Se exponen a continuación las cuatro situaciones más frecuentes.
Acidosis respiratoria y acidosis metabólica. Cursa con valores de PaCO2 inadecuadamente altos para el descenso del bicarbonato (por ejemplo, ante edema de pulmón e insuficiencia renal)29, o ante valores de bicarbonato inadecuadamente bajos −aunque dentro, o incluso por encima, del rango «normal»− para el aumento de la PaCO2 (hipercapnia crónica y diarrea).
Acidosis respiratoria y alcalosis metabólica. Relativamente habitual en pacientes con EPOC que reciben tratamiento con dieta hiposódica, diuréticos de asa o tiazídicos, y/o corticoides28. Cursa con valores de bicarbonato inadecuadamente elevados para la elevación de la PaCO2. Se trata de una combinación peligrosa, toda vez que la AlcM perpetúa la hipoventilación y puede empeorar el proceso respiratorio25,28,30.
Acidosis metabólica y alcalosis respiratoria. Cursa con PaCO2 inadecuadamente baja para el descenso de bicarbonato (intoxicación por salicilatos31 o topiramato32).
Alcalosis mixta. Cursa con PaCO2 inadecuadamente baja (podría estar dentro del rango «normal») para un bicarbonato elevado, o con una concentración plasmática de bicarbonato inadecuadamente alta (podría estar en el rango «normal») para una PaCO2 baja. Puede verse, entre otros, en pacientes en diálisis con alcalosis respiratoria33 o en embarazadas con hiperemesis gravídica.