La anticipación del cribado de las aneuploidías fetales al primer trimestre ha requerido implementar técnicas diagnósticas en este momento de la gestación. La biopsia de vellosidades coriales (BVC) es un procedimiento diagnóstico invasivo en Medicina Materno-Fetal, que consiste en la obtención de vellosidades coriales para estudio citogenético, molecular o bioquímico. Existen dos vías para la realización de la BVC, la transcervical y la transabdominal. La preferencia por una de las dos vías se ha basado históricamente en factores como son la localización placentaria, paridad, peso materno, preferencias del operador, etc. En nuestra institución pasamos a utilizar la vía transcervical de manera casi exclusiva, con resultados ventajosos para la gestante y el laboratorio. Todo ello, sin diferencias en cuanto a la tasa de pérdida gestacional u otras complicaciones. A pesar de 3 décadas de uso de la BVC transcervical, existe poco consenso en cuanto a su técnica y las guías clínicas específicas para su realización son escasas. Aprovechando la experiencia y el volumen acumulado de procedimientos realizados en nuestro centro, hemos planteado una guía clínica eminentemente práctica para la realización de BVC transcervical.
Early screening for foetal aneuploidies in the first trimester has required the introduction of diagnostic procedures appropriate for this period of pregnancy. Chorionic villi sampling (CVS) is an invasive diagnostic procedure in Maternal-Foetal Medicine to obtain chorionic villi for cytogenetic, molecular or biochemical analysis. There are two routes for CVS, transcervical and transabdominal. Preference for one of two routes has been historically based on factors such as, placental location, parity, maternal weight, operator preferences, etc. Our institution switched to using the transcervical approach almost exclusively, with advantages for the patients and laboratory with no differences in the pregnancy loss rate and other complications. Despite 3 decades of CVS use, there is no consensus as regards its application, and practice guidelines are few. Taking advantage of our experience with a large amount of procedures, we propose this practice guideline.
La anticipación del cribado de las aneuploidías fetales al primer trimestre ha requerido implementar técnicas diagnósticas en este momento de la gestación, para poder ofrecer tempranamente confianza a los padres cuando el resultado es normal, y en caso de diagnosticar una alteración cromosómica poder brindar un asesoramiento precoz que permita a los padres optar por una interrupción más temprana y más segura para la madre. El diagnóstico prenatal de primer trimestre ha permitido iniciar el segundo trimestre con la cuestión «diagnóstico cromosómico» prácticamente resuelta.
La biopsia de vellosidades coriales (BVC), o coriocentesis, como preferimos denominarlo, es un procedimiento diagnóstico invasivo de complejidad media en Medicina Materno-Fetal, que consiste en la obtención de vellosidades coriales para estudio cromosómico, molecular y estudios bioquímicos en caso de errores congénitos del metabolismo. Requiere de entrenamiento y experiencia suficientes del operador, así como de su equipo y del laboratorio de Genética, ya que tanto las tasas de obtención del resultado como las de pérdida gestacional estarán relacionadas directamente con estos factores1,2.
Existen dos vías para la realización de la BVC, la transcervical y la transabdominal3. La preferencia por una de las dos vías se ha basado históricamente en factores como son la localización placentaria, paridad, peso materno, preferencias del operador, entre otros. Las sugerencias de nuestro laboratorio para disponer de muestras de vellosidades coriales más abundantes, de fácil limpieza y selección, nos hizo decantarnos progresivamente por la vía transcervical. Pasamos de utilizar en los 90 las dos vías casi indistintamente, a la vía transcervical de manera casi exclusiva. Nuestra experiencia, así como la de otros grupos, indica que casi todas las BVC pueden realizarse por dicha vía, con resultados ventajosos para la gestante y el laboratorio, ya que existe menor dolor y mejor calidad de la muestra4. Todo ello, sin diferencias en cuanto a la tasa de pérdida gestacional u otras complicaciones5. El inconveniente de la vía transcervical radica en ser un procedimiento diferente a la mayoría de los restantes procedimientos invasivos de diagnóstico prenatal, como la amniocentesis, cordocentesis y BVC transabdominal, que utilizan de manera similar una aguja y una sonda ecográfica.
A pesar de 3 décadas de uso de la BVC transcervical, existe poco consenso en cuanto a su técnica y las guías clínicas específicas para su realización son escasas. Existen 2 instrumentos para su realización: el catéter flexible de plástico o la pinza metálica maleable, la primera de mayor uso en Estados Unidos y la segunda en Europa. Hemos podido comparar ambos instrumentos, encontrando claras ventajas de la pinza sobre el catéter6, debido a su mayor rigidez y a obtener muestras de mayor cantidad y calidad. Aprovechando la experiencia y el volumen acumulado de procedimientos realizados en nuestro centro7, hemos planteado una guía clínica eminentemente práctica para la realización de BVC transcervical.
Preparación de la pruebaComo todo procedimiento invasivo se debe realizar una lista de comprobación-checklist- previamente al procedimiento, ya que dicha sistematización evitará que deba interrumpirse la BVC por causa previsibles. A continuación se describe el checklist» para gestaciones evolutivas:
- -
Las indicaciones se resumen en la tabla 1.
Tabla 1.Indicaciones de biopsia de vellosidades coriales
- Cribaje combinado del primer trimestre con riesgo ≥ 1/250 para T21 o T18 - Anomalía cromosómica en gestación previa (sobre todo trisomía) - Anomalía cromosómica en uno de los progenitores - Anomalía fetal ecográfica detectada en el estudio morfológico precoz - Confirmación de un diagnóstico pre-implantatorio - Aborto diferido (sobre todo si es de repetición) - Discordancia > 1 semana en la LCC entre gemelos(CIR severo precoz) - Enfermedad monogénica con diagnóstico molecular o bioquímico disponible en vellosidades coriales CIR: crecimiento intrauterino restringido; LCC: longitud cráneo-caudal.
- -
Valorar las contraindicaciones relativas:
- ∘
Metrorragias: en general recomendamos diferir la BVC hasta lograr una semana libre de metrorragias
- ∘
Infección materna por HIV y VHB: el procedimiento de elección es la amniocentesis no-transplacentaria
- ∘
- -
Edad gestacional: se podrá realizar una biopsia corial transcervical entre las 10+0 y las 14+6 semanas, aunque es preferible entre las 11+0 y 13+6 semanas. En placentas de inserción baja, la BVC es factible hasta la semana 1512.
- -
Asesoramiento previo a la prueba, por parte de un genetista, obstetra o matrona
- -
Consentimiento informado.
- -
Se debe conocer el RhD materno: en caso de que sea negativo se pautará gammaglobulina anti-D antes de las 72 horas post-procedimiento, a excepción de que se haya realizado un genotipado no invasivo fetal con resultado de feto RhD negativo.
- -
Se deben conocer las serologías VIH, VHB y en casos de riesgo VHC.
- -
Es recomendable que en el momento de la prueba la gestante tenga una distensión vesical media, que permita la visualización ecográfica del cérvix, ya que una mayor o menor distensión vesical pueden interferir con el procedimiento.
En gestaciones no evolutivas, la BVC tiene mejores resultados que el análisis de los restos ovulares post-evacuación uterina8,9. En las gestaciones no evolutivas existen los siguientes cambios sobre el checklist precedente:
- -
No hay contraindicaciones.
- -
Edad gestacional: hasta las 15 semanas.
- -
No es necesario el asesoramiento genético previo a la prueba, ni un consentimiento informado específico para BCV.
- -
No es necesario conocer las serologías.
Los requerimientos de personal y material son los siguientes:
- -
Es necesaria la presencia de un ayudante con experiencia en ecografía para guiar al operador durante el procedimiento.
- -
En cuanto a instrumental, los requerimientos mínimos son:
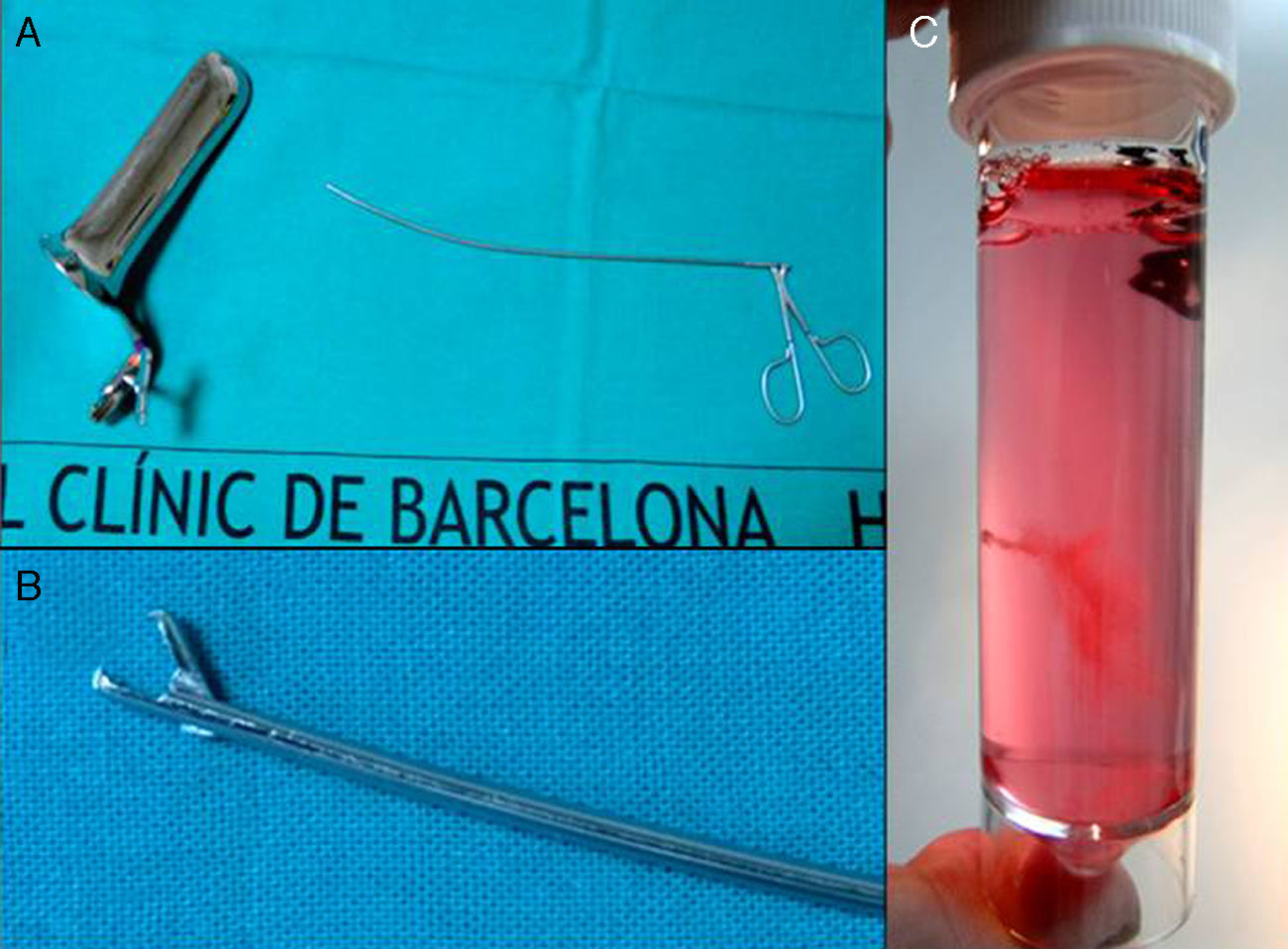
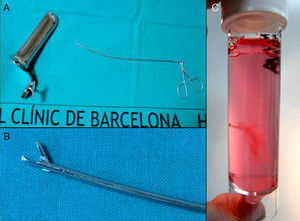
La pinza de BVC transcervical denominada snake, de 25cm de largo y 1,9mm de diámetro fue diseñada por Charles Rodeck en los años 80 en Londres y fue fabricada inicialmente por un artesano inglés. Posteriormente fue comercializada por la empresa DeElles Instruments hasta hace un par de años y en la actualidad por Area Medica, en Barcelona. Storz ha comercializado una pinza similar, aunque es más corta, más gruesa y más rígida.
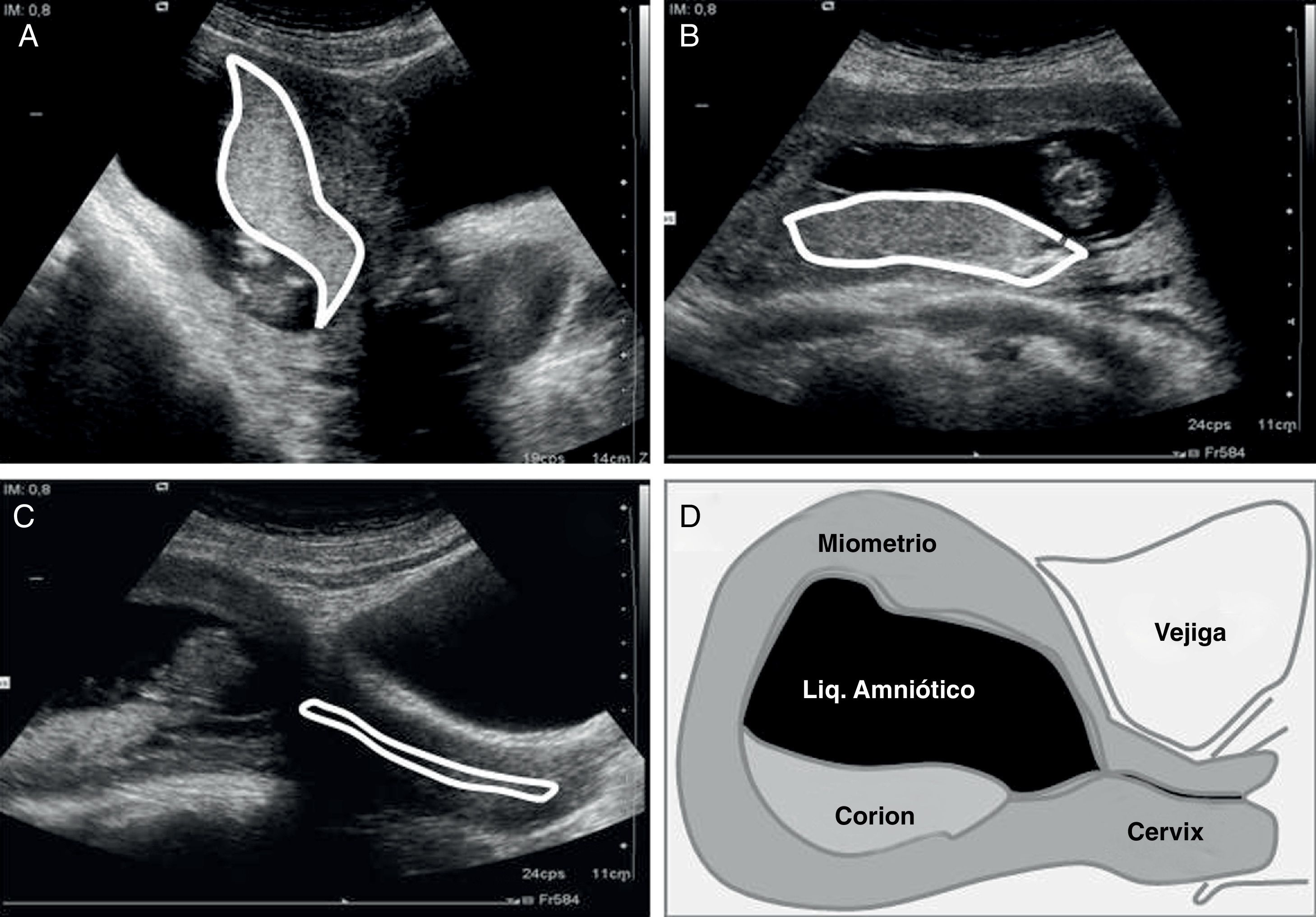
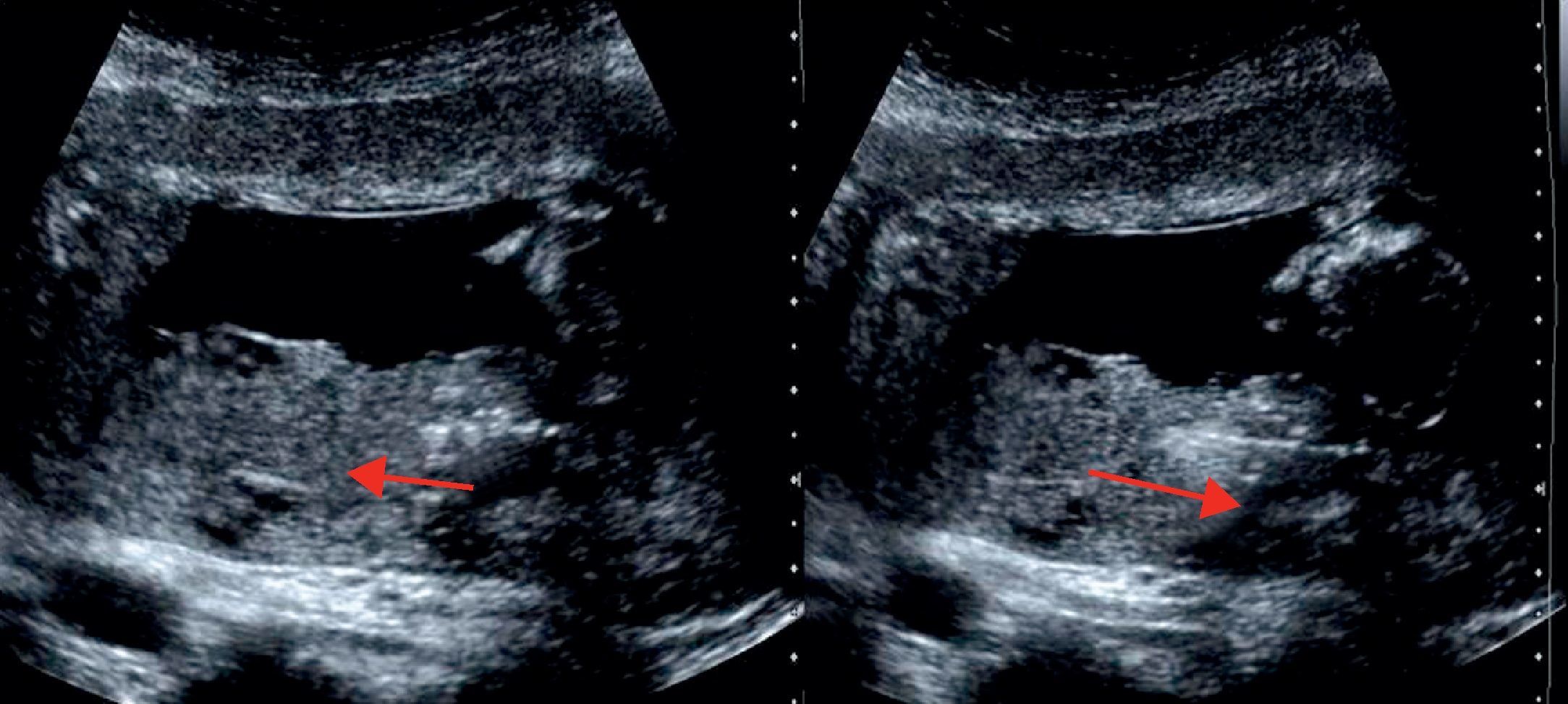
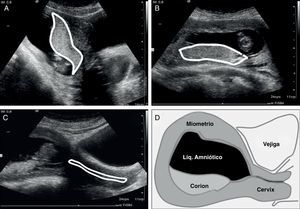
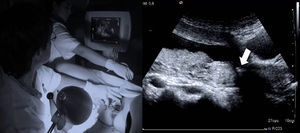
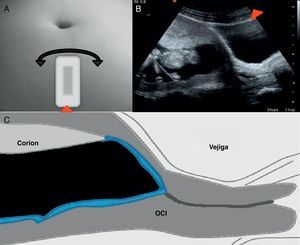
Valoración y planeamientoNo se iniciará el procedimiento sin realizar una valoración ecográfica transabdominal previa. Inicialmente la realiza el operador con tres cortes básicos (Fig. 2 A-D):
- -
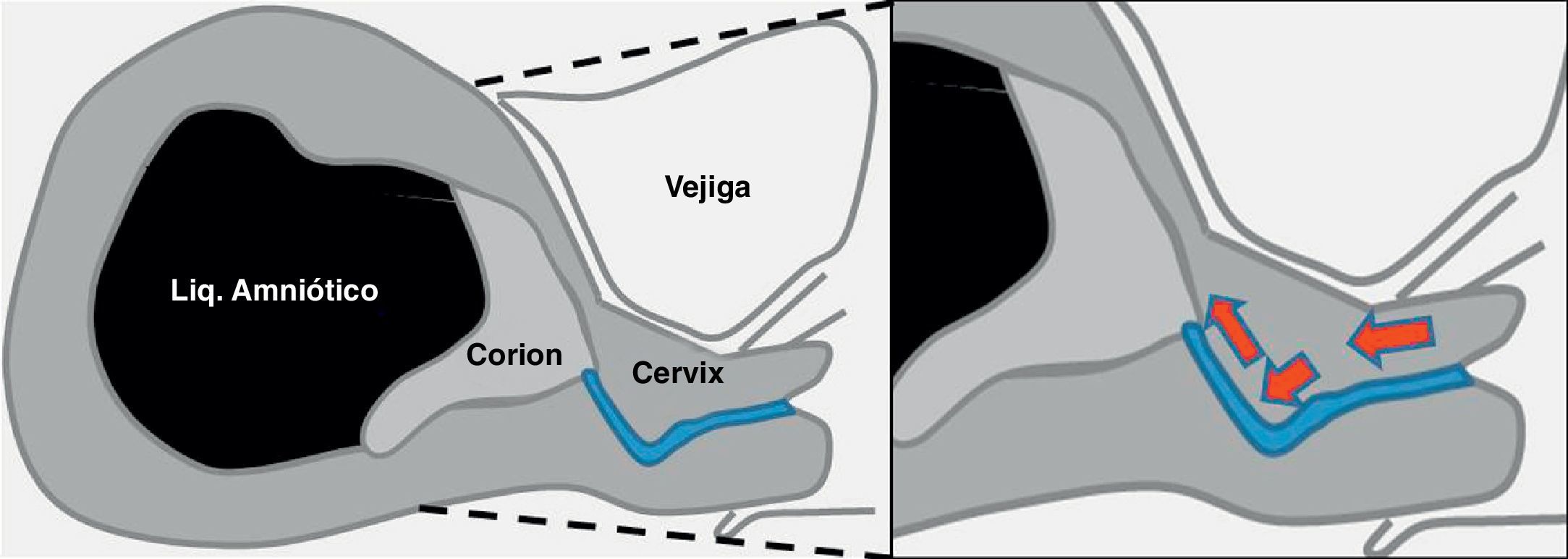
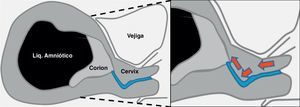
Sagital medio: permite definir la localización anterior o posterior del corion, así como la distancia entre este y el orificio cervical interno (OCI).
- -
Transversal: define la lateralidad del corion, pudiendo este ser central, izquierdo o derecho; algo especialmente importante cuando el corion es anterior.
- -
Sagital del cérvix: se define el trayecto del canal cervical.
Recomendación: siempre se debe orientar la sonda perpendicularmente al abdomen materno sin angularla lateralmente.
Durante la ecografía previa, el operador planea la vía de acceso al corion y selecciona la zona ideal para la toma de la muestra, que será la porción de corion de mayor grosor y ecogenicidad cercana a la placa corial (cara fetal del corion).
Recomendación: cuando el útero está en anteversión y el corion es anterior, el acceso por la pared anterior puede resultar impracticable, siendo necesario prever un plan B alternativo, de entrada por la pared posterior, lateral derecha o izquierda.
Preparación de la gestanteMientras el operador se prepara, el ayudante repetirá los 3 cortes ecográficos para hacerse una «composición de lugar» y guiar de manera adecuada el procedimiento.
Se ubica la gestante en posición de litotomía, con las caderas bien apoyadas y lo más cerca posible del borde de la camilla, ya que esta posición permitirá un mayor ángulo de maniobrabilidad.
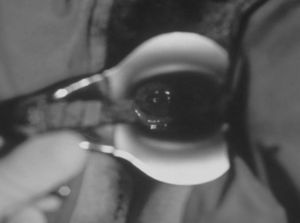
El operador realiza asepsia de la zona vulvar y vaginal, inserta el espéculo vaginal procurando realizar una apertura no excesiva que permita la visualización del cérvix y que este quede fijado entre las 2 palas del espéculo (fig. 3). Una vez el espéculo se encuentra en la posición correcta, se realiza asepsia del cérvix.
Recomendación: utilizar espéculos metálicos con mecanismo de apertura en posición lateral, ya que la posición central interfiere en el procedimiento, sobre todo la angulación anterior y el manejo de la pinza.
Biopsia corial: trayecto cervicalLa realización de la biopsia corial tiene 3 tiempos: el primero es avanzar la pinza hasta el OCI (fig. 4) y consiste en los siguientes pasos:
- -
El ayudante enfoca todo el cérvix en la pantalla e identifica el trayecto del canal cervical, tratando de evitar la sombra producida por el espéculo.
- -
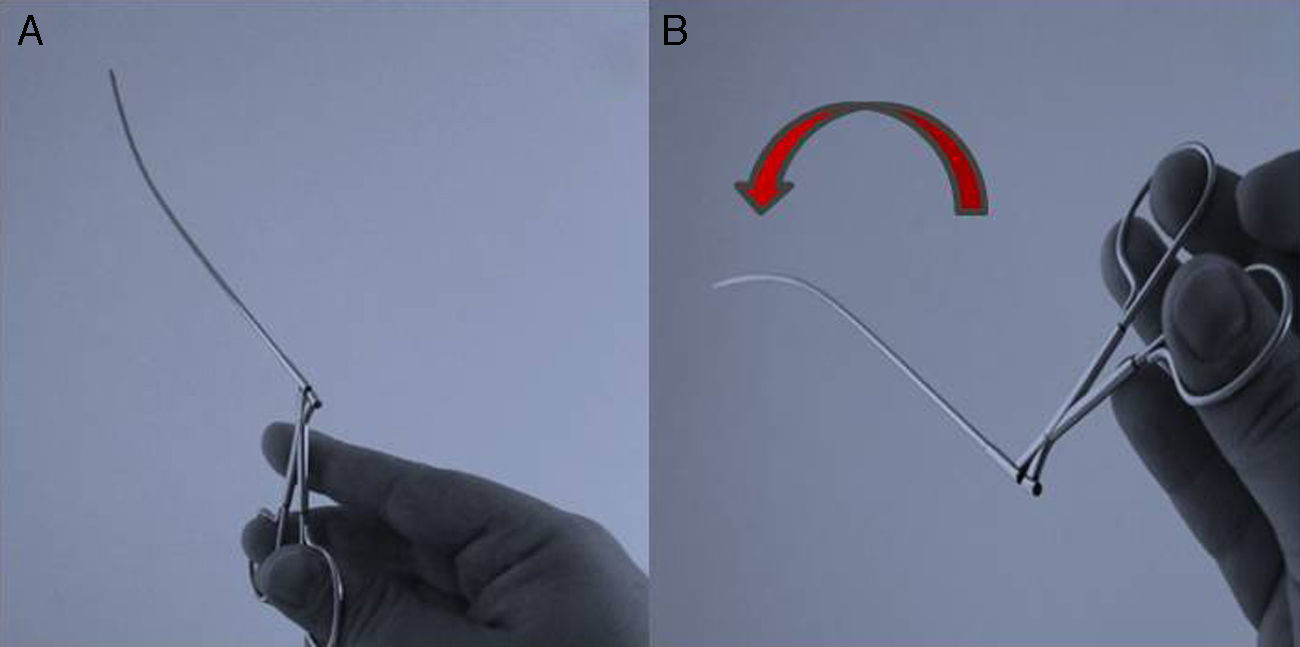
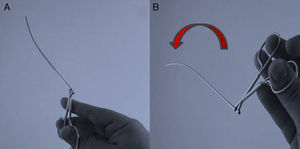
El operador toma la pinza de la mesa por el mango, seca el tallo con una gasa estéril, comprueba que se abra y cierre correctamente y que su curvatura sea la correcta.
- -
El operador coloca la pinza en la vagina, cuidando de no tocar la pared vaginal e introduciéndola en el cérvix por el orificio cervical externo (OCE).
- -
Se presiona ligeramente para recorrer el canal cervical. En caso de encontrar resistencia debe orientarse la pinza a lo largo de los 360° del reloj, hasta encontrar un punto de menor resistencia. Si no se consigue, se gira toda la pinza por el mango 360° con presión constante y suave hasta encontrar la vía de entrada. Como última opción, se podrá colocar una pinza de Pozzi para traccionar y reorientar el cérvix.
Recomendaciones:
- -
En un gran número de casos el canal tiene un recorrido en «J» haciéndose necesario avanzar la pinza en dirección posterior (dorsal) y posteriormente reorientarla hacia arriba (ventral) antes de llegar a OCI (fig. 5).
- -
Todo cambio de orientación del avance de la pinza en sentido anterior o posterior se realiza mediante el movimiento correspondiente del espéculo.
- -
En las multíparas el canal ofrece menor resistencia y al ser más corto, no se debe avanzar sin control ecográfico continuado.
- -
En úteros en retroversión, la introducción de la pinza se inicia con una rotación del mango de 180 grados, que se sitúa en la parte superior, para aprovechar una curvatura de la pinza orientada en sentido posterior (fig. 6).
La segunda fase de la BVC consiste en avanzar la pinza hasta el corion:
- -
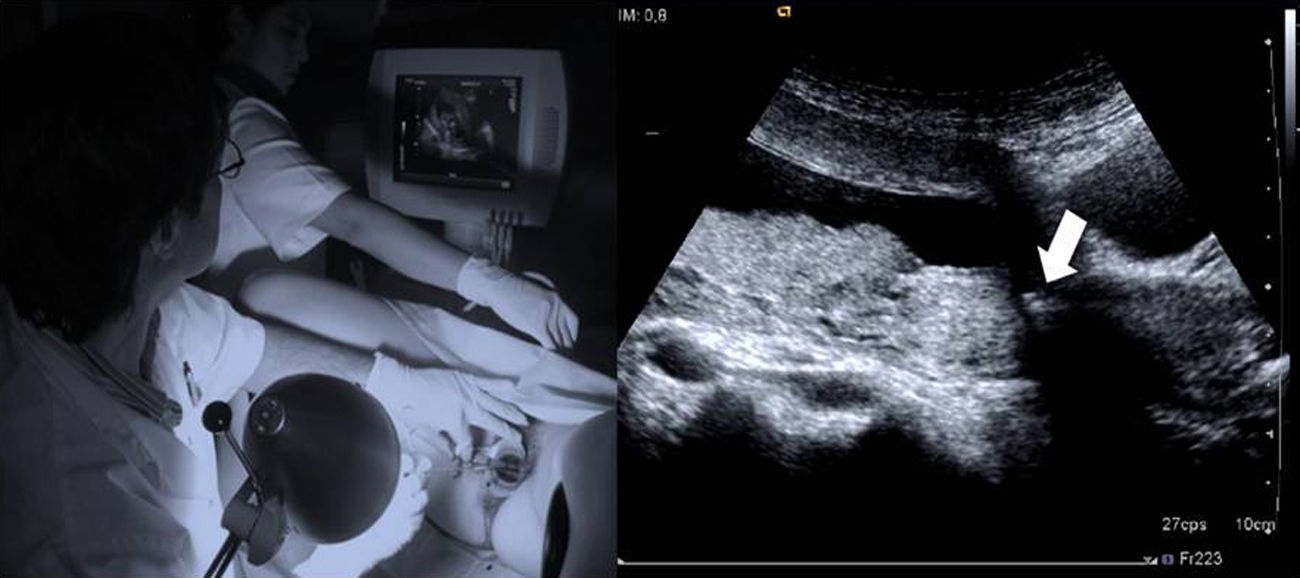
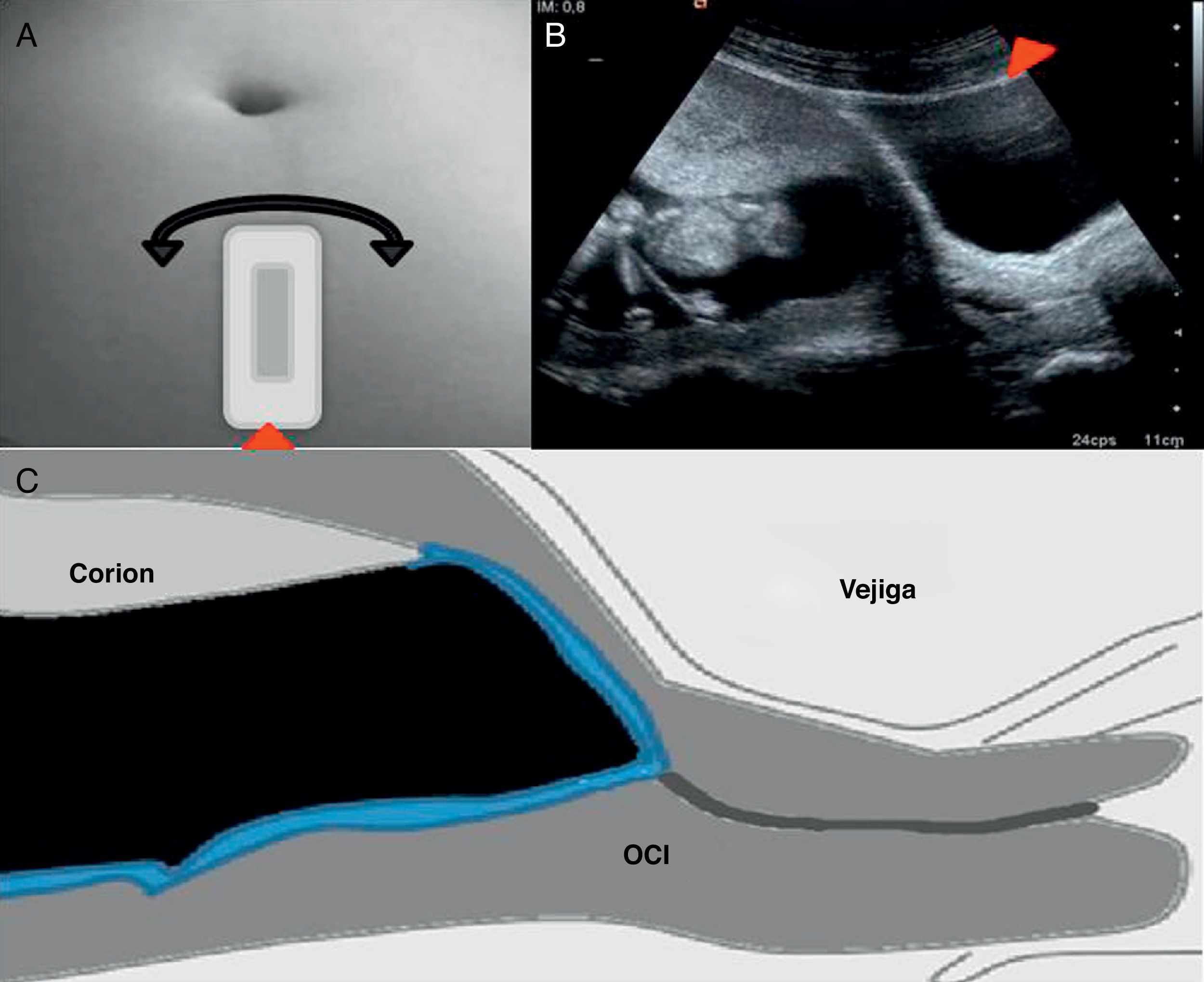
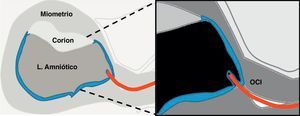
Una vez en el OCI, es necesario reevaluar la vía de progresión hasta el corion, ya que en algunos casos, su localización no siempre es predecible por ecografía. Esta reevaluación se realiza en el corte sagital valorando la distancia desde el OCI, donde se encuentra la punta de la pinza en este momento, hasta el borde proximal del corion, tanto por la pared posterior como por la anterior. Se fija el extremo inferior de la sonda en el OCI y se desplaza ligeramente el extremo superior de la sonda hacia la derecha o izquierda/ en sentido horario o antihorario (movimiento en «limpiaparabrisas»), buscando la zona corial óptima, de mayor grosor y ecogenicidad placentaria (fig. 7A, B). Si el corion es de inserción baja esta fase no es necesaria.
- -
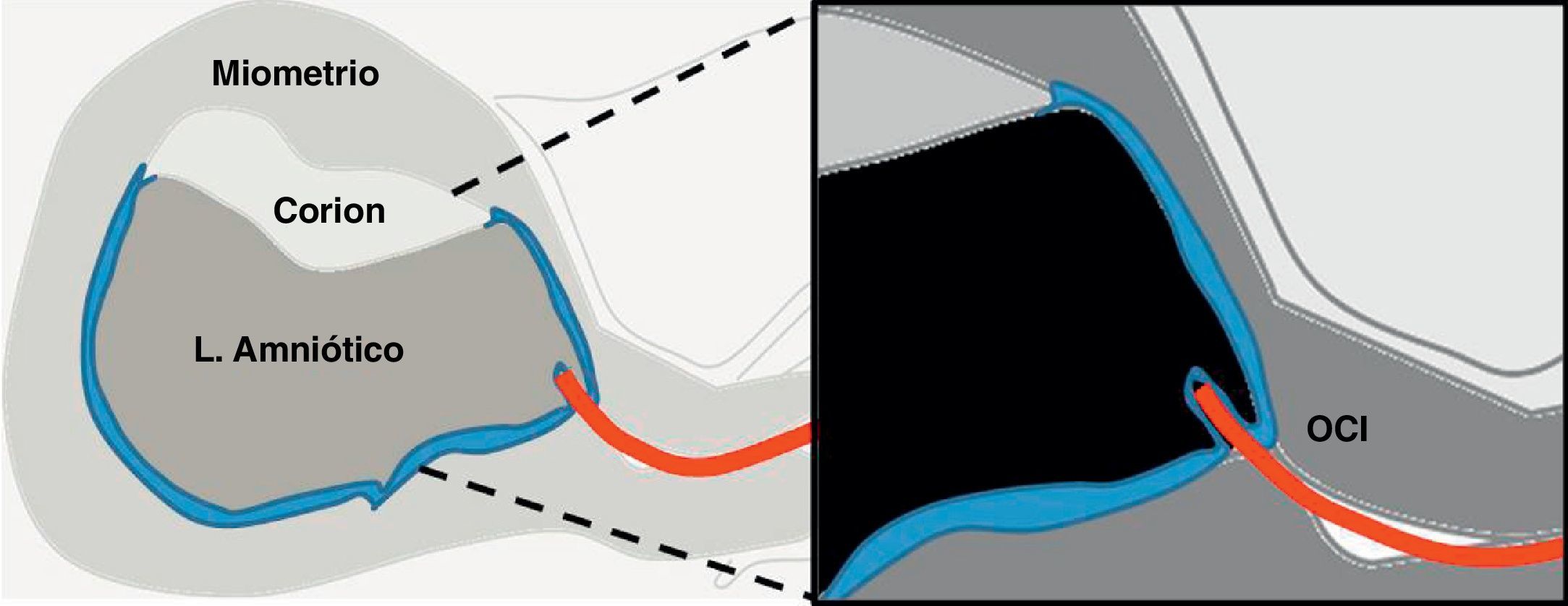
Una vez se decide la vía, se avanza la pinza por el espacio virtual entre la decidua y la membrana corial (corion liso) (fig. 7C). Cuando se accede por la pared posterior y el útero está en anteversión, se debe ir rozando tangencialmente la decidua de la pared posterior, con escaso riesgo de romper las membranas.
Cuando se avanza por la pared anterior en un útero anteverso, existe un mayor riesgo de crear una falsa ruta (fig. 8). Por lo tanto, el avance de la pinza desde el OCI debe realizarse de manera muy cautelosa, rozando la pared uterina anterior, angulando de manera forzada la pinza hacia arriba, mediante un movimiento forzado del espéculo hacia abajo.
Esta misma maniobra se aplica de manera inversa (pinza hacia abajo, espéculo hacia arriba) cuando el útero está en retroversión, sobre todo cuando el corion es posterior.
Cuando el corion es anterior y es imposible avanzar la pinza rozando la pared uterina anterior debido a la anterversoflexión, una opción alternativa es avanzar por una pared lateral, si el corion está lateralizado a la derecha o izquierda y cuando se llega al fundus se puede centrar la pinza.
Durante el procedimiento se deberá visualizar en la pantalla toda la pinza y especialmente la punta (pero nunca solo la punta). No se puede avanzar ni un milímetro sin visualización continuada.
En las maniobras de reorientación de la pinza en sentido anterior y posterior es importante que el operador se ayude con movimientos de espéculo vaginal con la mano no dominante. A veces también es necesario un movimiento en sentido lateral, cuando el útero o el corion están muy lateralizados.
Biopsia corial: extracción de la muestra de vellosidadesLa tercera fase de la BVC es la coriocentesis y extracción de la muestra:
- -
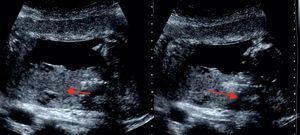
Una vez se alcanza el corion, se avanza la pinza a través de su espesor hasta la zona óptima: la más ecogénica y cercana a la placa corial (cara fetal del corion), orientándose la pinza paralelamente a esta, pero sin llegar al límite del saco gestacional.
En este momento, se abre la pinza y se avanza unos 3cm, siempre lejos de la decidua. Se cierra la pinza y se inicia una tracción suave. Si se nota resistencia o se observa una tracción importante de la placa corial se debe abrir la pinza, retroceder un poco, volver a cerrar y reiniciar la extracción de la muestra. (fig. 9).
La extracción de la pinza con la muestra se debe realizar siguiendo la misma ruta que se usó para introducirla.
- -
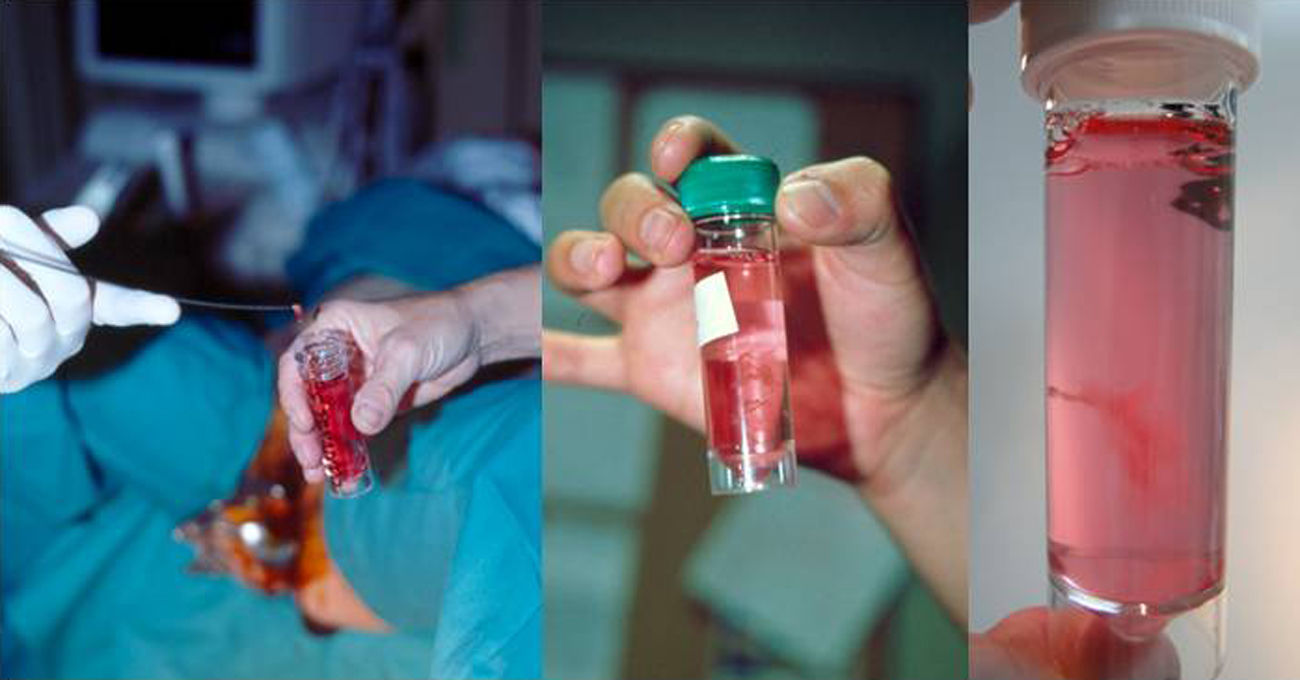
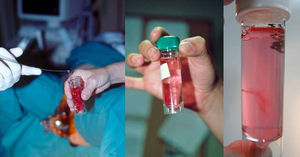
Una vez extraída la muestra de vellosidades, se coloca en el contenedor que contiene el medio de transporte, idealmente Roswel Park Memorial Institute (RPMI) que es un medio de cultivo celular usado para el cultivo de células humanas, al que se le añaden antibióticos, normalmente penicilina y estreptomicina. De manera alternativa, se puede utilizar suero fisiológico, sin precisar la adición de sustancias antibióticas.
- -
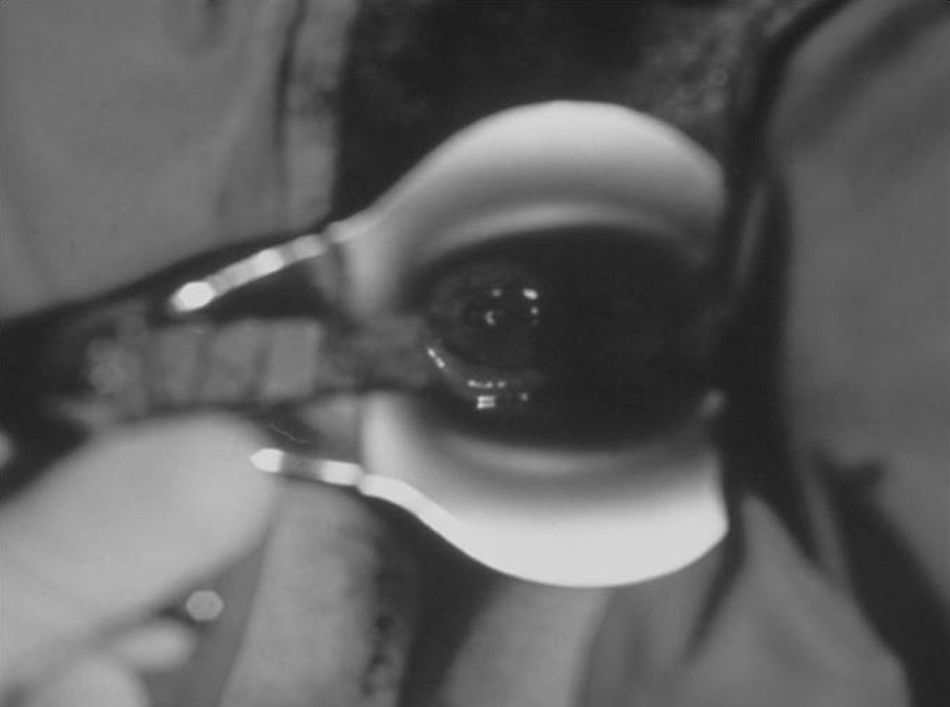
La muestra debe evaluarse macroscópicamente, utilizando la fuente de luz y realizando movimiento de agitación suave del contenedor, para confirmar que la cantidad y la calidad sean adecuadas (fig. 10). Las vellosidades coriales son blanquecinas y se abren con un aspecto coraliforme. Si la muestra es materna (decidua) tiene un aspecto más denso, sin digitaciones y normalmente flota en el medio de transporte.
- -
En caso de requerir una segunda muestra, se repiten los pasos enumerados previamente, procurando seleccionar una zona corial óptima.
En condiciones normales deben realizarse un máximo de 2 introducciones por sesión y si es necesario repetir la sesión una semana más tarde. Sin embargo, es muy importante tener in mente la indicación del procedimiento, especialmente el riesgo de la anomalía cromosómica/genética a diagnosticar, así como la historia reproductiva materna y la opinión de la pareja. En casos excepcionales puede forzarse una tercera introducción, por ejemplo, cuando hay un riesgo de 1/2 de trisomía 21 o un 50% de Huntington. Por el contrario, debemos desistir de tomar una nueva muestra en caso de que el motivo sea la angustia materna o riesgos menores de 1/200.
- -
La muestra debe llegar al laboratorio idealmente en el mismo día y debe conservarse mientras tanto a temperatura ambiente, nunca en un frigorífico ni bajo aire acondicionado.
En las gestaciones no evolutivas hay algunas variaciones:
- -
Al haber menor cantidad de corion y este ser de peor calidad, la obtención de vellosidades es más dificultosa.
- -
La muestra debe tomarse aún más próxima al saco gestacional, para disminuir la posibilidad de contaminación con decidua materna.
- -
Podrán realizarse hasta 5 introducciones, para asegurarse un resultado.
Recomendaciones para la paciente después del procedimiento:
- -
Administración de gammaglobulina cuando está indicada.
- -
Reposo domiciliario de 24 horas. Es una medida de precaución cuya efectividad no está comprobada. Se permitirán las actividades de cuidado personal y desplazamientos cortos en su habitación.
- -
Restricción de actividad intensa, deportes y relaciones sexuales durante una semana.
- -
Signos de alarma para acudir a urgencias: sangrado similar o superior a una regla, dolor abdominal intenso, fiebre o pérdida de líquido amniótico.
- -
Una semana después del procedimiento se recomienda realizar un control ecográfico, coincidiendo con la entrega de resultados del estudio citogenético.
Deben monitorizarse los siguientes indicadores:
- -
Muestra insuficiente o inadecuada: se debe monitorizar el centro y el laboratorio ya que la tasa de «no-resultado» debe ser inferior al 1%.
- -
Pérdida fetal: existe un riesgo similar al de la amniocentesis cuando la BVC se realiza por parte de un operador experimentado5 que sería cercano al 0,5%.
- -
Corioamnionitis: muy rara después de BVC con una incidencia < 1/1.000.
- -
RPM: muy rara después de BVC transcervical, casi no hay clínica por la cantidad escasa de líquido amniótico en una edad gestacional temprana. Su incidencia es < 1/1.000
- -
Hematomas placentarios: de escasa relevancia cuando no es masivo, debe documentarse su existencia cuando el hematoma es previo al procedimiento.
- -
Despegamiento corial: de escasa relevancia cuando no es masivo, debe documentarse su existencia previa al procedimiento.
- -
Reducción de extremidades: descrita en BVC realizadas antes de las 10 semanas10.
El Royal College of Obstetricians and Gynecologists (RCOG) recomienda auditar los procedimientos invasivos a partir de diversos parámetros de calidad y mantener un registro de todos los procedimientos realizados14. Se recomienda tener auditados anualmente como mínimo los siguientes parámetros:
- -
Tasa de pérdida fetal en los 14 días post-procedimiento.
- -
Tasa de pérdida fetal antes de las 24 semanas.
- -
Porcentaje de BVC que requirieron más de una entrada.
- -
Porcentaje de BVC en las que no se consiguió muestra.
- -
Tasa de no-obtención de resultado.
En la gestación gemelar la BVC también es un procedimiento seguro y efectivo que permite el diagnóstico cromosómico, molecular o bioquímico temprano, con mayores beneficios que los descritos para la gestación única y con algún inconveniente añadido. La BVC es el procedimiento de elección en la gestación bicorial, ya que una eventual interrupción selectiva de uno de los gemelos comportará menores complicaciones cuanto más precozmente se realice. El inconveniente de la BVC en gestaciones bicoriales es la confusión en las muestras cuando los dos coriones son adyacentes11.
En el planeamiento de la BVC en gestación múltiple, es indispensable realizar un mapeado detallado de los sacos gestacionales, fetos y coriones existentes.
En gestaciones bicoriales, con dos coriones bien definidos y separados, la elección del sitio de la muestra para cada corion se realiza de manera similar a las gestaciones únicas. No es necesario evitar el paso a través del corion del hermano en el momento de toma de la muestra.
Cuando son dos coriones adyacentes es indispensable delimitar con precisión el territorio de cada uno; y la recomendación es tomar la muestra cerca de la inserción del cordón de cada gemelo y siempre con pinzas diferentes para cada una, evitando así la contaminación entre ellas. Cuando solo se disponga de una pinza debe asegurarse que no quedan restos de la primera muestra antes de acceder al segundo corion. Finalmente, si un corion no es accesible por vía transcervical, puede realizarse una BVC combinada por vía transcervical y vía transabdominal.
Para evitar confusiones, siempre se realiza primero la BVC del gemelo A y a continuación la del gemelo B.
En general, se recomienda obtener una muestra de cada gemelo, aunque se trate de una anomalía discordante, ya que es preferible disponer de un resultado normal en el feto aparentemente sano, antes de realizar una interrupción selectiva.
En las gestaciones monocoriales se recomienda actuar como en la gestación única. En caso de fetos discordantes para alguna anomalía, se considerará la obtención de 2 muestras, siguiendo las recomendaciones de las gestaciones bicoriales.
El RCOG recomienda que en el caso de una anomalía discordante en gemelos, cuando la interrupción selectiva pueda ser una opción, el procedimiento invasivo debe ser realizado exclusivamente en centros dispuestos a realizar dicha interrupción, para evitar posibles confusiones14.
Entrenamiento en biopsia de vellosidades corialesCon relación a la curva de aprendizaje en BVC, no existen datos específicos sobre el número de procedimientos supervisados necesarios antes de alcanzar la competencia, aunque clásicamente se han considerado como requisitos tener experiencia en amniocentesis de segundo trimestre y realizar un número mínimo de 50 procedimientos bajo supervisión. Quizás ante la disminución drástica de procedimientos invasivos en la actualidad, 30 podrían ser suficientes. En dichos procedimientos se evaluará la técnica y el proceso diagnóstico completo, incluyéndose la interpretación de resultados y la interacción con las pacientes. Además se hace necesaria una práctica regular para mantener el nivel de competencia, recomendándose la realización de 30 procedimientos anuales, de los cuales cada operador debería llevar un registro individual para auditar los parámetros de control de calidad descritos anteriormente13,14.
Recomendaciones finales- -
No iniciar el procedimiento sin valoración y planeamiento ecográfico previos por parte del operador.
- -
Siempre tener en mente un plan alternativo que permita resolver las dificultades que se encuentren durante el procedimiento.
- -
Tener en mente siempre la «gravedad» de la indicación del procedimiento y el grado de riesgo, para forzar o desistir antes en un procedimiento dificultoso.
Al ser un procedimiento invasivo, requiere de la máxima concentración y atención necesaria. Debe evitarse la realización simultánea de otras actividades y procurar que la comunicación con su equipo gire en torno al procedimiento
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.