Determinar el valor predictivo de la proteinuria en 24 h en las resultantes neonatales de las preeclámpsicas.
Materiales y métodosSe seleccionó a 87 preeclámpsicas que acudieron a urgencias del Hospital Central «Dr. Urquinaona», Maracaibo, Venezuela. Se evaluaron las características generales de las pacientes, los valores de proteinuria en 24 h y resultante neonatal.
ResultadosLa edad promedio de las pacientes fue de 26,0±5,4 años. La edad gestacional en el momento fue de 32,9±3,3 semanas. Los valores promedio de proteinuria en 24 h fue de 4,5±1,8 g. Al separar la proteinuria en cuartiles dependiendo de la concentración (baja, moderada, alta y muy alta), se observó que los valores más bajos de peso neonatal pertenecían a los grupos de concentraciones altas y muy altas comparado con el grupo de concentraciones bajas (p<0,05). No se encontraron diferencias significativas entre los grupos con respecto a la resultante y la mortalidad perinatal entre los grupos (p=ns). Se encontró que un punto de corte para la proteinuria en 24 h de 3 g no presentó un valor de área bajo la curva mayor de 0,70 que fuese significativa y permitiera su uso en la predicción de la resultante y mortalidad neonatales (p=ns).
ConclusiónLa proteinuria en 24 h no tiene valor predictivo en la resultante neonatal en preeclámpsicas.
To determine the predictive value of 24-hour proteinuria in neonatal outcome in preeclamptic patients.
Materials and methodsWe selected 87 preeclamptic patients attending the Accident and Emergency Department of the Dr. Urquinaona Central Hospital, in Maracaibo, Venezuela. General characteristics, 24-hour proteinuria values, and neonatal outcome were evaluated.
ResultsThe mean age of patients was 26.0±5.4 years. Gestational age at diagnosis was 32.9±3.3 weeks. The mean value of 24-hour proteinuria was 4.5±1.8 grams. When proteinuria was separated in quartiles depending on concentration (low, moderate, high and extremely high), we observed that lower values of neonatal weight corresponded to groups of high and extremely high concentrations compared with the group with low concentrations (P<.05). No significant differences were found among groups in neonatal complications and mortality (P=ns). A cut-off of 3 grams for 24-hour proteinuria did not show an area below the curve higher than 0.70, the value necessary to be significant, nor was this value significant (P=ns) in predicting neonatal complications and mortality (P=ns).
ConclusionThis study did not find that 24-hour proteinuria had any value in predicting neonatal outcomes in preeclamptic patients.
La preeclampsia es un desorden multisistémico que afecta a hígado, riñones, cerebro, sistema de coagulación y la placenta. Está caracterizada por la presencia de daño endotelial y aterosis aguda1. La incidencia varía del 2 al 10% dependiendo de la región estudiada y los criterios utilizados para su diagnóstico2. La base para el diagnóstico es el incremento de la presión arterial después de las 20 semanas de embarazo3.
La escasa invasión citotrofoblástica endovascular de las arterias espirales y la disfunción endotelial generalizada de la circulación materna son características de la preeclampsia, pero aún se desconoce su etiología4. Se ha considerado que factores genéticos, inmunológicos, ambientales y vasculares desempeñan un importante papel en el desarrollo de la preeclampsia5,6. Se han identificado varios factores de riesgo como la nuliparidad, antecedentes de hipertensión y diabetes, obesidad materna y embarazo gemelar que presentan una relación consistente con un aumento del riesgo7,8.
La preeclampsia se diferencia de la hipertensión gestacional por la presencia de proteinuria significativa9. La recolección de orina en 24 h es el gold standard para realizar el diagnóstico de proteinuria significativa en pacientes con hipertensión durante el embarazo10. Un criterio diagnóstico importante entre los parámetros clásicos para la preeclampsia es la proteinuria severa (mayor de 5 g en 24 h) que tradicionalmente ha servido como un criterio de enfermedad severa. También ha sido utilizada como un indicador de daño del endotelio glomerular11.
Debido a que la única cura para la preeclampsia es el parto y la extracción de la placenta, existe acuerdo universal en que los embarazos deben ser interrumpidos si la preeclampsia se desarrolla después de las 34 semanas o si aparecen convulsiones en cualquier momento. Esto crea un conflicto de intereses tanto para la madre como para el feto, ya que la primera se beneficiaría de una interrupción temprana, mientras que el segundo puede presentar complicaciones por la prematuridad9.
El curso natural de la proteinuria durante el manejo de la preeclampsia severa aún se desconoce11. La presencia y la cantidad de la proteinuria han sido asociadas con un incremento de la mortalidad perinatal; sin embargo, la fuerza de esta asociación es desconocida12,13. La severidad de la proteinuria en la preeclampsia ha sido utilizada por algunos investigadores como predictor de efectos adversos maternos14. Otros investigadores han descartado esta posibilidad15. Una relación confiable entre los valores de proteinuria en 24 h y la severidad de la resultante neonatal en las preeclámpsicas sería extremadamente útil para tomar decisiones clínicas.
El objetivo de la investigación fue determinar el valor predictivo de la proteinuria en 24 h en la resultante neonatal de las preeclámpsicas.
Materiales y métodoLa muestra fue de 87 embarazadas preeclámpsicas y con embarazos de más de 25 semanas que acudieron a las urgencias obstétricas. Se obtuvieron los valores de proteinuria en 24 h de todas las pacientes. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo consentimiento por escrito de todas las pacientes.
Se excluyó a las embarazadas con polihidramnios, con hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, autoinmune, respiratoria, hepática, renal o sistémica crónica, diabetes mellitus pregestacional o gestacional y hábito tabáquico. También se excluyó a las pacientes que se negaron a participar en la investigación o aquellas de las cuales no se pudo obtener datos sobre los valores de proteinuria o de la resultante neonatal.
La preeclampsia se definió como presión arterial sistólica de 140mmHg o más, o presión arterial diastólica de 90mmHg o más, confirmada por 6 h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24 h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación. La presión sanguínea se midió en posición sentada después de 15 min de descanso usando un esfigmógrafo de mercurio estándar con un manguito de 14 cm. La presión arterial sistólica y diastólica (tomada en relación con el quinto ruido de Kortkoff) se ubicó con relación al punto de 2mmHg más cercano. El método palpatorio se utilizó para verificar las lecturas auscultatorias de la presión arterial sistólica. Las presiones arteriales sistólica y diastólica se calcularon del promedio de la presión arterial de cada brazo.
Todas las preeclámpsicas fueron hospitalizadas y se les solicitó recolectar las muestras de orina de 24 h. La prueba se realizó de la siguiente forma: al despertar la paciente, la primera orina de la mañana debía ser descartada y se inició la recolección de orina a partir de la segunda micción del día. La muestra final fue la primera micción del día siguiente. La proteinuria se determinó en una muestra de orina de 24 h y se almacenó a −20°C. La proteinuria en orina se midió por medio de una prueba turbidimétrica (Raichem, EE. UU). Los coeficientes de variación inter e intraensayo fueron menores del 5 y el 7%, respectivamente.
Las muestras de sangre para la determinación de urea, creatinina, ácido úrico, transaminasas y recuento de plaquetas se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico, las cuales fueron tomadas de la vena antecubital y se les dejó coagular a temperatura ambiente. Posteriormente, fueron centrifugadas y almacenadas a −80°C. Todas las mediciones fueron hechas por duplicado y el promedio de las 2 mediciones fue el resultado final.
Se evaluaron el número de nacimientos por cesárea, los casos de sufrimiento fetal agudo (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), el Apgar menor de 7 puntos al minuto, el Apgar menor de 7 puntos a los 5 min y el número de muertes neonatales. Los casos de sufrimiento fetal agudo se diagnosticaron de acuerdo con la presencia de desaceleraciones tardías, desaceleraciones recurrentes o bradicardia persistente.
En todos los casos de mortalidad neonatal, las historias clínicas y las autopsias de los recién nacidos fueron revisadas por los investigadores para confirmar la causa de la muerte. La mortalidad neonatal se definió como aquellas que ocurren antes de los 7 días después del nacimiento. Las muertes relacionadas con anomalías congénitas fueron excluidas. Solo se analizaron las muertes neonatales que se produjeron posteriormente a la medición de la proteinuria en 24 h.
Los datos se presentan como valores promedios±desviación estándar. En el análisis estadístico entre los 2 grupos se realizó una prueba de estadística inferencia para datos no relacionados para comparar las características demográficas y los valores de la proteinuria en 24 h. La sensibilidad, la especificidad, la precisión diagnóstica y los valores predictivos positivos y negativos la proteinuria en 24 h fueron calculados sobre la base de la resultante neonatal. El análisis estadístico se realizó usando la prueba exacta de Fischer. Se consideró p<0,05 como estadísticamente significativo.
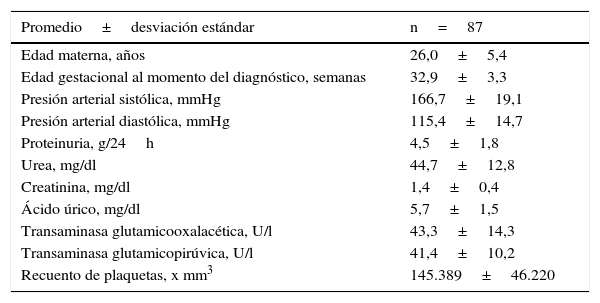
ResultadosSe seleccionó a 87 pacientes, de las cuales 83 de ellas fueron diagnosticadas con preeclampsia severa y 4 pacientes con diagnóstico de eclampsia. La edad promedio de las pacientes fue de 26,0±5,4 años. La edad gestacional en el momento del diagnóstico fue de 32,9±3,3 semanas. El valor promedio de presión arterial sistólica fue de 166,7±19,1mmHg y el de la presión arterial diastólica fue de 115,4±14,7mmHg. Los valores promedio de proteinuria en 24 h fueron de 4,5±1,8 g. En la tabla 1 se muestran las características clínicas y de laboratorio de las pacientes seleccionadas.
Características maternas clínicas y de laboratorio
| Promedio±desviación estándar | n=87 |
|---|---|
| Edad materna, años | 26,0±5,4 |
| Edad gestacional al momento del diagnóstico, semanas | 32,9±3,3 |
| Presión arterial sistólica, mmHg | 166,7±19,1 |
| Presión arterial diastólica, mmHg | 115,4±14,7 |
| Proteinuria, g/24h | 4,5±1,8 |
| Urea, mg/dl | 44,7±12,8 |
| Creatinina, mg/dl | 1,4±0,4 |
| Ácido úrico, mg/dl | 5,7±1,5 |
| Transaminasa glutamicooxalacética, U/l | 43,3±14,3 |
| Transaminasa glutamicopirúvica, U/l | 41,4±10,2 |
| Recuento de plaquetas, x mm3 | 145.389±46.220 |
El peso promedio de los recién nacidos al nacer fue 2054±398 g. Entre la resultante neonatal se encontró: 60 casos (69,0%) de restricción del crecimiento intrauterino del feto, 48 casos (55,2%) de sufrimiento fetal, 29 neonatos (33,3%) con Apgar al minuto menor de 7 y 27 neonatos (31,0%) con Apgar a los 5 min. Se reportaron 18 muertes neonatales (20,7%).
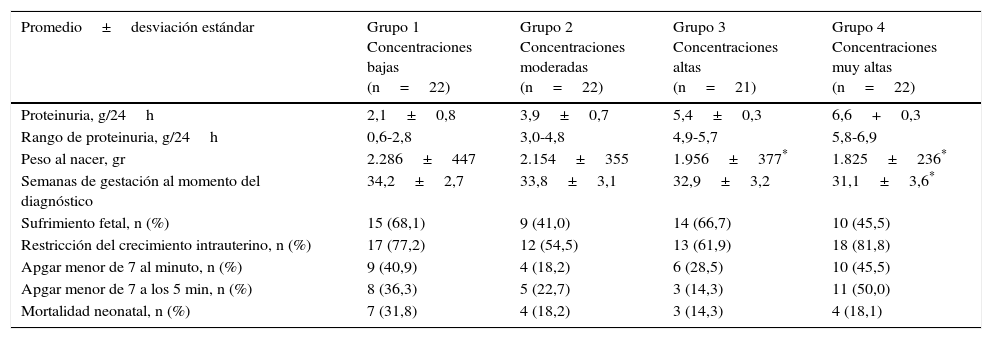
En la tabla 2 se muestra la relación de la proteinuria en 24 h con la resultante neonatal. Al separar la proteinuria en cuartiles dependiendo de la concentración (baja, moderada, alta y muy alta), se observó que los valores más bajos de peso neonatal estaban a los grupos de concentraciones altas y muy altas (1825±236 g y 1956± 377 g, respectivamente) comparado con el grupo de concentraciones bajas (2286± 447 g; p<0,05). Igualmente se observó una diferencia significativa en la semana de gestación en el momento del diagnóstico, el cual fue más bajo en el grupo que presentó concentraciones muy altas (31,1± 3,6 semanas) comparado con el grupo de concentraciones bajas (34,2± 2,7 semanas; p<0,05). No se encontraron diferencias significativas entre los grupos con respecto a la resultante y la mortalidad neonatal entre los grupos (p=ns).
Relación de la proteinuria de 24 h con la resultante neonatal
| Promedio±desviación estándar | Grupo 1 Concentraciones bajas (n=22) | Grupo 2 Concentraciones moderadas (n=22) | Grupo 3 Concentraciones altas (n=21) | Grupo 4 Concentraciones muy altas (n=22) |
|---|---|---|---|---|
| Proteinuria, g/24h | 2,1±0,8 | 3,9±0,7 | 5,4±0,3 | 6,6+0,3 |
| Rango de proteinuria, g/24h | 0,6-2,8 | 3,0-4,8 | 4,9-5,7 | 5,8-6,9 |
| Peso al nacer, gr | 2.286±447 | 2.154±355 | 1.956±377* | 1.825±236* |
| Semanas de gestación al momento del diagnóstico | 34,2±2,7 | 33,8±3,1 | 32,9±3,2 | 31,1±3,6* |
| Sufrimiento fetal, n (%) | 15 (68,1) | 9 (41,0) | 14 (66,7) | 10 (45,5) |
| Restricción del crecimiento intrauterino, n (%) | 17 (77,2) | 12 (54,5) | 13 (61,9) | 18 (81,8) |
| Apgar menor de 7 al minuto, n (%) | 9 (40,9) | 4 (18,2) | 6 (28,5) | 10 (45,5) |
| Apgar menor de 7 a los 5 min, n (%) | 8 (36,3) | 5 (22,7) | 3 (14,3) | 11 (50,0) |
| Mortalidad neonatal, n (%) | 7 (31,8) | 4 (18,2) | 3 (14,3) | 4 (18,1) |
En la tabla 3 se muestra la eficacia diagnóstica de la proteinuria en 24 h en la resultante neonatal en pacientes con preeclampsia. Se encontró que un punto de corte para la proteinuria en 24 h de 3 g no presentó un valor de área bajo la curva mayor de 0,70 que fuese significativa y permitiera su uso en la predicción de la resultante y mortalidad neonatales (p=ns).
Eficacia diagnóstica de la proteinuria en la predicción de la resultante neonatal
| Resultante | Área bajo la curva | Sensibilidad (%) | Especificidad (%) | Valor predictivo positivo (%) | Valor predictivo negativo (%) |
|---|---|---|---|---|---|
| Sufrimiento fetal | 0,44 | 52,0 | 61,5 | 51,0 | 38,4 |
| Restricción del crecimiento intrauterino | 0,57 | 71,4 | 34,2 | 44,8 | 48,1 |
| Apgar menor de 7 al minuto | 0,54 | 34,8 | 68,4 | 58,6 | 44,5 |
| Apgar menor de 7 a los 5 min | 0,57 | 28,8 | 65,7 | 51,8 | 41,6 |
| Mortalidad neonatal | 0,39 | 72,9 | 35,9 | 58,3 | 51,8 |
Los resultados de la investigación demuestran que valores de proteinuria en 24 h superiores a 5 g se asocian a una disminución significativa en el peso del recién nacido y de la semanas de gestación en el momento del diagnóstico de la paciente. Sin embargo, no se observó que estos valores afectaran en forma significativa la resultante ni la mortalidad neonatal.
La cantidad de proteinuria y de la producción de orina se asocia a varios factores hemodinámicos, además de la funciones básicas del riñón. Al igual que otros tipos de proteinuria de origen glomerular, en la preeclampsia involucra proteínas de alto peso molecular, como la albúmina. Todo esto es causado por alteraciones estructurales reversibles de la filtración glomerular secundaria a la lesión de las células endoteliales en los capilares glomerulares, mostrando la imagen patológica clásica de endoteliosis glomerular11. Aunque la proteinuria masiva es considerada como un indicador importante de la resultante materno-perinatal, Morris et al.10 describieron que la cantidad de proteinuria no es un predictor importante de la resultante neonatal.
Existe un fuerte debate sobre el manejo de la preeclampsia severa, ya que el curso clínico de esta condición puede llevar a deterioro progresivo de la madre y el feto. La proteinuria, en combinación con la hipertensión, es considerada un elemento clave en el aumento de la frecuencia de las complicaciones neonatales16. Se considera que la proteinuria severa es un evento final en el curso del síndrome17. Aunque se ha estudiado la resultante materna en embarazos complicados con diferentes grados de proteinuria, la correlación de la resultante neonatal con la magnitud de la proteinuria ha sido raramente investigada.
La proteinuria masiva (igual a 5 g en 24 h) ha servido como un criterio en la definición de preeclampsia severa. El manejo tradicional es el parto inmediato junto a la extracción de la placenta, sin importar la edad gestacional. En 2 estudios clínicos18,19, el manejo de pacientes bien seleccionadas con preeclampsia severa lejana al término (prolongación del embarazo hasta que una indicación materna o fetal específica obligue a la interrupción) ha demostrado los beneficios para el feto como escaso riesgo materno. La historia natural de la excreción urinaria de proteínas durante la prolongación del embarazo en preeclámpsicas severas con la resultante neonatal es desconocida.
En la mayoría de las preeclámpsicas con proteinuria mayor de 5 g en 24 h, la función renal es reflejada por las concentraciones de creatinina y depuración de creatinina11. En esta investigación, se observó que en las pacientes con diferentes valores de proteinuria en 24 h (de 0,6 a 6,9 g), los valores de urea, creatinina y ácido úrico estaban normales o ligeramente elevados. Oettle et al.20 demostraron que la proteinuria severa en pacientes con preeclampsia tratadas en forma conservadora por un promedio de 2 semanas no mostraron evidencia de alteración residual de la función renal.
A pesar que los recién nacidos de preeclámpsicas con valores bajos de proteinuria en 24 h presentaron una mayor frecuencia de muertes neonatales que las pacientes con valores muy altos, esta diferencia no fue estadísticamente significativa. Este hallazgo es similar al reportado por Schiff et al.11, que describieron que aquellas pacientes con proteinuria en 24 h mayor de 5 g (y aún en aquellas con proteinuria en 24 h de 10 a 20 g) tienen resultantes neonatales similares a embarazadas con valores más bajos de proteinuria. Newman et al.21 demostraron que la magnitud de la proteinuria no se asoció a un incremento de la morbilidad neonatal en preeclámpsicas. Estos datos confirman que el valor de proteinuria en las preeclámpsicas no es un factor importante para la predicción de la resultante o mortalidad neonatal.
Los datos de esta investigación indican que el embarazo en las preeclámpsicas no debe ser interrumpido sobre la base de los valores de proteinuria mientras que las pruebas bioquímicas y biofísicas fetales se encuentren dentro de límites normales para el síndrome. Más aún, parece que puede ser el grado de prematuridad el que predice mejor la resultante neonatal, ya que la proteinuria masiva aparece de forma más temprana en el embarazo y se asocia a un incremento en otros indicadores de interrupción inmediata.
Finalmente, es importante reconocer que los factores de riesgo predisponentes adicionales que afectan a las preeclámpsicas pueden desempeñar un papel importante en la resultante neonatal. Los cambios en las características demográficas, incluyendo el aumento de la tasa de obesidad, hipertensión crónica y diabetes, están asociados a la proteinuria como marcador de severidad en mujeres no embarazadas. Esto puede alterar la relación entre la proteinuria gestacional y las complicaciones fetales y/o neonatales, y la determinación de la proteinuria en las preeclámpsicas debe ser evaluada de acuerdo con las condiciones subyacentes.
Se concluye que la proteinuria en 24 h no tiene un valor predictivo en la resultante neonatal en preeclámpsicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.