El tumor de células de la granulosa (TCG) es una neoplasia poco común que se clasifica en 2 subtipos, adulto y juvenil.
Se presenta una serie de 7 casos de TCG, de tipo adulto, diagnosticados en nuestro hospital entre los años 2003 y 2017. La edad media al diagnóstico fue de 47 años, todos en estadio i. Se realizó biopsia intraoperatoria en 4 pacientes, con resultado de TCG en 3 de ellas y de cáncer de ovario en una. El estudio anatomopatológico se realizó en diferido en los otros 3 casos. El tratamiento fue siempre quirúrgico, realizándose adyuvancia con quimioterapia en un caso. Cinco pacientes presentaron hiperplasia endometrial concomitante, y una un carcinoma de mama de forma sincrónica. Durante el seguimiento se objetivaron 2 recurrencias.
En nuestra serie se confirma la asociación del TCG a otras enfermedades hormonodependientes. A pesar del buen pronóstico de esta neoplasia los casos de recidiva tardía no son infrecuentes, y es necesario llevar a cabo un seguimiento a largo plazo.
Granulosa cell tumour (TCG) is an uncommon neoplasia that has two subtypes, adult and juvenile.
We present a report of 7 cases of adult-type TCG, that were diagnosed in our center during 2003 and 2017. The average age at diagnosis was 47 years, and all were in stage I. In four patients an intraoperative biopsy was performed, in three of which the diagnosis of TCG was obtained. Treatment was surgical in all cases, and in one case required adjuvant chemotherapy. Five patients presented with concomitant endometrial hyperplasia, and one had a synchronous breast carcinoma. During follow-up, 2 recurrences were observed.
In our series, the association of TCG with other hormone-dependent pathologies was confirmed. Despite a good prognosis of this cancer, cases of late recurrence are not uncommon, and a long-term follow-up is required.
El tumor de células de la granulosa (TCG) representa un 2-5% de todas las neoplasias primarias de ovario. Deriva de las células de la granulosa productoras de estradiol. Por tanto, se clasifica en el grupo de los tumores de los cordones sexuales del estroma ovárico (TECS) y constituye el tipo de tumor más frecuente de esta categoría (70%). Se clasifica en 2 subtipos, el juvenil y el adulto.
Debido a su baja incidencia existen pocos estudios clínicos aleatorizados que permitan validar su diagnóstico y tratamiento. Por este motivo, ambos suponen un desafío para ginecólogos y patólogos.
Presentamos una serie de 7 casos de TCG que pretende aportar nuestra experiencia y revisar la literatura sobre este tipo de tumores.
Material y métodosSe realizó un estudio descriptivo retrospectivo de los TCG tipo adulto del ovario diagnosticados en el Hospital Universitario Príncipe de Asturias, entre los años 2003 y 2017. Los casos se seleccionaron a partir del registro de cáncer de ovario del servicio de ginecología de nuestro centro.
Se recogieron variables que incluyeron la edad al diagnóstico, el estado menstrual, la paridad, los marcadores tumorales, las características ecográficas, el motivo de consulta, el diagnóstico preoperatorio, el tratamiento primario, la biopsia intraoperatoria y definitiva, la asociación con otras enfermedades, el estadio, el tratamiento adyuvante, el seguimiento y la recurrencia de la enfermedad. Los datos fueron organizados en una base de datos elaborada con el programa Excel y analizados con el programa estadístico SPSS.
ResultadosSe recogieron 7 casos de TCG de un total de 148 neoplasias primarias de ovario. Por tanto, en nuestro centro los TCG representan el 4,7% de los tumores malignos de ovario diagnosticados durante el periodo de tiempo estudiado. Todos pertenecieron al subtipo adulto y ninguno a la variante juvenil.
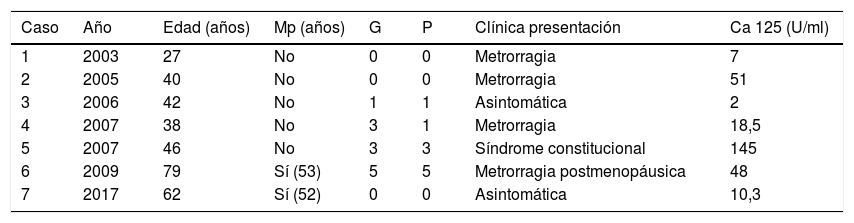
La edad media en el momento del diagnóstico fue 47,71 años (rango 27-79). Cinco de las pacientes se encontraban en edad reproductiva (71,42%) y 2 eran menopáusicas (28,57%). El 42,85% de las pacientes eran nuligestas y el resto tuvo una media de 2,4 gestaciones y 2 hijos (tabla 1).
Características epidemiológicas y clínicas
| Caso | Año | Edad (años) | Mp (años) | G | P | Clínica presentación | Ca 125 (U/ml) |
|---|---|---|---|---|---|---|---|
| 1 | 2003 | 27 | No | 0 | 0 | Metrorragia | 7 |
| 2 | 2005 | 40 | No | 0 | 0 | Metrorragia | 51 |
| 3 | 2006 | 42 | No | 1 | 1 | Asintomática | 2 |
| 4 | 2007 | 38 | No | 3 | 1 | Metrorragia | 18,5 |
| 5 | 2007 | 46 | No | 3 | 3 | Síndrome constitucional | 145 |
| 6 | 2009 | 79 | Sí (53) | 5 | 5 | Metrorragia postmenopáusica | 48 |
| 7 | 2017 | 62 | Sí (52) | 0 | 0 | Asintomática | 10,3 |
G: gestaciones; Mp: menopaúsica; P: partos.
El motivo de consulta más frecuente fue la presencia de ciclos menstruales irregulares asociados a hipermenorrea (3 casos). Otros síntomas incluyeron la metrorragia posmenopáusica en un caso y un cuadro de anorexia y pérdida de peso en otro. Las 2 pacientes restantes se encontraban asintomáticas y fueron diagnosticadas incidentalmente por el hallazgo de una masa anexial en una ecografía rutinaria (tabla 1).
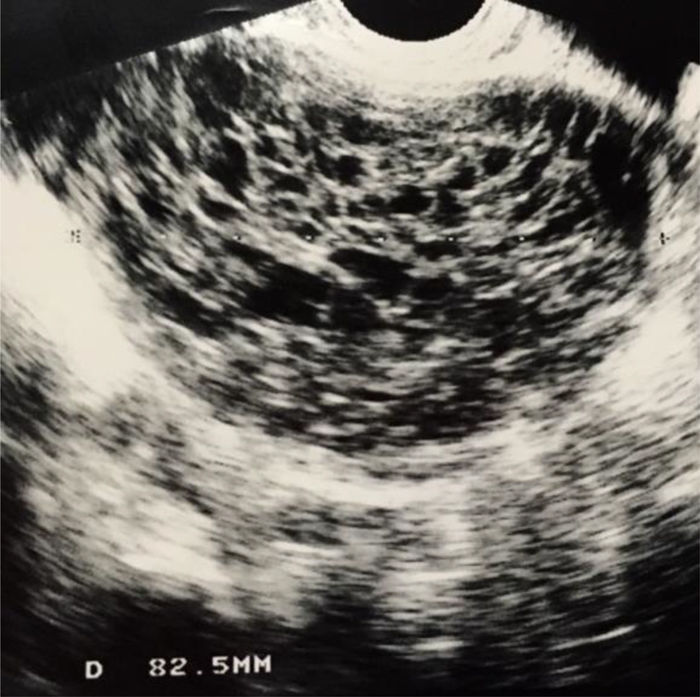
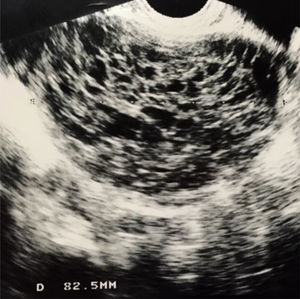
La ecografía mostraba una tumoración de consistencia mixta o sólida en todos los casos (fig. 1). El endometrio apareció engrosado en las 2 mujeres posmenopáusicas. No se objetivó ascitis en ningún caso.
El antígeno Ca 125 estaba alterado en el 42,86% de las mujeres, con valor medio de 81,33U/ml (rango 48-145). El resto de los marcadores tumorales de ovario se encontraron en rangos normales, a excepción de un valor de CEA ligeramente elevado en una mujer fumadora (tabla 1).
El diagnóstico preoperatorio fue de tumoración anexial compleja en todos los casos, y en ninguno se planteó el diagnóstico preoperatorio de TCG.
El tratamiento primario fue siempre quirúrgico. Se realizó anexectomía para establecer un diagnóstico anatomopatológico.
Se realizó biopsia intraoperatoria en 4 pacientes, con resultado de TCG en 3 de ellas y de cáncer de ovario en una. En los otros 3 casos no fue posible realizar una biopsia intraoperatoria por la adecuación de los tiempos quirúrgicos y disponibilidad del servicio de anatomía patológica para realizar el estudio durante la cirugía.
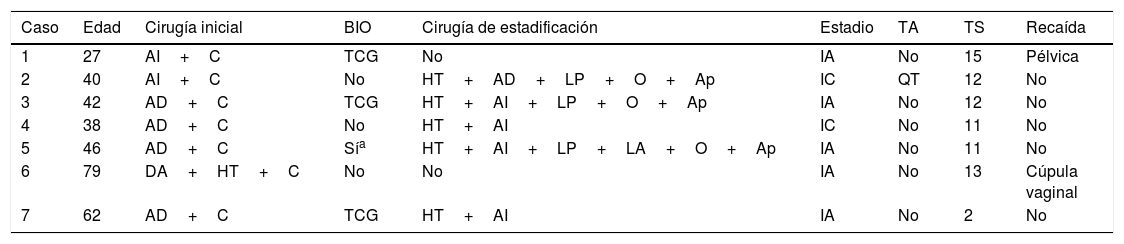
Tras conocer el resultado se realizó histerectomía y anexectomía contralateral en 2 de las pacientes, asociado a linfadenectomía pélvica en una de ellas. En la tercera mujer (caso 1) se prefirió realizar cirugía conservadora con la intención de conservar la fertilidad (tabla 2). El estudio intraoperatorio de la paciente restante (caso 5) se informó inicialmente de cáncer de ovario, sin poder precisar una estirpe concreta, y se procedió a realizar una cirugía completa de estadificación.
Enfoque terapéutico
| Caso | Edad | Cirugía inicial | BIO | Cirugía de estadificación | Estadio | TA | TS | Recaída |
|---|---|---|---|---|---|---|---|---|
| 1 | 27 | AI+C | TCG | No | IA | No | 15 | Pélvica |
| 2 | 40 | AI+C | No | HT+AD+LP+O+Ap | IC | QT | 12 | No |
| 3 | 42 | AD+C | TCG | HT+AI+LP+O+Ap | IA | No | 12 | No |
| 4 | 38 | AD+C | No | HT+AI | IC | No | 11 | No |
| 5 | 46 | AD+C | Sía | HT+AI+LP+LA+O+Ap | IA | No | 11 | No |
| 6 | 79 | DA+HT+C | No | No | IA | No | 13 | Cúpula vaginal |
| 7 | 62 | AD+C | TCG | HT+AI | IA | No | 2 | No |
AD: anexectomía derecha; AI: anexectomía izquierda; Ap: apendicectomía; BIO: biopsia intraoperatoria; C: citología de lavado peritoneal; HT: histerectomía total; LA: linfadenectomía paraaórtica; LP: linfadenectomía pélvica bilateral; O: omentectomía; QT: quimioterapia; TA: tratamiento adyuvante, TS: tiempo de seguimiento (años).
En 3 pacientes el diagnóstico de TCG fue postoperatorio, dado que no se llevó a cabo el estudio intraoperatorio. En 2 casos se reintervino a las pacientes y se realizó anexectomía contralateral e histerectomía. La última paciente, de 79 años, no se sometió a cirugía de estadificación por ser considerada de alto riesgo quirúrgico (tabla 2).
En todos los casos se realizó lavado peritoneal con resultado negativo.
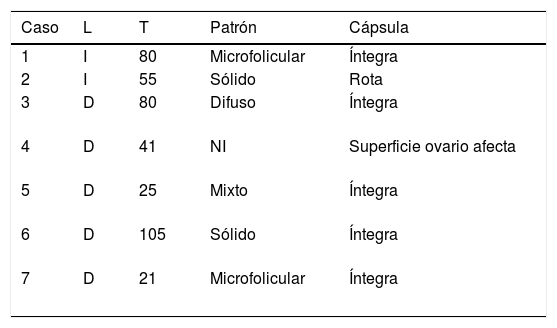
Todos fueron tumores unilaterales; el 71,42% derechos con diámetro medio de 58,14mm (rango 21-105mm). La cápsula tumoral se encontraba rota en un caso y la superficie ovárica afectada en otra paciente (tabla 3).
Características anatomopatológicas
| Caso | L | T | Patrón | Cápsula |
|---|---|---|---|---|
| 1 | I | 80 | Microfolicular | Íntegra |
| 2 | I | 55 | Sólido | Rota |
| 3 | D | 80 | Difuso | Íntegra |
| 4 | D | 41 | NI | Superficie ovario afecta |
| 5 | D | 25 | Mixto | Íntegra |
| 6 | D | 105 | Sólido | Íntegra |
| 7 | D | 21 | Microfolicular | Íntegra |
D: derecho; I: izquierdo; L: lado afecto; NI: no informado; T: tamaño tumoración (mm).
El estudio anatomopatológico mostró en todas las piezas la coexistencia de al menos 2 patrones histológicos. Teniendo en cuenta solo aquellos predominantes, los más frecuentes fueron el microfolicular (28,57%) y el sólido (28,57%) (tabla 3).
Según la clasificación FIGO para tumores de ovario, el 71,43% se encontraba en estadio IA y el 28,57% en IC (tabla 2).
Solo una de las pacientes que presentó un estadio IC, con cápsula ovárica rota, recibió tratamiento adyuvante con quimioterapia basada en una combinación de cisplatino y etopósido (tabla 2). En la otra paciente diagnosticada en estadio IC se decidió no realizar tratamiento adyuvante y reservarlo ante la eventualidad de una recurrencia.
Se realizó biopsia de endometrio preoperatoria a 5 de las pacientes. En todas el resultado fue de hiperplasia endometrial simple sin atipias, salvo una que presentó focos de complejidad sin atipias. En el postoperatorio encontramos 4 casos de hiperplasia endometrial de las 6 piezas de histerectomía (50% simple sin atipia, 25% compleja sin atipia y un 25% compleja con atipias). No hubo coexistencia con el cáncer de endometrio (tabla 4).
Características endometriales
| Caso | Clínica metropática | BE | AP definitiva |
|---|---|---|---|
| 1 | Irregularidades menstruales | No | No piezaa |
| 2 | Irregularidades menstruales | HE simple sin atipia | N |
| 3 | No | No | N |
| 4 | Irregularidades menstruales | HE simple sin atipia | HE simple sin atipias |
| 5 | No | HE simple sin atipia | HE compleja sin atipias |
| 6 | Metrorragia postmenopáusica | HE simple sin atipia | HE simple sin atipias |
| 7 | No | HE simple/compleja sin atipia | HE compleja con atipias |
AP: anatomía patológica; BE: biopsia de endometrio; HE: hiperplasia endometrial; N: dentro de la normalidad.
En una de las pacientes con hiperplasia se realizó un diagnóstico sincrónico de carcinoma tubular infiltrante de mama grado 1 con positividad a receptores de estrógeno y progesterona, una asociación poco descrita pero relacionada con la actividad hormonal que caracteriza a estos tumores.
Todas fueron sometidas a controles semestrales inicialmente y luego anuales que incluían exploración física, ecografía y marcadores tumorales. La media de seguimiento fue de 10,42 años (rango 2-15).
Durante ese periodo se objetivaron 2 recurrencias, una a los 14 y otra a los 6 años de seguimiento.
El primer caso de recurrencia (caso 1) fue una mujer nuligesta tratada mediante cirugía conservadora, en la que se observó en una revisión rutinaria una imagen ecográfica nodular, sólida, de 2cm en la zona de la anexectomía previa. Se completó el estudio con marcadores tumorales, que fueron normales, y una TAC en la que se describió una lesión anexial derecha sospechosa de malignidad asociada a imágenes compatibles con implantes pélvicos. Ante la sospecha de recidiva se indicó una laparoscopia diagnóstico-terapéutica en la que se identificaron múltiples implantes pélvicos (diámetro medio de 1,5cm) en la superficie del recto, ligamento ancho y vena iliaca izquierda. Se extirparon todas las lesiones y se analizaron de forma intraoperatoria con resultado de recidiva de TCG. Se completó la cirugía con anexectomía derecha, histerectomía total, linfadenectomía pélvica bilateral y omentectomía, consiguiéndose una cirugía óptima. El estudio anatomopatológico en diferido confirmó la presencia de TCG en todos los implantes resecados y en el ovario derecho. El útero presentó un endometrio proliferativo hiperplásico e infiltración de la serosa por TCG. Se realizó una TAC de control a los 3 meses de la cirugía en la que se visualizaron nuevos implantes pélvicos. Posteriormente se realizó tratamiento adyuvante con 3 ciclos de quimioterapia (paclitaxel más carboplatino) consiguiéndose una reducción de los implantes en un control por TAC realizado un mes más tarde. Tras otros 3 ciclos de quimioterapia la enfermedad permanece estable.
El segundo caso de recidiva (caso 6) corresponde a una paciente que trasladó su seguimiento a otro centro hospitalario, donde se detectó una recidiva en la cúpula vaginal tratada mediante colpectomía. La enferma rechazó el tratamiento adyuvante.
Ninguna paciente falleció durante el seguimiento.
DiscusiónLos TCG son un tipo de neoplasia poco común que representa del 2% al 5% de todas las neoplasias primarias de ovario y son el tipo más frecuente de los TECS1.
Se clasifican en 2 subtipos, el juvenil y el adulto. La forma adulta es la más frecuente (95% de los casos) y es a la que nos referiremos en este trabajo.
Aunque puede presentarse a cualquier edad, existe una mayor incidencia durante la perimenopausia y la menopausia temprana2.
Clínicamente suele presentarse como una masa abdominal, unilateral y asintomática3. Una de sus particularidades es su capacidad de secreción hormonal. Como consecuencia, puede manifestarse precozmente con síntomas secundarios a hiperestrogenismo como metrorragia posmenopáusica o irregularidades menstruales, y constituye un factor de riesgo para el desarrollo de enfermedades hormonosensibles4,5.
El dolor abdominal es otro síntoma común, especialmente en grandes masas (más de 10-15cm de diámetro) o en casos de hemorragia intratumoral. La aparición de un cuadro de dolor agudo puede ser el resultado de una torsión ovárica, y si se asocia a distensión abdominal e hipotensión se debe descartar la rotura hemorrágica del tumor6 ya que, al igual que otras neoplasias productoras de hormonas, posee una gran vascularización.
Su asociación con hiperplasia (27%) y adenocarcinoma (8%) de endometrio está bien documentada5 aunque, como ya hemos mencionado, en nuestra serie de casos hubo un 66% de coexistencia con hiperplasia de endometrio y no se objetivó ningún caso de adenocarcinoma de endometrio. Cuando se asocia a adenocarcinoma endometrial este suele ser diferenciado, de buen pronóstico y aparece en un estadio precoz7. El diagnóstico diferencial de un cáncer de endometrio en una mujer que presente una masa de ovario, además de incluir a los TCG, debe excluir la posibilidad de un cáncer endometrial primario con metástasis ovárica y de un tumor epitelial de ovario sincrónico con un tumor endometrioide de útero8.
Existe poca literatura sobre su asociación con otras neoplasias hormonodependientes como el cáncer de mama. Sin embargo, algunos estudios sugieren un aumento significativo de la incidencia de cáncer de mama en pacientes con TCG9. Entre los casos revisados en nuestro centro destaca una paciente que presentó hiperplasia endometrial y carcinoma de mama con receptores hormonales positivos de forma sincrónica.
Histológicamente, las células tumorales del subtipo adulto tienen un citoplasma escaso y un núcleo redondeado con una hendidura típica que le confiere el aspecto de «grano de café». Estas células proliferan siguiendo patrones muy variables que a menudo coexisten y dificultan su diagnóstico. De ellos el más característico es el microfolicular, en el que las células se agrupan en rosetas alrededor de una cavidad central, que recuerdan a los cuerpos de Call-Exner de los folículos primordiales. Existen otros como el macrofolicular, trabecular, sólido, insular o difuso3. Debido a la gran variedad de patrones existentes no siempre es sencillo diferenciar los TCG de otras neoplasias primarias o metastásicas de ovario10. En los casos de diagnóstico diferencial dificultoso, pueden ser útiles las técnicas de inmunohistoquímica que utilizan anticuerpos contra antígenos de diferenciación de los cordones sexuales del estroma ovárico. De ellos la inhibina es el marcador más sensible y específico11.
En cuanto al diagnóstico, los hallazgos ecográficos son inespecíficos y suele presentarse como masas con criterios sugestivos de malignidad. Algunos autores destacan el posible engrosamiento endometrial secundario a la coexistencia de hiperplasia de endometrio12.
La cirugía es el pilar de tratamiento y permite establecer el diagnóstico histológico definitivo y el estadio de la enfermedad. La técnica de elección es la histerectomía total con salpingo-ooforectomía bilateral. Sin embargo, en pacientes en estadio i que desean preservar la fertilidad o evitar el tratamiento hormonal sustitutivo la salpingo-ooforectomía unilateral con preservación uterina tiene una tasa de curación equivalente. En ambos casos debe realizarse una estadificación quirúrgica de forma similar a la definida por la FIGO para el cáncer epitelial de ovario para determinar la extensión de la enfermedad y orientar el tratamiento13. Sin embargo, la linfadenectomía pélvica y paraaórtica puede omitirse como parte del tratamiento por la rareza de metástasis ganglionares en el diagnóstico inicial en este tipo de tumores14. Si la cirugía es conservadora se debe realizar una biopsia endometrial, por su alta asociación con la hiperplasia o el adenocarcinoma de endometrio.
La rareza de estos tumores hace que no sean infrecuentes decisiones quirúrgicas de estadificación y tratamiento no idénticas, aun en casos con diferencias poco relevantes. La linfadenectomía no está justificada a la luz de los conocimientos actuales en la paciente n.° 2. En nuestra serie puede influir el hecho de que la recogida de casos se realiza en un amplio rango de tiempo y con equipos quirúrgicos diferentes.
La baja incidencia de los TCG ha generado discusiones a la hora de valorar la necesidad de tratamiento adyuvante con quimioterapia o radioterapia debido a la falta de estudios aleatorizados bien diseñados. Por lo general se acepta que no es necesaria en estadios IA. En estadios ii-iv, a pesar de la falta de datos que demuestren beneficios en la supervivencia, el tratamiento adyuvante parece limitar la progresión de la enfermedad. En estadios i con factores de mal pronóstico como gran tamaño, rotura de la cápsula del tumor o índice mitótico elevado podría ofrecer beneficios13. Sin embargo, otros autores solo recomiendan tratamiento adyuvante en casos de enfermedad residual tras la cirugía, o de recurrencia15.
La identificación de factores pronósticos permite valorar la necesidad de tratamiento postoperatorio. Se ha propuesto una gran variedad de factores clínicos, patológicos y moleculares, aunque la reproducibilidad de muchos ha sido difícil de establecer16.
El estadio es el factor pronóstico más importante16,17. La mayoría de los estudios demuestran una supervivencia a los 5 años para pacientes en estadio i superior al 90%, aunque los resultados son menos favorables en pacientes que presentan otros factores de riesgo. Esto contrasta con la supervivencia a los 10 años del 55-75% en pacientes en estadio ii y del 22-50% en estadio iii-iv. La supervivencia a los 10 años varía a un 84-95%, 50-65% y 17-33% para estadios i, ii y iii-iv respectivamente, que refleja el potencial de recaídas en pacientes con enfermedad avanzada16.
Algunos estudios señalan la edad como factor pronóstico, aunque los datos son contradictorios. Los tumores de gran tamaño se han asociado con un peor pronóstico, especialmente aquellos con un diámetro mayor de 10-15cm de diámetro. La rotura del tumor se ha propuesto como factor pronóstico importante16. En nuestra serie de casos solo se produjo rotura de la cápsula ovárica en el caso 2. En cuanto a las características histológicas del tumor, muchos autores defienden que los únicos predictores significativos de recurrencia temprana son la atipia celular, el alto índice mitótico (4 a 10 mitosis/campo) y la ausencia de cuerpos de Call-Exner. Por el contrario, el cariotipo anormal, la sobreexpresión de p53 y la ploidía no parecen tener valor pronóstico16,17.
A pesar de su bajo potencial de malignidad se caracterizan por tener tendencia a la recidiva tardía (20-26% de los casos)18. El tiempo medio de aparición es de 4 a 6 años, aunque se han descrito casos de recaídas hasta 40 años después. La localización de recidiva más común es la pélvica (30-45% de los casos) y en el 55-70% de los tumores existe afectación extrapélvica, especialmente en el hígado, el pulmón y el hueso7,16. Como se ha detallado previamente, en nuestra revisión la enfermedad recidivó en 2 casos (28%) a los 14 y 6 años del diagnóstico, con localización pélvica y vaginal respectivamente.
No existe un tratamiento estándar claramente definido para las recurrencias. En algunas series la cirugía seguida de radioterapia o quimioterapia mejora de las tasas de supervivencia19. Las recaídas pélvicas o intraabdominales ocurridas años después de una cirugía inicial son candidatas a una segunda intervención. Si la enfermedad ha sido óptimamente citorreducida y confinada en la cavidad abdominal o pélvica, el tratamiento recomendado sería la radioterapia adyuvante. En el caso de enfermedad citorreducida de forma subóptima en el momento de la recaída o enfermedad ampliamente diseminada se prefiere la quimioterapia16.
Algunas series clínicas sugieren el beneficio de terapias hormonales como los agonistas de la hormona liberadora de gonadotropina (leuprolida) o terapia antiestrogénica (tamoxifeno) en casos de enfermedad progresiva que no responde a quimioterapia o radiación20,21.
La tendencia a la recurrencia tardía que caracteriza a estos tumores obliga a realizar un seguimiento a largo plazo a pesar de cirugía óptima. La capacidad hormonal de los TCG permite el uso de gran variedad de marcadores tumorales séricos en la vigilancia postoperatoria, de los cuales la inhibina es el más útil16,16. Además de la inhibina los TCG segregan otras sustancias, como la hormona antimulleriana y estradiol.
La inhibina es una hormona sintetizada por las células de la granulosa de los folículos ováricos y ejerce un potente feedback negativo sobre la secreción de FSH. En mujeres posmenopáusicas sus niveles suelen ser bajos. Lappohn et al.22 encontraron valores elevados de inhibina en mujeres con TCG, y definieron la inhibina como marcador sérico fiable en el seguimiento de la enfermedad. Posteriormente muchos autores defienden esta teoría22.
Sin embargo, la inhibina no es específica de los TCG y puede observarse en cánceres epiteliales de ovario, especialmente de variedad mucinosa. Está formada por 2 subunidades, alfa y beta. La subunidad alfa puede asociarse a 2 tipos de subunidades beta A o B, para formar una inhibina A o B respectivamente. Ambas pueden secretarse por los TCG, aunque la inhibina B parece ser la forma predominante en pacientes con esta enfermedad22,23.
El estradiol fue la primera sustancia utilizada como marcador de detección de recurrencia de los TCG, pero su concentración no se correlaciona adecuadamente con la actividad tumoral. Lappohn et al.24 señalan que la actividad de la enfermedad solo se correlacionaba con 3 de 6 pacientes estudiadas. Además, la ausencia de estradiol se observa en aproximadamente el 30% de las pacientes, quizás por la ausencia de células de la teca, responsables de la producción de la sustancia precursora del estradiol (androstenediona).
La hormona antimulleriana ha surgido recientemente como un posible marcador de los TCG. Es producida por las células de la granulosa de los folículos ováricos en desarrollo. Sus valores son cíclicos en la vida reproductiva y se hacen indetectables en la menopausia. Rey et al.25 compararon sus niveles en 58 mujeres sanas, 16 con TCG tipo adulto y 75 con cáncer epitelial y quistes benignos de ovario, y otros cánceres no ginecológicos. En posmenopáusicas sanas los valores fueron indetectables, y en las premenopáusicas nunca superiores a 5μg/l. En contraste, 8 de las 9 mujeres con TCG activo presentaron valores elevados, y en 10 de las 11 mujeres en remisión clínica los valores fueron indetectables. La elevación de la hormona en plasma apareció con una media de 11 meses antes de la recurrencia clínica. Los valores elevados fueron normales en el 93% de otros cánceres ginecológicos y no ginecológicos.
ConclusionesEl TCG de tipo adulto es una neoplasia poco frecuente que pertenece al grupo de TECS.
Su capacidad de secreción hormonal hace que con frecuencia se manifieste con síntomas asociados al hiperestrogenismo como metrorragias, y supone un factor de riesgo para el desarrollo de enfermedades hormonosensibles como la hiperplasia endometrial, adenocarcinoma endometrial o el cáncer de mama.
Su diagnóstico preoperatorio es infrecuente y requiere la confirmación histológica del ovario. Sus células adoptan múltiples patrones histológicos que a menudo coexisten. Este hecho supone un reto para el patólogo, y con gran frecuencia el diagnóstico intraoperatorio no es concluyente y puede conducir a intervenciones innecesarias.
Generalmente se presenta en estadios precoces y tiene buen pronóstico. El tratamiento de elección es la histerectomía total con anexectomía bilateral. Sin embargo, en mujeres con deseo genésico y en estadio inicial se acepta la cirugía conservadora. El tratamiento adyuvante es objeto de debate por la rareza del tumor. A pesar de su bajo potencial de malignidad, tienen tendencia a recidivar años después del tratamiento inicial, por lo que es necesario realizar un seguimiento a largo plazo.
FinanciaciónFinanciado por una ayuda no condicionada de Cordynamic-Iberhospitex, S.A. (Barcelona, España).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los compañeros que dedicaron parte de su tiempo para responder la encuesta y la inestimable colaboración de la Gerencia de AP de Burgos, posibilitando este trabajo para todos.