La aparición de defectos congénitos produce una gran ansiedad en la familia y una enorme demanda asistencial. El objetivo principal radica en la redacción de las recomendaciones de buenas prácticas que sirvan de guía a los profesionales sanitarios para el diagnóstico clínico-genético de defectos congénitos.
MetodologíaEl protocolo que proponemos contempla un modelo de actuación óptimo que incluye, la recogida de la información clínica inicial, la obtención de las muestras biológicas y los protocolos de actuación.
ResultadoSe ha elaborado un modelo de historia clínica que ayude a la recogida de la información clínica pertinente. En la obtención de las muestras biológicas se aconseja la obtención de muestras fetales (de las 3 capas embrionarias) y muestras de los progenitores que serán procesarán teniendo en cuenta el algoritmo de actuación propuesto para el correcto diagnóstico genético del defecto congénito correspondiente.
ConclusiónEsta guía recoge por primera vez, las recomendaciones de buenas prácticas para el diagnóstico genético de abortos con defectos congénitos
Congenital anomalies can cause anxiety within a family and high healthcare demand. The aim of this study was to write good practice recommendations to guide health professionals in the clinical-genetic diagnosis of congenital defects.
MethodsThe proposed protocol focuses on an optimal case scenario that includes collection of initial clinical data, biological sampling, and diagnostic algorithms.
ResultsA model of the optimal clinical history form was created to facilitate the collection of initial clinical data. For sampling, it is recommended to obtain at least one fetal sample (of the three embryonic germ layers). Moreover, samples from both parents should be taken to exclude mosaicism, following the diagnostic algorithm proposed for the correct genetic diagnosis of the corresponding congenital defect.
ConclusionThis document is the first to gather good practice recommendations for the pre- and post-natal genetic diagnosis of miscarriages and abortions due to congenital defects.
El desarrollo embrionario es un proceso complejo que requiere la expresión de numerosos genes de forma precisa y coordinada para la correcta formación del individuo. El término defecto congénito (DC), que podríamos considerar sinónimo de anomalías, o alteraciones congénitas, incluye cualquier tipo de error del desarrollo, sea físico, psíquico, funcional, sensorial o motor1. La prevalencia global de los DC en el mundo industrializado se estima en torno al 2-3% de los recién nacidos vivos, alcanzando el 6-7% con el seguimiento posnatal2. Según los datos registrados por el Estudio Colaborativo Español de Malformaciones congénitas (ECEMC), la frecuencia basal de recién nacidos con defectos congénitos en España se sitúa en el 2,50% antes del año 1986, a partir de esa fecha esta cifra ha ido disminuyendo debido a la mejora en la detección ecográfica de los defectos congénitos seguida por la interrupción de los embarazos de fetos afectados2. La gran mayoría de los DC cumplen, individualmente, la definición de enfermedad rara. Según la Unión Europea (UE) se entiende por enfermedades raras, todas aquellas enfermedades que pueden ser mortales o provocar un debilitamiento crónico del paciente y que, debido a su escasa prevalencia, requieren esfuerzos combinados para tratarlas. A título indicativo, se considera una prevalencia escasa aquella inferior a 5 casos por 10.000 habitantes (DecisiónN.° 1295/1999/CE del Parlamento Europeo y del Consejo de 29 de abril de 1999. Diario Oficial de las Comunidades Europeas L 155/1. 1999). Mientras que la gran mayoría de los DC muestran cifras de frecuencias de alrededor de un niño por cada 100.000 recién nacidos3.
Los DC pueden manifestarse de forma grave siendo causa de abortos y muerte fetal intraútero, o bien pueden tratarse de anomalías congénitas leves siendo indicadores físicos de una morfogénesis alterada que ocurre temprano en la gestación y que proporciona claves importantes para el diagnóstico. A pesar de que las anomalías leves suelen ser defectos estructurales sin relevancia clínica, su detección ecográfica puede ser un indicativo de la presencia de anomalías mayores de importancia médica y puede suponer el primer indicio de una de anomalías cromosómicas, síndromes de genes contiguos, enfermedades monogénicas o bien la exposición a teratógenos durante la embriogénesis. Se ha observado que a mayor número de anomalías menores presentes en un feto, mayor es el riesgo de DC de importancia clínica4–6.
En la actualidad, la causa de las anomalías congénitas es desconocida aproximadamente en el 50-60% de los recién nacidos con defectos congénitos. De entre los casos de causa conocida, se ha estimado que el 10% se debe a la influencia de factores ambientales, el 15% a factores genéticos y el 20-25% son resultado interacción entre los factores genómicos y ambientales7.
La aparición de defectos congénitos, detectados tanto prenatal como posnatalmente, produce una gran ansiedad en la familia y una enorme demanda asistencial que debe ser satisfecha y abordada por un equipo multidisciplinar8.
Guía genético-clínica como modelo de actuación para el estudio de abortosLa finalidad del presente documento es proporcionar, con base en nuestra experiencia, las herramientas adecuadas que permitan, mediante la optimización de recursos, realizar un eficiente diagnóstico de un aborto espontáneo o un feto, que ecográficamente manifieste DC por los cuales se ha decidido interrumpir voluntariamente la gestación, para así poder proporcionar un adecuado y personalizado consejo genético. Asimismo, se han propuesto las recomendaciones mínimas para el estudio de abortos bien sean estos de origen espontáneo o producto de una interrupción voluntaria de una gestación por presentar el feto algún tipo de malformación congénita. Estas recomendaciones incluyen todos los aspectos de manejo genético clínico de los casos: desde la atención clínica de una forma multidisciplinar hasta el algoritmo de actuación a realizar, que sirva como guía para los distintos profesionales (ginecólogo-obstetra, genetista o anatomopatólogo) que estén implicados en el diagnóstico de abortos con DC. Además, se ha confeccionado un modelo de historia clínica (Anexo disponible en la web), para que el ginecólogo-obstetra junto con el genetista, pudieran realizar una consulta conjunta y pudieran completar el dossier con el detalle mínimo requerido, realizando las preguntas precisas para dirigir los análisis posteriores. Esto es un paso crucial, ya que facilita el protocolo de actuación y permite llegar al diagnóstico de una forma más eficiente.
El conocimiento de las causas del suceso del aborto ya sea espontáneo o interrumpido por presentar DC graves y la determinación de un diagnóstico genético-clínico, permite establecer el diagnóstico y su posible causa, además de disminuir la ansiedad en la pareja, conocer los riesgos de recurrencia en cada situación en particular, conocer sus opciones reproductivas ante esa situación, entender, prevenir o paliar la enfermedad y asimismo nos permitiría dar a conocer estos riesgos a los familiares.
El protocolo que proponemos contempla un modelo de actuación óptimo que incluye la recogida de la información clínica inicial, la obtención de las muestras y el protocolo de actuación. Toda información que pueda arrojar un feto puede servir para conseguir finalmente una adecuada filiación del producto de un aborto. Llegar a este punto supone proporcionar a la gestante y su pareja el consejo genético apropiado en cada situación en particular.
Recogida de la información clínica inicial: servicio de obstetricia y ginecología y servicio de genéticaLa recogida de la información clínica es un paso crucial para poder realizar los estudios posteriores. Los puntos más relevantes de la recogida de la información se han contemplado en el modelo de historia clínica (Anexo disponible en la web).
Ante un embarazo donde el feto pueda tener parámetros alterados, bioquímicos o ecográficos, se reunirá toda la información necesaria en un documento detallado por el especialista ginecólogo-obstetra. Posteriormente, se realizará una consulta donde conjuntamente obstetra y genetista realicen las preguntas necesarias para obtener la información precisa para realizar los estudios pertinentes. En los casos donde no se pueda reunir a los 2 especialistas, en primer lugar, el ginecólogo-obstetra tras establecer las sospecha diagnóstica una vez realizada la exploración ecográfica completará la anamnesis en una consulta a la paciente en la que obtendrá los datos precisos como fecha de última regla, semanas de gestación, hábitos sociales de la gestante durante el embarazo, así como, los posibles teratógenos que hayan podido influir en el periodo gestacional y la sospecha clínica inicial, explicando los hallazgos que sugieren dicho diagnóstico clínico. A continuación, la paciente será remitida al servicio de genética, para poder completar este dossier que contendrá adjunta una copia de la información ecográfica y bioquímica, con la información genética relevante de la gestante, de su cónyuge (en los casos que se pueda) y de sus familiares: consanguinidad, árbol genealógico, otros casos en la familia con malformaciones o abortos, etc. En la elaboración del árbol genealógico será necesario recabar toda la información disponible y útil tal como la edad, número de hijos previos, origen geográfico, así como también las peculiaridades propias de cada cultura en cuanto a matrimonios, apellidos, consanguinidad, endogamia etc.
La recogida de la información clínica debe ir ineludiblemente acompañada del consentimiento informado para el estudio fetal. Con este documento decidirán si dan su consentimiento para el estudio genético fetal, anatomopatológico o ambos, si quieren ser conocedores de los resultados y decisión del destino final del feto en los casos en los que se precise.
El aborto será referido con un volante al servicio de genética para la obtención de las muestras pertinentes y posteriormente se solicitará estudio fotográfico y radiológico posmortem (en un volante de rayos X debe constar como motivo: estudio rayos X posmortem, haciendo constar las anomalías que se observan en la visión frontal y lateral, al igual que en las recomendaciones para el racién nacido vivo). Previo al envío del feto al servicio de anatomía patológica es esencial completar el estudio de rayos X posmortem.
Esta documentación será referida a un especialista radiólogo para la evaluación de la manifestación clínica sobre todo en los casos de sospecha de displasia esquelética. [Uno de los diagnósticos más solicitados son las displasias esqueléticas: en estos casos las radiografías son indispensables para poder realizar un diagnóstico diferencial que incluye en primer lugar descartar aneuploidías o poliploidías. La petición de estudio genético molecular de displasias óseas, si no va acompañado de la evaluación radiográfica, obliga a realizar un extenso trabajo que puede resultar infructuoso].
La información derivada de su análisis se proporcionará al servicio de genética para la realización de los análisis genéticos pertinentes en cada caso en función de la evaluación clínica.
Ante un feto de más de 22 semanas de gestación, se requiere una autorización adicional de estudio necrópsico de fetos, estudio que se realiza en el servicio de anatomía patológica, donde los padres tienen que decidir cómo proceder para el destino final del aborto: inhumación, incineración o donación para investigación para llegar al conocimiento objetivo y científico de la enfermedad subyacente. Cada servicio de obstetricia y ginecología del centro hospitalario de procedencia y referencia de muestras procederá según su protocolo específico de procedimiento, en su defecto atenderá según las recomendaciones de la Sociedad Española de Ginecología y Obstetricia (SEGO) en sus protocolos asistenciales.
Obtención de las muestras y medidas pertinentes para su análisisEl aborto deberá ser transportado desde el centro emisor en las condiciones precisas para su mínima alteración posible. En caso de tener que guardar el aborto durante unas horas o días antes de poderlo remitir al laboratorio de genética con su correspondiente volante, debe ser guardado, se conservará en nevera (4-5°C) y en suero fisiológico (nunca en formol).
Las muestras biológicas iniciales corresponden a: a) muestras embrionarias o fetales previas a la expulsión (material de biopsia corial o liquido amniótico), tomadas por duplicado, de tal manera que una se analizará mediante estudio molecular y otra mediante estudio citogenético; b) material embrionario/placentario en el caso de abortos de primer trimestre con toma de muestra de corion, embrión y decidua; c) sangre de cordón y tejido muscular en el caso de abortos segundo trimestre, de tal manera que se tomará al menos una muestra, siendo recomendable obtener una muestra por cada capa embrionaria para descartar posibles mosaicismos. Esta/s muestra/s se tomará/n después de la fotografía general y los rayos X. En los casos en los que se pueda se recomienda también, que tras la evaluación por parte del servicio de anatomía patológica, se tome muestras del tejido afectado, al menos una para los análisis pertinentes y otra para el banco de muestras. De la/s muestra/s inicial/es, se tomará una muestra para estudio molecular y otra muestra para estudio citogenético; d) sangre periférica de los progenitores. Es recomendable intentar conseguir una muestra sanguínea de la madre y siempre que sea posible también la del padre. Este punto se justifica por la necesidad de confirmar los resultados de los estudios moleculares, de determinar si una determinada mutación genética es hereditaria o de novo con la finalidad de determinar los riesgos de recurrencia, y de averiguar el origen de ciertas anomalías cromosómicas tales como por ejemplo las translocaciones equilibradas que siendo asintomáticas en los progenitores, están implicados en los abortos de repetición.
Las muestras biológicas finales son aquellas tras su procesamiento mediante extracción de ADN de las muestras o cultivo celular para estudios citogenéticos.
Tras la obtención de las muestras destinadas al servicio de genética, se remitirá el aborto al servicio de anatomía patológica para su evaluación. Al feto se le tomarán las medidas estatoponderales y se realizará el estudio del hábito externo. En fetos de edad inferior a 22 semanas (Ley Orgánica 2/2010, de 3 de marzo, de salud sexual y reproductiva y de la interrupción voluntaria del embarazo), se procederá a su fijación por inmersión en formol al 4% tamponado, con el doble de volumen de formol, en un recipiente adecuado. Es deseable realizar fijación de los órganos internos, para lo cual es necesaria la inyección de formol intracavitario (5cc) intracraneal, torácico y abdominal. Se efectuará estudio necrópsico de estos restos en las siguientes 48 horas.
En fetos de edad superior a 22 semanas, el estudio necrópsico se realiza de manera inmediata, procediéndose al estudio de hábito externo, disección y estudio de hábito interno, procediéndose a la fijación de los órganos internos en formol al 4% tamponado. Se procede al cierre del cadáver, se emite un informe macroscópico provisional y se prepara para exequias (en caso de ser esa la opción decidida por los padres). Los órganos se estudian una vez fijados, a fin de obtener una mejor visión de la estructura anatómica y de mejorar el estudio microscópico.
Toda la información recogida en este estudio se facilitará al servicio de genética para establecer el estudio genético dirigido en función de los datos clínicos de partida.
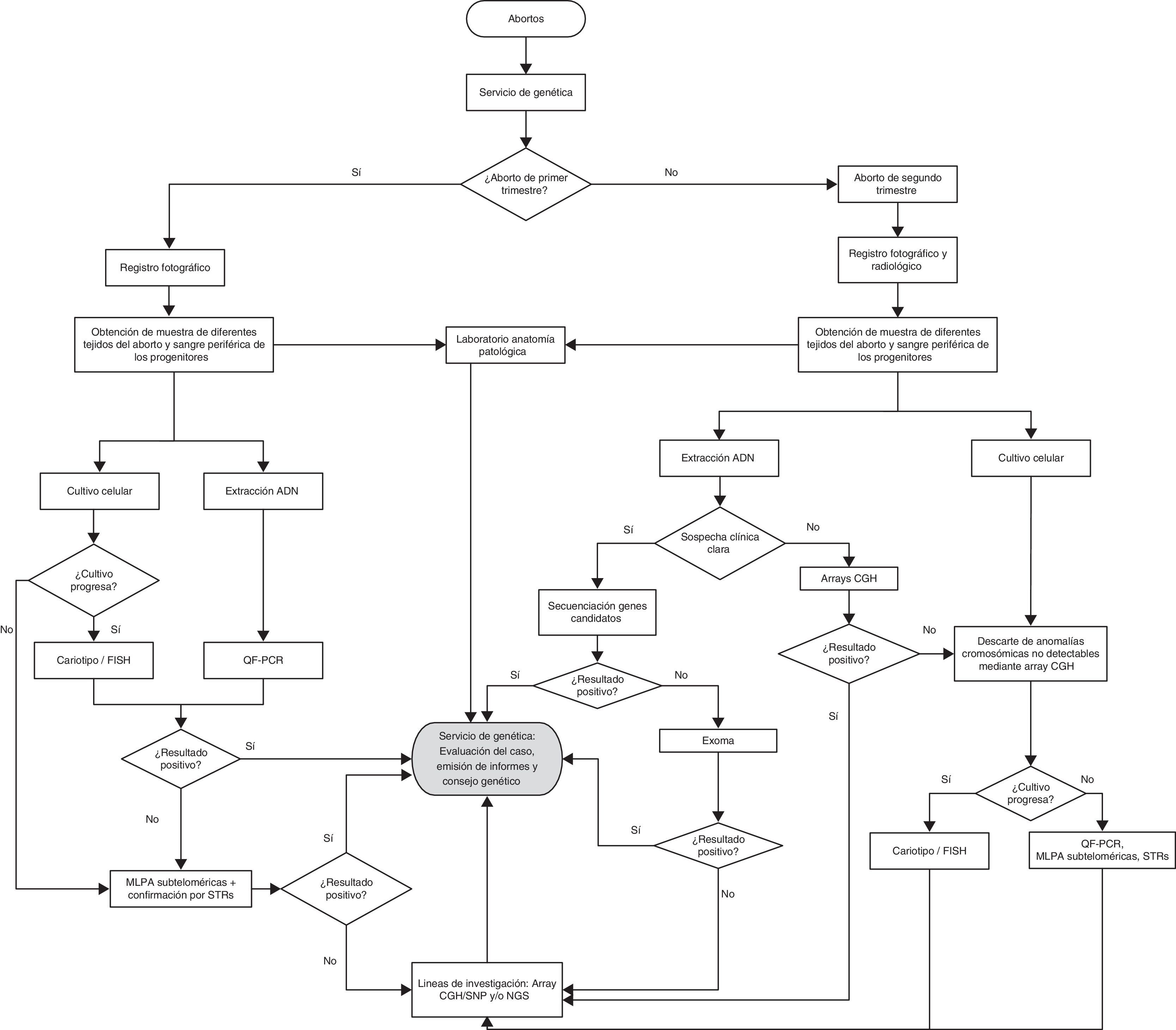
Protocolo de actuación para análisis genético de los abortosCon base en la experiencia adquirida se proponen las siguientes recomendaciones para el análisis genético de los restos abortivos (fig. 1).
En la consulta del servicio de obstetricia y ginecología tras la intervención se solicitará a los progenitores la cumplimentación de la anamnesis y restantes datos clínicos así como la extracción de una muestra sanguínea de ambos progenitores. A continuación, se remitirá al servicio de genética para el estudio del feto. Tras la recepción del feto, se realizará una fotografía y en el caso de que el feto sea cercano al segundo trimestre o posterior se realizará además una radiología frontal y lateral.
En el caso de que el aborto sea de primer trimestre de gestación es recomendable en primer lugar, descartar aneuploidías o poliploidías mediante técnicas como cariotipo/FISH. Si el cultivo no progresa se emplearán técnicas moleculares como QF-PCR para el análisis de anomalías en la dosis génica de los cromosomas 13, 15, 16, 18, 21, 22 y cromosomas sexuales o MLPAp036/p070 para el análisis de las regiones subteloméricas de todos los cromosomas. Si el resultado es negativo se podría emplear el MLPAp235 para el análisis de regiones involucradas en la manifestación de síndromes de microdeleción. En el caso de que los resultados anteriores sean negativos, se recomienda enviar las muestras a estudios de investigación tales como microarrays de CGH, microarrays de SNP o plataformas de secuenciación masiva. Para el empleo de estas tecnologías resulta indispensable disponer de una muestra de ADN de cada progenitor. Además, la muestra de ADN del aborto debe tener la suficiente calidad por lo que aquellas muestras maceradas o que hayan sido sometidas a formol puede afectar seriamente a los resultados. En caso de que los microarrays no proporcionen información clínica contrastada con la literatura o que los resultados de MLPA sean negativos, o bien no se dispongan de las plataformas de secuenciación masiva, se reevaluará toda la información clínica recogida para la búsqueda de mutaciones en genes que puedan explicar el fenotipo.
En los abortos cercanos al segundo trimestre de gestación o posterior resulta imprescindible en primer lugar evaluar la radiografía así como la fotografía y los informes ecográficos para la determinación de una sospecha clínica precisa que oriente de una forma dirigida el estudio genético posterior. En el caso de que se tenga un diagnóstico clínico de un determinado síndrome o patología se procederá al estudio de la región genómica implicada. Si por lo contrario no se obtiene una sospecha clínica clara, se recomienda comenzar por el estudio de microarray de CGH/SNP para el estudio de anomalías cromosómicas, descarte de isodisomías, la búsqueda de genes candidatos, etc. En el caso de no detectar CNV patológicas, es necesario descartar mediante cariotipo la posible existencia de poliploidías u otras anomalías no detectables mediante array CGH, y en el caso de presentar ploidía normal se recomienda el análisis de las muestras mediante estudios de investigación como el análisis de paneles de los posibles genes que pudieran estar asociados al fenotipo del aborto mediante secuenciación masiva. Finalmente, con los resultados obtenidos, se emitirá un informe siguiendo las guías de recomendación europeas y se le ofrecerá el consejo genético oportuno por un especialista entrenado en el campo de la genética.
ConclusiónEste manuscrito recoge por primera vez las recomendaciones de buenas prácticas para el diagnóstico genético de abortos con defectos congénitos, de tal manera que sirva de guía para el adecuado manejo de los pacientes. Mediante estas recomendaciones se pretende el establecimiento de las bases adecuadas que permitan, mediante la optimización de recursos, realizar un eficiente diagnóstico.
FinanciaciónEste trabajo ha sido financiado por la Fundación Ramon Areces (4715/001) y por la Fundación Conchita Rábago de Jiménez Díaz. Monica Martinez-Garcia ha recibido la beca de investigación Conchita Rábago y este trabajo ha recibido apoyo financiero de la Fundación Ramón Areces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos el trabajo realizado por Rocío Cardero y Fernando Infantes del servicio de genética del Hospital Fundación Jiménez Díaz.