Hay una tendencia generalizada a realizar ooforectomía al mismo tiempo que la histerectomía, con la idea de que la ooforectomía profiláctica es la mejor estrategia para disminuir la tasa de cáncer de ovario, y también se alude a que confiere protección ante el cáncer de mama y una disminución del riesgo de cirugía ovárica posterior. Por otro lado, es interesante reseñar el hecho que el cáncer de ovario es una afección maligna poco frecuente. Por el contrario, se conocen los efectos beneficiosos de preservar los ovarios, que incluyen disminuir el riesgo de enfermedad cardiovascular, de fractura osteoporótica, demencia, enfermedad de Parkinson, disfunción sexual, una incidencia más baja de síntomas menopáusicos y una mortalidad menor, de modo que la preservación de los ovarios hasta la edad de 65 años se asocia con tasas de supervivencia más altas.
Tras analizar los pros y los contras de ambas actitudes, se concluye con la afirmación que las únicas indicaciones para realizar ooforectomía a la vez que histerectomía en los procesos benignos serían en mujeres con mutaciones BRCA1 y 2, en casos de endometriosis grave y, finalmente, por elección de la paciente.
There is a widespread tendency to perform oophorectomy at the same time as hysterectomy, based on the view that prophylactic oophorectomy is the best strategy to reduce the rate of ovarian cancer, as well as to confer protection against breast cancer and decrease the subsequent risk of ovarian surgery. However, ovarian cancer is an uncommon malignant disease. In contrast, the beneficial effects of conserving the ovaries are well known and include a reduction of the risks of cardiovascular disease, osteoporotic fracture, dementia, Parkinson's disease, and sexual dysfunction, as well as a decrease in the incidence of menopausal symptoms and mortality. Consequently, ovarian conservation until the age of 65 years is associated with higher survival rates.
The present article analyzes the pros and cons of both approaches and concludes that the only indications for performing simultaneous oophorectomy at hysterectomy in benign processes would be the presence of BRCA1 and 2 mutations or severe endometriosis and, finally, patient choice.
Más de las 600.000 histerectomías que se realizan anualmente en Estados Unidos se practican en mujeres premenopáusicas que tienen procesos ginecológicos benignos, y en la mitad de ellas se incluye la práctica de ooforectomía bilateral1. La ooforectomía profiláctica es la mejor estrategia para disminuir la tasa de cáncer de ovario (CO). Por este motivo, el porcentaje de ooforectomías profilácticas bilaterales que acompaña a las histerectomías se ha duplicado. Por otro lado, es interesante reseñar el hecho que el CO es una enfermedad maligna poco frecuente y, si bien 16.000 mujeres mueren por CO al año, 70.000 mueren por cáncer de pulmón, 28.000 por cáncer de colon, 40.000 por cáncer de mama (CM), 490.000 por enfermedad cardíaca y 48.000 después de una fractura de cadera2.
En la tabla 1 se expresa la incidencia anual de CO distribuida por grupos de edad2. En ella se observa que, en pacientes de 50 años, sólo a una de 1.500 mujeres se diagnosticará CO y, a la edad de 70 (la edad de más incidencia), en una de cada 400 mujeres se hallará un CO.
Ovarios en la posmenopausiaEn relación con el tema que se está tratando, hay una serie de hechos que deben conocerse:
- •
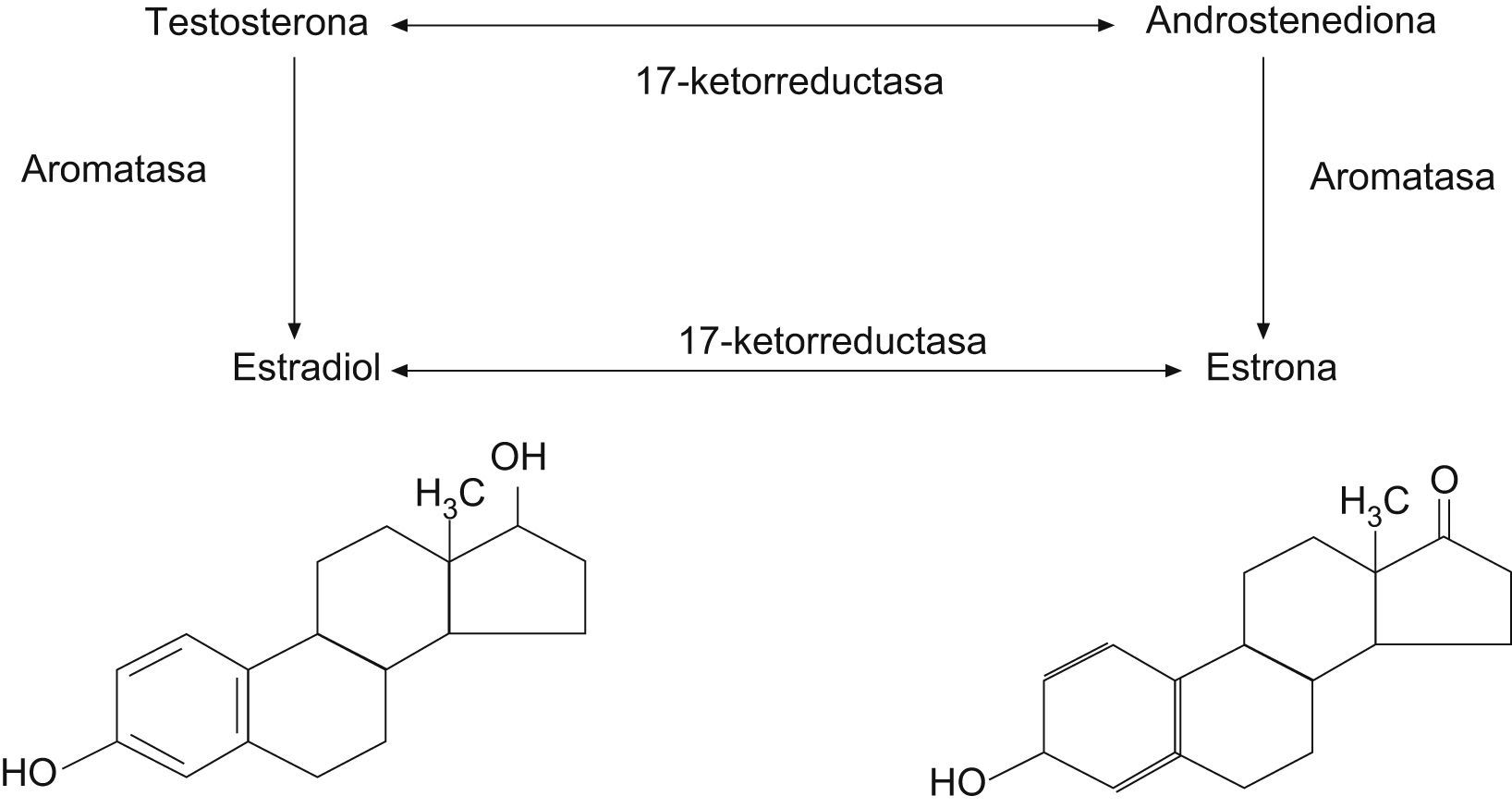
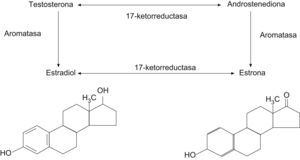
Durante los años reproductivos, los ovarios producen estradiol, testosterona y androstendiona. Cerca de un 50% de la testosterona circulante proviene de los ovarios.
- •
La ooforectomía en la premenopausia causa una pérdida inmediata y significativa de esas hormonas3.
- •
La menopausia natural en sí no se asocia a un cambio significativo de los valores circulantes de testosterona, de modo que, después de la menopausia, los ovarios continúan produciendo androstendiona y testosterona en cantidades significativas hasta la edad de 80 años4. La androstendiona (fig. 1) se convierte en estrona en la grasa y el músculo, y la estrona y la testosterona se convierten en estradiol.
- •
Después de la ooforectomía bilateral, la mujer menopáusica muestra una disminución mayor y significativa de los valores plasmáticos de androstendiona y testosterona respecto a la mujer con menopausia natural que conserva los ovarios5,6.
Los beneficios de preservar los ovarios incluye disminuir el riesgo de:
- •
Enfermedad cardiovascular (ECV).
- •
Fractura osteoporótica.
- •
Demencia.
- •
Enfermedad de Parkinson.
- •
Disfunción sexual.
- •
Una incidencia más baja de síntomas menopáusicos.
- •
Mortalidad.
Veamos estos diversos apartados de forma individual2,7.
Enfermedad cardiovascularSe sabe que la ooforectomía realizada en la mujer premenopáusica y posmenopáusica está ligada a un incremento de riesgo de ECV, la principal causa de muerte para todas las mujeres. Hay una serie de estudios al respecto:
- •
Análisis de los datos derivados del Women's Health Initiative (WHI) muestran que la histerectomía con ooforectomía es un factor predictor independiente de infarto agudo de miocardio (IAM) o muerte por enfermedad coronaria8.
- •
Datos del WHI hallan también que el tratamiento con estrógenos no afecta al rango de ECV, e indican que la conservación de los ovarios puede ser la mejor de las estrategias para disminuir el riesgo de ECV9.
- •
Tanto la menopausia natural, como la quirúrgica, se asocian con más aterosclerosis subclínica10,11.
- •
El Nurses’ Health Study (estudio prospectivo que incluyó a 121.700 mujeres) informó que la ooforectomía realizada en mujeres entre los 40 y los 44 años de edad duplicaba el riesgo de IAM, comparado con un grupo de mujeres con los ovarios intactos12. Estudios posteriores con la misma cohorte confirmaron estos hallazgos13.
- •
La cirugía a edades tempranas o la menopausia natural temprana se ha correlacionado con un incremento en el riesgo de mortalidad por ECV14.
- •
La ooforectomía realizada después de los 50 años de edad incrementa el riesgo de desarrollar un primer IAM en un 40%, en comparación con un grupo control15.
- •
Es un hecho bien conocido que los estrógenos y los andrógenos inhiben la resorción ósea y los andrógenos incrementan la formación ósea16. Por otra parte, en un estudio de seguimiento a 15 años17, mujeres a las que se sometió a ooforectomía después de los 49 años de edad tuvieron un 54% más de fracturas osteoporóticas que las mujeres con ovarios intactos. Sin embargo, Antoniucci et al18 no encuentran que la ooforectomía realizada después de la menopausia se asocie con un incremento de fractura vertebral o de cadera, contrastando estos resultados con los descritos previamente, con lo que estos autores afirman que la relación existente entre la ooforectomía posmenopáusica y el riesgo de fracturas no está dilucidado totalmente.
- •
Un estudio prospectivo19 halla que las mujeres ooforectomizadas después de los 60 años tuvieron un incremento doble de la mortalidad (odds ratio=2,18) después del trauma producido por una fractura de cadera.
- •
En recientes estudios de la Clínica Mayo20–22, los investigadores aportan un incremento, con significación estadística, del riesgo de demencia y de enfermedad de Parkinson en mujeres a las que se había practicado ooforectomía antes de la menopausia. Es así que estas mujeres se enfrentan a 2 veces más riesgo de demencia y parkinsonismo en comparación con las mujeres que mantuvieron sus ovarios o las que recibieron un tratamiento hormonal sustitutivo (THS) adecuado después de la cirugía hasta al menos los 50 años de edad. Los investigadores observaron que el riesgo era mayor cuanto menor era la edad en la que se intervino las mujeres, así como que en las sometidas a ooforectomía; pero en las que recibieron THS al menos hasta los 50 años, el riesgo volvía a valores normales. Para los autores, estos hallazgos son los primeros que muestran que hay una ventana de oportunidad terapéutica para el THS en mujeres sometidas a ooforectomía antes de los 50 años.
- •
Otros estudios23 aportan una disminución de la capacidad cognitiva tras la ooforectomía.
- •
Algunas mujeres ooforectomizadas tienen una peor función sexual después de la histerectomía, comparadas con las que mantienen sus ovarios. Estos efectos adversos se manifiestan en una disminución del deseo sexual, frecuencia y respuesta orgásmica24.
- •
La ooforectomía en mujeres premenopáusicas y en algunas posmenopáusicas puede desencadenar la aparición súbita de sofocos, bochornos y de alteraciones del ánimo25. Del mismo modo, los síntomas de atrofia urogenital se incrementan en mujeres después de la ooforectomía. Teplin et al26 comparan aspectos relacionados con la calidad de vida y la función sexual en las mujeres premenopáusicas sometidas a salpingo-ooforectomía bilateral frente a un grupo de mujeres que conservaron los ovarios al tiempo de practicársele la histerectomía, y encuentran que, en los primeros 6 meses de la intervención, las mujeres sometidas a ooforectomía empeoraron en algunos aspectos relacionados con la calidad de vida; sin embargo, estas diferencias entre los 2 grupos estudiados no aparecieron hasta 2 años después de la cirugía.
En un trabajo publicado por Rocca et al27, de la Clínica Mayo, se descubre la relación entre extirpación profiláctica de los ovarios y muerte prematura en mujeres jóvenes (menores de 45 años) que no reciben un THS adecuado. La mortalidad debida a todas las causas aumentó 1,7 veces en las mujeres dentro de este grupo etario y fue particularmente más alta para cáncer asociado con estrógeno (CM y de útero) y enfermedades cerebrales o del sistema cardiovascular. Además, el aumento en el riesgo se hizo evidente sólo 10 o más años después de la ooforectomía. La Dra. Bobbie Gostout, cirujano ginecológico de la Clínica Mayo, a la vista de los resultados de este estudio, manifiesta que “debemos ser muy cautos con la ooforectomía, porque podría poner a las mujeres jóvenes en riesgo de muerte prematura”.
Ello ha llevado a considerar los efectos de la ooforectomía en la mortalidad a largo plazo7:
- •
Mujeres entre los 50 y los 54 años con histerectomía, conservación de los ovarios y sin tratamiento estrogénico tienen una probabilidad de supervivencia a la edad de 80 años del 62%, comparada con el 54% cuando la ooforectomía se realizó, igualmente sin tratamiento estrogénico sustitutivo.
- •
Esta diferencia en la supervivencia es el resultado de la ECV (el 16 frente al 8%) y fractura de cadera (el 5 frente al 3%).
- •
Igualmente, la probabilidad de supervivencia a los 80 años después de histerectomía a la edad de 50–54 años, con conservación de los ovarios y sin tratamiento estrogénico, es algo mayor que en las pacientes ooforectomizadas con tratamiento estrogénico.
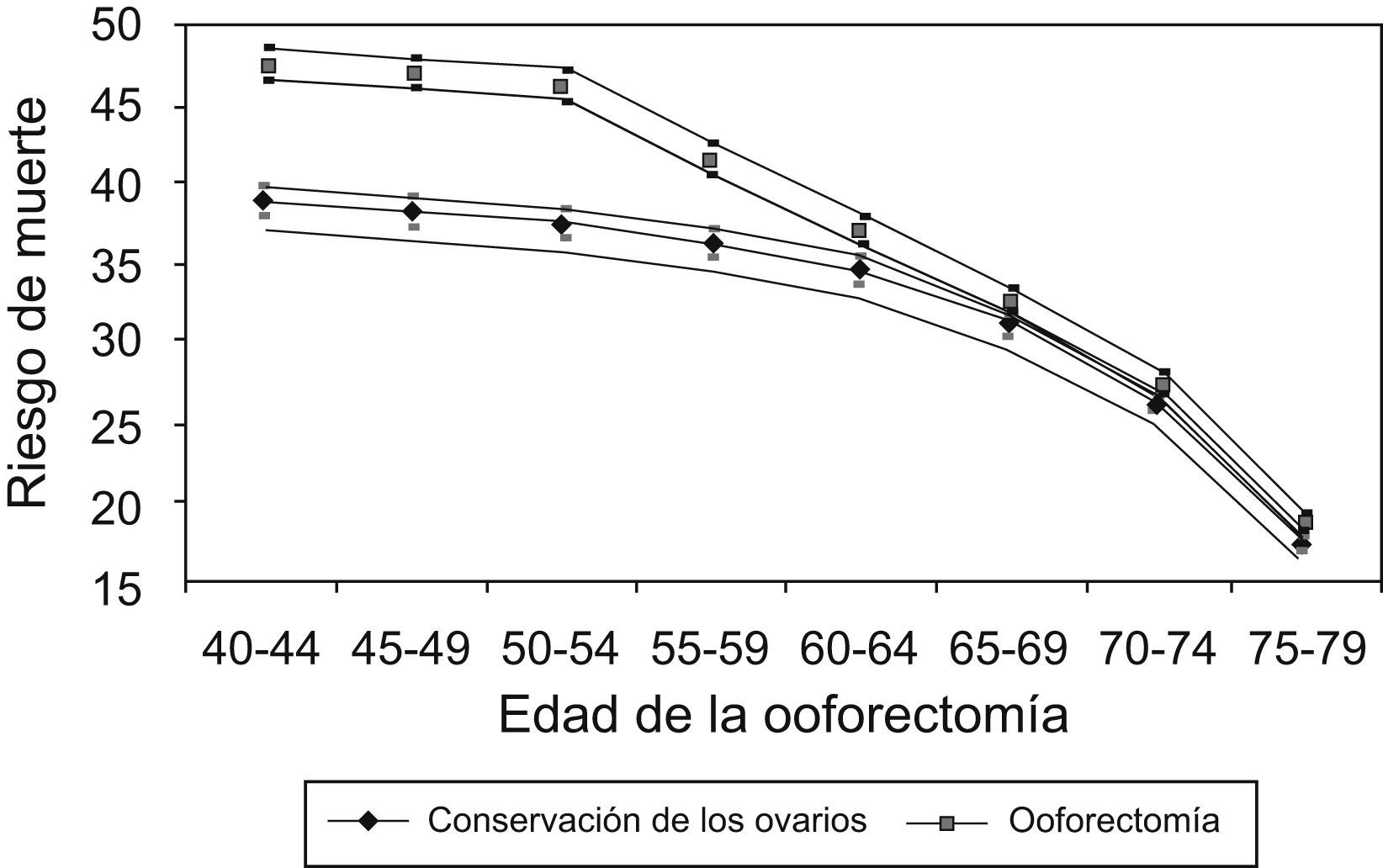
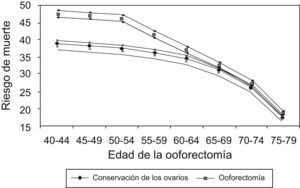
Al aplicar el modelo de Parker et al7 (fig. 2), hipotéticamente, si 10.000 mujeres se someten a ooforectomía con histerectomía entre los 50 y los 54 años, este modelo predice que, a la edad de 80 años, habrían muerto 47 mujeres menos a causa de CO; sin embargo, 838 más habrían fallecido por ECV y 158 más por fracturas de cadera.
Riesgo de muerte hasta la edad de 80 años para no usuarias de tratamiento estrogénico en función de la edad de la ooforectomía con un intervalo de confianza del 95%. Tomada de Parker et al7.
En un estudio a largo plazo de mortalidad después de la ooforectomía usando el modelo de Markov, Shoupe et al28 hallan que la preservación de los ovarios hasta la edad de 65 años está asociada con tasas de supervivencia más altas.
En contraposición, habrá que recordar los beneficios de la ooforectomía3:
- •
Prevención del CO.
- •
Protección ante el CM.
- •
Disminución del riesgo de cirugía ovárica posterior.
Desglosemos estos beneficios:
- 1.
Prevención del CO: aunque la histerectomía por sí sola se asocia con un 50% menos de riesgo de CO, la ooforectomía bilateral reduce este riesgo esencialmente a cero29.
- 2.
Protección frente al CM: la ooforectomía realizada antes de los 50 años puede resultar en una reducción del 50% de CM durante los 10 años siguientes a la cirugía; sin embargo, no hay reducción en el riesgo en mujeres sometidas a ooforectomía después de los 50 años30.
- 3.
Disminución del riesgo de cirugía ovárica posterior (por quistes ováricos o dolor pélvico):
- •
Los quistes benignos ováricos son comunes en las mujeres posmenopáusicas, y en diversos estudios su prevalencia se sitúa entre un 1 y un 13%. No representan, pues, una enfermedad excepcional, y pueden permanecer durante mucho tiempo, incluso hasta la novena década de la vida, y rara vez requieren intervención quirúrgica. Su tratamiento es expectante, si no aumentan de tamaño, si no desarrollan componentes sólidos, si la fluxometría Doppler nos muestra un mapa color negativo y si los valores de CA-125 son normales31.
- •
Después de 20 años de seguimiento de 2.561 mujeres a las que se había practicado histerectomía sin ooforectomía, sólo un 2,8% requirió una ooforectomía posterior32.
- •
El síndrome de ovario restante, caracterizado por algia pélvica, dispareunia, hinchazón abdominal, requiere a veces cirugía, que suele ser muy dificultosa, con una morbilidad alta por lesiones intestinales y ureterales.
- •
Por todo lo referido hasta ahora, habría que preguntarse cuándo es apropiada realizar la ooforectomía:
- 1.
En mujeres con mutaciones BRCA1 y 2. Realizada en este grupo de pacientes, la salpingo-ooforectomía bilateral reduce significativamente el riesgo de CM en aproximadamente el 50% de los casos y el riesgo de CO en un 80–95%33. Hay unos datos que debemos tener presentes:
- a.
En mujeres con mutaciones BRCA1 y 2 a las que se ha practicado salpingo-ooforectomía bilateral profiláctica, se ha informado la presencia, en un 2–5% de los casos, de cáncer primario peritoneal (neoplasia idéntica a carcinoma seroso papilar ovárico sin evidencia de tumor primario ovárico), y puede ocurrir con más frecuencia en BRCA1, en comparación con las portadoras de mutaciones BRCA34,35.
- b.
En estas pacientes, una vez realizada la ooforectomía profiláctica tras completar sus deseos genésicos, podría esperarse un incremento en su expectativas de vida de 3–5 años, dependiendo de la edad en que se realizara la ooforectomía36.
- a.
- 2.
En casos de endometriosis grave, en las pacientes que no han respondido a tratamiento médico, o bien en las que se someten a tratamiento quirúrgico y, durante éste, se observa que los ovarios están seriamente afectados. Si en estas pacientes se realiza ooforectomía bilateral, se les debe ofrecer tratamiento estrogénico sustitutivo.
- 3.
Ooforectomía por elección de la paciente.
Por todo lo referido hasta ahora, es fundamental informar de forma adecuada a la paciente de los riesgos y los beneficios obtenidos si se conservan los ovarios37.
Como ya se ha indicado, la ooforectomía profiláctica puede acompañarse de síntomas menopáusicos (sofocos, sequedad vaginal, disfunción sexual, alteraciones del sueño y cambios cognitivos) que empeoran la calidad de vida de la paciente. Por otra parte, se acelera la pérdida de masa ósea y se incrementa el riesgo de enfermedad cardiovascular. Por todo ello, el THS puede mejorar todos esos síntomas. Sin embargo, son múltiples los estudios que indican que el THS combinado (estrógenos más progesterona) incrementa el riesgo de CM en la mujer posmenopáusica, lo cual induce a pensar que la protección ofrecida por la ooforectomía profiláctica en cuanto a la reducción del riesgo de CM podría reducirse por el uso del THS. A este respecto, se aconseja en estas pacientes sometidas a ooforectomía el tratamiento estrogénico a corto plazo, que se ha demostrado que no afecta el efecto protector de la ooforectomía en el riesgo de CM38.