Comparar las concentraciones de dimetilarginina asimétrica en pacientes con preeclampsia y gestantes normotensas sanas.
MétodoSe seleccionó a un total de 100 pacientes. Se incluyó a 50 pacientes con preeclampsia como los casos (grupo A) y a un grupo control (grupo B) seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio que consistió en 50 gestantes normotensas sanas. Las muestras de sangre se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo B para determinar las concentraciones de dimetilarginina asimétrica.
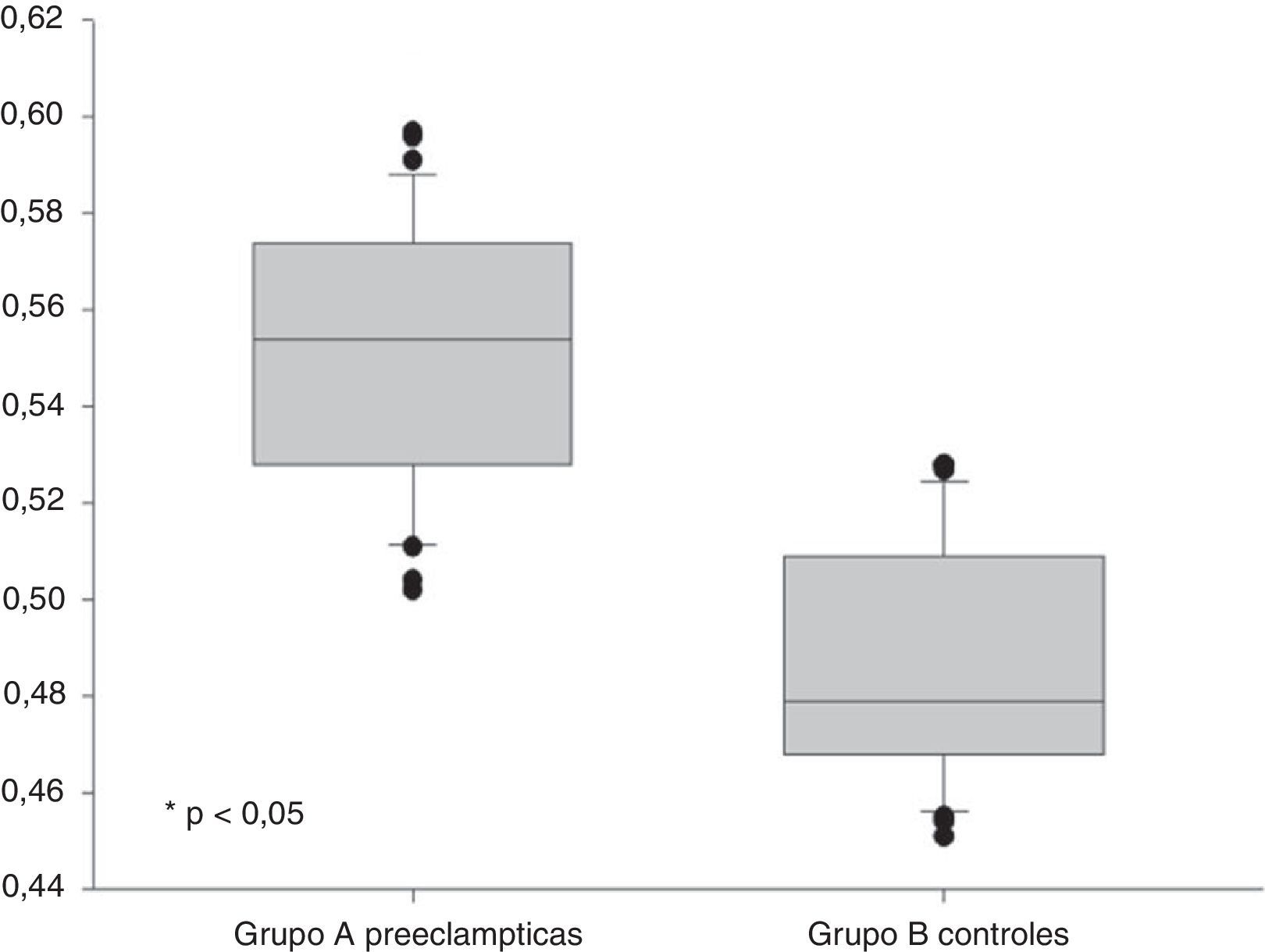
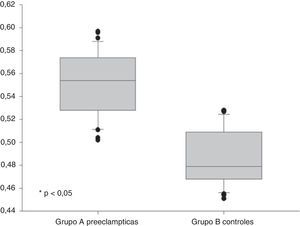
ResultadosSe encontraron diferencias estadísticamente significativas en las concentraciones de dimetilarginina asimétrica entre las pacientes del grupo A (0,551±0,027pmol/L) y las pacientes del grupo B (0,487±0,024pmol/L p<0,05). No se observó una correlación con los valores de presión arterial sistólica ni diastólica (p=ns). Se observaron correlaciones significativas entre las concentraciones de dimetilarginina asimétrica con las concentraciones de ácido úrico, proteinuria en 24 h, transaminasas y creatinina (p<0,05).
ConclusionesLas pacientes con preeclampsia presentaron concentraciones significativamente más altas de dimetilarginina asimétrica al compararlas con gestantes normotensas sanas, lo cual la convierte en un marcador de riesgo útil en pacientes con preeclampsia.
To compare asymmetric dimethylarginine concentrations in patients with preeclampsia and healthy normotensive pregnant women.
MethodWe selected a total of 100 patients. Fifty patients with preeclampsia were selected as cases (group A) and 50 healthy normotensive pregnant women with the same age and body mass index as those in group A were selected as controls (group B). Blood samples were collected in all patients before labor and immediately after diagnosis in group B to determine asymmetric dimethylarginine concentrations.
ResultsThere was a statistically significant difference in asymmetric dimethylarginine concentrations between patients in group A (0.551±0.027pmol/L) and those in group B (0.487±0.024pmol/L; p<0.05). No significant correlation was found with values of systolic and diastolic blood pressure (p=ns). Significant correlations were found between asymmetric dimethylarginine concentrations and uric acid, 24-hour proteinuria, transaminase and creatinine levels (P<.05).
ConclusionsAsymmetric dimethylarginine concentrations were significantly higher in patients with preeclampsia than in healthy normotensive pregnant women, making it a useful risk marker in patients with preeclampsia.
La preeclampsia es un desorden multisistémico del embarazo humano. Es una enfermedad de origen placentario y el único tratamiento es la obtención del feto y la placenta. La mayoría de los casos se producen al principio del embarazo debido a la pobre adaptación fisiológica de las arterias espirales, las cuales no se convierten en vasos de alta capacitancia y baja resistencia1. También se ha propuesto que existe una respuesta inflamatoria sistémica materna que está asociada a la disfunción endotelial generalizada, secundaria a la presencia de diferentes mediadores séricos anormales2. Las concentraciones anormales de sustancias derivadas de la placenta pueden evidenciar la disfunción trofoblástica o hipoxia.
El óxido nítrico producido por las células endoteliales contribuye a la vasodilatación, produciendo la disminución de la resistencia vascular observada durante el embarazo normal3. Se ha propuesto que la disminución de la producción o biodisponibilidad de óxido nítrico contribuye al aumento de la presión arterial, de la resistencia vascular sistémica y de la sensibilidad de los vasopresores observada en la preeclampsia, en donde la disfunción endotelial es la vía final común que lleva a los signos clínicos de la preeclampsia, incluyendo la hipertensión y la proteinuria3,4. Los análogos metilados de la arginina, en forma natural, son inhibidores endógenos de las 3 isoformas de la sintetasa de óxido nítrico5.
La dimetilarginina asimétrica (ADMA) es un producto del metabolismo proteico que se forma en todas las células del cuerpo y, al bloquear la producción de óxido nítrico, induce la disfunción endotelial, lo que favorece el proceso aterogénico. El compuesto dimetil-L-arginina simétrica es producido en cantidades equivalentes pero no afecta la producción de óxido nítrico6,7. Las concentraciones plasmáticas de ADMA se incrementan en diferentes condiciones patológicas como hipercolesterolemia, hipertrigliceridemia e hiperhomocisteinemia8,9. Las concentraciones plasmáticas elevadas están asociadas con eventos cardiovasculares10.
Existe escasa información sobre la concentración de ADMA en el embarazo y la preeclampsia, por lo que el objetivo de la investigación fue comparar las concentraciones de ADMA en pacientes con preeclampsia y gestantes normotensas sanas.
Materiales y métodosSe seleccionó a un total de 160 pacientes. Se incluyó a 80 pacientes con preeclampsia en los casos (grupo A) y a un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio, que consistió en 80 gestantes normotensas sanas (grupo B). Todas las pacientes eran primigestas. Se obtuvo la firma del consentimiento informado para la obtención de las muestras. El Comité de Ética del hospital aprobó el estudio.
La preeclampsia se definió como la presión arterial sistólica de 140mm de Hg o más, o presión arterial diastólica de 90mm de Hg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Se excluyó a las embarazadas polihidramnios, con hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre- o gestacional, hábito tabáquico y tratamiento con medicamentos que puedan alterar las concentraciones de la ADMA (por ejemplo, antihipertensivos). También se excluyó a las pacientes que se negaron a participar en la investigación.
Las muestras de sangre (10ml) se recolectaron en todas las pacientes en forma consecutiva antes del parto e inmediatamente después del diagnóstico en el grupo de casos de la vena antecubital y se las dejó coagular a temperatura ambiente. Posteriormente fueron mezcladas con EDTA-aprotinina y congeladas. Se agregó ácido trifluoroacético en una cantidad similar a la muestra y fueron centrifugadas a 1.700g por 20 min y almacenadas con posterioridad a –801 °C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa de ADMA. El rango estándar utilizado fue de 0,1 a 5,0 pmol/L y la sensibilidad del método fue de 0,05 pmol/L. Los coeficientes de variación intra- e interensayo fueron de 5 y 6%, respectivamente.
Los valores obtenidos se presentaron como promedio±desviación estándar. Se utilizó la prueba de Kolmogorov-Smirnov para comprobar la distribución normal de los datos (p>0,05) y posteriormente se utilizó La prueba t de Student para muestras no relacionadas para el análisis de los grupos y comparar las variables continuas. Los coeficientes de correlación entre la ADMA y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. La precisión de la ADMA para el diagnóstico de preeclampsia se presenta en función de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Se utilizó el análisis receptor-operador para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativa.
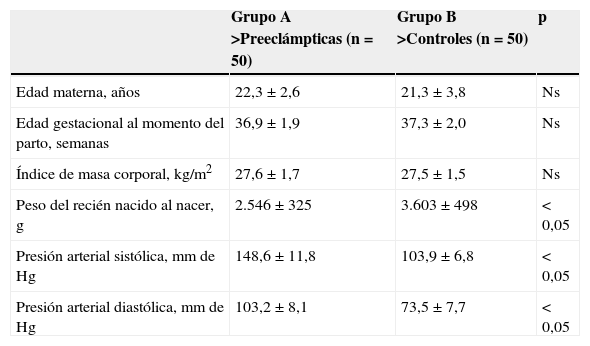
ResultadosLas características generales de los 2 grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, la edad gestacional al momento del parto ni al índice de masa corporal al momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de peso del recién nacido al nacer, presión arterial sistólica y presión arterial diastólica (p<0,05).
Características generales
| Grupo A >Preeclámpticas (n=50) | Grupo B >Controles (n=50) | p | |
|---|---|---|---|
| Edad materna, años | 22,3±2,6 | 21,3±3,8 | Ns |
| Edad gestacional al momento del parto, semanas | 36,9±1,9 | 37,3±2,0 | Ns |
| Índice de masa corporal, kg/m2 | 27,6±1,7 | 27,5±1,5 | Ns |
| Peso del recién nacido al nacer, g | 2.546±325 | 3.603±498 | < 0,05 |
| Presión arterial sistólica, mm de Hg | 148,6±11,8 | 103,9±6,8 | < 0,05 |
| Presión arterial diastólica, mm de Hg | 103,2±8,1 | 73,5±7,7 | < 0,05 |
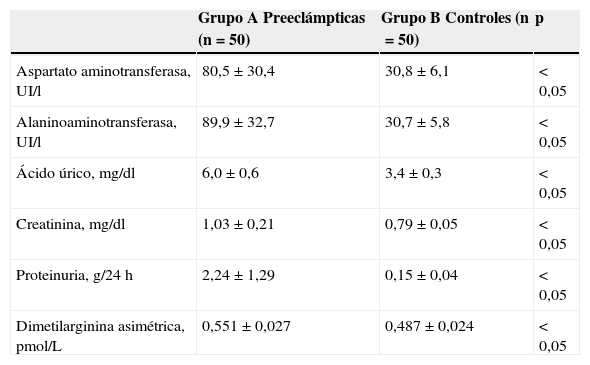
En la tabla 2 se muestran las variables de laboratorio. Se observó que las pacientes con preeclampsia presentaban valores significativamente más altos de transaminasas, ácido úrico, creatinina y proteinuria en 24 h que las pacientes del grupo control (p<0,05). Se encontraron diferencias estadísticamente significativas en las concentraciones de ADMA entre las pacientes en el grupo de estudio (grupo A: 0,551±0,027 pmol/L) y las pacientes del grupo control (grupo B: 0,487±0,024 pmol/L; p<0,05) (fig. 1).
Variables de laboratorio
| Grupo A Preeclámpticas (n=50) | Grupo B Controles (n=50) | p | |
|---|---|---|---|
| Aspartato aminotransferasa, UI/l | 80,5±30,4 | 30,8±6,1 | < 0,05 |
| Alaninoaminotransferasa, UI/l | 89,9±32,7 | 30,7±5,8 | < 0,05 |
| Ácido úrico, mg/dl | 6,0±0,6 | 3,4±0,3 | < 0,05 |
| Creatinina, mg/dl | 1,03±0,21 | 0,79±0,05 | < 0,05 |
| Proteinuria, g/24 h | 2,24±1,29 | 0,15±0,04 | < 0,05 |
| Dimetilarginina asimétrica, pmol/L | 0,551±0,027 | 0,487±0,024 | < 0,05 |
Al realizar la correlación entre las concentraciones de ADMA y los valores de presión arterial, no se observó una correlación con los valores de presión arterial sistólica (r=0,246) ni con los valores de presión arterial diastólica (r=0,208; p=ns). Se observaron correlaciones significativas (p<0,05) entre las concentraciones de ADMA con las concentraciones de ácido úrico (r=0,345), proteinuria en 24 h (r=0,334), aspartato aminotransferasa (r=0,333), alanino aminotransferasa (r=0,327) y creatinina (r=–0,231).
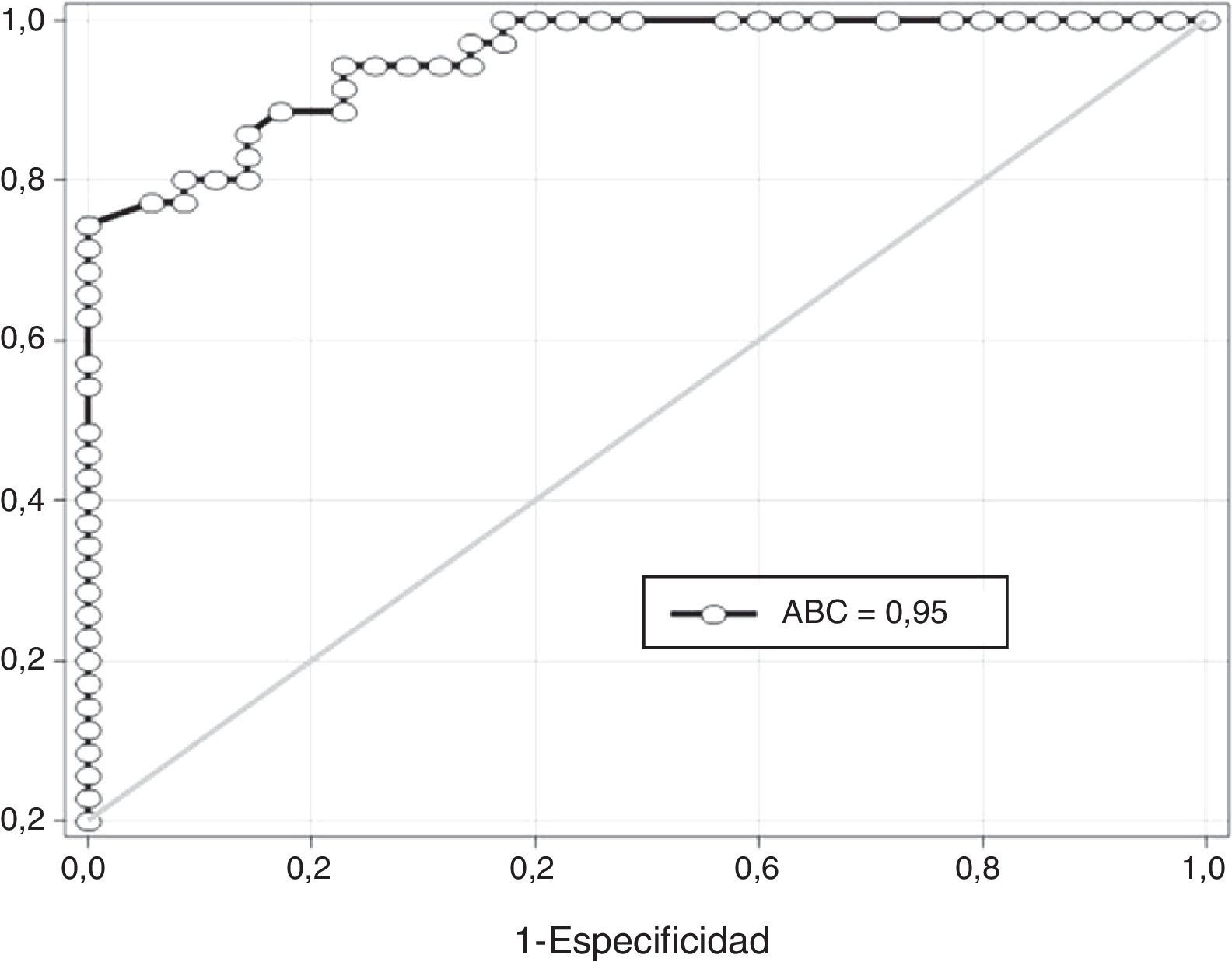
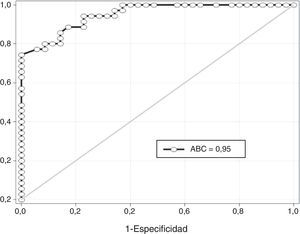
En la fig. 2 se muestra la curva receptor-operador para la precisión de la ADMA para el diagnóstico de preeclampsia. Un valor de corte de 0,518 pmol presentó un valor por debajo de la curva de 0,95 y tiene una sensibilidad del 85,2% (intervalo de confianza [IC] del 95%; 68,9-95,5), especificidad del 83,3% (IC del 95%; 67,2-93,6), valor predictivo positivo del 82,8% (IC del 95%; 66,3-93,4) y valor predictivo negativo del 85,7% (IC del 95%; 69,7-95,1).
DiscusiónEn el presente estudio, las pacientes con preeclampsia presentaron concentraciones significativamente más altas de ADMA en comparación con gestantes normotensas sanas. La ADMA es capaz de afectar la angiogénesis en el embarazo al alterar la actividad de sustancias como el factor de crecimiento endotelial vascular, placentario y de los fibroblastos, que es mediada por un mecanismo dependiente de la actividad del óxido nítrico, el cual es inhibido por la ADMA11.
Durante el embarazo normal, las concentraciones de ADMA en la circulación materna disminuyen por debajo de los valores previos al embarazo y se ha propuesto que esto está relacionado con los efectos del óxido nítrico12,13. Al igual que los resultados de investigaciones previas12–15, esta investigación demostró que las preeclámpticas tienen valores de ADMA sérico más altos que los controles sanos. Sin embargo, otros investigadores16,17 no han confirmado estos hallazgos. Se desconoce la explicación para esta diferencia, aunque en algunos casos las diferencias en el origen étnico, localización geográfica y estado nutricional junto a otros factores pueden representar un papel importante como la severidad de la enfermedad y la extensión de la afección renal y hepática.
La disfunción endotelial dependiente del endotelio es el hallazgo fisiopatológico central en la preeclampsia18. Esta puede ser el resultado de la alteración de la síntesis de óxido nítrico, con evidencia que sugiere que las concentraciones elevadas de ADMA actúan como un inhibidor endógeno que contribuye a la disfunción vascular dependiente del endotelio en enfermedades como la diabetes, hipertensión, hipercolesterolemia y obesidad5,19. La ADMA también puede promover la alteración de la actividad enzimática de la sintetasa de óxido nítrico y convertirla en una enzima generadora de superóxido. Se ha propuesto que la alteración de esta actividad contribuye a una mayor disfunción vascular y puede representar un papel importante en la fisiopatología de la preeclampsia al servir como fuente de estrés oxidativo vascular.
El mecanismo responsable de las altas concentraciones de ADMA en las preeclámpticas es desconocido. La ADMA se deriva del catabolismo de las proteínas que contienen residuos metilados de arginina que son liberados a la circulación materna. La principal vía de degradación de la ADMA es por la enzima dimetilarginina dimetilaminohidrolasa (DADH), que tiene 2 isoformas: I y II. La DADH II es la principal isoforma en las células endoteliales y en la placenta, la cual se considera la fuente más importante por la cual la ADMA se incrementa en forma significativa.
El estrés oxidativo ha sido propuesto como un contribuyente importante en la fisiopatología de la preeclampsia20, e inhibe la actividad de la DADH21. Más aún, las concentraciones de ADMA, y otros aminoácidos, son afectadas por la función renal12. Por lo tanto, entre las preeclámpticas, la ADMA puede incrementarse en forma secundaria la sobreproducción de los residuos metilados de arginina de las proteínas, la degradación de la ADMA por la DADH produce las alteraciones subyacentes de la función renal, lo cual en esta investigación fue demostrado por la correlación de las variables de funcionamiento renal (ácido úrico, creatinina y proteinuria en 24 h) con las concentraciones de ADMA.
Se ha descrito que la disfunción hepática también puede afectar las concentraciones plasmáticas de ADMA durante la preeclampsia. La mayoría de los estudios no han mostrado los resultados de la función del hígado. En esta investigación se demostró que las concentraciones de ADMA tienen una correlación positiva y significativa con las concentraciones de transaminasas hepáticas. En forma interesante, la elevación de las enzimas y los parámetros de la función hepática indican la progresión de la preeclampsia hacia el síndrome de HELLP. Se ha demostrado que las concentraciones de ADMA en pacientes con síndrome de HELLP son mayores en comparación con las preeclámpticas y las embarazadas normotensas16. Además, se ha propuesto que cuando el curso clínico de la preeclampsia se agrava y se involucran órganos que modifican las concentraciones de ADMA (hígado, riñón y endotelio), las concentraciones de ADMA aumentan y podrían afectar en forma negativa el flujo sanguíneo de los órganos.
ConclusionesLos hallazgos de esta investigación demuestran que las pacientes con preeclampsia presentaron concentraciones significativamente más altas de ADMA al compararlas con gestantes normotensas sanas, lo cual la convierte en un marcador de riesgo útil en pacientes con preeclampsia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.