El análisis de los falsos negativos (FN) detectados en programas de cribado prenatal para trisomía 21 (T21) mediante cribado combinado de primer trimestre (CC1.erT) puede ser una herramienta que ayude a mejorar los resultados finales y la calidad global de dichos programas. El objetivo es evaluar las características de FN para T21 y compararlas con los verdaderos positivos (VP) de nuestro programa.
Material y métodosEstudio retrospectivo (enero del 2005-diciembre del 2012). Se seleccionó a los CC1.erT con resultado VP o FN para T21, excluyéndose gestaciones múltiples. Edad y peso materno, edad gestacional (momento de extracción), medida de translucencia nucal (TN) en milímetros y múltiplos de mediana (MoM), concentración sérica y MoM corregido de β-HCG libre y PAPP-A y riesgo bioquímico fueron las variables analizadas. Análisis estadístico con el programa SPSS® 22.
ResultadosEn los FN las medianas para la edad materna, la TN (milímetros y MoM) y el riesgo bioquímico fueron menores, mientras que el peso materno fue superior, siendo todas estas diferencias estadísticamente significativas. En el resto de las variables no se encontró diferencia significativa.
ConclusionesLa aparición de FN es multifactorial. Dadas las diferencias significativas encontradas en peso materno y TN, así como la significación límite en las diferencias del MoM de PAPP-A, es esencial disponer del peso correcto en el momento de la extracción y sobre todo asegurar la calidad en las medidas de TN y PAPP-A. La edad materna determina el riesgo previo, condicionando el resultado final, es significativo que nuestros FN aparezcan en gestantes más jóvenes.
Analysis of false negatives (FN) detected in Prenatal Screening Programme for trisomy 21 (T21) by First Trimester Combined Screening (CC1°T) could be a tool to help improve the final results and the overall quality of these programmes. The objective is to evaluate the characteristics of the FN cases for T21 and compare them with the true positives (TP).
Material and methodsA retrospective study (January 2005 - December 2012). FN and TP results for CC1°T were selected, excluding multiple gestations. The analyzed variables were maternal age and weight, gestational age (at the time of biochemical testing), nuchal translucency (NT) measurement in millimeters and in Multiples of Medians (MoM), serum concentrations and corrected MoM of free β-HCG and PAPP-A and biochemical risk. Statistical analysis was carried out with SPSS® 22 software.
ResultsMedian maternal age, median NT (in millimeters and in MoM) and median biochemical risk were lower in FN cases, however, maternal weight was higher, all these differences were statistically significant. We did not find significant differences in the rest of variables.
ConclusionsThe occurrence of FN is caused by multiple factors. We found significant differences in maternal weight and NT, as well as borderline significance in differences of MoM of PAPP-A, therefore, it is essential to use the correct weight at the time of biochemical testing and, most important, ensure the quality of NT and PAPP-A measurement. Maternal age determines the previous risk and final result; so it is significant that our FN cases appeared in younger pregnant.
Desde mediados de la década pasada, se considera justificada la instauración de programas universales de cribado prenatal para aneuploidías en los sistemas sanitarios públicos, fundamentalmente para la más prevalente de ellas, la trisomía 21 (T21). Tras la publicación de los resultados de 2 importantes estudios prospectivos, FASTER1 y SURUSS2, el cribado combinado de primer trimestre (CC1.erT) fue la estrategia recomendada por diversas sociedades científicas, como la Sociedad Española de Obstetricia y Ginecología y, por tanto, la mayoritariamente elegida para implementar estos programas. Dicha estrategia se basa en la determinación conjunta de 2 marcadores bioquímicos como la proteína plasmática asociada al embarazo (PAPP-A) y la fracción β libre de la gonadotropina coriónica humana (β-HCG libre) y la evaluación de un marcador ecográfico la translucencia nucal (TN).
Garantizar la calidad dentro de un programa de cribado prenatal de aneuploidías debe ser una prioridad. El concepto de calidad debe entenderse de forma amplia, ya que no solo estriba en garantizar la fiabilidad del resultado final, sino que debe considerar otros aspectos no siempre bien valorados, como: cobertura, satisfacción de los clientes (entendiendo como tales, no solo a las gestantes, sino también a los profesionales implicados) y eficiencia de dichos programas.
La calidad del resultado final es obviamente indispensable. Habitualmente, se incide en garantizar la calidad de la medida de los marcadores bioquímicos y ecográficos empleados para el cálculo de riesgo: PAPP-A, β-HCG libre y TN3,4. La precisión y la exactitud de las mediciones bioquímicas están bien aseguradas mediante la aplicación de rigurosos controles de calidad internos y la participación en programas de control de calidad externo de ámbito internacional, como los de la agencia United Kingdom National External Quality Assessment Schemes (UK NEQAS). Debido al gran impacto de la TN en el resultado final del riesgo calculado, en los últimos años ha aumentado el interés por asegurar la calidad en la medición de la misma. En esta dirección, además de la certificación de los ecografistas por la Fetal Medicine Foundation (FMF)5, han surgido nuevas herramientas. Entre estas se encuentran: programas de control interno basados en el método Cumulative Sum Control Chart (CUSUM)6,7, en el que se valora la suma acumulada de las desviaciones con respecto a la media de las mediciones de TN que realiza el observador y programas de control externo basados en imágenes ecográficas para la medición de TN, que posteriormente se envían a ecografistas expertos.
Otros requisitos para asegurar la calidad del resultado final son: disponer para cada uno de los marcadores empleados de medianas adecuadas, y a ser posible propias, para nuestra población, así como la evaluación periódica de las mismas y su ajuste cuando sea necesario; el empleo de adecuados factores de corrección para los múltiplos de la mediana (MoM) de los distintos marcadores bioquímicos y, por último, que los parámetros (media ± desviación estándar) que definen la distribución de los marcadores en la población afectada y no afectada estén bien ajustados a los de nuestras gestantes.
El objeto de todas estas herramientas es garantizar una tasa de detección (TD) y una tasa de falsos positivos (TFP) que cumplan con los estándares publicados en la bibliografía en función de la estrategia de cribado empleada. Para el cálculo de estos indicadores es esencial conocer el resultado final de las gestaciones (nacidos no afectados y el diagnóstico citogenético en nacidos afectados, abortos espontáneos e interrupciones voluntarias del embarazo). La proporción de gestaciones de las cuales se conoce el resultado final es un indicador que se debería tener presente al valorar la calidad de un programa. Sin este dato, difícilmente sabremos si la TD o la TFP son objetivas.
El estudio de las características de los CC1.erT clasificados como negativos de forma errónea, es decir, falsos negativos (FN), ha sido centro hasta el momento de escasas publicaciones. Este análisis puede ser una herramienta más que ayude a mejorar los resultados finales de los programas.
El objetivo del presente trabajo es la evaluación detallada de los resultados FN de T21 dentro del programa de cribado prenatal de aneuploidías que tenemos implantado en nuestra área sanitaria y comparar sus características con las de los verdaderos positivos (VP).
Material y métodosEstudio observacional, retrospectivo, realizado con datos relativos al programa de cribado de aneuploidías en gestantes procedentes del Área de Gestión Sanitaria Sevilla Sur, en el periodo comprendido entre enero del 2005 y diciembre del 2012. Se seleccionó a los afectados (nacidos o no) de T21, tanto con CC1.erT positivo (VP) como CC1.erT negativo (FN). Se incluyeron en el estudio exclusivamente los CC1.erT de gestaciones simples.
Descripción del programa: CC1.erT descentralizado en 2 pasos, realizado bajo consentimiento informado; con determinación β-HCG libre y PAPP-A entre la semana 8 y 12+6 (datado por fecha de última regla) y ecografía entre la semana 10+4 y 14+2 para datar la gestación mediante la longitud cráneo-caudal (CRL) y medición de la TN. Como estrategia de rescate, se realizó cribado bioquímico de segundo trimestre (CB2.°T) entre la semana 14 y 17+6 mediante la determinación de alfafetoproteína (AFP) y β-HCG libre. Los resultados del CB2.°T no son objeto de este estudio.
Determinación de marcadores bioquímicos: PAPP-A y β-HCG libre fueron cuantificados en un analizador IMMULITE 2000 (Siemens Healthcare Diagnostics, EE.UU.) mediante un inmunoanálisis quimioluminiscente en fase sólida.
Biometría fetal: la medición de la CRL y la TN fue realizada por ecografistas certificados según las normas de la FMF. Los ecógrafos utilizados para la valoración ecográfica fueron: Toshiba Famio (Toshiba Medical Systems Corporation, Japón) y Sonoline Adara (Siemens Medical Solutions, Erlangen, Alemania).
Cálculo de riesgo: mediante el software PRISCA V4.0 (Typolog software). El punto de corte utilizado para indicar la realización de pruebas invasivas fue de 1/270 en el caso de la T21.
Estudios citogenéticos: se realizaron los diagnósticos genéticos a partir de muestras obtenidas por técnicas invasivas (biopsia de vellosidades coriales o amniocentesis) de gestantes con CC1.erT positivos, así como de los recién nacidos con sospecha clínica de aneuploidía, en cuyo caso el espécimen para la realización del diagnóstico fue sangre periférica. Dichos estudios genéticos fueron realizados por un laboratorio externo.
Variables analizadas: edad y peso materno en la fecha de la extracción sanguínea, edad gestacional en la fecha de la extracción sanguínea, edad gestacional en la fecha de la ecografía, medición de TN, MoM de TN, concentración sérica de β-HCG libre, MoM corregido de β-HCG libre, concentración sérica de PAPP-A, MoM corregido de PAPP-A y riesgo bioquímico para T21. Para la corrección del MoM de β-HCG libre y PAPP-A se utilizaron los siguientes factores: etnia y peso de la gestante, presencia de diabetes y/o de hábito tabáquico. Se analizaron otros indicadores calculados a partir de los datos del módulo de estadística de PRISCA V4.0 como la cobertura poblacional del programa de cribado, TD y TFP.
Análisis estadístico: a partir del módulo de estadísticas de PRISCA V4.0 se exportaron los datos a una hoja de cálculo Excel Office, 2010 de Microsoft® y se analizaron con el programa estadístico SPSS® versión 22 (IBM SPSS Statistic 22). Tras seleccionar los 2 grupos del estudio, FN y VP, se verificó si las variables analizadas seguían una distribución normal mediante el estadístico de Shapiro-Wilk. Las variables cuantitativas se resumieron con la mediana (percentil 25, percentil 75). La comparación de medianas de cada variable para cada uno de los grupos se realizó mediante la prueba de la U de Mann-Whitney.
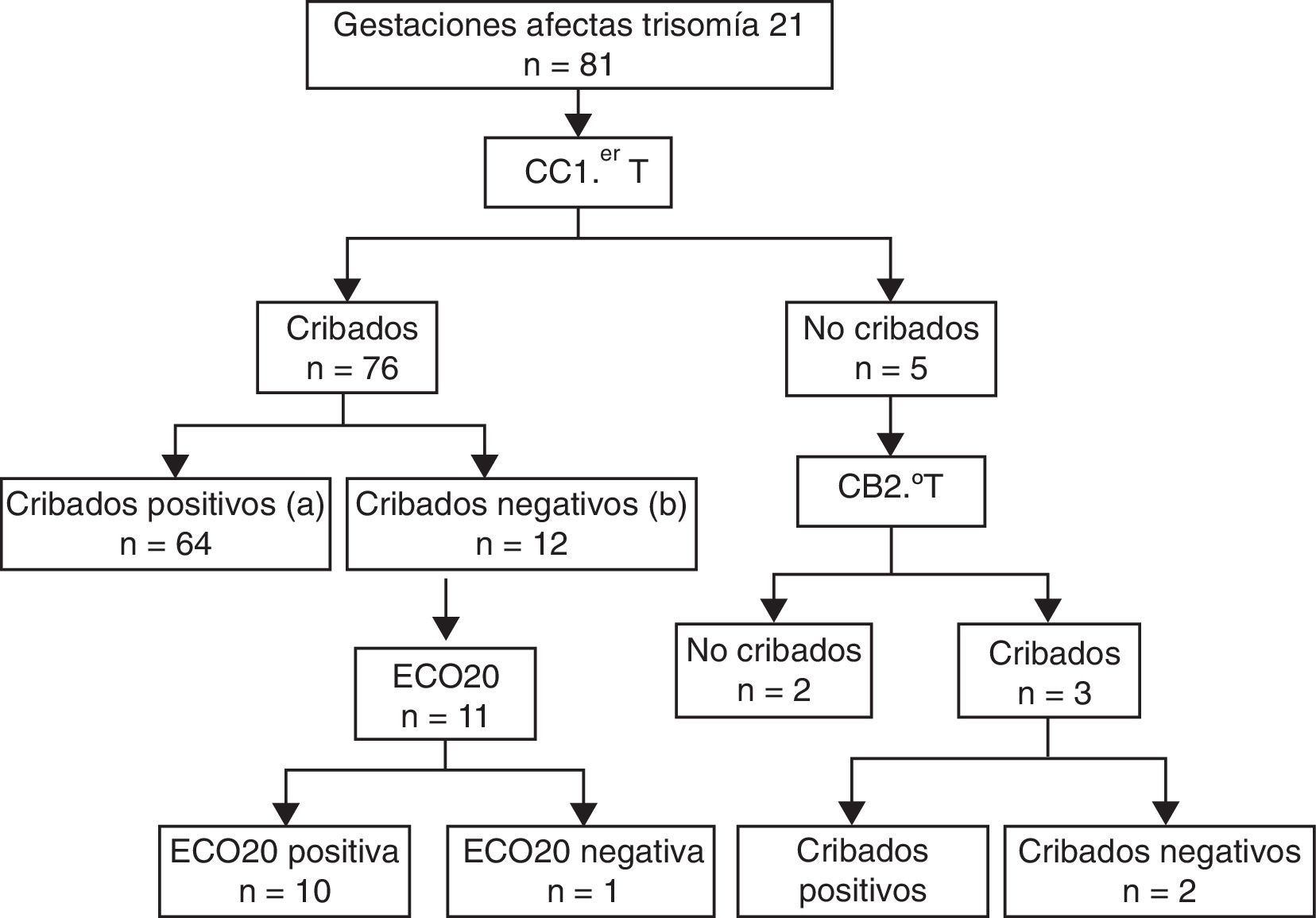
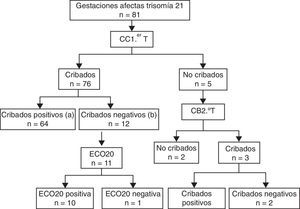
ResultadosDurante el periodo de estudio, a un total de 30.003 gestantes de nuestra área sanitaria se les realizó un cribado de T21 mediante CC1.erT. La cobertura del programa fue del 95,1% de las gestantes. Se detectó a 81 gestaciones afectados de T21. Las gestaciones afectadas de T21 a las que se les practicó un CC1.erT fueron 76. De ellas, 64 presentaron cribado positivo (VP) y 12 cribado negativo, constituyendo el grupo de FN 11 afectados, al excluirse una gestante por tratarse de una gestación gemelar. En la figura 1 se recoge el diagrama de flujo con los resultados del programa.
Diagrama de flujo con los resultados del estudio.
a Son los verdaderos positivos (VP) del cribado combinado de primer trimestre (CC1.erT).
b Son los falsos negativos (FN) del CC1.erT. De los 12 casos FN, se excluye uno por tratarse de una gestación gemelar. El grupo FN queda constituido por 11 afectados de gestaciones simples con CC1.erT negativo. De estos, 10 fueron detectados mediantes la ecografía morfológica de la semana 20 (ECO20).
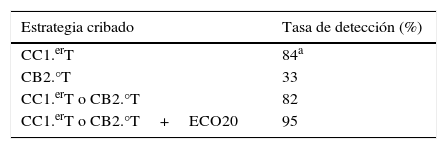
Se han podido cerrar con un resultado gestacional el 93% de los casos. La TD para el CC1.erT fue del 84%, con una TFP del 4,6%. En la tabla 1 se muestran las TD de las distintas estrategias de cribado del programa de cribado de aneuploidías.
Tasas de detección para las distintas estrategias del Programa de cribado de cromosomopatías del estudio
| Estrategia cribado | Tasa de detección (%) |
|---|---|
| CC1.erT | 84a |
| CB2.°T | 33 |
| CC1.erT o CB2.°T | 82 |
| CC1.erT o CB2.°T+ECO20 | 95 |
CB2.°T: cribado bioquímico de segundo trimestre; CC1.erT: cribado combinado de primer trimestre; ECO20: ecografía morfológica de la semana 20.
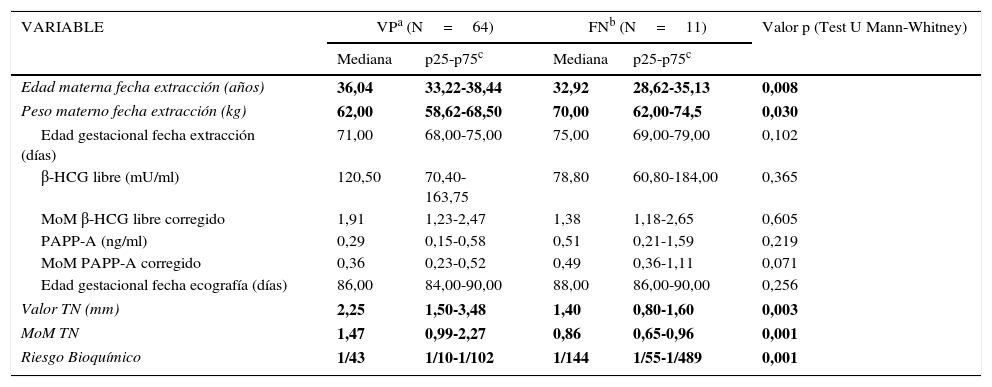
La estadística descriptiva de las variables estudiadas en el grupo de FN y VP se resume en la tabla 2. Si analizamos las medianas de las variables en el grupo de FN, se observa una edad materna menor, mayor peso materno, realización de la extracción analítica para marcadores bioquímicos con edad gestacional ligeramente más tardía y edad gestacional en el momento de la datación ecográfica muy similar a la de los VP. Con respecto a los marcadores, los FN presentan tanto en unidades de medida como en MoM corregidos valores de β-HCG libre y TN inferiores y PAPP-A más elevadas. Lógicamente, en el grupo de FN, los riesgos bioquímicos son menores.
Variables analizadas en el estudio
| VARIABLE | VPa (N=64) | FNb (N=11) | Valor p (Test U Mann-Whitney) | ||
|---|---|---|---|---|---|
| Mediana | p25-p75c | Mediana | p25-p75c | ||
| Edad materna fecha extracción (años) | 36,04 | 33,22-38,44 | 32,92 | 28,62-35,13 | 0,008 |
| Peso materno fecha extracción (kg) | 62,00 | 58,62-68,50 | 70,00 | 62,00-74,5 | 0,030 |
| Edad gestacional fecha extracción (días) | 71,00 | 68,00-75,00 | 75,00 | 69,00-79,00 | 0,102 |
| β-HCG libre (mU/ml) | 120,50 | 70,40-163,75 | 78,80 | 60,80-184,00 | 0,365 |
| MoM β-HCG libre corregido | 1,91 | 1,23-2,47 | 1,38 | 1,18-2,65 | 0,605 |
| PAPP-A (ng/ml) | 0,29 | 0,15-0,58 | 0,51 | 0,21-1,59 | 0,219 |
| MoM PAPP-A corregido | 0,36 | 0,23-0,52 | 0,49 | 0,36-1,11 | 0,071 |
| Edad gestacional fecha ecografía (días) | 86,00 | 84,00-90,00 | 88,00 | 86,00-90,00 | 0,256 |
| Valor TN (mm) | 2,25 | 1,50-3,48 | 1,40 | 0,80-1,60 | 0,003 |
| MoM TN | 1,47 | 0,99-2,27 | 0,86 | 0,65-0,96 | 0,001 |
| Riesgo Bioquímico | 1/43 | 1/10-1/102 | 1/144 | 1/55-1/489 | 0,001 |
En negrita se presentan las variables cuyas medianas presentan diferencias estadísticamente significativas entre ambos grupos (p<0,05).
Al realizar la comparación de medianas de cada una de las variables entre ambos grupos se observa que existen diferencias significativas en las variables: edad y peso materno en fecha de la extracción y valor de TN, tanto en unidades de medida como en MoM corregido. La diferencia en el MoM corregido de PAPP-A se encuentra en el límite de la significación estadística (p=0,07).
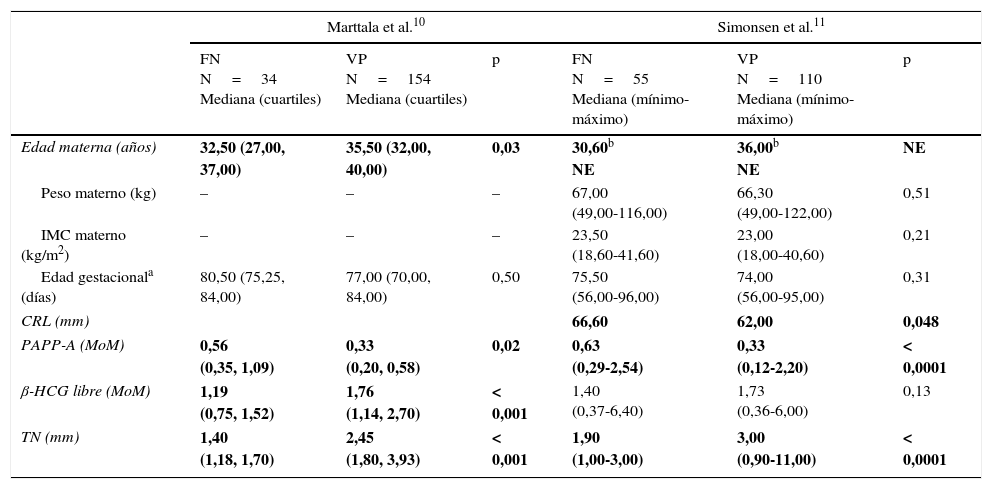
DiscusiónEl riesgo previo de una gestación junto con el riesgo determinado por los marcadores medidos condiciona el riesgo final para que el feto presente una anomalía cromosómica. La edad materna es el factor de mayor impacto en ese riesgo previo. Fue Shuttleworth8 en 1909 quien citó por primera vez la edad materna avanzada como factor de riesgo para la aparición T21. El riesgo previo aumenta progresivamente con la edad, pero lo hace de forma lineal hasta los 30 años y de forma exponencial a partir de ese momento. Dicho riesgo a los 30 años es de 1/1.000, mientras a que a los 35 es de 1/3009. Es interesante observar cómo en nuestro estudio la mediana de edad materna es menor en los FN (32,9 años) con respecto a la de los verdaderos afectados (36 años), siendo esta diferencia estadísticamente significativa (p=0,008). Estos resultados son concordantes con los obtenidos en estudios publicados por Marttala et al.10 y Simonsen et al.11, en los que analizan las características de los FN de sus programas de CC1.erT y que se muestran en la tabla 3. La diferencia de 3 años que se observa en los 2 grupos de gestantes de nuestro estudio, aunque pueda parecer reducida, al estar en esa zona crítica (30-35 años) creemos que tiene influencia en la aparición de esos resultados erróneos.
| Marttala et al.10 | Simonsen et al.11 | |||||
|---|---|---|---|---|---|---|
| FN N=34 Mediana (cuartiles) | VP N=154 Mediana (cuartiles) | p | FN N=55 Mediana (mínimo-máximo) | VP N=110 Mediana (mínimo-máximo) | p | |
| Edad materna (años) | 32,50 (27,00, 37,00) | 35,50 (32,00, 40,00) | 0,03 | 30,60b NE | 36,00b NE | NE |
| Peso materno (kg) | – | – | – | 67,00 (49,00-116,00) | 66,30 (49,00-122,00) | 0,51 |
| IMC materno (kg/m2) | – | – | – | 23,50 (18,60-41,60) | 23,00 (18,00-40,60) | 0,21 |
| Edad gestacionala (días) | 80,50 (75,25, 84,00) | 77,00 (70,00, 84,00) | 0,50 | 75,50 (56,00-96,00) | 74,00 (56,00-95,00) | 0,31 |
| CRL (mm) | 66,60 | 62,00 | 0,048 | |||
| PAPP-A (MoM) | 0,56 (0,35, 1,09) | 0,33 (0,20, 0,58) | 0,02 | 0,63 (0,29-2,54) | 0,33 (0,12-2,20) | < 0,0001 |
| β-HCG libre (MoM) | 1,19 (0,75, 1,52) | 1,76 (1,14, 2,70) | < 0,001 | 1,40 (0,37-6,40) | 1,73 (0,36-6,00) | 0,13 |
| TN (mm) | 1,40 (1,18, 1,70) | 2,45 (1,80, 3,93) | < 0,001 | 1,90 (1,00-3,00) | 3,00 (0,90-11,00) | < 0,0001 |
En negrita se presentan las variables cuyas medianas presentan diferencias estadísticamente significativas entre ambos grupos.
β-HCG libre: fracción β libre de la gonadotropina coriónica humana; CRL: longitud cráneo caudal; FN: falsos negativos; IMC: índice de masa corporal; NE: no especificado; PAPP-A: proteína plasmática asociada al embarazo, TN: translucencia nucal; VP: verdaderos positivos.
Los MoM de los marcadores bioquímicos deben ser corregidos por distintos factores maternos, como peso y etnia, hábitos como el tabaquismo o enfermedades como la diabetes mellitus. El peso materno es el factor de corrección más determinante para las concentraciones séricas de los marcadores mencionados, debido al efecto de dilución provocado por el mayor volumen sanguíneo. La infravaloración del peso corporal condiciona un aumento de los FP y la sobrevaloración un aumento de los FN. Distintas estimaciones indican que un error en la valoración del peso de la gestante de 2,3 kg modificará el MoM de PAPP-A corregido en un 5%12. En nuestro estudio, podemos observar cómo pequeñas diferencias de peso, como las observadas entre los 2 grupos de gestantes, 62 kg en los VP frente a 70 kg en los FN, además de ser estadísticamente significativas (p=0,03), podrían tener también cierta influencia en la génesis del error en el resultado del cribado. Nuestros resultados se aproximan a lo hallado por Huang et al.12, donde se observa en el grupo de gestantes con un riesgo final entre 1/301-1/350 como el riesgo final cambió de positivo a negativo en 28 de 42 gestantes (66,7%) al incrementar el peso 6,8kg. Por ello, es esencial conocer el peso correcto de la gestante en el momento de la extracción sanguínea y disponer de una ecuación de corrección por peso ajustada a la población que está siendo cribada.
La edad gestacional en el momento de la extracción es otro factor que condiciona la validez de los resultados finales de un programa de cribado. El poder de discriminación de los marcadores bioquímicos entre gestaciones con feto afectado y no afectado es máximo en el entorno de la semana 1013,14. Kirkegaard et al.13 observaron que la TD de CC1.erT era estadísticamente mayor cuando la determinación de los marcadores bioquímicos se realizaba antes de la semana 10+0 (TD=100%) que cuando se realizaba después de la semana 10+0 (TD=77%). En la misma línea, Kuc et al.14 observaron un 84% de TD cuando la extracción se realizaba en la semana de gestación menor de 11+0 frente al 73% en el grupo donde se realizó en la semana igual o mayor a 11+0. En nuestro caso, las medianas de las edades gestacionales de ambos grupos se encuentran en este punto recomendado y además la diferencia entre ellas es reducida (10 semanas y 5 días en los FN frente a las 10 semanas y 1 día en los VP). A nuestro juicio, esa diferencia, además de no ser estadísticamente significativa, tendría una mínima repercusión en el proceso de cálculo del riesgo.
El comportamiento de los marcadores bioquímicos en el caso de gestaciones afectadas de T21 se caracteriza por concentraciones plasmáticas disminuidas de PAPP-A y elevadas de β-HCG libre con respecto a lo que correspondería a una determinada edad gestacional15,16. En el caso de los FN, podemos observar un patrón con mediana de concentraciones séricas de PAPP-A elevadas (0,51ng/ml en FN frente 0,29ng/ml en VP; p=0,219) y descendidas en el caso de la β-HCG libre (78,8 mU/ml en FN frente 120,5 mU/ml en VP; p=0,365) siempre respecto de los VP. Este patrón favorece la infravaloración de los riesgos y la aparición de FN. En cualquier caso, siempre se debe valorar el comportamiento de estos marcadores bioquímicos, PAPP-A y β-HCG libre, en función de sus MoM corregidos, ya que soslayamos la influencia de elementos como la edad gestacional en el momento de la extracción o ciertas características individuales de la gestante (etnia, hábitos, etc.). En este sentido, en nuestro estudio encontramos el patrón de mayor mediana de MoM corregido de PAPP-A (0,49 en FN frente 0,36 en VP; p=0,071) con menor mediana de MoM corregido de β-HCG libre en el grupo de FN con respecto los VP (1,38 en FN frente 1,91 en VP; p=0,605). Aun no habiéndose observado diferencias con significación estadística en dichos resultados, estos coinciden con los encontrados en los estudios de Marttala et al.10 y Simonsen et al.11, reflejados en la tabla 3. El comportamiento anómalo de los marcadores bioquímicos en estas gestaciones con resultado FN tiene un carácter excepcional, ya que dichos FN son escasos y podrían explicarse por razones analíticas y/o extraanalíticas. Dentro de las primeras podríamos citar todas las causas de errores aleatorios en las determinaciones analíticas, como sería, por ejemplo, un problema de pipeteo que hubiese afectado a esa muestra concreta. Entre los motivos extraanalíticos, citaríamos, entre otros, una mala conservación de la muestra, pues es conocido que la temperatura afecta a la proporción de la fracción libre de la β-HCG17.
Con respecto a las características ecográficas, lo primero que se debe destacar es que las medianas de las edades gestacionales en el momento de la ecografía son muy similares en ambos grupos (12+4 semanas en FN frente 12+2 semanas en VP; p=0,256). Esto nos indica que la datación de la edad gestacional, mediante la medición del CRL, se efectuó de forma correcta. Si hubiese existido una diferencia importante en esta variable, podríamos inferir la posibilidad de un error en la datación ecográfica en los FN, que lógicamente sesgaría el cálculo de los MoM de los marcadores, tanto bioquímicos como ecográficos18. En los FN, la mediana de la TN está descendida de forma significativa tanto en su medida directa (1,4mm en FN frente 2,25mm en VP; p=0,003), como en su transformación en MoM (0,86 en FN frente 1,47 en VP; p=0,001). Estos resultados también coinciden con los descritos en los estudios publicados por Marttala et al.10 y Simonsen et al.11. La TN es el marcador con más influencia a la hora de calcular el riesgo final de aneuploidía, por tanto, un valor erróneamente bajo dificulta enormemente la posibilidad de obtener un riesgo positivo en una gestación afectada19-21. Factores de diverso origen influyen en la obtención de unas medidas adecuadas de TN: origen materno (deficiente visualización por obesidad, cirugía previa) o fetal (posición fetal). También el uso de una técnica incorrecta de medición o el empleo de ecógrafos de resolución inadecuada pueden afectar a su medición. La infra o sobreestimación de la medida de la TN tiene un impacto importante en la valoración del riesgo de cromosomopatías. Su infraestimación se traduce en una disminución de la TD y, por tanto, en un posible aumento de los casos de recién nacidos con T21 sin diagnosticar (FN). Su sobreestimación supone un aumento de los FP, que se traduce en un aumento de realización de procedimientos invasivos innecesarios, con el consecuente riesgo secundario de pérdidas fetales. En nuestra serie, una parte significativa de los resultados FN tienen un importante componente ecográfico, en concreto un 60% de los afectados no detectados tienen un riesgo bioquímico claramente positivo. Es conocida la tendencia a infravalorar la TN20, por tanto su correcta medición es un elemento esencial en la calidad del resultado final del CC1.erT. Es imprescindible optimizar la medición de la TN; para ello, uno de los requisitos fundamentales es una auditoría de los resultados que permita un control de la calidad global e individual por ecografista.
Entre las limitaciones de nuestro estudio se encuentran el pequeño y desigual tamaño de ambos grupos objeto de estudio y que no hemos evaluado otros factores con influencia sobre el cálculo del riesgo: etnia, consumo de tabaco, técnica de reproducción asistida o la presencia de diabetes mellitus y, por tanto, no podemos obtener conclusiones al respecto.
En conclusión, en nuestro estudio existen diferencias significativas entre los grupos FN y VP en la edad y peso materno y la TN, con significación estadística límite en el caso de los MoM corregidos de PAPP-A. Estos 2 últimos marcadores, en especial la TN, tienen alto peso en los algoritmos de cálculo de riesgo de aneuploidías. Por ello debemos asegurar la calidad de la medida de los mismos. La edad materna determina el riesgo previo, que condiciona notablemente el resultado final, por tanto, es significativo que los FN aparezcan en gestantes más jóvenes.
Aunque las diferencias en algunas de las variables estudiadas hayan resultado con baja significación estadística, es indudable que el resultado final de un cribado está condicionado por múltiples factores, que, aunque no determinantes, influyen, a nuestro juicio, en la aparición de estos FN. En nuestro caso, el perfil de una gestante con resultado FN para CC1.erT sería el de una gestante joven (menor de 35 años), con sobrevaloración del peso, extracción sanguínea realizada en momento adecuado, edad gestacional correctamente estimada por la medición del CRL y en la que se ha podido producir alguna desviación en la medidas de los marcadores, sobre todo una infravaloración de la TN y, en menor medida, una sobrevaloración de la PAPP-A.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.