La hipercolesterolemia familiar (HF) infantil está infradiagnosticada y su diagnóstico no es fácil en la práctica clínica. El objetivo fue evaluar qué características clínicas, bioquímicas y de imagen vascular pueden ayudarnos a detectar a niños/as y adolescentes con hipercolesterolemia afectados de HF.
MétodosDoscientos veintidós niños y adolescentes de entre 4 y 18 años fueron reclutados para participar en un proyecto de detección precoz de HF (proyecto DECOPIN). La HF se diagnosticó por criterios genéticos o clínicos. Se definió hipercolesterolemia poligénica (HP) cuando el c-LDL >135mg/dl pero sin criterios clínicos ni genéticos de HF. Participantes con c-LDL < 135mg/dl se incluyeron en el grupo control (GC). Se recogieron la historia familiar, los datos antropométricos y las variables clínicas. Se analizaron parámetros bioquímicos y lipídicos. Se determinó el grosor íntima-media carotídeo (GIMc) y los tendones de Aquiles por ecografía.
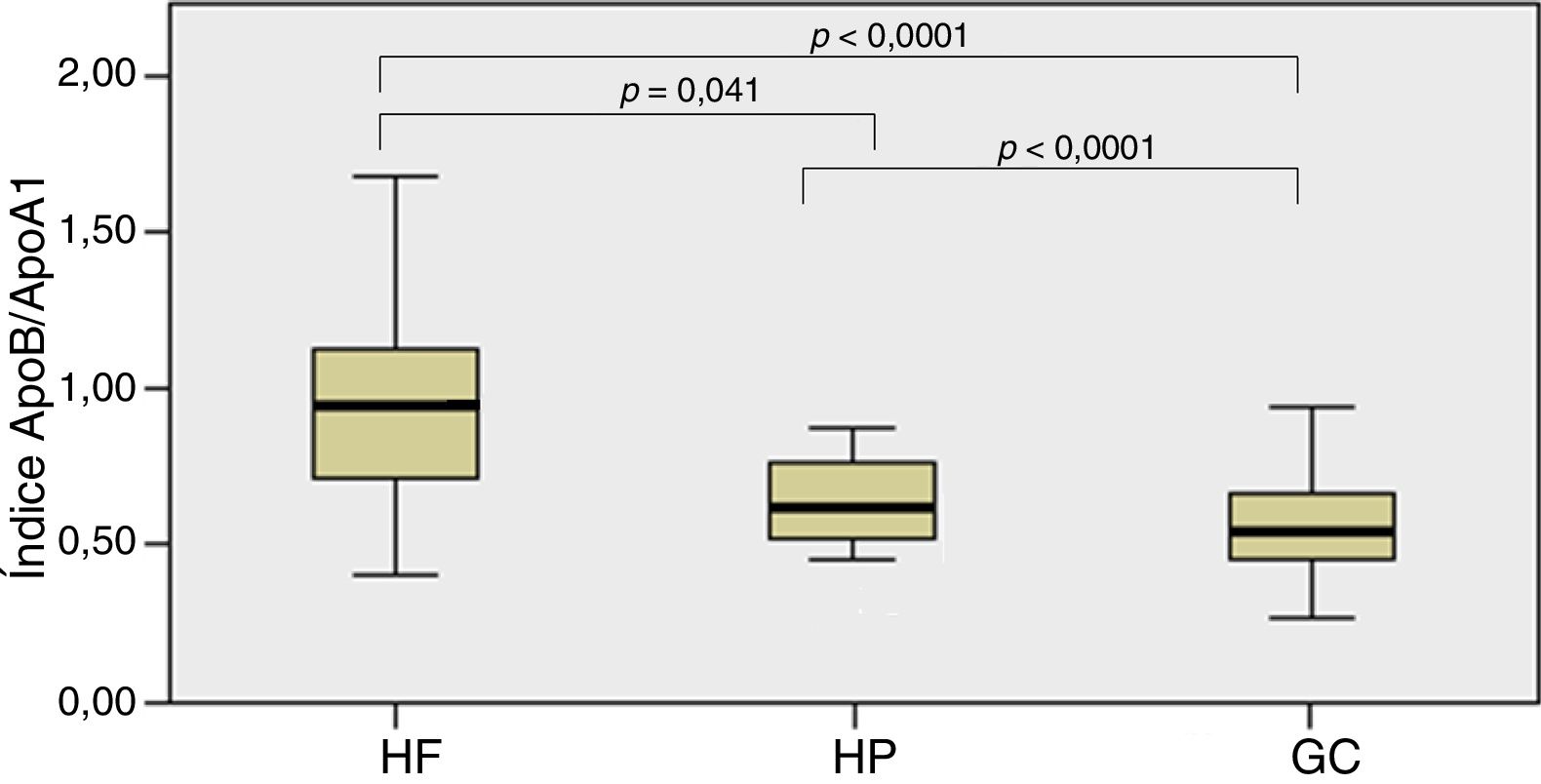
ResultadosNoventa y un niños fueron diagnosticados de HF y 23 de HP, y 108 como GC. El grupo HF presentó mayores concentraciones de CT, c-LDL, índice ApoB/ApoA1 e índice colesterol año. El c-HDL fue menor en grupo HF que en el GC. Si bien el c-LDL fue el parámetro más definitorio de HF, el índice ApoB/ApoA1 > 0,82 fue el que de forma aislada mostró mayor sensibilidad y especificad para predecir la presencia de mutación en el grupo de niños HF. El grosor de los tendones de Aquiles no mostró diferencias entre grupos. El GIMc fue mayor en los niños HF sin diferencias significativas.
ConclusionesLos niveles de c-LDL son el marcador de HF. Un índice ApoB/ApoA1 > 0,82 puede ser una herramienta útil para decidir el estudio genético en niños con sospecha de HF.
Familial hypercholesterolaemia (FH) in children is under-detected and is difficult to diagnose in clinical practice. The aim of this study was to evaluate clinical, biochemical and vascular imaging variables in order to detect children and adolescents with FH.
MethodsA total of 222 children aged 4-18 years old were recruited to participate in a project for the early detection of FH (The DECOPIN Project). They were distributed into 3groups: FH, if genetic study or clinical criteria were positive (n=91); Polygenic hypercholesterolaemia (PH) if LDL-Cholesterol >135mg/dL without FH criteria (n=23), and Control group (CG) if LDL-C <135mg/dL (n=108). Data were collected from family history, anthropometric data, and clinical variables. The usual biochemical parameters, including a complete lipid profile were analysed. The carotid intima-media thickness (cIMT) and thickness of Achilles tendons were determined using ultrasound in all participants.
ResultsA total of 91 children had a diagnosis of FH, 23 with PH, and 108 with CG. Children with FH had higher concentrations of total cholesterol, LDL-C, ApoB/ApoA1 ratio, and cholesterol-year score, than the other groups. HDL-C was lower in the FH group than in the CG. Thickness of the Achilles tendon and cIMT did not show any differences between groups, although a greater cIMT trend was observed in the FH group. ApoB/ApoA1 ratio >0.82 was the parameter with the highest sensitivity and specificity to predict the presence of mutation in children with FH.
ConclusionsAlthough LDL-C is the main biochemical parameter used to define FH, the ApoB/ApoA1 ratio (>0.82) may be a useful tool to identify children with FH and a positive mutation.
La hipercolesterolemia familiar (HF) es el trastorno monogénico más común. Se puede presentar de 2formas, la homocigota (HFHo) y la heterocigota (HFHe). La HFHo tiene una prevalencia de 1/160.000-300.000 según datos publicados en población europea1. En España, datos recientes estiman una prevalencia de 1/450.0002. En los últimos estudios en población europea se establece que la prevalencia de la HFHe oscila entre 1/200-2501. La prevalencia en población española con fenotipo de HFHe en menores de 18 años es de 1/2173. En un reciente metaanálisis en población infantil en menores de 19 años se observó una prevalencia de HFHe 1/2794.
La HF es un trastorno autosómico dominante, lo que significa que se puede transmitir con una probabilidad del 50% a la descendencia, pudiéndose detectar desde el nacimiento por la presencia de niveles elevados de colesterol total (CT). Los niños afectados de HF llegan a tener hasta 3veces más elevadas las concentraciones plasmáticas de lipoproteínas de baja densidad (c-LDL) que los niños no afectados5. Esta enfermedad está causada mayoritariamente por mutaciones en el gen que codifica el receptor del c-LDL (RLDL). En menor proporción, se han descrito defectos en el gen que codifica la apolipoproteína B (APOB) y en el gen que codifica proprotein convertase subtilisin-kexin type 9 (PCSK9). Se expresan clínicamente de la misma forma y solo el estudio genético nos permitirá diferenciarlas. Sin embargo, en la actualidad, en el 5-30% de los casos con fenotipo de HF no se identifica el gen causal de esta patología6. Los adultos jóvenes (20 a 39 años) diagnosticados de HF tienen 100 veces más riesgo de presentar un episodio coronario prematuro que la población no afectada. La arteriosclerosis en la HF se inicia a edades tempranas de la vida7, por lo que la detección y su diagnóstico son prioritarios para poder iniciar, de la forma más precoz posible, las recomendaciones sobre hábitos de vida saludables y, en su caso, el tratamiento farmacológico. Ello va a contribuir de forma decisiva a la disminución de la enfermedad cardiovascular prematura (ECVP), característica de esta población. A pesar de las múltiples evidencias de los beneficios de un diagnóstico precoz, la implementación de estrategias de detección sigue siendo un tema pendiente. Solo en Eslovenia se aplica el cribado universal en la población infantil8. Los consensos de expertos no siempre caminan en la misma línea. La edad ideal para el diagnóstico es entre los 8-10 años; sin embargo, en nuestro país no hay una política de detección establecida. La realidad actual es que, en la mayoría de los casos, la detección se realiza por cribado en cascada directa o bien por detección oportunista9.
La sospecha diagnóstica en pacientes con edades inferiores a los 18 años se establece ante niveles de c-LDL > 130mg/dl (percentil 90, en población española)10, junto con los antecedentes de hipercolesterolemia severa en un progenitor o bien antecedentes de ECVP en familiares de primer o segundo grado. Dado que no siempre es posible realizar el estudio genético, en la práctica clínica sería ideal disponer de biomarcadores que nos permitieran diferenciar la hipercolesterolemia de origen monogénico de la poligénica.
El objetivo del presente estudio fue evaluar qué características clínicas, bioquímicas y de imagen vascular pueden ayudarnos a diferenciar los niños/as y adolescentes con hipercolesterolemia poligénica (HP) de los afectados de HF.
Sujetos y métodosDiseño del estudioEstudio transversal del Programa para la Detección de la Hipercolesterolemia Familiar en Población Infantil (proyecto DECOPIN). Se ha incluido a un total de 222 niños/as y adolescentes con edades comprendidas entre los 4 y los 18 años. Se han aplicado 3tipos de estrategia de detección: la oportunista, la cascada inversa y la cascada directa. Para implementar el cribado oportunista se organizó una campaña informativa para los pediatras, invitándolos a participar en el proyecto. Los criterios de detección fueron aplicados por la Atención Primaria pediátrica en niños/as y adolescentes de 4 a 14 años. Los niños con sospecha de HF fueron reevaluados por la Unidad de Endocrinología Pediátrica y, a su vez, remitidos a la Unitat de Medicina Vascular i Metabolisme (UVASMET) del Hospital Universitari Sant Joan (Reus, Tarragona) para realizar el diagnóstico genético. A los niños/as detectados de forma oportunista con sospecha de HF se les aplicó el estudio en cascada inversa si reunían los siguientes criterios: c-LDL > 135mg/dL en al menos 2determinaciones y antecedentes de ECVP en familiares de primer o segundo grado o hipercolesterolemia severa (CT > 300mg/dl) en uno de los progenitores o progenitores desconocidos. Cuando un niño/a reunía los criterios de sospecha de HF se procedía al estudio de sus progenitores. A los padres se les aplicaron los criterios clínicos de la Red de Clínicas de Lípidos Holandesa (DLCN) para el diagnóstico de la HF y se realizó el estudio genético a los que tenían una puntuación superior o igual a 8. En caso de positividad, el estudio genético se realizaba al niño/a1 y a sus hermanos, si los hubiera, independientemente de sus cifras de c-LDL.
La cascada directa se aplicó a los niños/as y adolescentes de 4-18 años, hijos de pacientes diagnosticados de HF en nuestra Unidad. Cuando el estudio genético fue positivo en el progenitor, también se realizó en los hijos. Si el resultado genético era negativo en el progenitor, no se realizaba en el niño/a.
El Comité de Ética del Hospital Universitari Sant Joan aprobó el estudio. Los padres o representantes legales dieron su consentimiento por escrito. También se solicitó el consentimiento para realizar el estudio genético en caso necesario. El protocolo del estudio cumplió con la normativa ética de la Declaración de Helsinki de 1975.
PacientesDoscientos veintidós niños/as y adolescentes, de edades comprendidas entre los 4 y los 18 años, se incluyeron en el proyecto DECOPIN entre marzo del 2013 y junio del 2017.
La población de estudio fue dividida en 3grupos:
- -
Niños/as con HF: portadores de la mutación o niños con c-LDL > 135mg/dl y progenitor con diagnóstico de HF por criterios DLCN con puntuación ≥ 8, independientemente del resultado genético.
- -
Niños/as con HP: c-LDL > 135mg/dl pero sin diagnóstico ni clínico ni genético de HF en los progenitores.
- -
Niños/as control (grupo control [GC]): niños con c-LDL < 135mg/dl.
Se excluyó a aquellos niños/as con hipercolesterolemias secundarias: hipotiroidismo, enfermedades renales, enfermedades hepáticas o con otras enfermedades crónicas y los afectados de HFHo.
Anamnesis y exploración físicaSe realizó una historia clínica personal, incluyendo antecedentes familiares de ECVP y dislipidemia en familiares de primer y segundo grado. En la exploración física se recogieron los datos antropométricos. Para calcular el IMC se utilizó el IMCScore (IMC en niños/as-IMC percentil 50 de las curvas de crecimiento de Orbegozo/DS percentil 50 de las curvas de crecimiento de Orbegozo11). Se evaluaron los hábitos alimentarios, así como la actividad física. Se buscaron de forma específica estigmas de dislipidemia en todos los niños/as. Se examinó a los 2progenitores de los niños/as procedentes de la detección oportunista para detectar la presencia de arco corneal, xantomas tendinosos y xantelasmas.
Análisis bioquímico y perfil lipídicoNinguno de los niños/as evaluados había sido tratado con fármacos hipolipidemiantes. Tras al menos 8 h de ayuno, se realizó una extracción de sangre a todos los participantes. Los parámetros bioquímicos y lipídicos y las lipoproteínas se determinaron mediante métodos enzimáticos, colorimétricos e inmunoturbidimétricos, que fueron adaptados a un autoanalizador Cobas Modular 700 (Roche®, Basel, Suiza).
El c-LDL fue calculado aplicando la fórmula de Friedewald. Se calculó el índice colesterol años (c-LDL×años), así como el índice ApoB/ApoA1. Se descartó la presencia de proteinuria.
Estudio genéticoLa presencia de mutaciones se estudió mediante el test genético Liponext que detecta de forma selectiva mutaciones en LDLR, APOB, PCSK9 y grandes reordenamientos. Utiliza una herramienta de secuenciación genética (SEQPRO LIPO RS® [Progenika Pharma]).
Estudio ecográficoSe llevó a cabo en la UVASMET del Hospital Universitari Sant Joan. Se realizó con un ecógrafo «MyLab 60-X Vision Ultrasound» (Esaote, Génova, Italia). Se utilizó una sonda lineal de 7,5-10MHz con un software semiautomático. Las imágenes fueron obtenidas por el mismo operador para reducir la variabilidad del observador12.
a. Determinación del grosor íntima media carotídeoEl grosor íntima media carotídeo (GIMc) se determinó por un método semiautomático con imágenes en vivo y por radiofrecuencia. Se obtuvieron imágenes de la pared posterior de la arteria carótida común, a 1cm proximal a la bifurcación carotídea. El GIMc final es el resultado de la media de ambos GIMc de las carótidas comunes.
b. Determinación del grosor del tendón de AquilesPara la determinación de esta variable, los participantes en posición en decúbito prono y con los pies en un ángulo de flexión de 90°, con una sonda de alta resolución colocada en perpendicular al tendón a 2cm de la zona proximal de inserción del calcáneo. Se realizaron 3mediciones en la zona de máximo grosor del tendón separadas de 0,5cm entre ellas. El grosor del tendón de Aquiles de cada pie es el resultado de la media de las 3mediciones. También se revisó la presencia de xantomas.
Análisis estadísticoLa descripción de las variables se presenta mediante los estadísticos estándar, incluyendo media y desviación estándar (DE) para las variables normales y mediana, y rango intercuartílico (RI) para las variables no normales. Las frecuencias se presentan en porcentaje. Se estudió la distribución normal de las variables continuas por el test de Kolmogorov-Smirnov. Para las variables categóricas y las comparaciones de frecuencias entre grupos se utilizó la prueba de la chi al cuadrado. Para comparar las variables continuas entre grupos y con distribución normal se analizó mediante el test de la t de Student o ANOVA con prueba post hoc Bonferroni, y para las no normales el test U de Mann-Whitney o el test Kruskall-Wallis. Para poder asociar las variables se realizaron correlaciones de Pearson o Spearman entre variables continuas de distribución normal o no normal, respectivamente. El análisis multivariante se realizó con regresiones logísticas o lineales, dependiendo de si las variables eran dicotómicas o continuas. Se generaron curvas ROC (acrónimo de las siglas en inglés: receiver operating characteristic curve) y se calculó el área bajo la curva (AUC) para evaluar la capacidad de identificar a los niños/as HF con o sin mutación. La significación estadística se consideró con p < 0,05.
El análisis estadístico se ejecutó con el programa de tratamiento estadístico SPSS 22.0 para Windows (SPSS, IBM®, Chicago, IL).
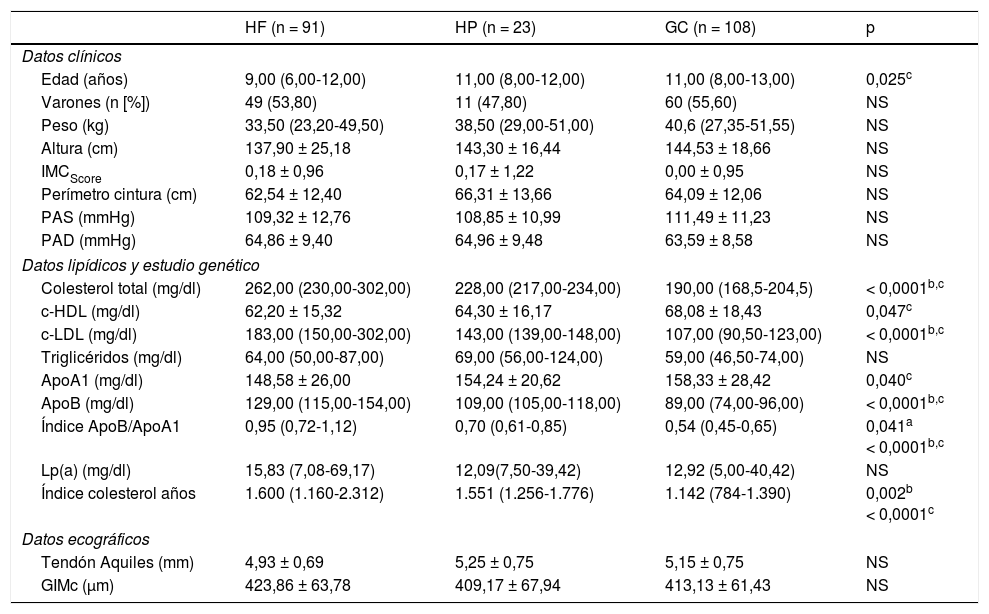
ResultadosA través del proyecto DECOPIN fueron incluidos un total de 222 niños/as y adolescentes, de los cuales 91 fueron diagnosticados de HF (53 mediante cascada directa y 38 por cascada inversa) y 23 de HP, y 108 como GC. En la tabla 1 se describen las características basales de la población estudiada distribuida según diagnóstico. Las variables clínicas estudiadas no mostraron diferencias estadísticamente significativas, excepto en la edad entre el grupo HF y GC (p = 0,025). En el perfil lipídico se observaron diferencias estadísticamente significativas entre el GC respecto al grupo HF y HP con el CT, c-LDL, ApoB e índice colesterol-años (p < 0,0001), que también mostró diferencias entre HF y HP (p = 0,002). Se observó una menor concentración de c-HDL en el grupo HF con relación al GC (p = 0,047). La medición del tendón de Aquiles y del GIMc no mostró diferencias estadísticamente significativas entre grupos. Aunque en el GIMc sí se observó una tendencia superior en el grupo HF respecto a los otros 2grupos. En 66 niños/as con HF, el estudio genético fue positivo (92,5% con mutación en RLDL, 3,0% en APOB y 4,5% en PCSK9). El resto de los parámetros bioquímicos analizados en sangre y en orina no mostraron diferencias significativas entre grupos (datos no mostrados).
Datos de la población estudiada distribuida según diagnóstico
| HF (n = 91) | HP (n = 23) | GC (n = 108) | p | |
|---|---|---|---|---|
| Datos clínicos | ||||
| Edad (años) | 9,00 (6,00-12,00) | 11,00 (8,00-12,00) | 11,00 (8,00-13,00) | 0,025c |
| Varones (n [%]) | 49 (53,80) | 11 (47,80) | 60 (55,60) | NS |
| Peso (kg) | 33,50 (23,20-49,50) | 38,50 (29,00-51,00) | 40,6 (27,35-51,55) | NS |
| Altura (cm) | 137,90 ± 25,18 | 143,30 ± 16,44 | 144,53 ± 18,66 | NS |
| IMCScore | 0,18 ± 0,96 | 0,17 ± 1,22 | 0,00 ± 0,95 | NS |
| Perímetro cintura (cm) | 62,54 ± 12,40 | 66,31 ± 13,66 | 64,09 ± 12,06 | NS |
| PAS (mmHg) | 109,32 ± 12,76 | 108,85 ± 10,99 | 111,49 ± 11,23 | NS |
| PAD (mmHg) | 64,86 ± 9,40 | 64,96 ± 9,48 | 63,59 ± 8,58 | NS |
| Datos lipídicos y estudio genético | ||||
| Colesterol total (mg/dl) | 262,00 (230,00-302,00) | 228,00 (217,00-234,00) | 190,00 (168,5-204,5) | < 0,0001b,c |
| c-HDL (mg/dl) | 62,20 ± 15,32 | 64,30 ± 16,17 | 68,08 ± 18,43 | 0,047c |
| c-LDL (mg/dl) | 183,00 (150,00-302,00) | 143,00 (139,00-148,00) | 107,00 (90,50-123,00) | < 0,0001b,c |
| Triglicéridos (mg/dl) | 64,00 (50,00-87,00) | 69,00 (56,00-124,00) | 59,00 (46,50-74,00) | NS |
| ApoA1 (mg/dl) | 148,58 ± 26,00 | 154,24 ± 20,62 | 158,33 ± 28,42 | 0,040c |
| ApoB (mg/dl) | 129,00 (115,00-154,00) | 109,00 (105,00-118,00) | 89,00 (74,00-96,00) | < 0,0001b,c |
| Índice ApoB/ApoA1 | 0,95 (0,72-1,12) | 0,70 (0,61-0,85) | 0,54 (0,45-0,65) | 0,041a < 0,0001b,c |
| Lp(a) (mg/dl) | 15,83 (7,08-69,17) | 12,09(7,50-39,42) | 12,92 (5,00-40,42) | NS |
| Índice colesterol años | 1.600 (1.160-2.312) | 1.551 (1.256-1.776) | 1.142 (784-1.390) | 0,002b < 0,0001c |
| Datos ecográficos | ||||
| Tendón Aquiles (mm) | 4,93 ± 0,69 | 5,25 ± 0,75 | 5,15 ± 0,75 | NS |
| GIMc (μm) | 423,86 ± 63,78 | 409,17 ± 67,94 | 413,13 ± 61,43 | NS |
Datos expresados como media ± DE para las variables que siguen una distribución normal, media (RI) para las variables que no siguen una distribución normal y n (%) para variables categóricas.
El test estadístico utilizado fue ANOVA (distribución normal), Kruskal-Wallis (distribución no normal) o chi al cuadrado (para datos categóricos).
Se consideró estadísticamente significativo un valor p<0,05.
ApoA1: apoproteína A1; ApoB: apoproteína B; c-HDL: colesterol HDL; c-LDL: colesterol LDL; GC: grupo control; GIMc: grosor íntima media carotídeo; HF: hipercolesterolemia familiar; HP: hipercolesterolemia poligénica; IMCScore: índice de masa corporal score; Lp(a): lipoproteína a; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
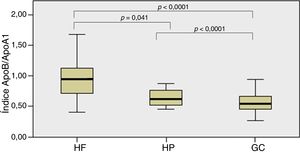
En la figura 1 se muestra el índice ApoB/ApoA1 entre grupos que detectó diferencias estadísticamente significativas entre el grupo HF y HP (p = 0,041) y entre estos 2grupos con el GC (p < 0,0001).
En la tabla 2 se recogen los datos de 81 familias con HF, incluyendo antecedentes de ECVP en familiares de primer y segundo grado, y los depósitos lipídicos en los progenitores afectados, así como su c-LDL medio basal y el porcentaje en los que se detectó la mutación.
Enfermedad cardiovascular prematura en familiares de primer y segundo grado en niños/as HF del total de 81 familias y exploración física del progenitor afecto de HF
| Familias HF, n (%) | |
|---|---|
| Datos familiares | |
| Enfermedad cardiovascular prematura | |
| Primer grado (%) | 10 (11,40) |
| Segundo grado (%) | 16 (18,20) |
| Arco corneal (%) | 34 (40,00) |
| Xantomas (%) | 34 (40,00) |
| c-LDL (mg/dl) | 251,16 ± 64,92 |
| Mutación (%) | 75,70 |
Datos expresados como media ± DE para las variables que siguen una distribución normal y n (%) para variables categóricas.
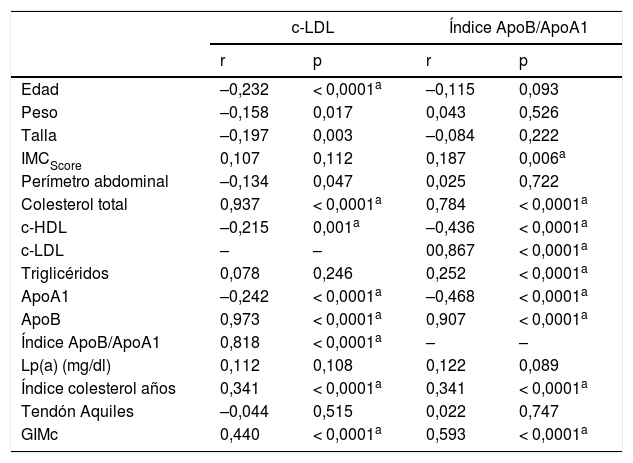
Se analizaron correlaciones bivariadas entre c-LDL y el índice ApoB/ApoA1 con las variables antropométricas, perfil lipídico y estudio ecográfico en las poblaciones estudiadas (tabla 3).
Correlaciones de las variables antropométricas, perfil lipídico y estudio ecográfico con C-LDL y Índice ApoB/ApoA1 en la población estudiada (n = 222)
| c-LDL | Índice ApoB/ApoA1 | |||
|---|---|---|---|---|
| r | p | r | p | |
| Edad | –0,232 | < 0,0001a | –0,115 | 0,093 |
| Peso | –0,158 | 0,017 | 0,043 | 0,526 |
| Talla | –0,197 | 0,003 | –0,084 | 0,222 |
| IMCScore | 0,107 | 0,112 | 0,187 | 0,006a |
| Perímetro abdominal | –0,134 | 0,047 | 0,025 | 0,722 |
| Colesterol total | 0,937 | < 0,0001a | 0,784 | < 0,0001a |
| c-HDL | –0,215 | 0,001a | –0,436 | < 0,0001a |
| c-LDL | – | – | 00,867 | < 0,0001a |
| Triglicéridos | 0,078 | 0,246 | 0,252 | < 0,0001a |
| ApoA1 | –0,242 | < 0,0001a | –0,468 | < 0,0001a |
| ApoB | 0,973 | < 0,0001a | 0,907 | < 0,0001a |
| Índice ApoB/ApoA1 | 0,818 | < 0,0001a | – | – |
| Lp(a) (mg/dl) | 0,112 | 0,108 | 0,122 | 0,089 |
| Índice colesterol años | 0,341 | < 0,0001a | 0,341 | < 0,0001a |
| Tendón Aquiles | –0,044 | 0,515 | 0,022 | 0,747 |
| GIMc | 0,440 | < 0,0001a | 0,593 | < 0,0001a |
El test estadístico utilizado fue correlación de Pearson (distribución normal) y de Spearman (distribución no normal) o chi al cuadrado (para datos categóricos).
Se consideró estadísticamente significativo un valor p < 0,05.
ApoA1: apoproteína A1; ApoB: apoproteína B; c-HDL: colesterol HDL; c-LDL: colesterol LDL; GIMc: grosor íntima media carotídeo; IMCScore: índice de masa corporal score; Lp(a): lipoproteína a.
Cabe destacar las correlaciones positivas estadísticamente significativas entre el índice ApoB/ApoA1 y el perfil lipídico completo, así como el GIMc (p = < 0,0001).
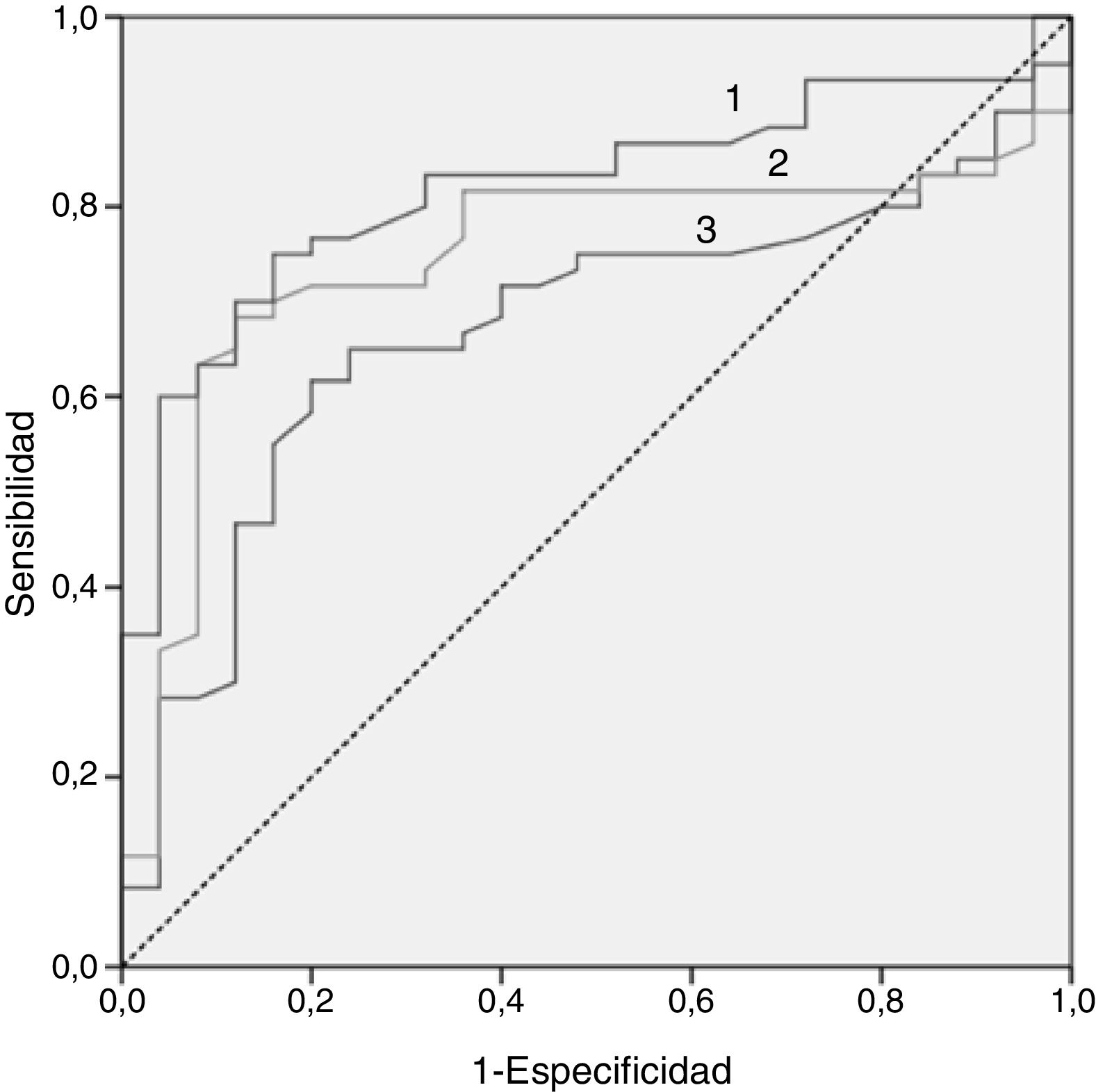
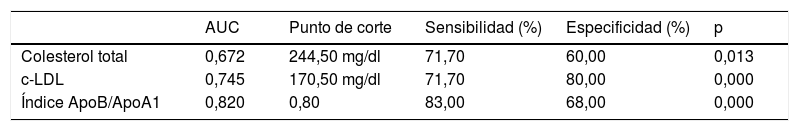
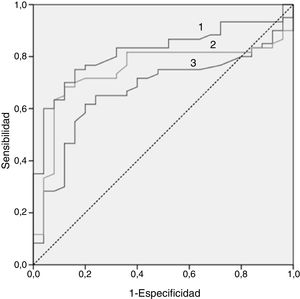
En la figura 2 se puede observar la curva ROC de los 3biomarcadores lipídicos que mejor nos permiten discriminar a la población infantil con HF con mutación positiva y negativa, siendo el mejor predictor el índice ApoB/ApoA1. En la tabla 4 se puede observar el punto de corte con su sensibilidad y especificidad.
Puntos de corte para los 3mejores biomarcadores por su capacidad discriminativa (sensibilidad y especificidad) para diferenciar entre población HF genéticamente positiva y negativa
| AUC | Punto de corte | Sensibilidad (%) | Especificidad (%) | p | |
|---|---|---|---|---|---|
| Colesterol total | 0,672 | 244,50 mg/dl | 71,70 | 60,00 | 0,013 |
| c-LDL | 0,745 | 170,50 mg/dl | 71,70 | 80,00 | 0,000 |
| Índice ApoB/ApoA1 | 0,820 | 0,80 | 83,00 | 68,00 | 0,000 |
Para analizar estos datos se empleó la curva ROC.
Se consideró estadísticamente significativo un valor p < 0,05.
ApoA1: apoproteína A1; ApoB: apoproteína B; AUC: área debajo la curva; c-LDL: colesterol LDL.
En el estudio de la hipercolesterolemia en la edad infantil, la determinación de CT es la herramienta más utilizada entre 1 y 9 años para detectar la HF13. En la práctica clínica real, ante todo niño/a o adolescente hipercolesterolémico, una vez descartadas las causas secundarias, debemos plantear el diagnóstico de HF. Sin embargo, dado que los criterios clínicos no pueden aplicarse en la edad infantil y el estudio genético no siempre es posible realizarlo, el diagnóstico de HF no es fácil. En este estudio incluimos a un total de 222 niños/as, 114 con hipercolesterolemia detectados tras la aplicación de la cascada directa o bien por la detección oportunista del pediatra de Atención Primaria con la posterior aplicación de la cascada inversa. Ciento ocho niños normocolesterolémicos fueron incluidos como GC procedentes de la aplicación de la cascada directa al tener un progenitor con HF o de la detección oportunista. Nuestro objetivo fue buscar biomarcadores lipídicos o vasculares que nos ayudaran a diferenciar a los niños/as con más probabilidad de estar afectados de HF.
La HF es totalmente asintomática en el niño/a y adolescente, por lo que la historia familiar es de mayor interés si cabe. Así mismo la exploración de los progenitores, en busca de estigmas de dislipidemia genética (arco corneal, xantomas), son elementos de gran interés para el diagnóstico, si bien hay que tener en cuenta que en los padres jóvenes estos signos clínicos característicos no suelen estar presentes. Otro dato relevante es conocer la historia familiar de ECVP, teniendo en cuenta la edad de los padres; suele ser más frecuente hallar estos antecedentes en los familiares de segundo grado como los abuelos14. En nuestra población, el 18,2% de los familiares de segundo grado habían presentado un ECVP, mientras que solo un 10,4% de los padres referían dicho antecedente. Klančar et al. comunicaron que solo un tercio de los familiares de los niños/as con HF con diagnóstico genético tenían antecedentes de ECVP, por ello concluían que la detección de HF en el niño/a no se podía basar en la historia familiar de ECVP7. En el mismo sentido, O’Loughlin et al. comunicaron que la detección de HF en el niño/a, basada en la historia familiar de enfermedad cardiovascular, tenía una baja sensibilidad y especificidad15. El diagnóstico clínico actual se basa en los niveles de c-LDL. Sabemos que el fenotipo de los niños/as con HF, diagnosticados genéticamente, es muy diverso, presentando desde hipercolesterolemias muy severas (c-LDL > 190mg/dl) hasta valores de c-LDL normales, si bien la mayoría de los casos muestran cifras que oscilan entre 130 y 190mg/dl. En nuestro estudio, la media de c-LDL fue de 183mg/dl, mientras que en los niños/as con HP fue de 143mg/dl. La variabilidad del fenotipo del niño/a con HF se ha objetivado en un estudio de cribado universal para la detección de HF realizado en 10.095 niños/as entre 1 y 2 años de edad mediante análisis genético. Los niños/as con FH, demostrada genéticamente, mostraban cifras de c-LDL medio de 155mg/dl, aunque en algunos casos las cifras eran inferiores a 130mg/dl. Esto indica que la detección basada solo en el fenotipo es insuficiente10. Se ha indicado que el índice ApoB/ApoA1 superior a 0,68 es un marcador más sensible y específico para la detección de la HF16. Este índice se utilizó para discriminar a los pacientes afectados de infarto de miocardio en el estudio InterHeart17. Más recientemente, los datos del estudio Pure18 han indicado que el parámetro lipídico asociado al riesgo cardiovascular mediado por una alimentación aterogénica es también el índice ApoB/apoA1. El índice ApoB/ApoA1 es una estimación de la relación entre las partículas lipoproteicas pro y antiaterogénicas. La medición de estas apolipoproteínas podría tener un doble valor al evaluar el riesgo cardiovascular y aumentar la detección de HF en niños/as19, si bien es cierto que la determinación de las lipoproteínas no está generalizada en la práctica clínica asistencial, hecho que limita su utilización en Atención Primaria; sin embargo, es una determinación habitual en las unidades especializadas. Debemos destacar la correlación positiva y estadística significativa entre el índice ApoB/ApoA1 y el GIMc observado en el conjunto de los participantes en nuestro estudio. Datos similares han sido descritos previamente por otros grupos, indicando que un perfil lipoproteico proaterogénico en niños/as y adolescentes predispone al desarrollo de arteriosclerosis subclínica en adultos19.
En nuestra población de niños/as diagnosticados de HF, un índice ApoB/ApoA1 superior a 0,82 mostró mayor sensibilidad y especificidad en la detección de los portadores de una mutación genética, en comparación con el c-LDL o el CT. Este hecho es de gran interés al no haber sido descrito previamente.
En nuestro estudio el índice colesterol años está incrementado en los niños/as hipercolesterolémicos con relación al GC. La carga de c-LDL acumulado en la pared arterial a lo largo de la vida, junto con la presencia de otros factores de riesgo cardiovascular, van a determinar el desarrollo de arteriosclerosis. En los niños/as una forma de medir la carga de c-LDL, es la determinación de índice colesterol años (c-LDL por años) sin tratamiento. Tonstad et al. observaron que los niños/as HF con mayor índice colesterol años presentaban mayor número de placas a nivel de la artería carotídea20.
En nuestro estudio, la concentración de c-HDL fue significativamente menor con relación al GC. Datos actuales indican que puede ser debido a una menor actividad en el transporte reverso de colesterol, como consecuencia de una alteración en la concentración del contenido lipídico de las HDL pequeñas21.
Por otro lado, nuestro grupo ha participado en un estudio, observando que los pacientes con HF no tratados presentan alteraciones en las concentraciones de las enzimas que participan en el remodelado de las HDL; ello originaría HDL disfuncionales comportando un defecto en la capacidad de eliminar el colesterol de los macrófagos22.
El GIMc de los niños/as con HF fue mayor que el grupo con HP pero sin diferencia significativa. Estos datos difieren de los descritos anteriormente por otros grupos, en los que sí se había observado diferencias en niños/as con HF respecto a sus hermanos no afectados antes de los 8 años de edad23. En la actualidad, las últimas guías de prevención cardiovascular del 2016 no recomiendan la determinación del GIMc como marcador de arteriosclerosis subclínica en población general; sin embargo, en niños/as el GIMc ha mostrado un papel discriminatorio aceptable y creemos que sigue siendo una herramienta adecuada en poblaciones muy seleccionadas con alto riesgo cardiovascular, como es población infantil con HF.
En este estudio medimos solo el grosor de los tendones de Aquiles; no se valoró la presencia de depósitos de colesterol ni tampoco la distorsión de la red miofibrilar. Nosotros nos planteamos que su determinación nos podría ayudar en la detección y el diagnóstico de los niños/as HF, tal como se ha descrito en la población adulta24. Tanto en la palpación como en su medición por ecografía, si bien parecían ser más gruesos de lo esperado, no existían diferencias significativas entre las 3poblaciones estudiadas.
Como punto fuerte del estudio, cabe destacar que es el primero realizado en España en población infantil para la detección y el diagnóstico de la HF, con la colaboración e implicación de diferentes áreas asistenciales. La aplicación del cribado oportunista por los pediatras de asistencia primaria y la aplicación de la cascada directa e inversa en la unidad especializada.
Como limitaciones del estudio, debemos mencionar el tamaño de la muestra, especialmente en el grupo de niños/as con HP, pero debemos recordar que eran niños/as detectados en el seno de familias con HF y no de población general. También el rango de edad estudiado incluye el período puberal, siendo difícil evaluar el impacto hormonal sobre los resultados obtenidos.
Conclusiones y recomendacionesLas estrategias de detección de HF mediante cribado directo e indirecto permiten aumentar el diagnóstico infantil de HF. Las concentraciones de CT elevadas superiores a 245mg/dl o de c-LDL superiores a 170mg/dl se asocian a la presencia de HF con mutación genética positiva. Sin embargo, el parámetro con mejor relación entre sensibilidad y especificidad es el índice ApoB/ApoA1 superior a 0,82. Educar a los niños/as y familiares en seguir las recomendaciones de cambio de estilo de vida e iniciar tratamiento farmacológico en el momento oportuno tendrá un impacto claro en la prevención de la ECVP característica de esta población.
FinanciaciónEste estudio fue subvencionado por el proyecto de Marató con el código de identificación 201524 30 31 y por la Sociedad Española de Arteriosclerosis y la Fundación Española de Arteriosclerosis por la Beca SEA/FEA para investigación clínica del año 2013 y título «Detección precoz de la hipercolesterolemia familiar heterocigota en la población infantil», presentada en el Congreso XXVI de Zaragoza.
AutoríaDra. Núria Plana: concepción y diseñado del estudio, seguimiento clínico, obtención de datos, supervisión de los datos de la colección, interpretación de los datos, borrador y aprobación definitiva de la versión que se presenta.
Dra. Cèlia Rodríguez-Borjabad: ha contribuido en la coordinación del estudio, obtención de datos, análisis e interpretación de los datos, revisión crítica del contenido intelectual.
Dra. Daiana Ibarretxe: ha contribuido en la obtención de datos, análisis e interpretación de los datos, revisión crítica del contenido intelectual.
Dra. Raimon Ferré: ha realizado el estudio ecográfico, la revisión crítica del contenido intelectual.
Dr. Albert Feliu: concepción y diseño del estudio, reclutamiento de los pacientes, revisión de los criterios de inclusión y exclusión, revisión crítica del contenido intelectual.
Dra. Alejandra Caselles: colaboración en el reclutamiento, revisión crítica del contenido intelectual.
Dr. Luís Masana: Dr. concepción y diseño del estudio, interpretación de los datos, borrador y aprobación definitiva de la versión que se presenta.
Conflicto de interesesCon relación al estudio, los autores declaran que no ha habido ninguna influencia en los resultados ni en la interpretación de los mismos, por lo que no tienen ningún conflicto de intereses. Algunos de los autores han recibido honorarios por conferencias o asesoría, como se detalla a continuación.
Núria Plana ha recibido honorarios por conferencias de Aléxion, Amgen, Ferrer, MSD, Rubió y Sanofi.
Luis Masana ha recibido honorarios por conferencias o consejería científica de Amgen, MSD, Recordati y Sanofi.
Daiana Ibarretxe ha recibido honorarios por conferencias de Sanofi, MSD, Rubió y Esteve.
Los otros autores declaran no tener conflicto de intereses.
A Carmen Buixadera, por su inestimable trabajo de coordinación. A Núria Aguilera y Anna Varela, por sus manos de oro como enfermeras del proyecto.
Queremos agradecer a todos los participantes y a sus familias por su participación en este proyecto.
También agradecemos a todos los pediatras de Atención Primaria (Grupo DECOPIN) por el reclutamiento de los participantes y de las familias con HF; su implicación ha sido crucial para el éxito del proyecto.
Investigadores que han participado en el reclutamiento: Aguado, Fèlix (CAP Marià Fortuny, Reus); Amigó, Elisabeth (Hospital Sant Pau i Santa Tecla, Tarragona); Andrés, Patricia (CAP Riudoms, Riudoms); Barrio, Mercedes (CAP El Morell, Morell); Bilbao, José Ángel (CAP Riudoms, Riudoms); Bosch, Montserrat (CAP Salou, Salou); Cabedo, José Lluís (CAP Marià Fortuny, Reus); Calvo, Josefa (Hospital Sant Pau i Santa Tecla, Tarragona); Campillo, Carmen (CAP Torreforta-La Granja, Tarragona); Castejón, Emma (CAP La Selva del Camp, Selva del Camp); Castillejo, Gemma (Hospital Universitari Sant Joan, Reus); Castro, María (Hospital Sant Pau i Santa Tecla, Tarragona); Cliville Rosa (CAP Sant Pere, Reus); de Gotardo, Enrique (Hospital Sant Pau i Santa Tecla, Tarragona); Doménech, Vanesa (CAP Amposta, Amposta); Domínguez, Dolores (CAP Muralla, Tarragona); Duràn-Ballén, Marta (CAP Sant Pere, Reus); Escolà, Maria (CAP Roquetes, Les Roquetes); Fernández, Marta (Hospital Universitari Joan XXIII, Tarragona); García, Joan (CAP Sant Pere, Reus); Girona, Raquel (CAP El Pla de Santa Maria, Pla de Santa Maria); Gutiérrez, M. Antonia (CAP Constatí, Tarragona); Iglesias, Dolores (CAP Torreforta-La Granja, Tarragona); Miquel Salsas, Jaume (CAP Santa Bárbara, Santa Bárbara); Luque, Verónica (Hospital Universitari Joan XXIII, Tarragona); Machado, Pilar (Torreforta-La Granja, Tarragona); Maixé, Jordi (Hospital Sant Pau i Santa Tecla, Tarragona), Mallafré, Marta (CAP Cambrils, Cambrils); Martin, Ramona (CAP Marià Fortuny, Reus); Jiménez, Milagros (CAP Horts de Miro, Reus); Monne, Raquel (Hospital Universitari Joan XXII, Tarragona); Morillo, Susana (CAP Llibertat, Reus); Naranjo, Àngels (CAP L’Espluga de Francolí, Espluga de Francolí); Pérez, Cristina (CAP Llibertat, Reus); Planelles, Montserrat (CAP M. Fortuny, Reus); Querol, Cecilia (CAP de Sant Pere, Reus); Rabadà, M. José (CAP La Selva del Camp, Selva del Camp); Remedi, Ayelen (Hospital Mora d¿Ebre, Mora d’Ebre); Riquelme, Carmen (Hospital Sant Pau i Santa Tecla, Tarragona); Rodríguez, Neus (Hospital Verge de la Cinta, Tortosa); Rosell, Laura (CAP Llibertat, Reus); Salvado, Maria (CAP Riudoms, Riudoms); Salvador, Olga (CAP Llibertat, Reus); Santos, Alicia (Hospital Universitari Joan XXIII,Tarragona); Sanz, Núria (CAP Les Borges del Camp, Les Borges del Camp); Segura, Sandra (CAP Montroig del Camp); Subirana, Gloria (CAP Rambla Nova, Tarragona); Tarrades, Pilar (Pius Hospital, Valls); Vendrell, Montserrat (ABS de Vandellós-Hospitalet del Infant, Hospitalet de l’Infant); Vilella, Mireia (CAP Rambla Nova, Tarragona), y Zalaba, Eduardo (CAP Riudoms, Riudoms).