La lipoproteína (a) [Lp(a)] es una lipoproteína definida por presentar una apolipoproteína específica, la apoA, unida a la apoB-100 por diversos tipos de enlaces químicos, entre ellos un puente disulfuro. A pesar de que su mecanismo aterogénico no es completamente conocido, está demostrada su importancia en el desarrollo de ateroesclerosis prematura, mostrando múltiples estudios su papel como factor de riesgo cardiovascular asociado a enfermedad coronaria e ictus. Presentamos el caso de una paciente con diagnóstico de arteritis de Takayasu en la que se detectó una elevación masiva de Lp(a), y abordamos las implicaciones diagnósticas y terapéuticas que tuvo este hallazgo.
Lipoprotein (a) [Lp(a)] is a lipoprotein defined by presenting a specific apolipoprotein, ApoA, linked to the ApoB-100 by different types of chemical bonds, including a disulfide bridge. Despite their atherogenic mechanism is not fully understood, its importance has been demonstrated in the development of premature aterosclerosis. Multiple studies have shown its role as a cardiovascular risk factor associated with heart disease and stroke. We report the case of a patient with a diagnosis of Takayasu arteritis in which a massive elevation of Lp(a) was detected. We emphasize its diagnostic and therapeutic implications.
La lipoproteína (a) [Lp(a)] constituye uno de los principales focos de atención en patología cardiovascular de las últimas décadas. A pesar de que no se conoce por completo su papel aterogénico, ha sido demostrada su importancia en el desarrollo de ateroesclerosis prematura y su rol como factor de riesgo en el desarrollo de enfermedad cardiovascular (ECV)1. El caso que presentamos muestra como una ateroesclerosis favorecida por una elevación masiva de Lp(a) puede poner en duda el diagnóstico clínico de una vasculitis.
Caso clínicoPresentamos el caso de una paciente de 38años sin factores de riesgo cardiovascular conocidos, diagnosticada en 2008, a la edad de 31años, de arteritis de Takayasu (ATK) en otro centro. El cuadro se inició con dolor torácico e hipertensión arterial severa. El diagnóstico se basó en una diferencia de presión arterial (PA) en ambos brazos junto con alteraciones radiológicas consideradas compatibles que se objetivaron en angioRM y angioTC. Se evidenció una estenosis de carótida común izquierda y arteria subclavia izquierda. Se trató en primera instancia con ciclofosfamida intravenosa según protocolo y corticoides. Posteriormente se mantuvo con metotrexato 10mg, una administración semanal, durante 5años. La paciente acudió a nuestro centro solicitando una segunda opinión. No aportó pruebas de imagen salvo una ecocardiografía, que mostró una hipertrofia severa septal no obstructiva. La última prueba de imagen fue en 2008, año del diagnóstico. Entre sus antecedentes familiares destaca un padre con ictus isquémico con 49años y una hermana con elevación severa de Lp(a), con cifras de 156mg/dl.
La exploración física mostró una PA en brazo izquierdo: 105/70mmHg; PA en brazo derecho: 175/85mmHg. Índice tobillo brazo bilateral de 0,95. FC: 85lpm. La auscultación cardiopulmonar fue normal. El abdomen no presentaba soplos. Miembros inferiores sin edemas, con pulsos presentes y simétricos.
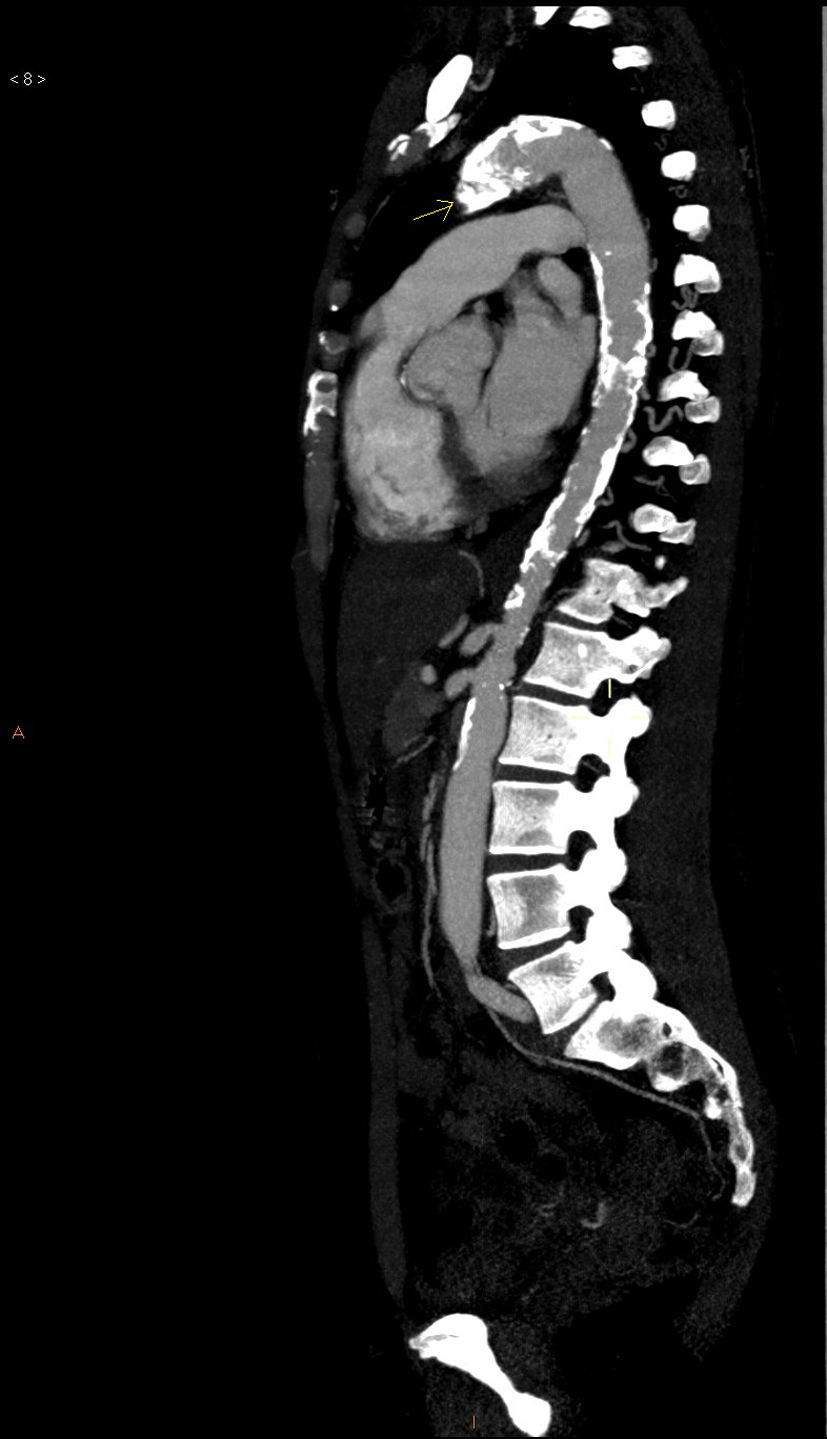
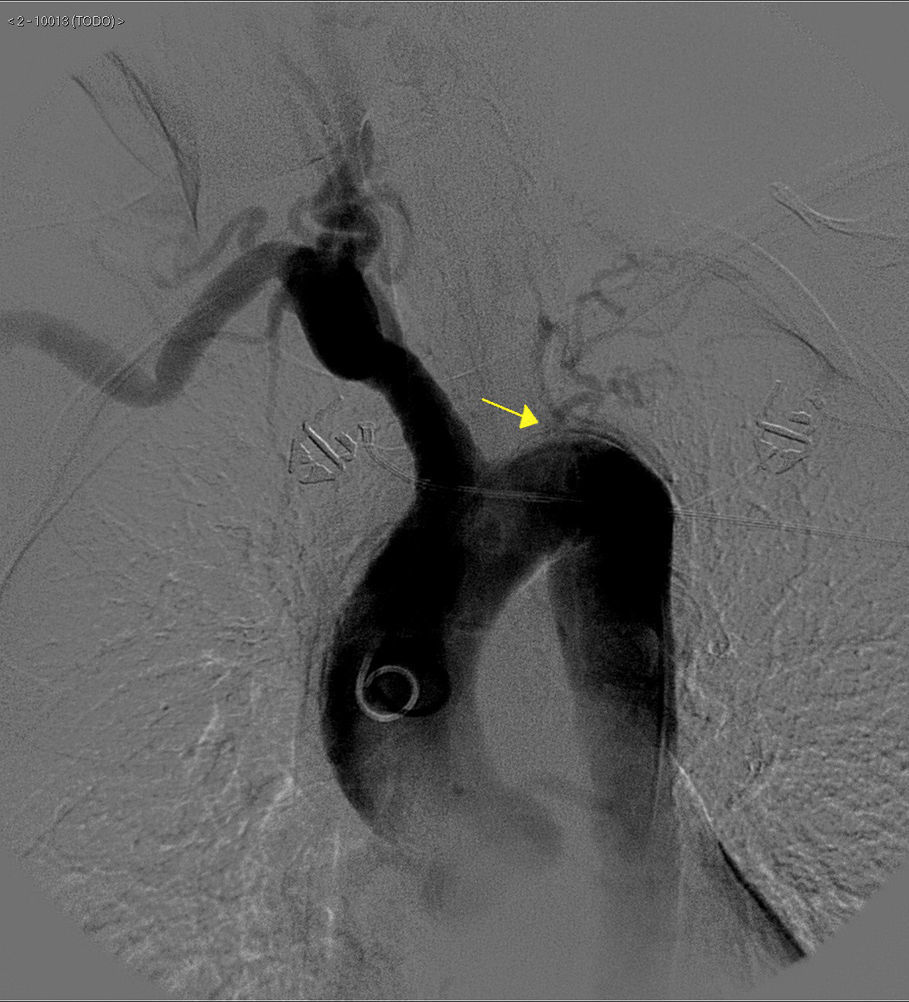
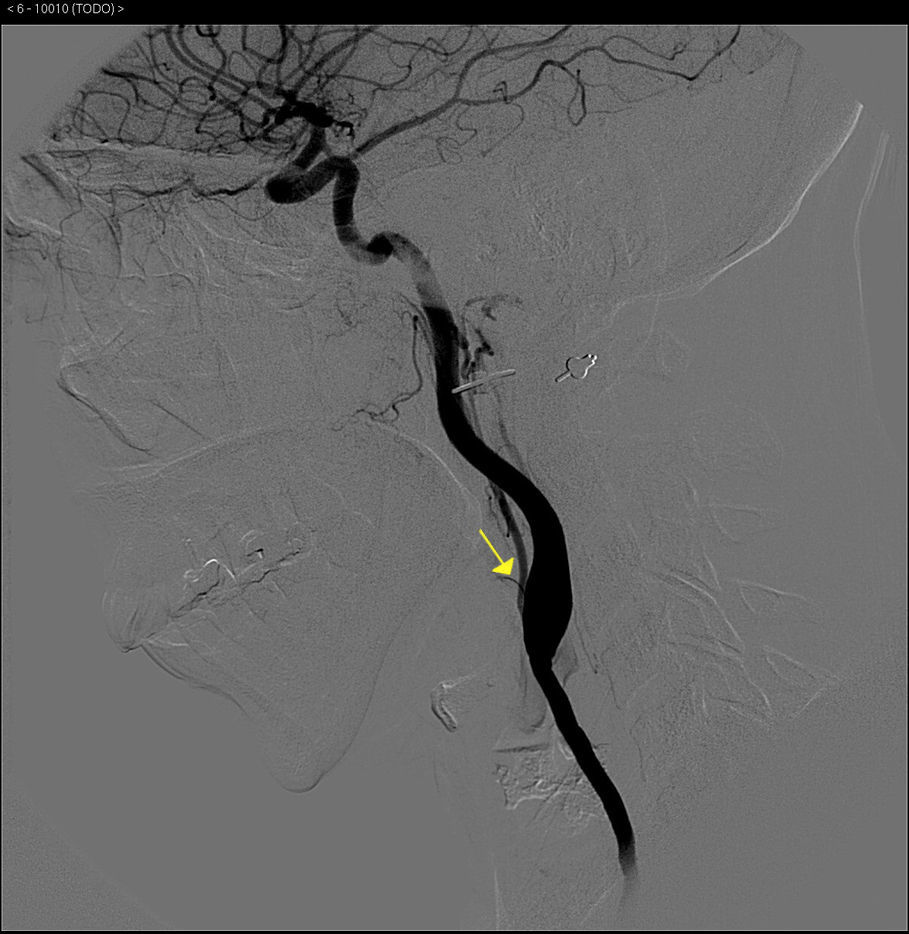
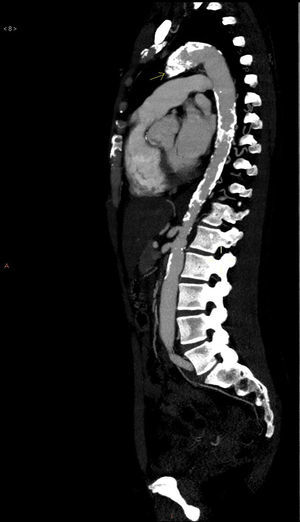
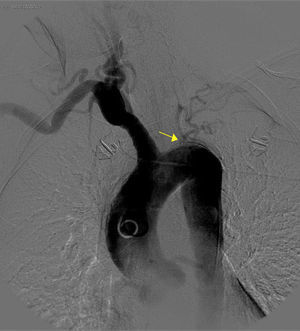
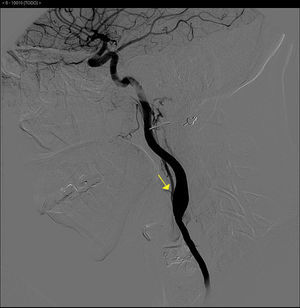
La analítica básica y la radiografía de tórax fueron normales. Se realizó una angioTC torácica que objetivó una obliteración de la arteria subclavia y de la carótida izquierdas junto a una ateromatosis calcificada de aorta torácica y abdominal (fig. 1). La angioRM mostró estenosis de arteria carótida interna izquierda por probable afectación de la arteria carótida cervical. No se pudieron visualizar los troncos supraaórticos por intolerancia a la prueba. Se realizó una arteriografía abdominal y de troncos supraaórticos que puso de manifiesto una ateromatosis difusa de aorta abdominal, estenosis del 50% de la arteria renal izquierda, oclusión desde el origen de la arteria carótida común, subclavia y vertebral izquierdas, una arteria carótida común disminuida de calibre y una obstrucción de la arteria carótida externa derecha (figs. 2 y 3). Ninguna lesión se consideró subsidiaria de tratamiento endovascular.
Ante estos hallazgos se puso en tela de juicio el diagnóstico de ATK y se comenzaron a investigar causas de una afectación vascular prematura. Los estudios de autoinmunidad, trombofilia y anticuerpos antifosfolípido resultaron normales. Homocisteína 11,7μmol/l. El sedimento de orina no mostró alteraciones. Se obtuvo un perfil lipídico que mostró los siguientes valores: colesterol total 197mg/dl; triglicéridos 74mg/dl; cHDL 68mg/dl; cLDL 114mg/dl; Lp(a) 277mg/dl; apoA 176mg/dl; apoB 102mg/dl.
Con el objetivo de discernir si nos encontrábamos ante una ateromatosis prematura por elevación masiva de Lp(a) o una ATK con lesiones residuales establecidas, se solicitó una PET-TC que no mostró signos de enfermedad inflamatoria activa. Finalmente se solicitó una angioTC coronaria, que mostró ateroesclerosis difusa mixta de todo el trayecto de la aorta torácica, con calcificación discontinua en el trayecto ascendente y en el cayado, afectación de ambos ostium coronarios, con estenosis estimada del 70% del derecho y marcada ateroesclerosis calcificada del trayecto del resto de arteria coronaria derecha. En consonancia con el resto de pruebas complementarias obtenidas, se interpretaron los hallazgos como de origen ateroesclerótico, sin poder descartar de manera definitiva el diagnóstico de ATK. La paciente se incluyó en programa de aféresis de lipoproteínas con adecuada tolerancia, se retiró el tratamiento inmunosupresor y actualmente se encuentra asintomática. El juicio clínico acorde a los hallazgos obtenidos fue: ateroesclerosis prematura por elevación masiva de Lp(a) con afectación aórtica, coronaria, carotídea y renal, sin poder descartar arteritis de Takayasu en fase de remisión.
DiscusiónEl caso clínico expuesto plantea si nos encontramos ante una ateroesclerosis prematura por elevación masiva de Lp(a), ante una ATK en fase residual sin signos de actividad, o ante ambos diagnósticos. Se intentó abordar este problema mediante el uso de la PET-TC. Está demostrada su utilidad en el diagnóstico y seguimiento de vasculitis de grandes vasos, entre ellas la ATK. De manera similar se ha demostrado una captación patológica en placas de ateroma en proceso de desarrollo. A través de esta prueba podríamos intentar discernir ambas patologías por el grado, la topografía y la morfología de la captación del radiotrazador2. En este caso, es una tarea compleja diferenciar las dos entidades dada la ausencia de captación en la PET-TC. El tiempo de evolución que la paciente ha permanecido asintomática, la normalidad en reactantes de fase aguda, la intensa calcificación vascular y la afectación coronaria, extraordinaria en la ATK, son datos que a nuestro juicio no apoyan el diagnóstico de ATK. La cardiopatía hipertrófica, relacionada en algunos casos con ATK, está justificada por los efectos sostenidos en el tiempo de una obstrucción al tracto de salida del ventrículo izquierdo, o por unas cifras de PA elevadas de manera prolongada, siendo esta última la más plausible en nuestra paciente3. Creemos que esto es independiente de la ATK. Por otro lado, es cierto que la paciente no presenta otros factores de riesgo cardiovascular (aunque tiene antecedentes familiares en primer grado de enfermedad cerebrovascular prematura), pudiendo discutirse que la extensa afectación vascular se deba únicamente a la elevación masiva de Lp(a). Esto hace que la posibilidad de una ATK en fase de remisión y con lesiones residuales no pueda descartarse completamente.
En cuanto a la Lp(a), múltiples estudios han demostrado su papel como factor de riesgo vascular asociado a enfermedad coronaria e ictus. Cabe destacar el publicado en JAMA, un metaanálisis de 36 estudios prospectivos con un total de 126.634 pacientes, donde se concluye que existe una relación continua e independiente entre la concentración de Lp(a) y el riesgo de enfermedad coronaria e ictus4. Nuestra paciente tenía niveles muy elevados de Lp(a), pero el umbral a partir del cual la concentración de Lp(a) aumenta el riesgo cardiovascular no ha sido totalmente establecido, y muchos estudios carecen de una estimación del riesgo vascular ante niveles extremos de Lp(a), como nuestro caso. Sin embargo, tras la publicación del análisis efectuado en la cohorte de estudio de enfermedad cardiaca de Copenhague se observó un incremento del riesgo de infarto de miocardio con el aumento proporcional de los niveles de Lp(a). No se halló un efecto umbral y hubo un incremento de 3 a 4 veces del riesgo de infarto agudo de miocardio ante niveles extremos (≥120mg/dl) de Lp(a)5. No hemos encontrado un caso tan explícito en la literatura como el presente que manifieste un nivel de afectación tan extenso. El mecanismo por el que la Lp(a) induce el desarrollo de ateroesclerosis aún no está aclarado. Debido a su similitud con el dominio del plasminógeno, se ha sugerido un mecanismo protrombótico en el desarrollo de ateroesclerosis. El receptor VLDL expresado en macrófagos presentes en placas de ateroma podría estar implicado en su metabolismo, permitiendo la endocitosis de Lp(a) y facilitando su depósito en zonas de lesión6. La gran heterogeneidad en el tamaño del gen que codifica la apoA sería responsable del amplio rango de concentraciones de Lp(a) encontradas en diferentes individuos, y del tamaño de las isoformas de la apoA. Hay una relación entre el tamaño de las isoformas y el riesgo cardiovascular, siendo las más pequeñas las que confieren un mayor poder aterogénico7.
El consenso europeo para el manejo de pacientes con elevación de Lp(a) sugiere su determinación en los siguientes casos: ECV prematura, hipercolesterolemia familiar, historia familiar de ECV prematura o elevación de Lp(a), ECV recurrente a pesar del tratamiento con estatinas, ≥3% y ≥10% de riesgo a los 10años de sufrir ECV fatal de acuerdo a la guía de práctica clínica europea y americana, respectivamente8.
Las opciones terapéuticas disponibles actualmente son escasas. Las medidas higiénico-dietéticas no han demostrado ejercer influencia sobre los niveles de Lp(a) y las estatinas no reducen su concentración. Uno de los fármacos que ha demostrado reducir el nivel de Lp(a) es el ácido nicotínico (niacina), con reducción de hasta un 40% a la máxima dosis tolerada. Los anticuerpos monoclonales anti-PCSK9 pueden reducir hasta un 30% los niveles de Lp(a), aunque su principal efecto se basa en la reducción de los niveles de cLDL. Mipomersen, un oligonucleótido antisentido contra la apoB100, podría reducir la concentración de Lp(a) entre un 19 y un 31%9. Los estudios de un oligonucleótido antisentido anti apoA se encuentran actualmente iniciando la fase2. Como último escalón disponible en la actualidad tenemos una de las medidas más eficaces para la reducción del nivel de Lp(a), la aféresis de lipoproteínas. Con este método se consiguen descensos de hasta un 70%. Leebmann et al.10 incluyeron 170 pacientes con aumento de niveles de Lp(a) y ECV progresiva con dosis máximas de tratamiento hipolipemiante toleradas. Se comprobó no solo la eficacia de la aféresis de lipoproteínas en la reducción de los niveles de Lp(a) y su seguridad, sino una reducción en la incidencia de episodios cardiovasculares. Hay que tener en cuenta que de forma paralela también se redujeron los niveles de cLDL, pudiendo justificarse la reducción de episodios al disminuir también el cLDL. En nuestro caso, se produjo una reducción del 71% de los niveles de Lp(a) (valores pre y post-aféresis de 257 y 86mg/dl, respectivamente). El nivel deseable de Lp(a) establecido por el consenso europeo es de <50mg/dl8.
ConclusiónEl aumento de los valores de Lp(a) en sangre representa un factor de riesgo cardiovascular independiente, con un papel importante en el desarrollo de ateroesclerosis prematura. En pacientes con una presentación o evolución atípica de una vasculitis de grandes vasos podría ser recomendable su medición. Una herramienta útil para diferenciar afectación vascular por ateroesclerosis o vasculitis es la PET-TC. En este caso, dada la ausencia de captación y síntomas, no es posible etiquetar a la paciente con un diagnóstico concreto.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaTodos los autores mencionados han contribuido al trabajo de este manuscrito, tanto en la aportación de ideas, en la redacción del borrador como en la aprobación final.
Conflicto de interesesLos autores de este manuscrito declaran no tener conflicto de intereses.