Buscar nuevos factores biológicos como el estrés oxidativo (EO) y su interacción con los clásicos, edad, HbA1c, Lp(a) y homocisteína plasmática asociados con la vasculopatía periférica (VP) del paciente con diabetes tipo2 (DMT2).
Sujetos y métodosEstudiamos 204 diabéticos tipo2 seleccionados de forma consecutiva de un hospital de referencia y un hospital comarcal de nuestra comunidad autónoma en el periodo comprendido entre enero de 2009 a mayo de 2010. Se trató de un estudio transversal de caso (ITB<0,9)/control (ITB0,9-1,2). La VP fue definida por el índice tobillo-brazo (ITB). Se excluyeron 39 sujetos por presentar un ITB>1,2. Los parámetros clinicobiológicos fueron medidos por procedimientos estandarizados.
ResultadosLos sujetos fueron divididos en 2 grupos: con VP (ITB>0,89) o sin VP (ITB0,9-1,2). Al comparar las variables clinicobiológicas entre ambos grupos encontramos diferencias estadísticamente significativas en la edad, el tiempo de evolución de la enfermedad, la Lp(a) y los valores plasmáticos de homocisteína. No encontramos diferencias en los parámetros de EO: glutatión reducido, glutatión oxidado y maloldialdehído entre grupos. La homocisteína plasmática fue un predictor independiente de la VP y se relacionó con los valores de glutatión reducido, la edad y el tiempo de evolución de la enfermedad.
ConclusionesNuestro estudio confirmó que los valores elevados de Lp(a) y de forma independiente de homocisteína plasmática, se asocian con la presencia de VP definida por ITB en sujetos con DMT2. No encontramos que los marcadores de EO estudiados se asocien con VP en sujetos DMT2 con más de 10años de evolución de su enfermedad y alta prevalencia de complicaciones crónicas.
To study new risk factors for peripheral macroangiopathy (PM) in patients with diabetes, as oxidative stress (OS) and its interaction with classical risk factors: age, Lp(a), plasma homocysteine values and HbA1c.
Subjects and methodsWe studied 204 type2 diabetic (T2DM) patients, consecutive selected form a reference hospital and a secondary hospital form our Community (2009-2010). Design was a case (ABI<0.89) control (ABI0.9-1.2) study. PM was defined using ankle brachial index (ABI). Thirty nine T2DM subjects presented ABI>1.2 and were excluded. Clinical and biological parameters were determined using standard methods.
ResultsComparing clinical and biological parameters obtained in both studied groups (T2DM+ABI<0.9 vs T2DM+ABI0.9-1.2), we found statistical significant differences in age, evolution time of diabetes, Lp(a) and plasma homocysteine values. No differences were found in OS parameters: reduced glutathione, oxidized glutathione and maloldialdehide between studied groups. Plasma homocysteine values were an independent risk factor for the presence of PM and were related to evolution time of diabetes and reduced glutathione.
ConclusionsWe have confirmed that Lp(a) and independently plasma homocysteine values were related to PM in T2DM subjects. No association with PM and OS markers (GSH, GSSG and MDA) were found in T2DM with more than 10years of evolution time of their disease and high prevalence of chronic complications.
La diabetes tipo 2 (DM2) es una enfermedad muy prevalente que tiene consecuencias importantes para el paciente y el sistema de salud por el desarrollo de complicaciones micro y macrovasculares1,2. La complicación macrovascular del diabético es una arteriosclerosis, que a diferencia del sujeto no diabético es más extensa, difusa y cursa con mayor morbimortalidad2. La vasculopatía periférica (VP) es responsable, junto con la neuropatía del pie diabético, de las amputaciones de miembros inferiores en los sujetos con diabetes3. Pero no todos los diabéticos desarrollan con la misma gravedad la VP. Por tanto, es prioritario conocer factores asociados con el desarrollo, presencia o gravedad de la VP, con el fin de identificar sujetos de alto riesgo cara a su prevención.
Algunos de estos factores son conocidos por diferentes estudios experimentales, clínicos y epidemiológicos. Por ejemplo, la dislipidemia aterogénica está relacionada con la VP del sujeto con diabetes2, así como la presencia de concentraciones elevadas de Lp(a)4. Además, las concentraciones elevadas de homocisteína plasmática son un factor mayor e independiente de riesgo para la macroangiopatía2,5.
Por otro lado, en la arteriosclerosis del sujeto con DM2 se ha demostrado una actividad inflamatoria crónica fibroproliferativa favorecida por fenómenos de glucosilación (AGE) y de estrés oxidativo (EO)6,7. Los principales sistemas conocidos de EO a nivel endotelial relacionados con la arteriosclerosis son la xantinoxidasa (XO), la NADPH oxidasa y la óxido nítrico sintetasa endotelial (eNOS)8. Estos sistemas pro-oxidantes generan especies reactivas de oxígeno. Para compensar este exceso oxidante nuestro organismo utiliza sistemas antioxidantes. Los principales sistemas antioxidantes endógenos son la superóxido dismutasa (SOD), la catalasa (CAT) y el sistema glutatión (GSH, GSSG y enzimas: GSS, GSR, GPX). El EO y numerosos productos a los que da lugar a nivel endotelial originan una serie de daños celulares —oxidación de lipoproteínas, alteración en el óxido nítrico— que se han relacionado con el inicio y desarrollo de la arteriosclerosis7-9.
Las complicaciones crónicas macrovasculares dependen, como sabemos, de la edad, del tiempo de evolución de la enfermedad y del control metabólico de la glucemia y lípidos2,4,5. Es básico conocer otros factores que, junto a los clásicos, se asocian con la VP de sujetos con diabetes. Probablemente, como hemos descrito, son la combinación de factores relacionados con la hiperglucemia crónica, la inflamación y el EO, junto a otros factores biológicos.
Esta necesidad de buscar nuevos factores biológicos como el EO y su interacción con los clásicos asociados con la VP del diabético es el principal objetivo de nuestro trabajo de investigación. Su conocimiento facilitará la prevención y el tratamiento, y evitará las elevadas consecuencias sociosanitarias que supone la enfermedad macrovascular del DM2.
Sujetos y métodosSe estudiaron 204 diabéticos tipo2 que acudieron a la consulta de Endocrinología y Nutrición del Hospital Clínico de Valencia o de Medicina Interna del Centro de Especialidades del Hospital de Ontinyent en el periodo comprendido entre enero de 2009 a mayo de 2010. El protocolo del estudio contó con la aprobación del Comité de Ética del Hospital Clínico Universitario de Valencia. La selección de la muestra fue consecutiva.
Todos los pacientes recibieron información suficiente sobre el estudio, y solo participaron los que otorgaron su consentimiento.
Los criterios de inclusión fueron: diagnóstico de diabetes tipo 2(basado en glucemia basal, HbA1c o tratamiento hipoglucemiante), pacientes no amputados o con amputación unilateral, edad mayor o igual a 40años y ambos sexos.
Fueron considerados criterios de exclusión: diagnóstico de diabetes tipo1 (inicio como cetoacidosis, inmunidad positiva o falta de reserva de insulina), amputación bilateral, presentar enfermedades avanzadas que modifican per se cualquiera de los factores de estudio: EPOC, insuficiencia cardiaca NYHA>II, cirrosis hepática y enfermedad neoplásica, artropatía de Charcot e índice tobillo-brazo (ITB)>1,20.
DiseñoSe trató de un estudio observacional transversal de caso/control. Se consideró caso a los diabéticos con VP, definida por un ITB<0,9. Se consideró control a los diabéticos con ITB entre 0,9 y 1,20. Se excluyeron pacientes con ITB>1,2 al no poder descartar un falso negativo debido a calcificación arterial.
MétodosEntrevista clínicaMediante entrevista se recogieron los siguientes parámetros: edad, sexo, hábito tabáquico y, en su caso, años de exfumador, consumo de alcohol, ejercicio físico semanal, tiempo de evolución de la diabetes conocida por el paciente, grado de educación diabetológica, tratamiento para hipertensión o dislipidemia, complicaciones cardiovasculares tales como: infarto agudo de miocardio definido como elevación transitoria de las CK-MB o de las troponinas, en un paciente que asocie al menos una de las siguientes condiciones: dolor precordial típico, signos electrocardiográficos como aparición de onda Q patológica o desnivel del segmento ST; infarto isquémico cerebral definido como sintomatología de focalidad neurológica que no se resuelve en 24h y tomografía computarizada craneal normal o con imagen hipodensa.
Exploración clínicaEl estudio antropométrico y la medición de la presión arterial se realizaron a todos los pacientes en condiciones iguales y por el mismo investigador.
Talla y peso. Se obtuvieron utilizando balanza y estadiómetro estandarizados y bien calibrados. El peso se determinó con el paciente descalzo y vistiendo ropa ligera. La medición se realizó en kilogramos, con una precisión de ±100g. La talla se midió con el sujeto descalzo, en bipedestación y con la cabeza situada en el plano de Frankfurt (plano horizontal nariz-trago), expresada en centímetros con una precisión ±0,5cm.
Índice de masa corporal (IMC). Peso en kilogramos partido por la altura en metros al cuadrado (kg/m2).
Perímetro de la cintura. Se midió con cinta métrica flexible y milimetrada; se fijó un punto medio entre la última costilla y la parte superior de la cresta ilíaca, rodeando la cintura y estando el paciente en espiración con el abdomen relajado, según consenso de la SEEDO 2007.
Presión arterial. Se midió después de 5min en reposo con el paciente sentado en una silla con la espalda apoyada y los brazos a nivel del corazón, sin haber fumado o ingerido cafeína durante los 30min previos. Se anotó el promedio de 2 o más mediciones tomadas de forma separada, desestimando la primera y con un intervalo de 2min, siguiendo las condiciones de medición del grupo de trabajo de la Sociedad Europea de Hipertensión.
Retinopatía diabética. Los pacientes se remitieron al Servicio de Oftalmología de nuestro centro para determinar la presencia de retinopatía por estudio de fondo de ojo y, en caso afirmativo, diferenciar si fue o no proliferativa.
Vasculopatía periférica. La vasculopatía se valoró por el ITB, mediante doppler bi-directional Smartdrop™ 20, tras 5-10min de reposo y con una temperatura ambiental agradable. Mediante el transductor se buscó el punto en el que se oía mejor el latido arterial y se deshinchó lentamente el manguito (2mmHg/s), considerando la aparición del primer ruido como el valor de presión arterial sistólica a ese nivel. Se utilizó como numerador la presión arterial más alta en el miembro inferior y como denominador la presión arterial más elevada en el brazo. La medida se realizó en las arterias tibial posterior y pedia de ambas piernas, y así mismo en ambos brazos, tomando en este caso solo el valor mayor obtenido.
Grado de polineuropatía. El diagnóstico se basó en datos clínicos, como parestesias y disestesias, recogidos con el índice NSS y en la exploración basada en criterios NDS. También se usó la prueba del monofilamento de Semmes-Weinstein en el pulpejo del primer dedo y el primer y quinto metatarsianos de ambos pies, catalogando como neuropatía una falta de respuesta a uno o más de los 6 puntos explorados.
Parámetros bioquímicosLas muestras de sangre se extrajeron con ayuno mínimo de 10h en la Unidad de Pruebas Funcionales del Hospital Clínico Universitario. Se utilizaron métodos estandarizados10 para la medición de: glucosa (método enzimático colorimétrico), HbA1c (cromatografía líquida de alta eficacia), creatinina (fotocolorimetría mediante reacción con ácido pícrico), urea (UV cinética), filtrado glomerular estimado por la fórmula Modification of Diet in Renal Disease [MDRD), colesterol total (método enzimático fotocolorimétrico), triglicéridos (fotocolorimétrico mediante la determinación del glicerol contenido en las moléculas de TG tras su hidrólisis mediante lipasas), colesterol HDL (cHDL) (precipitación con polianiones con ácido fosfotúngstico-cloruro de magnesio), colesterol LDL (cLDL) (fórmula de Friedewald), colesterol VLDL (cVLDL) (centrifugación en gradiente 1006), Apo A1 y B (inmunoturbimetría), Lp(a) (nefelometría), homocisteína, ácido fólico y vitaminaB12 (ELISA) y ácido úrico (método enzimático fotocolorimétrico, uricaza, reacción de Trinder).
En orina se determinó creatinuria y albuminuria por inmunoturbimetría para el cálculo de índice albúmina/creatinina y medición de la microalbuminuria.
Parámetros de estrés oxidativoLas determinaciones de glutatión reducido (GSH) y glutatión oxidado (GSSG) se realizaron mediante HPLC y detección ultravioleta, previa adicción de N-etilmaleimida para prevenir la oxidación de GSH en plasma, haciendo uso de patrones apropiados y siguiendo la metodología descrita previamente10.
Del mismo modo y según método validado10, se determinó el maloldialdehído (MDA) mediante HPLC previa hidrólisis de lipoperóxidos plasmáticos y reacción con ácido tiobarbitúrico (TBA) con MDA aislado, siendo el complejo MDA-TBA finalmente cuantificado mediante espectrofotometría.
Métodos estadísticosEl tamaño de la muestra se calculó teniendo en cuenta un error alfa inferior al 5% y un error beta inferior al 20%, para un riesgo atribuible (odds ratio) >2,5. Se calculó un mínimo de 60 sujetos por grupo.
Para las variables continuas se calculó la media y la desviación estándar (DE). Las medias de las variables cuantitativas se compararon entre grupos con la prueba t de Student para los datos no apareados. Para la Lp(a) se utilizó su logaritmo, puesto que no siguió una distribución normal. La comparación de las variables cualitativas entre grupos se realizó con el test de Chi2 y significación de Pearson.
Para estudiar las asociaciones entre variables se ha utilizado la prueba de regresión simple y múltiple, siendo la variable dependiente la presencia de VP (categorizada por el ITB). Como independientes se utilizaron la edad, el tiempo de evolución de la enfermedad, la Lp(a), la HbA1c y las concentraciones de homocisteína plasmática.
Se considera estadísticamente significativa una probabilidad menor al 5%.
ResultadosDe los 204 sujetos con DM2 inicialmente seleccionados se excluyeron 39 sujetos por presentar un ITB>1,2. Por tanto, la muestra final fue de 165 sujetos con DM2.
Los 165 sujetos fueron separados en 2 grupos: 108 sujetos con VP (ITB<0,9) y 57 sujetos sin VP (ITB entre 0,9-1,2).
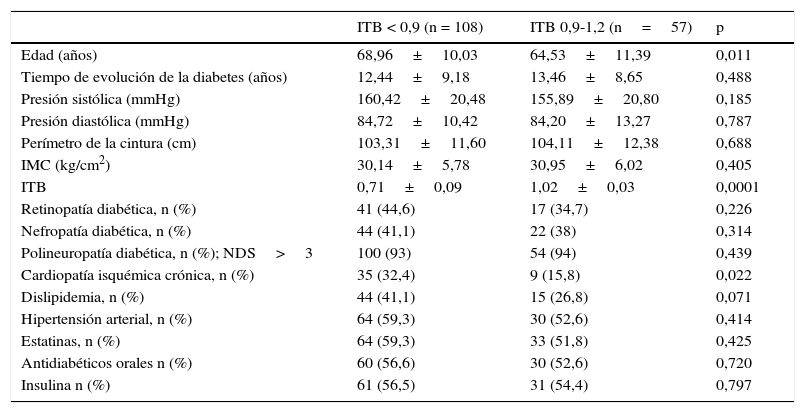
Al comparar ambos grupos se encontraron diferencias estadísticamente significativas en la edad, no así en otros parámetros como el IMC, el perímetro de cintura, la presión arterial o el tiempo de evolución de la diabetes (tabla 1). Tampoco encontramos diferencias estadísticamente significativas en la prevalencia de retinopatía o antecedente de hipertensión arterial. La toma de estatinas y la pauta de hipoglucemiantes (antidiabéticos orales e insulina) fueron similares en ambos grupos.
Características generales y parámetros clínicos de los sujetos con diabetes tipo 2 clasificados según el índice tobillo-brazo
| ITB < 0,9 (n = 108) | ITB 0,9-1,2 (n=57) | p | |
|---|---|---|---|
| Edad (años) | 68,96±10,03 | 64,53±11,39 | 0,011 |
| Tiempo de evolución de la diabetes (años) | 12,44±9,18 | 13,46±8,65 | 0,488 |
| Presión sistólica (mmHg) | 160,42±20,48 | 155,89±20,80 | 0,185 |
| Presión diastólica (mmHg) | 84,72±10,42 | 84,20±13,27 | 0,787 |
| Perímetro de la cintura (cm) | 103,31±11,60 | 104,11±12,38 | 0,688 |
| IMC (kg/cm2) | 30,14±5,78 | 30,95±6,02 | 0,405 |
| ITB | 0,71±0,09 | 1,02±0,03 | 0,0001 |
| Retinopatía diabética, n (%) | 41 (44,6) | 17 (34,7) | 0,226 |
| Nefropatía diabética, n (%) | 44 (41,1) | 22 (38) | 0,314 |
| Polineuropatía diabética, n (%); NDS>3 | 100 (93) | 54 (94) | 0,439 |
| Cardiopatía isquémica crónica, n (%) | 35 (32,4) | 9 (15,8) | 0,022 |
| Dislipidemia, n (%) | 44 (41,1) | 15 (26,8) | 0,071 |
| Hipertensión arterial, n (%) | 64 (59,3) | 30 (52,6) | 0,414 |
| Estatinas, n (%) | 64 (59,3) | 33 (51,8) | 0,425 |
| Antidiabéticos orales n (%) | 60 (56,6) | 30 (52,6) | 0,720 |
| Insulina n (%) | 61 (56,5) | 31 (54,4) | 0,797 |
IMC: índice de masa corporal; ITB: índice tobillo-brazo: NDS: neurological disability score.
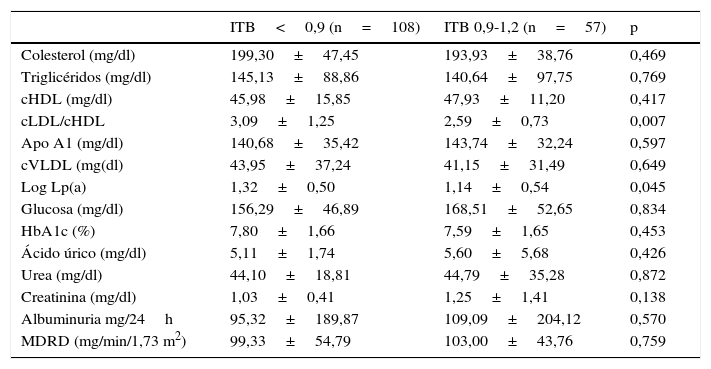
En cuanto a los parámetros bioquímicos, los sujetos con VP mostraron concentraciones significativamente mayores de la relación cLDL/cHDL (índice aterogénico) y de la Lp(a) (tabla 2). Los sujetos con VP presentaron mayores concentraciones de homocisteína plasmática, siendo los valores de vitaminaB12, de ácido fólico y de la función renal similares al compararlos en ambos grupos.
Valores bioquímicos en los sujetos con diabetes tipo 2 estudiados clasificados según el índice tobillo-brazo
| ITB<0,9 (n=108) | ITB 0,9-1,2 (n=57) | p | |
|---|---|---|---|
| Colesterol (mg/dl) | 199,30±47,45 | 193,93±38,76 | 0,469 |
| Triglicéridos (mg/dl) | 145,13±88,86 | 140,64±97,75 | 0,769 |
| cHDL (mg/dl) | 45,98±15,85 | 47,93±11,20 | 0,417 |
| cLDL/cHDL | 3,09±1,25 | 2,59±0,73 | 0,007 |
| Apo A1 (mg/dl) | 140,68±35,42 | 143,74±32,24 | 0,597 |
| cVLDL (mg(dl) | 43,95±37,24 | 41,15±31,49 | 0,649 |
| Log Lp(a) | 1,32±0,50 | 1,14±0,54 | 0,045 |
| Glucosa (mg/dl) | 156,29±46,89 | 168,51±52,65 | 0,834 |
| HbA1c (%) | 7,80±1,66 | 7,59±1,65 | 0,453 |
| Ácido úrico (mg/dl) | 5,11±1,74 | 5,60±5,68 | 0,426 |
| Urea (mg/dl) | 44,10±18,81 | 44,79±35,28 | 0,872 |
| Creatinina (mg/dl) | 1,03±0,41 | 1,25±1,41 | 0,138 |
| Albuminuria mg/24h | 95,32±189,87 | 109,09±204,12 | 0,570 |
| MDRD (mg/min/1,73 m2) | 99,33±54,79 | 103,00±43,76 | 0,759 |
Apo: apolipoproteína; cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; cVLDL: colesterol de las lipoproteínas de muy alta densidad, Log: logaritmo; MDRD: aclaramiento de creatinina calculado por la fórmula Modification of diet in renal disease.
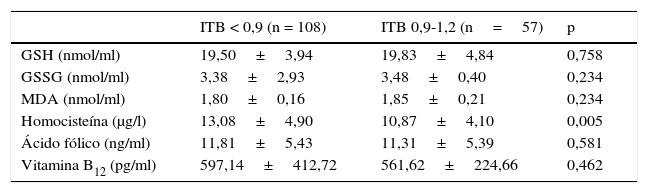
En la tabla 3 se analizaron los parámetros del EO estudiados entre ambos grupos. No se evidenciaron diferencias estadísticamente significativas en los valores de glutatión oxidado (GSSG), reducido (GSH) o su relación, ni de los valores de MDA, entre sujetos con DM2 con o sin VP.
Marcadores de estrés oxidativo y valores de homocisteína en los sujetos con diabetes tipo 2 estudiados clasificados según el índice tobillo-brazo
| ITB < 0,9 (n = 108) | ITB 0,9-1,2 (n=57) | p | |
|---|---|---|---|
| GSH (nmol/ml) | 19,50±3,94 | 19,83±4,84 | 0,758 |
| GSSG (nmol/ml) | 3,38±2,93 | 3,48±0,40 | 0,234 |
| MDA (nmol/ml) | 1,80±0,16 | 1,85±0,21 | 0,234 |
| Homocisteína (μg/l) | 13,08±4,90 | 10,87±4,10 | 0,005 |
| Ácido fólico (ng/ml) | 11,81±5,43 | 11,31±5,39 | 0,581 |
| Vitamina B12 (pg/ml) | 597,14±412,72 | 561,62±224,66 | 0,462 |
GSH: glutatión reducido; GSSG: glutatión oxidado; MDA: maloldialdehído.
En cuanto a las asociaciones simples entre variables, se encontró una correlación significativa en las concentraciones de GSH con los triglicéridos plasmáticos (r=−0,251, p=0,03) y con la concentración plasmática de homocisteína (r=0,271, p=0,026). De la misma forma entre los valores de GSSG o MDA con triglicéridos con valor r=0,222 (p=0,05) y con el colesterol total con valor r=0,204 (p=0,08).
Finalmente, las concentraciones de homocisteína plasmática se asociaron de forma significativa con la edad (r=0,401, p=0,001), con GSH (r=0,271, p=0,026) y con el tiempo de evolución de la diabetes (r=0,233, p=0,05).
En el análisis multivariante, utilizando como variable dependiente la presencia de VP (ITB<0,9=0) y como independientes la edad, el tiempo de evolución de la diabetes, la HbA1c, la Lp(a) y la homocisteína plasmática, las variables que predijeron de forma independiente la VP fueron la edad (p=0,02 B−0,63), el tiempo de evolución de la diabetes (p=0,004 B0,75), la HbA1c (p=0,019 B−0,30) y la concentración de homocisteína plasmática (p=0,001, B−0,13).
DiscusiónEn nuestro estudio hemos encontrado una relación del cociente cLDL/cHDL y de la Lp(a) con la VP, no así con otros parámetros lipídicos. Todos los sujetos con DM2 incluidos llevaban su tratamiento habitual (65% tomaban estatinas). Pese a ello, el cociente aterogénico siguió siendo un parámetro que discriminó entre sujetos con y sin VP.
La Lp(a) es una partícula similar a la LDL, relacionada con la arteriosclerosis por su capacidad de inflamatoria, apoptótica y por su efecto protrombótico al frenar la fibrinólisis4,11. En el Emerging Risk Factors Collaboration, un metaanálisis de 36 estudios prospectivos, la Lp(a) mostró una relación causal e independiente de los niveles de cLDL con la enfermedad arterial periférica y la enfermedad coronaria4,12. En nuestro estudio no fue un predictor independiente de VP frente a la edad, el tiempo de evolución de la diabetes, la HbA1c o las concentraciones plasmáticas de homocisteína.
Por otro lado, en nuestro estudio las concentraciones plasmáticas de homocisteína fueron significativamente más elevadas en los sujetos con DM2 y VP. En este sentido, numerosos estudios observacionales y de caso-control han encontrado una relación entre la hiperhomocisteinemia y la enfermedad cardiovascular en diabéticos13,14, así como en su pronóstico o recurrencia14,15. Algunos estudios indican que la homocisteína es un factor de riesgo más potente para VP que para cardiopatía isquémica en sujetos con diabetes15. En nuestro estudio, las concentraciones de homocisteína plasmática se relacionaron con VP y no con el antecedente personal de cardiopatía isquémica crónica. En otros trabajos, la homocisteína plasmática se relacionó con el grado de resistencia a la insulina y fue más potente como predictor de la VP que la HbA1c o el tabaquismo en sujetos con DM214,15. Similares resultados obtuvimos en nuestro estudio, ya que las concentraciones plasmáticas de homocisteína son potentes predictores de VP independientemente de la edad, del tiempo de evolución de la enfermedad, de la HbA1c o de la Lp(a).
Es conocido que la edad y el tiempo de evolución de la diabetes se relacionan de forma independiente con la VP. La edad es el principal factor no modificable asociado con la arteriosclerosis y la VP en numerosos estudios epidemiológicos2,4,5. Además, la edad se asocia con mayores concentraciones de homocisteína plasmática13,14. Apoyando estos resultados, en nuestro estudio la homocisteína plasmática se relacionó con la edad y los pacientes diabéticos mayores con la VP. Además, en el análisis multivariante tanto la edad como el tiempo de evolución de la diabetes fueron predictores independientes de VP.
En sujetos con diabetes se ha objetivado un desequilibrio entre la actividad pro y antioxidante a favor de la primera16. Este desequilibrio se ha propuesto como causa de disfunción endotelial, en estudios tanto experimentales como clínicos, relacionándolo con la arteriosclerosis7,8. Además, la oxidación de los lípidos plasmáticos (peroxidación lipídica y MDA), y especialmente las partículas de LDL y de proteínas glicadas, puede conducir al desarrollo de arteriosclerosis y complicaciones diabéticas micro y macroangiopáticas16-19.
En nuestro estudio no se hallaron diferencias en los parámetros de EO al comparar DM2 con y sin VP. Si observamos los valores de GSH, GSSG y MDA encontrados en nuestros pacientes con DM2, estos son muy elevados al compararlos con controles sanos no diabéticos, como verificamos en un estudio previo de nuestro grupo10. Pensamos que los parámetros utilizados como marcadores de EO no se asocian con VP en sujetos con DM2, porque los sujetos seleccionados tienen una alta prevalencia de complicaciones crónicas y el tiempo de evolución medio es de 10años de enfermedad. Son pacientes, pues, con elevado tiempo de exposición a hiperglucemia crónica y ya tienen posiblemente disfunción endotelial, independientemente del valor del ITB. Además, esa larga exposición temporal a la hiperglucemia condiciona per se valores elevados de EO. Por otro lado, la clasificación por ITB no descarta lesiones en otros territorios vasculares de estos sujetos. Por último, el EO ha sido implicado en las fases precoces de aterosclerosis y no ya en fases avanzadas, como probablemente presenten los sujetos seleccionados para nuestro estudio.
Además, la VP del diabético tiene un componente microvascular. Como hemos comentado, sí hemos encontrado una asociación de marcadores de EO con una complicación crónica de la diabetes que tiene este componente, la polineuropatía diabética10. En el presente estudio la clasificación de los sujetos se realizó teniendo en cuenta el ITB que solo evalúa obstrucción debida a complicación macrovascular, lo que podría explicar la falta de asociación con la VP de los marcadores de EO.
Las limitaciones del estudio son, además de las comentadas, que se trata de un estudio transversal, por lo que no se descartan sesgos de supervivencia y no implica relaciones causales.
En resumen, nuestro estudio muestra y confirma que las concentraciones elevadas de Lp(a), y de forma independiente de homocisteína plasmática, se asocian con la presencia de VP definida por ITB en sujetos con DM2. No hemos encontrado que los marcadores de EO estudiados (GSH, GSSG y MDA) se asocien con VP en sujetos con DM2 con más de 10años de evolución de su enfermedad y alta prevalencia de complicaciones crónicas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio está financiado con fondos de la Conselleria de Sanitat (JT Real, AP-04/06 y AP 068/08) y del CIBERDEM (ISCIII). CIBER de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) es una iniciativa del Instituto de Salud Carlosiii.