La enfermedad cardiovascular (ECV) es la principal causa de muerte e incapacidad en el mundo occidental1. La mujer sufre ECV 10-20 años más tarde que el varón, lo que ha llevado por varias décadas a sustentar la hipótesis que las hormonas ováricas endógenas ofrecen un efecto protector en el desarrollo de la enfermedad. Por otra parte, estudios clínicos recientes han mostrado que el reemplazo con terapia hormonal no reduce el riesgo de ECV en la mujer posmenopáusica2,3, lo que sugiere que la reducción de las concentraciones de estrógenos no es la clave determinante del riesgo de ECV acelerada asociado a la transición menopáusica.
Una hipótesis alternativa para la diferencia de sexos es que la testosterona desempeña un papel adverso, lo que explica en varones el mayor riesgo de presentar enfermedad coronaria, ya que los andrógenos, en general, y la testosterona en particular, se han asociado previamente a un alto riesgo de ECV en el varón4. Sin embargo, los valores de testosterona no han mostrado relación con eventos cardiovasculares en varones5 o mujeres6, y estudios sobre valores endógenos de dehidroepiandrosterona (DHEA) y eventos cardiovasculares mostraron resultados conflictivos7. Adicionalmente, estudios clínicos prospectivos8, transversales9 y experimentales10,11 sugieren que los andrógenos tienen un efecto neutral o benéfico sobre la aterosclerosis y sus manifestaciones clínicas en el varón.
En modelos animales, el tratamiento con testosterona tiende a inhibir el desarrollo de la aterosclerosis en conejos machos12, mientras que en primates no humanos hembras induce exacerbación de la aterosclerosis13, lo que sugiere efectos específicos de los andrógenos según el sexo y la especie sobre la ECV. Recientemente, se demostró que la castración en un modelo animal de conejos resulta en un incremento del 100% de la presencia de aterosclerosis aórtica, lo que sugiere que la testosterona endógena podría tener un fuerte efecto preventivo en la aterosclerosis en varones14.
Tanto para andrógenos de origen testicular como adrenal, se han sugerido diferentes mecanismos de acción mediados por vías no lipídicas15. En términos de inhibición de la aterosclerosis, varios estudios son consistentes y claramente soportan un impacto benéfico de los andrógenos endógenos sobre el perfil de lípidos y lipoproteínas, fibrinógeno, agregación plaquetaria, efectos antiinflamatorios, regulación de apoptosis y estabilidad de células de músculo liso vascular (CMLV). Además, propiedades vasoactivas directas de relajación vascular, como un efecto no genómico y específico estructural en la membrana de CMLV. La presencia de andrógenos induce inicialmente una reducción del colesterol unido a lipoproteínas de alta densidad (cHDL); sin embargo, esto podría no asumirse como un efecto proaterogénico inmediato, ya que puede reflejar una aceleración en el metabolismo reverso del colesterol.
En el presente estudio, pretendemos determinar los efectos vasculares (morfológicos y funcionales) y moleculares (inflamatorios y en la vía reversa del colesterol) con la reducción de los valores endógenos de testosterona, mediante castración en un modelo experimental en conejos hipercolesterolémicos y ateroscleróticos.
MétodosAnimales
Este estudio experimental, aleatorizado y controlado fueaprobado por el Comité de Ética en Investigación Animal (CEIA) de la Fundación Cardioinfantil. Se utilizó un total de 40 conejos blancos machos de la raza Nueva Zelanda de 4 meses de edad. Después de un período de adaptación de una semana, se sometieron 20 animales bajo anestesia general a orquidectomía (grupo 1) y se utilizaron 20 animales como grupo control (grupo 2). Después de 2 semanas en etapa de recuperación, se dividió a los 40 animales en 4 grupos y se los siguió por 20 semanas:
–Grupo 1: no castrados, sometidos a dieta normal.–Grupo 2: castrados, sometidos a dieta normal.
–Grupo 3: no castrados, sometidos a dieta aterogénica.
–Grupo 4: castrados, sometidos a dieta aterogénica.
La dieta aterogénica fue hecha con suplementos del 0,5% de colesterol (Purina, S.A.), y administrada por períodos de 4 semanas, alternados con una dieta normal para un total de 20 semanas, como describieron Abela et al16. Al finalizar se realizó una medición de las concentraciones de colesterol sérico y de testosterona total en muestras plasmáticas antes de la eutanasia en los 4 grupos.
Eutanasia y preparación del tejido vascular
La eutanasia electiva se realizó al final de un período de observación de 20 semanas, usando anestesia general con ketamina (50 mg/kg por vía intramuscular) y una inyección letal de tiopental sódico (Pentothal® USP) 150 mg/kg por vía intravenosa. Inmediatamente después, la aorta de cada conejo fue cuidadosamente removida. Se aisló el segmento proximal de la aorta torácica para los estudios de relajación vascular in vitro. El segmento de aorta torácica remanente fue mantenido y perfundido manualmente con formaldehído en solución bufferfosfato al 10% a 80 mmHg por 15 min. Se cortó en segmentos la porción distal de la aorta torácica, 2 cm por encima de la arteria renal derecha, para análisis histomorfométricos.
Análisis morfométricos
Procesamiento de tejidos. Después de fijación tisular en formol tamponada, se embebió los segmentos de tejido arterial en parafina a 56-58 °C. Las secciones fueron realizadas a 4 m y teñidas con hematoxilina-eosina y por el método de tricrómico elástica. Se realizó un análisis individual de los segmentos utilizando un microscopio de luz (Olympus BX50). Se midieron los segmentos mediante morfometría digital y planimetría computarizada (Media Cybernetics® Image-Pro Plus TM).
Morfometría. Se localizó sistemáticamente cada segmento de aorta examinado en el centro del campo del objetivo, usando magnificación 2. El área del vaso corresponde al área comprendida dentro de la lámina elástica externa (mm2), el área del lumen al área dentro de la superficie endotelial (mm2) y el área de la placa aterosclerótica al área comprendida entre la lámina elástica interna y el lumen arterial, cuantificada en mm2. El área de la media corresponde a la resta entre el área del vaso y el área del lumen. Se realizaron cálculos de índices área de placa aterosclerótica/área del vaso y área de placa ate-rosclerótica/área de la media.
Vasorreactividad arterial in vitro
Se realizó la preparación del segmento arterial para estudio de relajación vascular in vitro como se ha descrito previamente17. Los segmentos de aorta se transportaron al laboratorio para ser lavados, sometidos a disección y limpieza del tejido conectivo exuberante. Se obtuvo 8 anillos de cada vaso. Los segmentos se colocaron cuidadosamente en recipientes con solución de Krebs Henseleit con la siguiente composición (en mM): NaCl: 117; KCl 4,7; CaCl2: 6,1; MgSO4 1,17; NaHCO3 24,9; D-glucosa: 11; y pH 7,40 ± 0,05. El tiempo que se utilizó entre la obtención del tejido y su preparación fue menor a 15 min.
Experimentos con anillos vasculares aislados. Se suspendieron los anillos entre dos asas de alambre en una cámara de vidrio en el equipo de baño de órganos, con 25 ml de solución de Krebs Henseleit a 37 °C y pH 7,40, aireada con O2 al 95% y CO2 al 5%. Uno de los alambres tensores estaba conectado al transductor de fuerza (Kent-Scientific Corporation, Litchfield, CT), y los cambios en fuerza isométrica fueron recolectados en un sistema computarizado de registro (Power Lab/4 Sp) y en un programa Windows 2000. Se aplicó una tensión progresiva en reposo hasta de 3 g, la cual fue definida en estudios preliminares y cada anillo vascular se dejó suspendido en ese sistema durante aproximadamente 45-60 min.
Evaluación de la relajación vascular. Se evaluó la relajación independiente de endotelio (RIE) usando dosis acumulativas (10-8 a 10-4 M) de nitroglicerina (NTG) en anillos precontraídos con norepinefrina (NE) 3,16 10-6 M. La relajación dependiente de endotelio (RDE) fue evaluada utilizando acetilcolina (ACh) 3,16 10-6 M en anillos precontraídos con NE 3,16 10-6 M. Se administró sólo un tratamiento (ACh o NTG) en cada anillo de aorta.
Evaluación y respuesta inflamatoria tisular y de vías del metabolismo reverso del colesterol
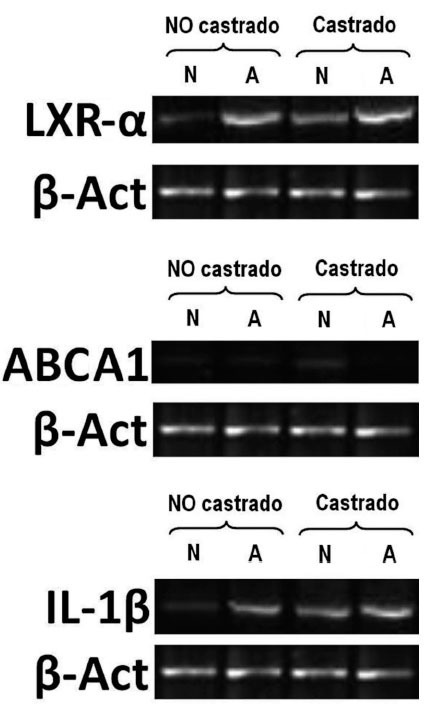
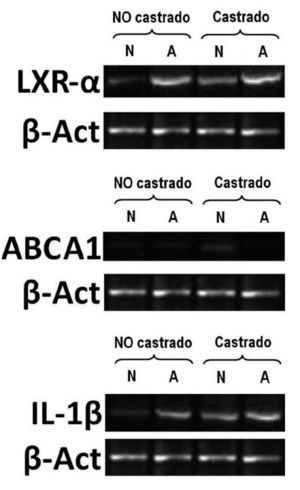
Inmediatamente después del sacrificio, se obtuvieron muestras de hígado, tejido graso y aorta torácica. Una vez rotuladas, se almacenaron a –70 °C y se transportaron al Centro de Investigaciones Biomédicas de la Universidad de La Sabana. La evaluación de la vía inflamatoria se realizó mediante cuantificación tisular de interleucina (IL)-1 y de vías del metabolismo reverso del colesterol mediante la cuantificación de los genes LXR- y ABCA1.
Las muestras de tejido se almacenaron en nitrógeno líquido, luego maceradas, y se llevó a cabo el protocolo de extracción de ARN total empleando TRIzol® (Invitrogen). Posteriormente, se hizo la lectura espectrofotométrica con un radio de absorbancia de 260/280 nm. En cada muestra se igualó la concentración a 1 g/l, con el fin de realizar la técnica de transcriptasa inversa-reacción en cadena de la polimerasa (RTPCR). Una vez tomado 1 g/l de ARNm y 2,5 l del iniciador específico, se adicionó 4 ml de agua libre de ARNasas, 10 l de Buffer First strand, 5 l de DDT 0,1 M, 16 l de dNTPs, 1 l de ARNsin y 1 l de MMLV. Se realizó una selección de iniciadores a través del software Amplify 3. Para determinar la especificidad, se comparó los segmentos con el GenBank, empleando el programa Blast (www.ncbi.nlm.nih.gov). Se realizó la síntesis de cada uno de los iniciadores en una escala de 50 nm. Se verificó la amplificación de cada segmento mediante electroforesis en gel de agarosa al 2%. Las condiciones de PCR fueron las siguientes:
Los parámetros de comparación del producto de PCR de los diferentes grupos se realizaron en forma semicuantitativa estandarizando el número de los ciclos, las concentraciones de ADNc (2 g) e iniciadores (50 pm). Posteriormente, se tomaron los valores de la expresión del gen de -actina como control. Como control endógeno, se empleó la misma cantidad de ARNm para amplificar la -actina, quien funcionó como gen housekeeping.
Se obtuvieron imágenes con cámara digital Nikkon Coolpix 5400 y la cuantificación de las bandas se realizó con software Image J Versión 4.0. La intensidad de la banda se expresó como unidades relativas de absorbancia. La relación entre la muestra de ARNm a ser determinada y la -actina se calculó para normalizar las variaciones iniciales en la concentración de la muestra y como un control para la eficiencia de la reacción. La media y la desviación estándar de todos los experimentos se calcularon después de la normalización con -actina. Se realizó cada experimento por triplicado en 3 ocasiones diferentes.
Análisis estadísticos
Los datos se presentan como promedio ± desviación están-dar. El número total de conejos del estudio fue de 40, 10 en cada uno de los grupos. Debido a que las variables analizadas no cumplen con las presunciones de normalidad y homogeneidad de varianza, para evaluar las diferencias entre los 4 grupos de conejos en las concentraciones de colesterol sérico, testosterona, morfometría vascular, vasorreactividad vascular y la expresión de los diferentes genes evaluados, se realizó la prueba de Kruskall Wallis. En los casos en que la diferencia entre los grupos era significativa se realizó la prueba de Tamhane para determinar entre qué grupos eran las diferencias. Los resultados fueron promediados para cada animal y el grado de significación fue establecido con un valor de p 0,05. Utilizamos el programa estadístico SPSS 12.0®.
ResultadosAl ingreso del estudio, los animales sometidos a una dieta normal (n = 20) tuvieron un peso de 3,2 ± 0,2 kg y valores de colesterol total de 43,1 ± 5,3 mg/dl. Los animales sometidos a una dieta aterogénica (n = 20) tuvieron un peso de 3,2 ± 0,3 kg (p = 0,758) y valores de colesterol total de 41,2 ± 3,7 mg/dl (p = 0,879). Todos los animales terminaron la observación de 20 semanas, al cabo de las cuales aquellos sometidos a una dieta normal tuvieron un peso de 4,2 ± 0,5 kg y valores de colesterol total de 51,1 ± 8,5 mg/dl y los animales sometidos a dieta aterogénica tuvieron un peso de 4,9 ± 0,3 kg (p < 0,001) y valores de colesterol total de 429,2 ± 262,0 mg/dl (p < 0,001).
Los animales sometidos a castración no presentaron complicaciones locales durante el seguimiento. Las concentraciones de testosterona al final del seguimiento en el grupo de animales no castrados fueron de 2,1 ± 0,3 ng/ml y en el grupo de animales castrados fueron 0,8 ± 0,4 ng/ml (p = 0,024).
Resultados de la castración en conejos con dieta normal
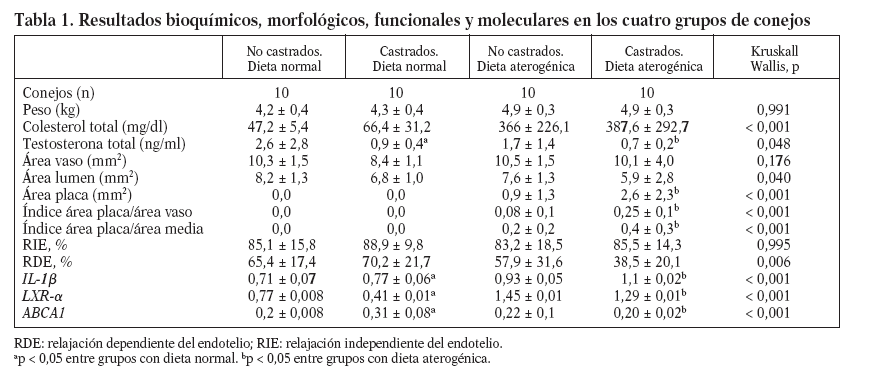
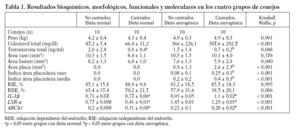
En animales alimentados con dieta normal (grupos 1 y 2), la castración redujo significativamente las concentraciones de testosterona total (2,6 ± 2,8 frente 0,9 ± 0,4 ng/ml; p = 0,017), incrementó la expresión de IL-1 (0,71 ± 0,07 frente 0,77 ± 0,06; p < 0,001), redujo la expresión de LXR- (0,77 ± 0,008 frente a 0,41 ± 0,01; p < 0,001) y aumentó la de ABCA1 (0,2 ± 0,008 frente a 0,31 ± 0,08; p < 0,001) (fig. 1). Sin embargo, en animales alimentados con dieta normal, la castración no mostró efectos en las concentraciones de colesterol total, medidas vasculares histomorfométricas y funcionales (tabla 1; fig. 2).
Figura 1. Electroforesis en gel de agarosa al 2%, teñido con bromuro de etidio. Ejemplo de la expresión de genes LXra ABCA1 e IL-1 analizados mediante transcriptasa inversareacción en cadena de la polimerasa (RT-PCR) semicuantitativa. Control interno de reacción gen housekeeping de -actina. A: conejos alimentados con dieta aterogénica; N: conejos ali-mentados con una dieta normal. El número de animales en cada grupo fue de 10.
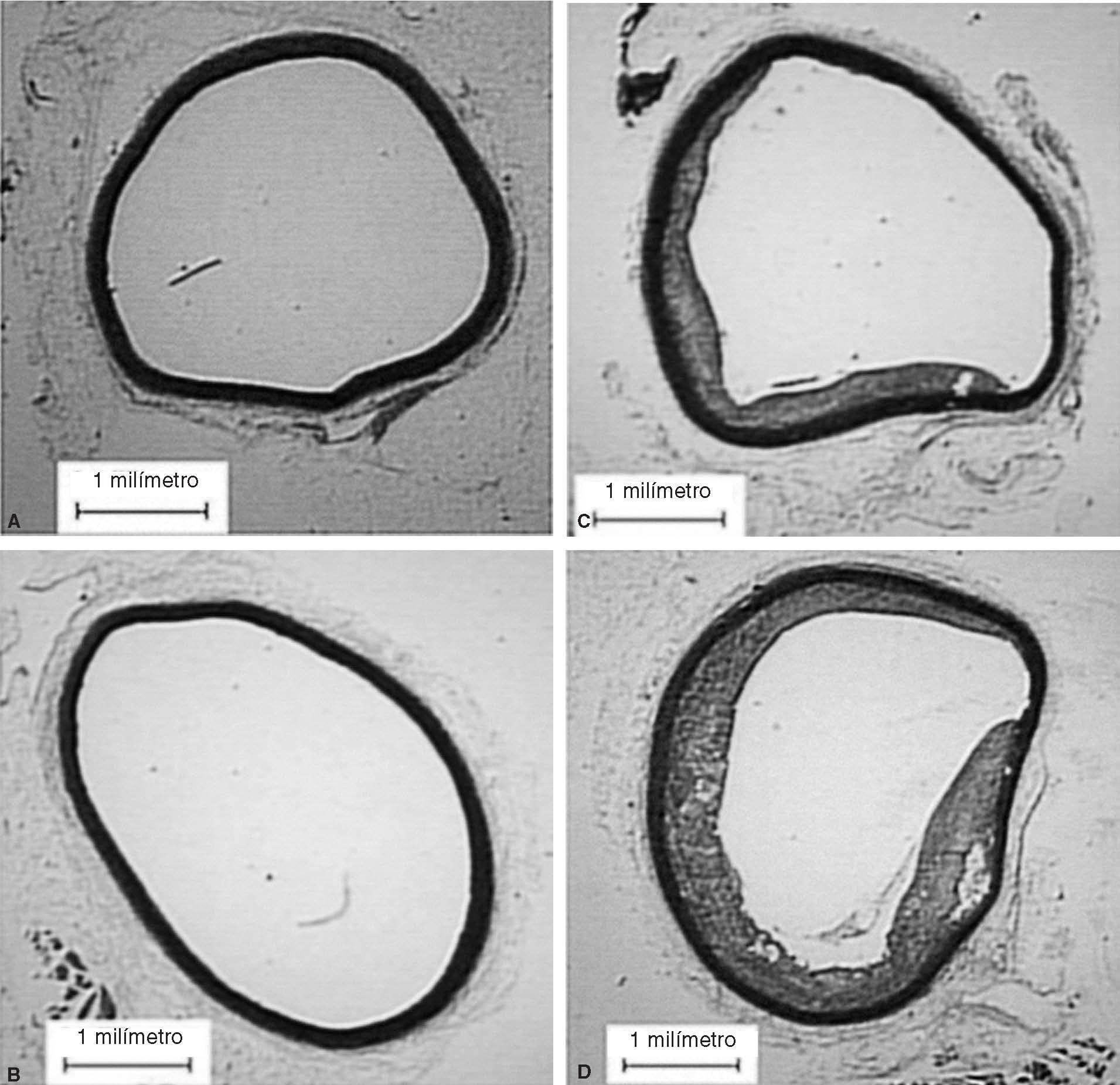
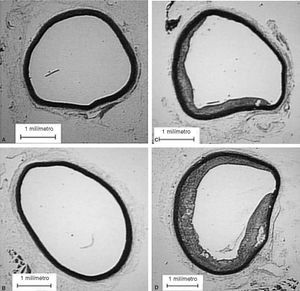
Figura 2. Cortes de aorta torácica procedente de conejos. A: conejos no castrados alimentados con dieta normal. B: conejos castrados alimentados con dieta normal. C: conejos no castrados alimentados con dieta aterogénica. D: conejos castrados alimentados
Tabla 1. Resultados bioquímicos, morfológicos, funcionales y moleculares en los cuatro grupos de conejos
Resultados de la castración en conejos con dieta aterogénica
En animales con dieta aterogénica (grupos 3 y 4), se observó una tendencia a que los conejos castrados presentaran valores menores de testosterona total (1,7 ± 1,4 frente a 0,7 ± 0,2 ng/ml; p = 0,142), además la castración en animales con dieta aterogénica indujo cambios histomorfométricos en el área de la placa (0,9 ± 1,3 frente a 2,6 ± 2,3 mm2; p = 0,026), el índice área placa/área vaso (0,08 ± 0,1 frente a 0,25 ± 0,1; p < 0,001) y el índice área pla-ca/área de la media (0,2 ± 0,2 frente a 0,4 ± 0,3; p = 0,003) (fig. 2). También en animales castrados se presentaron mayores cambios moleculares, aumentando la expresión de IL-1 (0,93 ± 0,05 frente a 1,1 ± 0,02; p < 0,001), disminuyendo la expresión de LXR- (1,45 ± 0,01 frente a 1,29 ± 0,01; p < 0,001) y disminuyendo la expresión de ABCA1 (0,22 ± 0,1 frente a 0,20 ± 0,02; p < 0,001) (tabla 1; fig. 1). La castración no presentó un efecto independiente en las pruebas funcionales de relajación vascular en conejos alimentados con dieta aterogénica.
DiscusiónLos resultados del presente estudio en conejos demuestran que los andrógenos endógenos circulantes se reducen significativamente con la castración en un 63%, y que esta condición en presencia de hipercolesterolemia inducida por una dieta aterogénica favorece la mayor formación de placa aterosclerótica en la aorta torácica, aumenta la expresión de interleucina proinflamatoria (IL-1) y se asocia con una reducción en la expresión de genes que favorecen la vía reversa del colesterol (LXR- y ABCA1). La castración per se no afectó las concentraciones de colesterol total ni la relajación vascular independiente o dependiente de endotelio. Los resultados sugieren que la testosterona endógena en presencia de dislipidemia puede ejercer una atenuación de la formación de la aterosclerosis a través de vías moleculares intracelulares.
Concentraciones de colesterol
En el presente estudio, la castración no mostró efecto directo en las concentraciones séricas de colesterol total. La influencia de andrógenos sobre lípidos séricos y lipoproteínas en varones es controvertida. Las diferencias entre especies, sexos y diseños de los estudios utilizados, incluidas las dosis y la ruta de administración de las hormonas, desempeñaron un papel esencial para estas discrepancias en el perfil de lípidos. Estudios experimentales18 y clínicos19 soportan un impacto benéfico de los andrógenos endógenos sobre los lípidos séricos y lipoproteínas.
Formación de placa aterosclerótica
Estudios clínicos20-22 sugieren que los andrógenos tienen un efecto neutral o benéfico sobre la génesis de la aterosclerosis. El efecto de la testosterona sobre la ECV en varones no fue investigado en estudios clínicos, ciegos y controlados. Alexandersen et al14 tuvieron la hipótesis que los andrógenos naturales tienen un efecto preventivo, similar al efecto de los estrógenos. Por primera vez se demostró que la castración per se resulta en un incremento del 100% en la presencia de aterosclerosis aórtica en conejos ateroscleróticos, lo que sugirió, como con nuestros resultados, que la testosterona endógena podría tener un efecto preventivo en la formación de aterosclerosis. En nuestro estudio, también demostramos que la reducción de los andrógenos endógenos inducida por la castración favorece la formación de placa aterosclerótica 2-3 veces mayor en aorta torácica de conejos sometidos a dieta aterogénica.
En varones, se ha descrito un efecto benéfico de la testosterona y la DHEA en los factores de riesgo cardiovascular23. Existe evidencia acerca de un papel protector de las hormonas sexuales endógenas y de la terapia estrogénica en el desarrollo de la aterosclerosis24. Van den Beld et al25 describieron en 403 varones (73-94 años) las concentraciones de testosterona endógena, estrona y IGF-1 libre pueden tener un papel protector en el desarrollo de la aterosclerosis medida en el grosor íntima-media en arterias carótidas por ultrasonido. En un estudio poblacional26, las concentraciones de testosterona sérica mostraron tener una relación inversa y correlación independiente con la presencia de placas aórticas calcificadas y progresión de aterosclerosis.
Se especula que la modulación de lipoproteínas es probablemente uno de los varios mecanismos por los cuales los andrógenos endógenos en dosis farmacológicas previenen la aterosclerosis. Tanto para andrógenos de origen testicular como adrenal, también se han sugerido varios mecanismos de acción mediados por vías no lipídicas. La conversión de testosterona a estrógenos por vía de la aromatasa puede desempeñar un papel en el efecto protector del reemplazo con andrógenos sobre la aterosclerosis, soportado por la demostración de la actividad de la aromatasa en CMLV de ratas en cultivo27,28. Otros posibles mecanismos de los andrógenos podrían incluir efectos antiinflamatorios, regulación de apoptosis y una estabilidad de CMLV29.
Función endotelial in vitro
En nuestro estudio no se demostró efecto independiente de los andrógenos endógenos en la vasodilatación arterial in vitro. Estudios previos realizados en animales han demostrado que la testosterona actúa como un vasodilatador arterial directo en varias especies30, incluidos conejos, perros, cerdos y ratas; tanto en experimentos in vivo como in vitro. La testosterona ha demostrado exhibir la acción vasodilatadora en arterias musculares y elásticas en diferentes especies. Otros estudios experimentales31 han demostrado que la vasodilatación inducida por testosterona puede ocurrir dependiente e independiente de endotelio e involucrar la activación de canales de K+ en CMLV. Yildiz et al32 demostraron recientemente el efecto vasodilatador de la testosterona en la arteria mamaria interna de humanos, utilizando concentraciones suprafisiológicas, lo que sugiere que la vasodilatación obtenida es dependiente del endotelio y mediada en parte por la activación de canales de K+ dependientes del Ca++.
Vías moleculares inflamatorias y del metabolismo reverso del colesterol
Los resultados moleculares obtenidos en nuestro estudio indican que aquellos conejos castrados incrementan de manera significativa la expresión de IL-1 y reducen la expresión de genes que median las vías de colesterol reversa, tales como LXR- y ABCA1.
La IL-1 se considera el prototipo de citocina proinflamatoria multifuncional. Es inducida por factores como el estrés, hiperosmolaridad, hipoxia, radiación (gamma, ultravioleta y láser), sustancias neuroactivas (sustancia P, melatonina, etc.), sustancias inflamatorias (C5a, C5b-9, productos finales glucosilados, PCR, etc.), matriz extracelular (fibronectina, colágeno), factores de coagulación (productos de degradación de la fibrina, plasmina y trombina) y lípidos (ácido 9-hidroxi-octadenoico, LDLox, factor activador de plaquetas), entre otros33. La presencia de IL-1 en tejidos ateromatosos se debe a la infiltración de células espumosas que la sintetizan en respuesta a la presencia de LDLox. Las propiedades proinflamatorias de IL-1 son relevantes para el desarrollo de la lesión ateromatosa, daño del tejido luego de isquemia, reestenosis coronaria y disfunción miocárdica. La presencia de andrógenos induce inicialmente una disminución de las partículas HDL; sin embargo, esto no se debe asumir como un efecto proaterogénico inmediato, ya que puede reflejar una aceleración en el metabolismo reverso del colesterol34. Las partículas HDL ejercen un efecto antiaterogénico que incluye un incremento en el metabolismo reverso del colesterol desde las células periféricas hasta el hígado.
La activación de ligandos endógenos para LXR- pueden potenciar el efecto que tiene el LXR sobre el metabolismo lipídico, incluida la estimulación del metabolismo reverso del colesterol, elevación de los valores plasmáticos de cHDL, inhibición de la absorción del colesterol y crea un antagonismo con las señales inflamatorias, convirtiéndolo en un blanco farmacológico potencial para revertir la aterosclerosis en etapas tempranas por su efecto en la modulación del metabolismo lipídico. Sin embargo, no hay que olvidar el potencial lipogénico que se puede presentar35.
Los transportadores ABC están críticamente involucrados en la homeostasis del colesterol celular y resistencia a múltiples fármacos. El ABCA1 ayuda a controlar la formación de partículas HDL, y además es una molécula blanco para incrementar los valores de HDL y proteger contra la aterosclerosis36. Es un blanco importante de LXR en los macrófagos. Este tipo de transportadores median el eflujo celular de fosfolípidos y colesterol a apolipoproteínas pobres en lípidos A1 (apo-1) y desempeñan un papel significativo en el metabolismo de HDL. Adicionalmente, para la regulación lipídica, estos genes están involucrados en la apoptosis e inflamación, procesos a través de los cuales se realiza la progresión de la placa aterosclerótica. La interacción de PPAR-LXR-ABCA1 es integral para la homeostasis del colesterol y, adicionalmente, estos receptores nucleares tienen una actividad antiinflamatoria y anti-MMP.
Mecanismos de acción de los andrógenos
Los avances en el conocimiento de la fisiología de los andrógenos han referido nuevos mecanismos que podrían ser cruciales para un mejor entendimiento de la acción sobre la vasculatura. Se considera que los andrógenos presentan mecanismos genómicos y extragenómicos que pueden influir en el desarrollo de la enfermedad cardiovascular37. La regulación genómica es la vía clásica de acción de los andrógenos, involucra la unión de los esteroides a receptores de andrógenos específicos (AR) y activan un factor de transcripción sobre el genoma con el que se transloca al núcleo y actúa como un factor de trascripción que puede producir efectos a largo plazo por la síntesis de nuevas proteínas. Los efectos no genómicos tienen la capacidad de involucrar una inducción de señales y cascadas de transducción, incluidas la movilización de calcio citosólico, la activación de proteincinasas (A, C) y MAPK, llevando a diversos efectos celulares que incluyen la relajación de CMLV, transmisión neuromuscular, señales intercelulares y plasticidad neuronal38.
A nivel fisiológico, en ausencia de andrógenos, se incrementa la lipogénesis en los adipocitos y se favorece la obesidad. El incremento en la aromatización de la testosterona a estradiol en conejos obesos disminuye posteriormente las concentraciones de testosterona. La activación metabólica de los andrógenos es una de las claves en el efecto biológico de la testosterona. Consiste en la conversión a metabolitos bioactivos. Aunque solamente una pequeña fracción (< 5%) de la testosterona experimenta la transformación en tejidos locales37. Sobre la base de estudios de inmunorreactividad, se ha identificado en tejido vascular el tipo 1 y el tipo 2 de la 5 reductasa39. La conversión de testosterona a estradiol por la enzima aromatasa (CYP19) diversifica la acción de los andrógenos activando receptores de estrógenos. La expresión del gen de la aromatasa, actividad proteica y actividad enzimática40 se han detectado en tejido vascular.
Los receptores de andrógenos se expresan por las células de la vasculatura, incluidas células endoteliales, CMLV, fibras del miocardio, macrófagos y plaquetas. Su contenido fue similar tanto en ratas machos como hembras y conejos. La expresión de receptores se ha relacionado con una mayor adhesión de monocitos circulantes al endotelio, formación de células espumosas en la estría grasa favoreciendo la expresión de moléculas de adhesión (VCAM-1). El tratamiento con testosterona de macrófagos murinos inhibe la liberación de nitritos por vía del óxido nítrico sintasa inducible (iNOS), aunque el mecanismo exacto de acción es desconocido41. Esta inhibición del iNOS puede incrementar la agregación plaquetaria y el riesgo de trombosis asociado al tratamiento con andrógenos por eliminación del efecto antiagregante del óxido nítrico.
ConclusionesEn este estudio, utilizando un modelo animal de ateroesclerosis reconocido, conejos adultos castrados en presencia de hipercolesterolemia, se demuestra que la testosterona endógena podría tener un efecto atenuante o protector en la aterosclerosis. Los efectos benéficos antiinflamatorios y en la expresión de genes involucrados en la vía reversa del colesterol podrían explicar en parte sus efectos benéficos sobre la aterosclerosis. A pesar que la evidencia sugiere que valores normales de andrógenos podrían proteger al varón del desarrollo de la aterosclerosis, nuevos estudios experimentales y clínicos son necesarios para explorar el efecto antiaterogénico de los andrógenos endógenos en el varón.
AgradecimientosLos autores agradecen ampliamente a Agrinal-Purina, S.A. por el soporte con la dieta de los animales; a Marcela Beltrán (MSc) por su ayuda en la recolección de resultados. A la Dra. Ingrid Mejía y a Javier Guzmán, por el cuidado diario de los animales y el soporte técnico.
Correspondencia: Dr. D. Echeverri. Laboratorio de Investigación en Función Vascular. Fundación Cardioinfantil-Instituto de Cardiología. Calle 163 A, número 13B-60. Primer Piso. Bogotá. Colombia. Correo electrónico: decheverri@cardioinfantil.org; funcionvas- cular@cardioinfantil.org
Recibido el 15 de junio de 2007 y aceptado el 12 de septiembre de 2007.