El presente documento ha sido preparado por un grupo de expertos, miembros de las sociedades de Cardiología, Endocrinología, Medicina Interna, Nefrología y Diabetes de los países de América Latina, para que sirva de guía a los médicos que cuidan a pacientes con diabetes, hipertensión y enfermedades concomitantes o complicaciones de ambas condiciones. Aunque el concepto de síndrome metabólico actualmente es discutido, la alta prevalencia en América Latina del conjunto de alteraciones metabólicas que lo conforman sugiere que el síndrome metabólico es una entidad nosográfica útil en el contexto de la medicina latinoamericana. Por lo tanto, en el presente documento se presta especial atención a este síndrome con el fin de alertar a los médicos de una particular población de alto riesgo que por lo general es subestimada y en la que no se tratan en forma óptima los factores de riego que constituyen el síndrome metabólico. Las presentes recomendaciones son el resultado de las presentaciones y los debates en los paneles de discusión durante una reunión de 2días celebrada en Bucaramanga en octubre de 2012. Todos los participantes han aprobado las conclusiones finales. Los autores reconocen que la publicación y la difusión de las guías no serán suficientes para alcanzar los cambios recomendados tanto en las estrategias diagnósticas como terapéuticas, por lo que se han programado intervenciones que permitan identificar las barreras del conocimiento, de las actitudes y del comportamiento, lo que permitirá tanto a los médicos como a los pacientes una adecuada adherencia a las recomendaciones de las guías.
The present document has been prepared by a group of experts, members of Cardiology, Endocrinology, Internal Medicine, Nephrology and Diabetes societies of Latin American countries, to serve as a guide to physicians taking care of patients with diabetes, hypertension and comorbidities or complications of both conditions. Although the concept of metabolic syndrome is currently disputed, the higher prevalence in Latin America of that cluster of metabolic alterations has suggested that metabolic syndrome is useful nosography entity in the context of Latin American medicine. Therefore, in the present document, particular attention is paid to this syndrome in order to alert physicians on a particular high- risk population, usually underestimated and undertreated. These recommendations results from presentation and debates by discussion panels during a 2-day conference held in Bucaramanga, in October 2012, and all the participants have approved the final conclusions. The authors acknowledge that the publication and diffusion of guidelines do not suffice to achieve the recommended changes in diagnostic or therapeutic strategies, and plan suitable interventions overcoming both physicians and patients from effectively adhering to guideline recommendations.
La hipertensión arterial, la diabetes y el conjunto de signos y síntomas que conforman el denominado síndrome metabólico son altamente frecuentes en América Latina y ocurren frecuentemente como condiciones asociadas. El desarrollo de recomendaciones diagnósticas y terapéuticas preparadas a través del trabajo conjunto de expertos de diferentes áreas de la medicina es deseable, considerando las bajas tasas de control alcanzadas de estas enfermedades en el mundo real y los beneficios que se pueden esperar cuando se alcanzan objetivos razonables. Los recursos para el cuidado de la salud, las prioridades para la inversión de estos recursos, el nivel socioeconómico de la población y las prevalencias de hipertensión, diabetes tipo2 y otras enfermedades relacionadas varían considerablemente en diferentes regiones del mundo, y también en diferentes países de una misma región, y aún más en diferentes áreas de un mismo país. Por tanto, las recomendaciones, para ser implementadas de forma útil en la práctica médica diaria, deben considerar las características particulares médicas y sociales de la región o del país donde deben ser aplicadas, y deben ser costo-efectivas en términos de las necesidades locales y de las posibilidades financieras y técnicas. Por estas razones, la Organización Mundial de la Salud (OMS), la Sociedad Internacional de Hipertensión (ISH)1 y la Sociedad Europea de Hipertensión (ESH), junto con la Sociedad Europea de Cardiología (ESC)2, han propuesto, en diferentes documentos, la necesidad de desarrollar guías regionales. Además, la aceptación y el uso de las guías regionales probablemente sean mejores si los médicos y expertos locales participan del desarrollo y de la subsecuente difusión e implementación de las guías3,4. Es por esto que este documento ha sido preparado por un grupo de expertos, miembros de sociedades nacionales y latinoamericanas de Cardiología, Endocrinología, Nefrología, Medicina Interna y Diabetes, para servir como una guía para los médicos que toman cuidado de los pacientes con diabetes, hipertensión y comorbilidades, o de las complicaciones de ambas condiciones. A pesar de que el concepto «síndrome metabólico» es actualmente controvertido, la alta prevalencia en América Latina de ese grupo de alteraciones metabólicas determina que el síndrome metabólico sea una entidad nosográfica útil en el contexto de la medicina latinoamericana. Por lo tanto, en el presente documento se presta especial atención a este síndrome con el fin de alertar a los médicos en una población particular de alto riesgo, generalmente subestimada y subtratada.
Estas recomendaciones son el resultado de las presentaciones y debates de los paneles de discusión durante una reunión de 2días celebrada en Bucaramanga, en octubre de 2012. Los consultores y moderadores de las sesiones plenarias fueron el Dr. Stephen Harrap y el Dr. Alberto Zanchetti, y todos los participantes aprobaron las conclusiones finales.
Los autores reconocen que la publicación y difusión de las guías no son suficientes para alcanzar los cambios recomendadas en el diagnóstico o en estrategias terapéuticas, y han programado acciones apropiadas que permitan superar las barreras comportamentales tanto de los médicos como de los pacientes, lo que permitirá de manera efectiva la adhesión a las recomendaciones de las guías5,6.
Existe una gran diversidad de las características socioeconómicas en los países de América Latina, y esto se refleja en diferencias en las tasas de morbimortalidad cardiovascular. A diferencia de lo que ha ocurrido en Estados Unidos y en Europa Occidental, en la mayoría de los países de América Latina la tasa de mortalidad cardiovascular ha aumentado durante las últimas décadas del sigloxx y comienzos del sigloxxi, con la excepción de Argentina y Uruguay. Pero incluso en estos últimos países la morbilidad cardiovascular y la prevalencia de los factores de riesgo cardiovascular se han mantenido sin cambios o han aumentado, especialmente la hipertensión arterial, la obesidad, el síndrome metabólico y la diabetes7,8. De hecho, años antes de que se presente el actual incremento de las enfermedades cardiovasculares (ECV) se dieron los cambios de estilo de vida en la región, especialmente de hábitos alimenticios tradicionales hacia modelos occidentales de la nutrición, lo que puede haber facilitado la expresión genética de estas enfermedades9. Además, los patrones de morbilidad se complican aún más por el fenómeno de la migración progresiva de la población rural a las zonas urbanas, lo que incrementa la periferia urbana con una población de bajos ingresos individuales, hecho que favorece la presencia de factores de riesgo emergentes como la aculturación, la violencia, el estrés y la desnutrición7.
Prevalencia de hipertensión arterial en América LatinaLos factores de riesgo cardiovascular se definen como características biológicas o formas de vida que aumentan la probabilidad (riesgo) de morbimortalidad cardiovascular10. Como factores de riesgo cardiovascular, la hipertensión generalmente integra un conjunto de factores de riesgo definidos, operativamente, como el síndrome metabólico. Entre estos factores de riesgo la hipertensión arterial es la primera causa de mortalidad a nivel mundial, y la tercera causa de incapacidad inducida por enfermedad después de la desnutrición y de las enfermedades sexuales11.
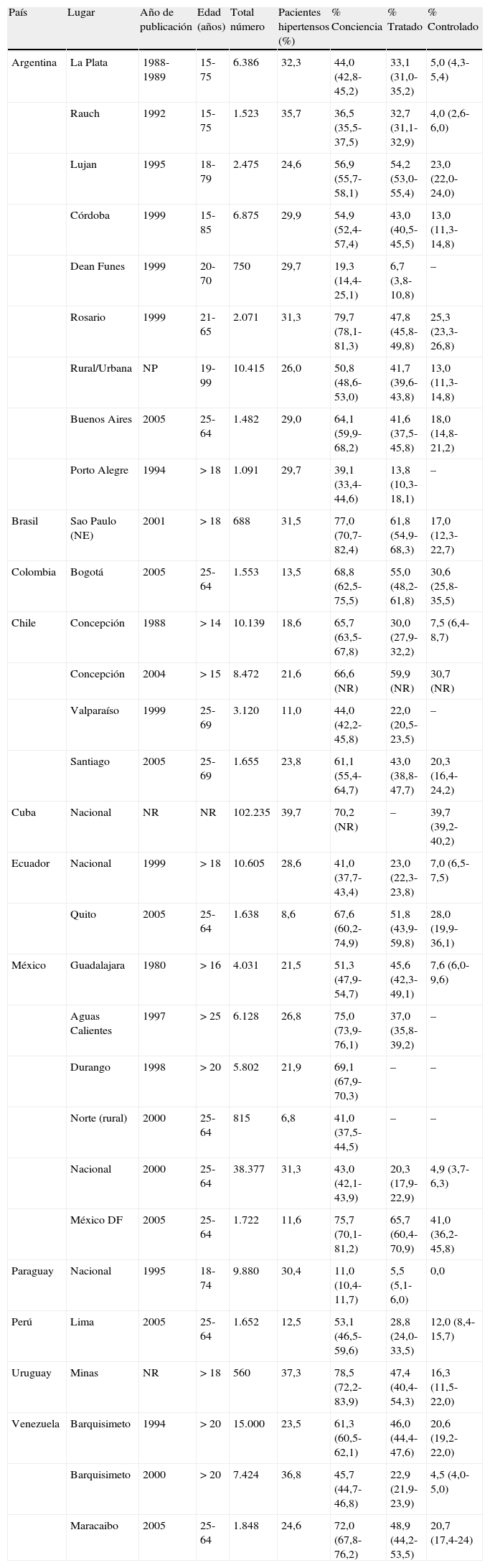
La tabla 1 muestra la prevalencia, el conocimiento, el tratamiento y el control de la hipertensión arterial en América Latina. La prevalencia de la hipertensión12-14 fue similar en Argentina (25-36%), Uruguay (30%), Paraguay (21-30%) y el sur de Brasil (31-33%). En Chile15 se encontraron diferencias dependiendo del nivel socioeconómico (bajas condiciones: 24,5%; altas condiciones: 17,9%). En México se observaron diferencias dependiendo de las zonas: 30% a nivel urbano, 11,7% a nivel rural16. El estudio reciente17 (Chow et al., en preparación) Prospectivo Urbano Rural Epidemiología (PURE) incluyó 153.996 adultos (35-70años) de 628comunidades rurales y urbanas de 3países de ingresos altos (PIA), 7países de ingresos medios altos (PIMA), 3países de ingresos medios bajos (PIMB) y 4países de ingresos bajos (PIB) en diversas partes del mundo. La hipertensión se definió cuando los individuos dijeron que recibían tratamiento para la hipertensión o tenían un promedio de presión arterial (PA) mayor de 140/90mmHg en 2mediciones de PA tomadas en posición sentada en reposo utilizando un dispositivo digital automatizado. Globalmente, el 40,7% de los participantes tuvieron hipertensión: el 13,3% presentaban una PA de al menos 160/100mmHg y el 4,4% una PA de al menos 180/110mmHg. De las personas con hipertensión, el 46,4% eran conscientes de esta condición, el 40,6% estaban en tratamiento farmacológico, pero solo el 13,1% tenían la PA controlada (<140/90mmHg).
Tasas de conocimiento, tratamiento y control de la hipertensión arterial en América Latina
| País | Lugar | Año de publicación | Edad (años) | Total número | Pacientes hipertensos (%) | % Conciencia | % Tratado | % Controlado |
| Argentina | La Plata | 1988-1989 | 15-75 | 6.386 | 32,3 | 44,0 (42,8-45,2) | 33,1 (31,0-35,2) | 5,0 (4,3-5,4) |
| Rauch | 1992 | 15-75 | 1.523 | 35,7 | 36,5 (35,5-37,5) | 32,7 (31,1-32,9) | 4,0 (2,6-6,0) | |
| Lujan | 1995 | 18-79 | 2.475 | 24,6 | 56,9 (55,7-58,1) | 54,2 (53,0-55,4) | 23,0 (22,0-24,0) | |
| Córdoba | 1999 | 15-85 | 6.875 | 29,9 | 54,9 (52,4-57,4) | 43,0 (40,5-45,5) | 13,0 (11,3-14,8) | |
| Dean Funes | 1999 | 20-70 | 750 | 29,7 | 19,3 (14,4-25,1) | 6,7 (3,8-10,8) | – | |
| Rosario | 1999 | 21-65 | 2.071 | 31,3 | 79,7 (78,1-81,3) | 47,8 (45,8-49,8) | 25,3 (23,3-26,8) | |
| Rural/Urbana | NP | 19-99 | 10.415 | 26,0 | 50,8 (48,6-53,0) | 41,7 (39,6-43,8) | 13,0 (11,3-14,8) | |
| Buenos Aires | 2005 | 25-64 | 1.482 | 29,0 | 64,1 (59,9-68,2) | 41,6 (37,5-45,8) | 18,0 (14,8-21,2) | |
| Porto Alegre | 1994 | > 18 | 1.091 | 29,7 | 39,1 (33,4-44,6) | 13,8 (10,3-18,1) | – | |
| Brasil | Sao Paulo (NE) | 2001 | > 18 | 688 | 31,5 | 77,0 (70,7-82,4) | 61,8 (54,9-68,3) | 17,0 (12,3-22,7) |
| Colombia | Bogotá | 2005 | 25-64 | 1.553 | 13,5 | 68,8 (62,5-75,5) | 55,0 (48,2-61,8) | 30,6 (25,8-35,5) |
| Chile | Concepción | 1988 | > 14 | 10.139 | 18,6 | 65,7 (63,5-67,8) | 30,0 (27,9-32,2) | 7,5 (6,4-8,7) |
| Concepción | 2004 | > 15 | 8.472 | 21,6 | 66,6 (NR) | 59,9 (NR) | 30,7 (NR) | |
| Valparaíso | 1999 | 25-69 | 3.120 | 11,0 | 44,0 (42,2-45,8) | 22,0 (20,5-23,5) | – | |
| Santiago | 2005 | 25-69 | 1.655 | 23,8 | 61,1 (55,4-64,7) | 43,0 (38,8-47,7) | 20,3 (16,4-24,2) | |
| Cuba | Nacional | NR | NR | 102.235 | 39,7 | 70,2 (NR) | – | 39,7 (39,2-40,2) |
| Ecuador | Nacional | 1999 | > 18 | 10.605 | 28,6 | 41,0 (37,7-43,4) | 23,0 (22,3-23,8) | 7,0 (6,5-7,5) |
| Quito | 2005 | 25-64 | 1.638 | 8,6 | 67,6 (60,2-74,9) | 51,8 (43,9-59,8) | 28,0 (19,9-36,1) | |
| México | Guadalajara | 1980 | > 16 | 4.031 | 21,5 | 51,3 (47,9-54,7) | 45,6 (42,3-49,1) | 7,6 (6,0-9,6) |
| Aguas Calientes | 1997 | > 25 | 6.128 | 26,8 | 75,0 (73,9-76,1) | 37,0 (35,8-39,2) | – | |
| Durango | 1998 | > 20 | 5.802 | 21,9 | 69,1 (67,9-70,3) | – | – | |
| Norte (rural) | 2000 | 25-64 | 815 | 6,8 | 41,0 (37,5-44,5) | – | – | |
| Nacional | 2000 | 25-64 | 38.377 | 31,3 | 43,0 (42,1-43,9) | 20,3 (17,9-22,9) | 4,9 (3,7-6,3) | |
| México DF | 2005 | 25-64 | 1.722 | 11,6 | 75,7 (70,1-81,2) | 65,7 (60,4-70,9) | 41,0 (36,2-45,8) | |
| Paraguay | Nacional | 1995 | 18-74 | 9.880 | 30,4 | 11,0 (10,4-11,7) | 5,5 (5,1-6,0) | 0,0 |
| Perú | Lima | 2005 | 25-64 | 1.652 | 12,5 | 53,1 (46,5-59,6) | 28,8 (24,0-33,5) | 12,0 (8,4-15,7) |
| Uruguay | Minas | NR | > 18 | 560 | 37,3 | 78,5 (72,2-83,9) | 47,4 (40,4-54,3) | 16,3 (11,5-22,0) |
| Venezuela | Barquisimeto | 1994 | > 20 | 15.000 | 23,5 | 61,3 (60,5-62,1) | 46,0 (44,4-47,6) | 20,6 (19,2-22,0) |
| Barquisimeto | 2000 | > 20 | 7.424 | 36,8 | 45,7 (44,7-46,8) | 22,9 (21,9-23,9) | 4,5 (4,0-5,0) | |
| Maracaibo | 2005 | 25-64 | 1.848 | 24,6 | 72,0 (67,8-76,2) | 48,9 (44,2-53,5) | 20,7 (17,4-24) |
IC: intervalo de confianza; NR, no reportado.
Conocimiento, tratamiento y control hace referencia a pacientes que son conscientes de la hipertensión arterial, que están recibiendo tratamiento y que han alcanzado valores <140/90mmHg. Los valores en estos casos son dados como porcentaje de la población de hipertensos (IC95%).
La prevalencia de hipertensión arterial fue similar en los PIMA (46,6%), los PIA (40,7%) y los PIMB (39,6%), pero más baja en los PIB (32,2%). Los porcentajes de conciencia de la enfermedad fueron PIA: 49,1%; PIMA: 52,4%; PIMB: 43,5%, y PIB: 40,8% (tendencia: p<0,001), el porcentaje de pacientes en tratamiento fueron 46,8, 48,3, 36,8 y 31,7%, respectivamente (tendencia: p<0,001) y el porcentaje de pacientes que tenían la PA controlada fueron 19, 15,5, 9,9 y 12,7%, respectivamente (tendencia: p<0,001), lo que demuestra que estos porcentajes fueron inversamente relacionados con el nivel económico del país (tabla 1).
La prevalencia, el conocimiento, los pacientes tratados y controlados fueron mayores en las zonas urbanas que en las comunidades rurales en los PIB y en los PIMB, pero esto no ocurrió en los PIA y en los PIMA. En general, el 12,5% de los pacientes hipertensos tratados recibieron 2 o más medicamentos para bajar la PA, con una tendencia decreciente a partir de los países ricos a los países más pobres (PIA: 18,1%; PIMA: 14,5%; PIMB: 14,1%, y PIB: 1,6%; p<0,0001). El bajo nivel de educación está fuertemente asociado con tasas más bajas de conocimiento, tratamiento y control de la PA en los países de menor nivel económico, pero esto es menos evidente en los países de mayores ingresos. La prevalencia de hipertensión fue mayor en los participantes con diabetes (63%), y a pesar de que la conciencia de la enfermedad fue del 74,4% y que el porcentaje de los diabéticos hipertensos que recibían tratamiento fue del 69,3%, el porcentaje de pacientes con adecuado control fue solo del 23,3%. El análisis por regiones indica que la prevalencia de hipertensión fue mayor en África (56,6%), seguido por Malasia (46,5%) y América del Sur (46,5%).
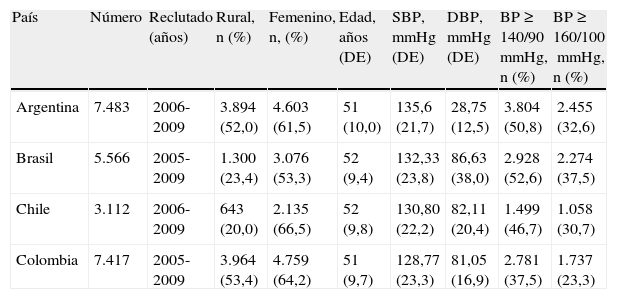
Los países de América del Sur incluidos en el estudio PURE fueron Argentina, Brasil, Colombia y Chile. La tabla 2 muestra las características de los individuos estudiados según el país. Los porcentajes de conocimiento, tratamiento y control de la hipertensión en los 4países de América del Sur en promedió fueron del 57,0, el 52,8 y el 18,3%, respectivamente (Chow et al., JAMA 2013, en prensa).
Características de los participantes de América del Sur por país
| País | Número | Reclutado (años) | Rural, n (%) | Femenino, n, (%) | Edad, años (DE) | SBP, mmHg (DE) | DBP, mmHg (DE) | BP≥140/90mmHg, n (%) | BP≥160/100mmHg, n (%) |
| Argentina | 7.483 | 2006-2009 | 3.894 (52,0) | 4.603 (61,5) | 51 (10,0) | 135,6 (21,7) | 28,75 (12,5) | 3.804 (50,8) | 2.455 (32,6) |
| Brasil | 5.566 | 2005-2009 | 1.300 (23,4) | 3.076 (53,3) | 52 (9,4) | 132,33 (23,8) | 86,63 (38,0) | 2.928 (52,6) | 2.274 (37,5) |
| Chile | 3.112 | 2006-2009 | 643 (20,0) | 2.135 (66,5) | 52 (9,8) | 130,80 (22,2) | 82,11 (20,4) | 1.499 (46,7) | 1.058 (30,7) |
| Colombia | 7.417 | 2005-2009 | 3.964 (53,4) | 4.759 (64,2) | 51 (9,7) | 128,77 (23,3) | 81,05 (16,9) | 2.781 (37,5) | 1.737 (23,3) |
PA>140/90mmHg: auto-reporte de hipertensión o valores de PA>140/90mmHg; PA>160/100mmHg: auto-reporte de hipertensión o valores de PA>160/100mmHg.
Adaptado de Chow et al. JAMA 2013, en prensa.
De los datos analizados se puede concluir que en todo el mundo la detección y el tratamiento de la hipertensión son deficientes, y que incluso la mayoría de los pacientes que están siendo tratados tienen mal control de la PA. Estos hallazgos fueron comunes en todos los países, independientemente de los niveles socioeconómicos, aunque el porcentaje de tratamiento y el control fueron marcadamente peores en los PIB. Por lo tanto, deben realizarse esfuerzos sistemáticos para la implementación a nivel comunitario de programas de detección eficientes, a través de la implementación de estrategias basadas en algoritmos simples que permitan un mejor tratamiento y control de la PA, programas que son cruciales para reducir la carga de las enfermedades relacionadas con la hipertensión.
Prevalencia del síndrome metabólico en América LatinaEn América Latina la prevalencia de los componentes del síndrome metabólico, como la hipertensión arterial, parece ir en aumento. Un gran cuerpo de estudios locales18–41 ha reportado que la prevalencia de síndrome metabólico en adultos oscila entre el 25 y el 45%, con diferencias importantes entre las zonas urbanas y rurales, pero las comparaciones son difíciles debido a las diferentes definiciones utilizadas. En pacientes con infarto agudo de miocardio o con accidente cerebrovascular27 la prevalencia fue tan alta como el 75%, independientemente de los criterios de diagnóstico utilizados para síndrome metabólico (International Diabetes Federation [IDF] o Adulto tratamiento PanelIII [ATPIII]).
Un reciente metaanálisis que incluyó 12estudios transversales realizados en los países latinoamericanos42 mostro que la prevalencia general (media ponderada) de síndrome metabólico según los criterios del ATPIII fue del 24,9% (rango: 18,8-43,3%). El síndrome metabólico fue ligeramente más frecuente en mujeres (25,3%) que en hombres (23,3%), y el grupo de edad con mayor prevalencia fue el de mayores de 50años. Los componentes más frecuentes de síndrome metabólico fueron bajas concentraciones de colesterol de lipoproteína de alta densidad (colesterol HDL; 62,9%) y obesidad abdominal (45,8%). Hallazgos similares se reportaron en el estudio multicéntrico CARMELA, realizado en ciudades capitales de los países de América Latina21 (tabla 2).
Prevalencia de diabetes tipo 2 en América LatinaEn la población urbana de América Latina la prevalencia de diabetes se sitúa entre el 4 y el 8%, y es mayor en los países o zonas con un nivel socioeconómico bajo o medio (tabla 3). Sin embargo, los datos son escasos y el porcentaje de pacientes sin confirmación del diagnóstico es alrededor del 30-50%, y puede ser mayor en las zonas rurales. El estudio CARMELA12, realizado en 7ciudades de países de América Latina durante el año 2005, encontró que la prevalencia de diabetes tuvo casi el doble de los valores previamente reportados. La prevalencia de diabetes fue del 6% en Barquisimeto (Venezuela), del 8% en Bogotá (Colombia), del 6,2% en Buenos Aires (Argentina), del 8,9% en México DF (México), y del 7,2% en Santiago (Chile). Al igual que en otras áreas del mundo, la creciente prevalencia de diabetes en América Latina se debe principalmente a los cambios en los estilo de vida: menor actividad física, mayor consumo de calorías y aumento de la prevalencia de sobrepeso/obesidad, decurrentes de la acelerada urbanización.
En sujetos con diabetes la prevalencia de hipertensión arterial es de 1,5 a 3 veces mayor que en los individuos no diabéticos con edad similar, asociación particularmente alta en países de medianos y bajos ingresos12,43–48.
Prevalencia de sobrepeso y obesidad en América LatinaDiferentes encuestas realizadas en América Latina44–61 reportan una importante prevalencia de personas con sobrepeso (IMC 25-29,9kg/m2) y obesidad (IMC ≥30kg/m2) (tabla 3).
En Rosario (Argentina)48, la prevalencia de sobrepeso fue del 40% y la de obesidad del 29%. En la ciudad de Río de Janeiro55 el sobrepeso estuvo presente en el 40% y la obesidad en el 21% de la población estudiada. En México43,49, la prevalencia de sobrepeso fue del 37% en las zonas rurales y del 48% en México DF, y la obesidad fue de alrededor del 21% (rural: 7%; DF: 29%). En Cuba54, el sobrepeso y la obesidad en conjunto alcanzaron cifras de alrededor del 22%. En muchos estudios hubo una fuerte asociación entre obesidad e hipertensión arterial, con el 40% de los individuos presentando hipertensión arterial y obesidad.
Las estimaciones de la prevalencia específica de obesidad han demostrado una gran variabilidad entre las poblaciones latinoamericanas, que van desde el 9,9 hasta el 35,7%57. Las mujeres23,33,37,51 y las personas que habitan en las zonas urbanas41 han sido identificadas como los grupos predominantemente afectados. Además, la obesidad ha sido relacionada de forma independiente con bajo estatus socioeconómico y bajos niveles educativos49,53, lo que contribuye a las desigualdades en salud observadas en la región59,60. Sin embargo, hay evidencia de una tendencia secular hacia el aumento de la prevalencia de obesidad en los países económicamente más desarrollados de América Latina61.
Al igual que en los adultos, la obesidad se ha convertido también en un problema de salud en los niños de América Latina, debido al alto riesgo de persistencia de la obesidad en la edad adulta asociada al desarrollo de hipertensión arterial22,50,51.
Síndrome metabólico, diabetes e hipertensión arterial: definición, diagnóstico y evaluación clínicaSíndrome metabólicoComo se mencionó anteriormente, el concepto de síndrome metabólico es controvertido, principalmente porque resulta difícil probar que el riesgo cardiovascular en las personas con síndrome metabólico es mayor que el atribuible a la suma del riesgo atribuible a cada uno de sus componentes. El síndrome metabólico es un cuadro clínico con características fácilmente detectables, y a pesar de esto todavía permanece insuficientemente diagnosticado, aunque tiene la ventaja de que bajo un solo término agrupa un conjunto de alteraciones metabólicas muy prevalentes en América Latina. Por lo tanto, es un instrumento útil para identificar a individuos en alto riesgo de ECV y de diabetes. Actualmente está bien aceptado que todos los componentes del síndrome metabólico están asociados con resistencia a la insulina26,62,63.
El reciente consenso del Grupo de Trabajo en Epidemiología y Prevención de la Federación Internacional de Diabetes (FID), del Instituto Nacional del Corazón, Pulmón y Sangre de Estados Unidos, de la Asociación Americana del Corazón, de la Federación Mundial del Corazón, de la Sociedad Internacional de Aterosclerosis y de la Asociación Internacional para el Estudio de la Obesidad62 propuso que la presencia de 3 de los 5 criterios siguientes hacen el diagnóstico de síndrome metabólico:
- (1)
Circunferencia de cintura elevada, cuya definición es específica para cada población y cada país.
- (2)
Triglicéridos iguales o mayores a 150mg/dl, o tratamiento farmacológico para la elevación de los triglicéridos.
- (3)
Reducción de colesterol HDL a menos de 40mg/dl en hombres y menos de 50mg/dl en mujeres. (El tratamiento con medicamentos para reducir el colesterol HDL tal como ácido nicotínico es un indicador alternativo.)
- (4)
PA en el rango alto de la normalidad o hipertensión (presión arterial sistólica [PAS]≥130mmHg y/o presión arterial diastólica [PAD]≥85mmHg) o en tratamiento farmacológico actual con antihipertensivos
- (5)
Glucosa venosa en ayunas igual o mayor a 100mg/dl o en tratamiento farmacológico con hipoglucemiantes.
Varios autores consideran que la obesidad central (abdominal) es el principal factor en el síndrome metabólico y debería incluirse como obligatorio en su diagnóstico. Para definir el punto de corte de obesidad abdominal en América Latina, un estudio reciente64, el cual incluyó las capitales de varios países, recomendó valores de cintura iguales o mayores a 94cm para los hombres y 88cm en las mujeres. Sin embargo, un importante número de estudios independientes realizados en diferentes poblaciones de América Latina han demostrado que los puntos de corte sugeridos por la FID (90cm para hombres y de 80cm para mujeres) son los que mejor se relacionan con la presencia de los otros componentes del síndrome metabólico27,28,30,34,36.
A pesar de que no existen estudios de cohorte en América Latina que evalúen la relación de los puntos de corte de la circunferencia de la cintura con el desarrollo de diabetes o de ECV, es de esperarse que, como ocurre con la mayoría de los otros factores de riesgo cardiovascular, la relación sea continua y que cualquier punto de corte se basa en convenciones arbitrarias. La elección de los autores de este documento de consenso es usar los valores de corte propuestos por la FID (90cm para hombres y 80cm para mujeres).
Los factores de riesgo que se asocian con un mayor riesgo de síndrome metabólico se enumeran a continuación:
- (1)
Antecedentes familiares de diabetes mellitus tipo2.
- (2)
Diabetes mellitus gestacional.
- (3)
Macrosomía.
- (4)
Bajo peso al nacer.
- (5)
Desnutrición infantil.
- (6)
Alta mortalidad perinatal y/o presencia temprana de ECV en familiares de primer orden.
- (7)
Hábito sedentario.
- (8)
Dieta rica en grasa animal.
- (9)
Raza.
- (10)
Bajo nivel socioeconómico.
- (11)
Historia de dislipidemia, obesidad e hipertensión.
- (12)
Hiperandrogenismo en la mujer.
- (13)
Acantosis nigricans.
El diagnóstico de síndrome metabólico puede ser útil para la identificación de sujetos en los cuales se puede realizar prevención primaria de diabetes mellitus, hipertensión y ECV. Se espera que un aumento en la detección mejore la conciencia tanto en los pacientes como en los médicos del riesgo cardiometabólico que corren estos individuos, y en consecuencia sea útil para reforzar la motivación para realizar los cambios necesarios en los estilos de vida y en la reducción de peso. Al momento no existen estudios que demuestren que el tratamiento del síndrome metabólico con medicamentos sea útil. Sin embargo, es claro que cuando la PA, los lípidos y la glucosa en plasma están por encima del umbral aceptado para definir hipertensión, dislipidemia y diabetes, el tratamiento medicamentoso antihipertensivo, antilipídico y antidiabético debe ser iniciado.
Diabetes tipo 2Los criterios para el diagnóstico de la diabetes mellitus tipo 2, aprobados y recomendados por el Consenso Latinoamericano, son las siguientes:
- (1)
Glucosa plasmática en ayunas igual o mayor a 126mg/dl en 2lecturas sucesivas.
- (2)
Glucosa plasmática igual o mayor a 200mg/dl después de 120min de administrados 75g de glucosa en la prueba de sobrecarga oral a la glucosa.
- (3)
Glucosa plasmática igual o mayor a 200mg/dl en cualquier momento día en presencia de síntomas.
Estos son los mismos criterios de la Asociación Americana de Diabetes (ADA)65, los cuales fueron adoptados por el Consenso. Sin embargo, se destacó la importancia del test de tolerancia oral a la glucosa (TTOG) como una herramienta diagnóstica más específica. Se consideró que si bien el recién revivido término «prediabetes» y los menores puntos de corte para definir intolerancia a la glucosa (glucosa en ayunas alterada [GAA: 100-125mg/dl] y/o TTOG alterado [TTOG: 140-199mg/dl]) pueden mejorar la detección de la diabetes66,67, el costo-efectividad de estas estrategia en términos de implementación de programas de tratamiento y prevención de las complicaciones es todavía desconocido68, por lo cual el Consenso prefirió recomendar la clasificación de la ADA65.
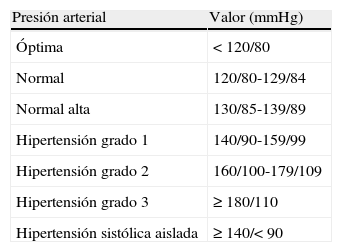
Hipertensión: clasificación y diagnósticoDespués de considerar las clasificaciones propuestas por el Séptimo Reporte del Comité Nacional Conjunto en Prevención, Detección, Evaluación y Tratamiento de la Hipertensión Arterial69, las guías de la ESH-ESC 2007 sobre el manejo de la hipertensión70, la revaluación del 2009 de la Guías Europeas71 y el anterior Consenso Latinoamericano de Hipertensión Arterial10, se decidió, como se muestra en la tabla 4, mantener el concepto de que la hipertensión arterial se diagnostica cuando los valores de PA son iguales o mayores a 140 o 90mmHg tomados en el consultorio del médico o en una clínica. Por encima de este valor, la hipertensión puede ser subdividida en grados1, 2 o 3. Esta clasificación también se aplica para la hipertensión sistólica aislada, la cual debe ser diagnosticada y tratada, especialmente en pacientes ancianos. Los pacientes ancianos mayores de 80años deben ser diagnosticados como hipertensos cuando la PA es igual o mayor a 150/90mmHg. En pacientes de edad avanzada la PA también debe medirse en posición de pie para detectar un posible descenso ortostático excesivo (tabla 4).
Clasificación de la presión arterial e hipertensión recomendado por el Consenso Latinoamericano
| Presión arterial | Valor (mmHg) |
| Óptima | <120/80 |
| Normal | 120/80-129/84 |
| Normal alta | 130/85-139/89 |
| Hipertensión grado 1 | 140/90-159/99 |
| Hipertensión grado 2 | 160/100-179/109 |
| Hipertensión grado 3 | ≥180/110 |
| Hipertensión sistólica aislada | ≥140/<90 |
La hipertensión arterial se clasifica como primaria, esencial o idiopática cuando la PA es consistentemente más alta que lo normal sin causa conocida, la cual representa más del 90% de todos los casos. Se define como hipertensión secundaria cuando la PA se eleva como resultado de una causa subyacente, identificable y con frecuencia corregible (el restante 10% de los pacientes hipertensos). El diagnóstico de la hipertensión debe basarse en al menos 3 mediciones diferentes de PA, tomadas en al menos 2 visitas separadas al consultorio o al hospital. Se diagnostica de hipertensión arterial cuando la PA es al menos 140 y/o 90mmHg. Aunque los valores obtenidos en el consultorio o en la clínica son en los que se basa usualmente el diagnóstico y el tratamiento, existen métodos adicionales de medición de la PA que son útiles en varios casos. La monitorización ambulatoria de la PA durante 24h (MAPA) está más relacionada con el pronóstico que la PA tomada en el consultorio72,73 y permite detectar 2 subgrupos de pacientes hipertensos cuando la PA ambulatoria y la del consultorio son divergentes: la hipertensión de bata blanca (hipertensión en el consultorio y normotensión ambulatoria) y la hipertensión enmascarada (normotensión en el consultorio e hipertensión ambulatoria). Los valores de corte para el diagnóstico de hipertensión mediante la MAPA se indican en la tabla 5.
Hipertensión: criterios de presión arterial
| Hipertensión | Presión arterial ≥140/90mmHg tomada en el consultorio o en el hospital (promedio de 3 mediciones/visita, durante 3 visitas) |
| MAPA 24h ≥130/80mmHg, MAPA diurna ≥135/85mmHg | |
| PA tomada en casa o auto-medición ≥135/85mmHg | |
| Hipertensión de bata blanca | Hipertensión en el consultorio o en el hospital y normotensión ambulatoria o en casa |
| Hipertensión enmascarada | Normotensión en el consultorio o en el hospital con hipertensión ambulatoria o en el hogar |
Hay situaciones clínicas en las que la MAPA es útil para el diagnóstico de hipertensión; por ejemplo, cuando se sospecha de hipertensión de bata blanca, cuando los pacientes con hipertensión marcada no presentan signos de daño de órgano blanco y cuando se observan importantes diferencias en los valores de PA medidos en diferentes visitas.
La indicación de toma de la PA en casa se da cuando se desea aumentar la aceptación del tratamiento, que se conoce por aumentar el cumplimiento del tratamiento. Solo se deben utilizar dispositivos automáticos validados y el paciente debe ser instruido para realizar las mediciones en la posición sentada, después de varios minutos de reposo, idealmente en la mañana y en la tarde. Durante el tratamiento, las mediciones deben hacerse en la mañana antes de la toma de los medicamentos antihipertensivos.
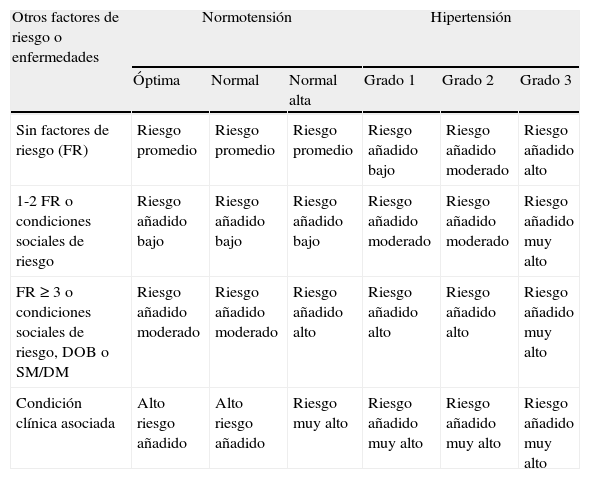
En el manejo del paciente hipertenso no solo deben considerarse los niveles de PA, sino también el riesgo cardiovascular global. Con el fin de estratificar el riesgo cardiovascular global debe considerarse el número de factores de riesgo presentes, la ausencia o presencia de lesiones de órgano blanco y las condiciones clínicas previas o simultáneas, incluyendo el síndrome metabólico y la diabetes, junto con la clasificación de PA que se resumen en la tabla 6.
Estratificación del riesgo en pacientes con síndrome metabólico, hipertensión y diabetes tipo 2
| Otros factores de riesgo o enfermedades | Normotensión | Hipertensión | ||||
| Óptima | Normal | Normal alta | Grado 1 | Grado 2 | Grado 3 | |
| Sin factores de riesgo (FR) | Riesgo promedio | Riesgo promedio | Riesgo promedio | Riesgo añadido bajo | Riesgo añadido moderado | Riesgo añadido alto |
| 1-2 FR o condiciones sociales de riesgo | Riesgo añadido bajo | Riesgo añadido bajo | Riesgo añadido bajo | Riesgo añadido moderado | Riesgo añadido moderado | Riesgo añadido muy alto |
| FR ≥ 3 o condiciones sociales de riesgo, DOB o SM/DM | Riesgo añadido moderado | Riesgo añadido moderado | Riesgo añadido alto | Riesgo añadido alto | Riesgo añadido alto | Riesgo añadido muy alto |
| Condición clínica asociada | Alto riesgo añadido | Alto riesgo añadido | Riesgo muy alto | Riesgo añadido muy alto | Riesgo añadido muy alto | Riesgo añadido muy alto |
DM: diabetes mellitus; DOB: daño de órgano blanco; FR: factor de riesgo; SM: síndrome metabólico.
En los individuos con diabetes como resultado de la alteración de la función autonómica y el daño extenso de órganos son comunes la presencia de una mayor variabilidad de la PA, una marcada respuesta ortostática y un importante deterioro de la reducción nocturna de la PA72. Estas características tienen implicaciones diagnósticas, pronósticas y terapéuticas. Así, se recomienda que el número de mediciones de PA para la toma de decisiones debe ser mayor, la detección de hipotensión ortostática debe ser un procedimiento de rutina, y la toma de PA en el hogar y sobre todo de la MAPA debe realizarse siempre que sea posible. La información actualizada sobre este tema está disponible73, y es aconsejable la formación de los médicos en la interpretación de estos datos.
Las recomendaciones sobre la evaluación diagnóstica en los pacientes con hipertensión y diabetes se resumen en la tabla 7. Las recomendaciones para el seguimiento son las siguientes:
- (1)
HbA1c (cada 4 meses).
- (2)
Automonitorización de la glucosa en sangre (cada 24 a 48h).
- (3)
Anualmente evaluación de fondo de ojo, ECG, microalbuminuria, pruebas básicas de laboratorio.
- (4)
Cada 2años realizar ecocardiograma y electrocardiograma de esfuerzo (para detectar posible isquemia silente) (tabla 6).
Recomendaciones de evaluación diagnóstica de los pacientes hipertensos con diabetes mellitus
| Investigaciones básicas o mínimas | Historia clínica y examen físico |
| Medición de la presión (según AAD) | |
| ECG | |
| Pruebas de laboratorio: glucemia en ayunas y HbA1c, creatinina sérica, perfil de lípidos, enzimas hepáticas, Na+, K+Microalbuminuria (según AAD) | |
| Fondo de ojo (si es anormal, interconsulta al oftalmólogo) | |
| Investigaciones opcionales | MAPA |
| ECG de esfuerzo (en hombres >40 años y en mujeres posmenopáusicas) | |
| Ecocardiograma Doppler |
AAD: Asociación Americana de Diabetes; MAPA: monitorización ambulatoria de la PA.
En términos de riesgo cardiovascular total, la presencia de diabetes generalmente se considera que implica un nivel alto de riesgo, pero es razonable pensar que el riesgo cardiovascular es diferente si la diabetes es de reciente diagnostico o si es de larga duración, en ausencia o en presencia de complicaciones. En pacientes normotensos con diabetes no hay ninguna evidencia de que la administración de fármacos reductores de la PA sea de algún beneficio.
Complicaciones renales y cardiovasculares en pacientes hipertensos diabéticosLos pacientes con diabetes e hipertensión tienen un mayor riesgo de enfermedad renal, enfermedad cardíaca coronaria (ECC), accidente cerebrovascular e insuficiencia cardíaca. La asociación con comorbilidades como la dislipidemia, el estado protrombótico y la disfunción autonómica74 contribuye a aumentar la morbimortalidad.
Nefropatía diabéticaLa prevalencia de la nefropatía en pacientes con diabetes tipo2 es del 30 al 50%75. Se han descrito 3 etapas en su desarrollo76:
- (1)
Nefropatía incipiente, con una duración de unos 10años. Cursa con una tasa supranormal de filtración glomerular (TFG), que después de unos 5años se acompaña de aumento de la excreción urinaria de albúmina (EUA: 30-300mg/día para microalbuminuria). La presencia de un aumento de la EUA identifica a los pacientes diabéticos con alto riesgo de desarrollar daño renal progresivo y ECV.
- (2)
Nefropatía clínica evidente, caracterizada por una EUA mayor de 300mg/día (proteinuria), TFG normal o moderadamente reducida e hipertensión. Si no se tratan, estos pacientes tienen un alto riesgo de desarrollar enfermedad renal terminal (ERT). Sin una adecuada intervención, esta condición puede progresar rápidamente, y el 50% de los pacientes pueden llegar a ERT en 10años y el 75% en 20años. A la inversa, las intervenciones terapéuticas en ambos tipos de diabetes disminuyen la velocidad de la alteración de la TFG y la progresión a ERT y la TFG. Se ha informado que del 20 al 40% de los individuos con EUA pueden progresar a la macroalbuminuria y el 20% de ellos a ERT.
- (3)
Insuficiencia renal progresiva que cursa con proteinuria franca (≥300mg/dl) y una notable reducción de la TFG (<30ml/min). La macroalbuminuria identifica a los pacientes diabéticos con daño renal histológico sustancial y predice un descenso lineal de la TFG.
Para la detección de la aparición y la progresión de la nefropatía diabética es obligatoria la evaluación de EUA todos los años desde el inicio de la diabetes tipo2, y el cálculo de la TFG a partir de la creatinina sérica mediante el uso de una de las fórmulas actualmente validadas (Modificación de la Dieta en Enfermedad Renal [MDRD] o por la fórmula del Grupo Colaborador de la Epidemiologia de la Enfermedad Renal Crónica [CKD-EPI]).
Enfermedad cardíaca coronariaLos pacientes hipertensos con diabetes tipo2 tienen un riesgo 1,9 veces mayor de presentar ECV que los pacientes hipertensos sin diabetes77. Se considera que factores como los niveles de fibrinógeno elevados, en particular durante el control glucémico deficiente, los niveles elevados del inhibidor-1 del activador de plasminógeno y la aumentada agregación plaquetaria pueden ser los responsables78. Estas alteraciones relacionadas con la diabetes pueden aumentar el riesgo de trombosis en el sitio de rotura de la placa y también el riesgo de reinfarto después de la terapia trombolítica o de la revascularización. Además son frecuentes las arritmias cardíacas como consecuencia de la disfunción autonómica. La evaluación de la ECC debe incluir una prueba de esfuerzo ser seguido, si es positivo, por un estudio de perfusión miocárdica (tomografía computarizada por emisión de fotón único).
Disfunción ventricular izquierda e insuficiencia cardíacaLa diabetes es un importante factor de riesgo para disfunción ventricular izquierda e insuficiencia cardíaca. En el estudio Monica Glasgow la incidencia de disfunción ventricular izquierda fue mayor en los pacientes diabéticos (29%) en comparación con los no diabéticos (7%)79. En el estudio de Framingham el riesgo relativo de insuficiencia cardíaca clínica fue 3,8 veces mayor en hombres diabéticos y 5,5 veces en mujeres con diabetes, en comparación con población sin diabetes80. En los pacientes diabéticos con hemoglobina glucosilada (HbA1c) menor de 7,0% la tasa de falla cardíaca fue 4,2 por 1.000 pacientes-año, la misma que aumentó a 9,2/1.000 pacientes-año cuando la HbA1c fue mayor del 10%80. El mal pronóstico de estos pacientes ha sido explicado por una miocardiopatía diabética subyacente, agravada por la hipertensión y por la enfermedad isquémica del corazón81.
La alta prevalencia y las implicaciones en la morbimortalidad que tiene la insuficiencia cardíaca determinan la imperiosa necesidad de la identificación temprana de sus factores de riesgo y de los signos clínicos asociados. Una historia clínica cuidadosa ayuda a detectar los síntomas de la insuficiencia cardíaca (disnea de esfuerzo, ortopnea, tos nocturna y fatigabilidad fácil), a pesar de que los pacientes con disfunción sistólica del ventrículo izquierdo pueden no presentar estos síntomas82. Por lo tanto, el diagnóstico de insuficiencia cardíaca en pacientes diabéticos e hipertensos puede requerir pruebas adicionales. Aunque el electrocardiograma y la radiografía de tórax pueden ser útiles, la ecocardiografía Doppler es necesaria para visualizar las alteraciones cardíacas estructurales y funcionales que subyacen a la insuficiencia cardíaca, y es la prueba recomendada cuando se sospecha insuficiencia cardíaca. Como la insuficiencia cardíaca es un predictor de muerte cardíaca súbita, se recomienda la realización de un ECG Holter para la detección de arritmias.
Accidente cerebrovascularLas tasas de discapacidad relacionada con ictus y accidente cerebrovascular son más altas en los diabéticos que en los no diabéticos83. El riesgo de accidente cerebrovascular fatal versus no fatal es mayor cuanto mayor es el nivel de Hb A1C, incluso muchos años antes que se presente el evento83–85.
Tratamiento de la hipertensión arterial en pacientes diabéticosTratamiento no farmacológicoPlan dietéticoEl consumo de hidratos de carbono debe representar el 55-60% de la ingesta total de calorías (ITC), minimizando los hidratos de carbono simples refinados (azúcar, miel, fructosa, melaza, etc.), al tiempo que se debe aumentar los hidratos de carbono complejos (verduras, frutas y granos enteros). El uso de edulcorantes no calóricos está permitido, pero se deben seleccionar los que tienen bajo contenido de sodio.
El consumo de proteínas debe ser de 0,8-1g/kg del peso corporal ideal. Las proteínas animales son preferibles debido a su alto valor biológico, pero legumbres y cereales deben ser incluidos para agregar a la proteína la fibra. La fibra debe consumirse en una cantidad aproximada 30g/día, preferiblemente fibra soluble.
El consumo de grasa no debe ser mayor que el 30% de la ITC; el 10% debe ser saturada (grasa láctea y sus derivados), el 10% poliinsaturada (aceites vegetales, frutos secos, pescado) y el 10% monoinsaturada (aguacate, aceitunas, carne de cerdo, pollo).
Las recomendaciones de vitaminas y oligoelementos son similares a las que se recomiendan para la población general. Así, el consumo de sodio debe ser de 3,2g/día (4-6g de cloruro de sodio), para lo cual hay que evitar los alimentos procesados. Es conveniente conocer el contenido de sodio del agua potable en la región de Latinoamérica, ya que esta puede variar ampliamente, como acontece con el agua embotellada. Se deben realizar esfuerzos para alcanzar las recomendaciones en el consumo de calcio, sobre todo en las dietas hipocalóricas, a través de una elección adecuada de los alimentos. Es necesario considerar las circunstancias que pueden interferir con la absorción de calcio (síndrome de mala absorción, alimentos ricos en fitohemaglutininas, drogas, etc.). Las necesidades de potasio normalmente se pueden satisfacer mediante el aumento en el consumo de verduras y frutas en la dieta.
En relación con el consumo de cafeína, no existen evidencias consistentes de los riesgos o beneficios del consumo crónico moderado de café (2 tazas/día), mientras que el consumo de alcohol está directamente relacionado con los niveles de PA y con la prevalencia de hipertensión en diferentes poblaciones. También hay pruebas de que el abuso de alcohol bloquea el efecto de los fármacos antihipertensivos. Se debe desestimular el consumo de alcohol en los pacientes diabéticos, o permitir un consumo máximo de 30g/día en los hombres y de 15g/día en las mujeres.
La distribución de los alimentos debe hacerse en 3 o 4 comidas y en 1 o 2 colaciones durante el día, dependiendo del horario del paciente y del tratamiento farmacológico de la diabetes mellitus, al igual que deben considerarse las preferencias étnicas, religiosas y el estatus socioeconómico del paciente.
Actividad físicaEl estilo de vida sedentario y la falta de actividad física son fuertes predictores de mortalidad cardiovascular, independiente de la presencia de hipertensión y de otros factores de riesgo. La intensidad del ejercicio recomendado debe ser individualizada de acuerdo con la condición clínica del paciente. El examen clínico es suficiente cuando la actividad programada no supera el 60% del consumo máximo de oxígeno (VO2max; por ejemplo, caminar). Cuando se ha previsto una actividad más intensa, es necesario un examen más extenso de las posibles complicaciones de la diabetes. Se debe prestar especial atención a la enfermedad cardíaca silente (o que está compensada en descanso), a la retinopatía proliferativa, a la nefropatía incipiente, a la enfermedad vascular periférica, a la neuropatía periférica y autonómica, y a la osteoartropatía, especialmente de las extremidades inferiores, ya que el ejercicio puede contribuir a causar lesiones en los pies. Se debe preparar un programa individualizado de 3veces a la semana, incluyendo actividad aeróbica recreativa de intensidad moderada (equivalente a 3 a 5METS) en la forma de deporte o ejercicio en casa, que dure de 20 a 60min por sesión, precedida por 5 a 10min de calentamiento y seguida de 5 a 10min de relajación.
El paciente debe ser instruido sobre el uso de ropa apropiada para prevenir lesiones de los pies, tales como calcetines de algodón y zapatos deportivos. La automonitorización de glucosa en sangre antes y después del ejercicio puede ayudar a prevenir la hipoglucemia y permitirle al paciente comprobar los efectos beneficiosos del ejercicio sobre el control glucémico86–88. El ejercicio intenso está contraindicado en pacientes con retinopatía proliferativa activa y con manifestaciones clínicas de nefropatía y neuropatía.
Tratamiento farmacológicoLos beneficios de la reducción de la PA en los pacientes diabéticos fueron demostrados claramente en los estudios HOT89 y UKPDS90, entre otros91–95. Hay que destacar que los diabéticos pueden requerir un tratamiento más intenso para alcanzar los mismos niveles de PA que los no diabéticos. En verdad, casi todos los pacientes diabéticos necesitan, además de las medidas no farmacológicas, un tratamiento antihipertensivo combinado para alcanzar los objetivos del tratamiento, y tan temprano como sea posible.
Recientemente ha sido ampliamente debatida la meta de PAS que debe alcanzarse para garantizar una protección óptima del riesgo cardiovascular en pacientes hipertensos con diabetes. Una serie de directrices en el pasado1,2,69,70 habían recomendado una meta menor (<130/80mmHg en diabéticos y en general en pacientes de alto riesgo) a la recomendada (<140/90mmHg) en pacientes hipertensos de riesgo bajo-moderado. Sin embargo, una revalorización reciente de la evidencia disponible71,96 demostró que ninguno de los ensayos clínicos aleatorizados de tratamiento antihipertensivo en diabéticos con hipertensión logró un promedio de los valores de PAS por debajo de 130mmHg, y el reciente estudio Action to Control Cardiovascular Risk in Diabetes (ACCORD)97 no mostro ninguna reducción adicional de los eventos cardiovasculares, y más bien se observó una mayor incidencia de efectos adversos en los pacientes diabéticos aleatorizados para alcanzar una PAS <120mm Hg en comparación con los aleatorizados para alcanzar una PAS <140mmHg (los valores medios realmente alcanzados fueron de 119 y 133mmHg). Una serie de recientes metaanálisis98,99 dirigidos a correlacionar los eventos cardiovasculares con la PA obtenida no han encontrado ningún beneficio adicional o un empeoramiento de la incidencia de eventos cardiovasculares cuando se alcanza una PA más baja, con la posible excepción de la incidencia de accidentes cerebrovasculares99. En realidad, parece que en pacientes hipertensos con diabetes el objetivo de PAS<140mmHg debe ser recomendado al igual que en los no diabéticos hipertensos. Los valores apenas por encima de 130mmHg (como se logró en ACCORD97 y ADVANCE100) parecen ser seguros y pueden ser más eficaces en la reducción o prevención de microalbuminuria100. En cuanto al objetivo de PAD, los resultados del HOT89 y del UKPDS90 indican que los valores entre 80 y 85mmHg son beneficiosos.
En cuanto a los pacientes diabéticos con nefropatía, las guías anteriores recomendaron como objetivo de PA cifras de <130/80mmHg y <120/75 en caso de proteinuria. Una revisión reciente101 demostró que estas recomendaciones no se basaron en resultados de ensayos clínicos de largo plazo, y que se obtuvieron de estudios observacionales no aleatorizados. Parece prudente, por lo tanto, recomendar que los objetivos de PA sean los mismos para los pacientes diabéticos con y sin nefropatía.
Cinco clases de agentes antihipertensivos (diuréticos, bloqueadores beta, inhibidores de la enzima convertidora de angiotensina [IECA], antagonistas de los receptores de angiotensinaii [ARA] y bloqueadores de canales de calcio [BCC]) han sido utilizados en los ensayos clínicos aleatorizados que demostraron que reducir la PA reduce significativamente los eventos cardio-cerebro-vasculares y la afectación renal en pacientes hipertensos con diabetes y sin diabetes102. Por lo tanto, todos ellos pueden ser utilizados en pacientes hipertensos con diabetes tipo2. Sin embargo, se recomienda que para iniciar el tratamiento con monoterapia se debe elegir los fármacos que bloquean el sistema renina-angiotensina-aldosterona (IECA o ARA) debido a su mayor efecto antiproteinúrico. Los ARA son generalmente mejor tolerados, tema que es relevante en pacientes con hipertensión y diabetes en los cuales la adherencia al tratamiento es esencial. Como regla general se recomienda seleccionar un agente de acción prolongada que proporcione reducción de la PA durante las 24h con el fin de utilizar una administración diaria única. Las agencias reguladoras norteamericana y europea (FDA y EMEA) han aprobado el ramipril (IECA) y el telmisartán (ARA) como fármacos cardioprotectores en pacientes con alto riesgo cardiovascular (pacientes hipertensos con diabetes tipo2) con base en los resultados de los estudio HOPE94 y ONTARGET103.
En la mayoría de los pacientes hipertensos con diabetes tipo2 no es fácil alcanzar los objetivos de PA con monoterapia, por lo que el tratamiento debe incluir 2 o más agentes antihipertensivos. Si antes del tratamiento la PAS/PAD están muy lejos de los valores objetivo, se recomienda iniciar el tratamiento con una combinación de 2 medicamentos: una combinación fija de un IECA o ARA con un BCC dihidropiridínico o un diurético. El estudio The Avoiding Cardiovascular Events trough Combination Therapy in Patients Living with Systolic Hypertension (ACCOMPLISH)104 demostró mayores beneficios con un IECA/BCC en lugar de una combinación IECA/diurético, pero estos interesantes datos deben ser confirmados. Cuando se necesitan 3 medicamentos, se recomienda utilizar un IECA o un ARA más un BCC y un diurético tiazídico. En pacientes con una TFG<30ml/min, los diuréticos tiazídicos deben ser sustituidos por un diurético de asa (como furosemida) en las dosis apropiadas. La asociación de IECA y ARA, como también de un IECA o ARA con un inhibidor de renina (aliskireno) tiene un mayor efecto antiproteinúrico, pero la asociación de IECA y ARA no demostró una mayor reducción de desenlacces en el estudio ONTARGET103 y hubo más efectos adversos, y en ALTITUDE105, un ensayo en pacientes diabético que estudió la asociación de aliskireno con un IECA o ARA, fue prematuramente interrumpido por la presencia de una mayor cantidad de eventos adversos de la asociación. Por tanto, la asociación de dos diferentes drogas que interfieren con el sistema renina-angiotensina-aldosterona (RAA) esta desaconsejado.
Los diuréticos y los bloqueadores beta, particularmente en asociación, aumentan la resistencia a la insulina y pueden facilitar la aparición de diabetes en sujetos predispuestos, por lo que esta asociación se debe evitar en lo posible en pacientes hipertensos con prediabetes o con síndrome metabólico. Recientemente se ha demostrado que los bloqueadores beta vasodilatadores, tales como nebivolol y carvedilol, no afectan la sensibilidad a la insulina, y en el caso del nebivolol se ha demostrado que no altera la tolerancia a la glucosa, incluso en asociación con diuréticos tiazídicos106. Por lo tanto, los bloqueadores beta vasodilatadores deben ser preferidos en aquellas condiciones en las cuales hay razones de peso para la administración de un bloqueador beta (enfermedad cardíaca isquémica, insuficiencia cardíaca, taquiarritmias, etc.).
En pacientes con insuficiencia renal y/o disfunción cardíaca, la función cardíaca puede mejorar mediante la administración de antagonistas del receptor de mineralocorticoides (espironolactona, eplerenona), los cuales se han demostrado eficaces en la hipertensión resistente. Sin embargo, los niveles séricos de potasio y la TFG deben ser estrechamente controlados en los pacientes con enfermedad renal utilizando un inhibidor del sistema RAA y un antagonista de la aldosterona.
Se ha demostrado que los bloqueadores alfa mejoran la resistencia a la insulina y podrían utilizarse como un agente adicional en pacientes hipertensos con diabetes tipo2 en los cuales no se alcanzan los objetivos de PA. Sin embargo, estos agentes no se recomiendan como monoterapia excepto en pacientes hipertensos con hipertrofia prostática. La tabla 8 indica los fármacos antihipertensivos que deben ser preferidos para el manejo farmacológico de los pacientes hipertensos con diabetes tipo2 y condiciones especiales.
Recomendaciones con otros medicamentos de uso para los pacientes hipertensos con tipo diabetes tipo2 y las condiciones especiales
| Enfermedad coronaria y/o disfunción ventricular izquierda | IECA/ARA, bloqueadores beta, antagonistas de la aldosterona |
| Hipertensión sistólica aislada en los ancianos | Bloqueadores de los canales de calcio, diuréticos, ARA |
| Angina de pecho | Bloqueadores de los canales de calcio, bloqueadores beta, a menudo asociados |
| Enfermedad renal crónica | IECA o ARA, sobre todo en presencia de microalbuminuria o proteinuria franca |
| Enfermedad arterial periférica | Bloqueadores de los canales del calcio |
| Pacientes con fibrilación auricular | Bloqueadores beta, ARA, IECA, bloqueadores de los canales del calcio no dihidropiridínicos |
| Hipertrofia ventricular izquierda | IECA, ARA, BCC |
| Hipertrofia prostática benigna | Bloqueadores alfa |
La población latinoamericana está constituida por diferentes etnias107. La prevalencia de los diferentes grupos étnicos en cada país de América Latina se caracteriza por una mezcla de razas, etnias y culturas como en ningún otro continente.
A pesar de la gran cantidad de población negra en América Latina, no existe ningún estudio epidemiológico sobre la prevalencia de hipertensión y diabetes en esta población, y ningún estudio ha investigado, en una muestra suficientemente grande y utilizando metodologías consistentes, la ingesta de alimentos, la actividad física y la composición corporal asociadas con hipertensión y diabetes. La mayor parte de la información obtenida resulta de los estudios realizados en Estados Unidos que incluyeron a negros que han emigrado de América Latina y el Caribe a Estados Unidos108,109 o jóvenes negros nacidos en Estados Unidos pero de origen latino y del Caribe32.
Por lo tanto, la primera recomendación del Consenso Latinoamericano es la de apelar para que las organizaciones académicas y gubernamentales en América Latina apoyen la investigación epidemiológica, clínica y terapéutica en los descendientes africanos que habitan en Latinoamérica para comprobar si los resultados de los estudios de Estados Unidos también se aplican a la población negra que vive en América Latina. Al momento existe un único estudio que evalúa la importancia de la hipertensión arterial en un distrito rural de negros que viven en la provincia de Esmeraldas, en Ecuador110, en donde se examinaron 4.284 de los 8.876 adultos que viven en la zona. Un total de 1.542 (36%) fueron hipertensos, y de ellos solo 4 (0,3%) estaban bien controlados con el tratamiento recibido. En los 2,5años de seguimiento las ECV fueron la principal causa de muerte en la población adulta. Además, 4 de cada 5 personas que murieron por ECV tenían antecedentes de hipertensión arterial. En verdad, la prevalencia de hipertensión no controlada en este estudio fue mucho mayor que lo reportado en los estudios realizados en Estados Unidos.
Hasta no tener una cantidad adecuada de datos originados de estudios que deben realizarse en la población negra de América Latina, el Consenso recomienda la adopción de las recientes guías de la Sociedad Internacional de Hipertensión en Negros111. De acuerdo con este último documento existe una clara diferencia geográfica en la prevalencia de la hipertensión entre personas de raza negra: el 14% en África Occidental, el 26% en el Caribe y el 33% en Estados Unidos. Estas diferencias son tentativamente atribuidas a diferencias en la dieta y en el estilo de vida. En Estados Unidos las mujeres negras son más sedentarias, tienen un elevado aporte calórico y son más obesas desde el período preadulto112,113. Los factores genéticos y ambientales, tales como el bajo nivel socioeconómico, la alta ingesta de sodio en la dieta y/o baja de potasio, y el peso bajo al nacer por desnutrición materna, han sido asociados con un pobre desarrollo renal y menor número de nefronas, lo que predispone a hipertensión arterial y a disfunción renal temprana114,115.
Las complicaciones cardiorrenales relacionadas con la hipertensión arterial y la diabetes tipo2 (derrame cerebral, hipertrofia ventricular izquierda, insuficiencia cardíaca crónica en fase terminal o insuficiencia renal) se producen más a menudo en negros que en blancos. Los negros hipertensos tienen un riesgo de 4 a 20 veces mayor de progresión a diálisis que los blancos con similares niveles de PA, y la mortalidad en los hombres afroamericanos es 3 veces mayor (49%) que en los blancos no hispanos en Estados Unidos (16%), y 2 veces y media mayor en mujeres de raza negra (37%) que en las mujeres blancas no hispanas (14%)116.
La elección entre monoterapia antihipertensiva o terapia combinada depende de la presencia o ausencia de comorbilidades, y de la eficacia específica de los medicamentos a ser utilizados. Estudios comparativos han demostrado que los hipertensos negros tienen una mejor respuesta a los diuréticos tiazídicos (hidroclorotiazida o clortalidona) y a los bloqueadores de los canales de calcio, que a los IECA o los ARA, o a los bloqueadores beta117,118. El mejor control siempre se obtiene si se reduce la ingesta de sodio. Además, los negros son más propensos a presentar edema angioneurótico en respuesta a los IECA que los blancos119. Por lo tanto, en los negros la monoterapia debe basarse en un diurético o un bloqueador de los canales de calcio, y cuando se requiera terapia combinada, esta debe incluir un BCC y/o un diurético más un bloqueador del sistema RAA, preferiblemente un ARA (tabla 8).
Hipertensión y diabetes en la población andinaLa población de América Latina que vive en la Cordillera de los Andes comparte similares características y patrones históricos de colonización con los que viven en altitudes más bajas, siendo en su mayoría amerindios o mestizos. Las personas que viven a gran altitud (más de 3.000m sobre el nivel del mar) constituyen un grupo especial en el que la prevalencia la hipertensión y diabetes es muy poco conocida. Un estudio poblacional120 que incluyó a 1.878 adultos en los Andes peruanos mostró que la prevalencia de hipertensión fue del 15,7% (intervalo de confianza [IC] del 95%: 14,0-17,4%), que no hubo diferencias por sexo, y que aumentó considerablemente con la edad, sobre todo en las mujeres. Las tasas de conocimiento, tratamiento y control fueron del 47,9, del 39,5 y del 14%, respectivamente. La PAD aumentó hasta la edad de 50años y alcanzó una meseta a partir de entonces, mientras que la PA media siguió aumentando con la edad, incluso después de 50años de edad.
El tipo predominante de hipertensión fue sistólica-diastólica (41,7%; IC95%: 35,1-48,5%) o diastólica aislada. La hipertensión sistólica aislada representó solo el 29,3% de los casos (IC95%: 23,9-35,4%) y fue responsable de una minoría de casos en todos los grupos de edad antes de los 70años. El dato de que la hipertensión diastólica es la predominante en la Cordillera de los Andes a más de 3.000m sobre el nivel del mar fue recientemente confirmado en otro estudio121, en el que se encontró que más del 50% de esta población no conocía su condición de hipertenso. Este estudio también mostró que la prevalencia de hipertensión arterial fue similar en la costa, la sierra y la selva del Perú120,121.
Hipertensión y diabetes en los ancianosEl reporte demográfico de la Organización Panamericana de la Salud (OPS)/WHO en Latinoamérica122 demuestra que la población mayor de 60años representa el 14% de la población total en Argentina, el 10% en Brasil, el 13% en Chile, el 8% en Colombia, el 9% en Ecuador, el 7% en Paraguay, el 8% en Perú, el 18% en Uruguay, el 8% en Venezuela y el 8% en México.
Los ancianos, definidos como las personas mayores de 65años, tienen un mayor riesgo de hipertensión arterial, especialmente de hipertensión sistólica aislada123,124, lo que implica un riesgo cardiovascular adicional, ya que la presión de pulso superior a 65mmHg se asocia con una mayor rigidez de la pared de las arterias grandes y aumento de la morbimortalidad cardiovascular124. La MAPA durante 24h se considera una herramienta útil para optimizar la evaluación clínica de los pacientes hipertensos de edad avanzada125,126, en quienes se observa una caída nocturna anormal de la PA y oleadas de aumento matutino de la PA, comportamiento que se asocia con un mayor riesgo de enfermedad cerebrovascular127,128, aunque estos hallazgos han sido recientemente cuestionados129.
Todos los ensayos que han demostrado los beneficios de la disminución de la PA en los ancianos se han dirigido a un objetivo de PAS<150mmHg96, y este debe ser considerado como el objetivo meta basado en la evidencia para ancianos hipertensos, pero por otro lado en ancianos sanos se recomienda un objetivo similar a la propuesta para hipertensos jóvenes (≤140mmHg). También hay evidencia de beneficios en la reducción de la PAS a <150mmHg en hipertensos mayores de 80años130. Personas frágiles o complicadas deben ser tratadas con especial atención para no empeorar sus condiciones generales de salud.
En las personas de edad avanzada el tratamiento farmacológico debe iniciarse gradualmente para garantizar una buena tolerabilidad y calidad de vida. La sexualidad (disfunción sexual), el sueño y el estado funcional deben ser considerados en la evaluación clínica de esta población10.
Diversos ensayos clínicos han demostrado los beneficios de la reducción de la hipertensión sistólica aislada131-133 mediante el uso de diuréticos o BCC. Otros ensayos clínicos en ancianos hipertensos en los cuales se incluyó un número importante de pacientes con hipertensión sistólica aislada han utilizado IECA y ARA, fármacos que también son útiles en las personas de edad avanzada, tanto en monoterapia como en combinación.
En los pacientes con riesgo cardiovascular asociado o comorbilidades, el fármaco de elección debe ser seleccionado de acuerdo con la enfermedad concomitante de acuerdo a lo indicado en la tabla 8. Son recomendables las drogas de larga acción para obtener un mejor cumplimiento y una acción antihipertensiva sostenida de 24h.
Papel de medio ambiente y la epigenética en el síndrome metabólico, la hipertensión y la diabetes en América LatinaEl aumento en la incidencia de síndrome metabólico, diabetes tipo2 y ECV en América Latina parece estar asociado a las influencias ambientales y a las características étnicas de la población134. Esto plantea la posibilidad de que la predisposición genética asociada a determinados grupos étnicos puede interactuar con factores ambientales para explicar las diferencias en la incidencia de la enfermedad. Recientemente existe un considerable interés en la especial influencia de la exposición medioambiental durante la vida uterina y en la vida extrauterina temprana. La propuesta se basa en la hipótesis de los orígenes evolutivos de la enfermedad, la cual enfatiza que las condiciones ambientales durante los períodos críticos de la vida temprana en los que se estructura el organismo y la función corporal se establecen de por vida. Más recientemente, los primeros efectos del medio ambiente se han concebido en términos de la epigenética.
La epigenética es la ciencia que explica la variación de la expresión génica en respuesta a cambios en las condiciones ambientales. Este término incluye cualquier proceso que altera la actividad del gen sin cambiar la secuencia de ADN y conduce a modificaciones rápidas pero reversibles del ADN (por ejemplo, metilación) o a alteraciones en la histona de la cromatina, modificaciones que pueden ser transmitidas a las células hijas. La metilación del ADN en una región reguladora de un gen específico puede inhibir la expresión génica. La cromatina es el complejo nuclear que consta de ADN envuelto alrededor de las proteínas histonas que pueden ser modificadas por acetilación e influir en la expresión de los genes135.
Los mecanismos que controlan los procesos epigenéticos todavía no están completamente comprendidas, pero sí está claro que las variaciones hereditarias del ADN podrían alterar la sensibilidad a ciertos desencadenantes ambientales o cambiar la naturaleza de las respuestas epigenéticas para una determinada exposición. En el contexto latinoamericano la cuestión es determinar si las diferencias en la sensibilidad para desarrollar síndrome metabólico a menores niveles de grasa visceral son dependientes de la variación regional y étnica en los procesos epigenéticos o simplemente se deben a diferencias en la exposición ambiental.
Es bien conocido que en América Latina la desnutrición materna y la desnutrición infantil son un problema importante que aún no se ha resuelto en una importante proporción de las poblaciones pobres136. Además, en América Latina se ha encontrado una alta prevalencia de hipertensión arterial en los niños, adolescentes y adultos con retraso en el crecimiento por una mala nutrición137–144. Un estudio realizado en Brasil137, que investigó el comportamiento de la PA en una muestra aleatoria de adolescentes con retraso en el crecimiento (10-16 años, n=56) residentes en tugurios, mostró un elevado porcentaje de personas con una PA por encima de los percentiles 90 y 95, luego de ajustar por la estatura, y estuvieron en mayor riesgo de desarrollar hipertensión. Considerando al grupo de pacientes como un todo, la prevalencia de hipertensión arterial diastólica fue del 21% (IC95%: 10-32%). La prevalencia de los casos con una PAS/PAD por encima del percentil 90 fue del 51% (IC95%: 37-65%). Otro estudio realizado en el nordeste de Brasil138 en 416 adultos (18-60años), también residentes de un barrio pobre, mostró que la prevalencia de hipertensión arterial fue del 28,5% (mujeres: 38,5%; hombres: 18,4%). La PAS y la PAD aumentaron de acuerdo con la menor estatura, y la hipertensión fue más frecuente en las mujeres que fueron obesas y de baja de estatura (50%) en relación con las obesas pero que no eran pequeñas (OR: 1,98; IC95%: 1,22-2,96).
Recientemente, otro estudio139 investigó si las condiciones de salud de las madres que tenían una estatura baja eran diferentes de las de las mujeres sin desnutrición, o a las de sus hijos. La baja estatura materna se asoció de forma independiente con obesidad, obesidad abdominal y PA elevada. Además, la baja estatura materna se asoció con bajo peso al nacer y retraso del crecimiento en los niños nacidos de estas madres. En Colombia se demostró que la PA de niños de 11años de edad que tenían una media de IMC de 21, el más alto tertil, presentó un incremento de 10mmHg en relación con los niños con un IMC medio de 15, el tertil inferior140. Franco et al.141 reportaron en Brasil cambios en los sistemas simpático-adrenal y renina-angiotensina en niños pequeños para su edad gestacional. Ellos investigaron los niveles plasmáticos de enzima convertidora de angiotensina (ECA), de angiotensina y de catecolaminas en niños de 8 a 13años de edad, y determinaron las correlaciones entre los niveles plasmáticos, el peso al nacer y la PA. Los niveles circulantes de noradrenalina estuvieron significativamente elevados en niñas pequeñas para la edad gestacional en comparación con las niñas que nacieron con un peso adecuado para su edad gestacional. Además, la angiotensinaii y la actividad de la ECA fueron más altos en los niños pequeños para la edad gestacional. Además se observó una asociación significativa entre los niveles circulantes de angiotensinaii y la actividad de ECA y PAS. Otro estudio en Brasil142 mostró que la actividad de la ACE se incrementa junto con un aumento de la PAS y la PAD en niños con retraso del crecimiento, independientemente del peso al nacer.
A pesar de que en América Latina la prevalencia de diabetes mellitus tipo2 en individuos con bajo peso al nacer y con desnutrición en sus primeros años de vida no se conoce, sí sabemos que los países pobres con un acelerado proceso de urbanización son particularmente vulnerables y han experimentado un incremento considerable en la prevalencia de diabetes143. Se han reportado cambios perjudiciales en el metabolismo de la glucosa en niños mexicanos que sufren de desnutrición en la infancia. El estudio examinó los efectos de la desnutrición en el primer año de vida en la tolerancia a la glucosa y la insulina plasmática, y se encontró que la desnutrición a inicios de la vida extrauterina, independientemente del peso al nacer, se asoció con hiperinsulinemia y una sensibilidad reducida a la insulina, lo cual empeoró a medida que el IMC aumentó en la vida adulta143.
En realidad es interesante especular que el aumento en las prevalencias de hipertensión arterial, síndrome metabólico y diabetes tipo2 que se observa actualmente en América Latina pueda ser el resultado de la discrepancia entre el medio ambiente nutricional durante la vida fetal y la primera infancia y el medio ambiente nutricional y de estilos de vida durante la etapa adulta. Esta discrepancia causa una confusión entre la programación fetal del sujeto y las circunstancias del adulto creadas por la imposición de los nuevos estilos de vida144. El conflicto entre la programación fetal y la presencia tardía de obesidad abdominal puede producir una mayor sensibilidad de nuestra población para desarrollar un estado de inflamación de bajo grado, resistencia a la insulina y, consecuentemente, una epidemia de hipertensión, síndrome metabólico y diabetes. Los papeles relativos jugados por los factores genéticos y medioambientales y la interacción entre ambos es todavía materia de gran debate que amerita clarificar con investigaciones futuras.
La recomendación del Consenso Latinoamericano es la de estimular a la academia para desarrollar investigación orientada a establecer los mecanismos epigenéticos que explican la relación entre la malnutrición materna, la restricción del crecimiento temprano y la aparición posterior de obesidad abdominal y ECV en América Latina.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Participantes del Consenso
Directores: López-Jaramillo, Patricio (Colombia); Sánchez, Ramiro (Argentina)
Coordinadores: Ramírez, Agustín J. (Argentina); Schmid, Helena (Brasil)
Asesores: Zanchetti, Alberto (Italia); Harrap, Stephen (Australia)
Participantes:
Accini, Jose Luis (Colombia)
Alvernia, Sergio (Colombia)
Arcos, Edgar (Colombia)
Ayala, Myrian (Paraguay)
Bendersky, Mario (Argentina)
Bolívar, Fabio (Colombia)
Botero, Rodrigo (Colombia)
Bryce, Alfonso (Perú)
Buelvas, Janes (Colombia)
Calderón, Carlos (Colombia)
Cárdenas, Juan Mauricio (Colombia)
Casanova, María Eugenia (Colombia)
Castillo, Gilberto (Colombia)
Cobos, Leonardo (Chile)
Cure, Carlos (Colombia)
Díaz, Margarita (Uruguay)
Duarte, Yan Carlos (Ecuador)
Duperly, John (Colombia)
Echeverría, Luis (Colombia)
Espinosa, Tatiana (Colombia)
Feliciano, John (Colombia)
Foss, Milton C. (Brasil)
Freire, Peggy (Ecuador)
García, Henry (Colombia)
García, Luis Hernando (Colombia)
García, Santiago (Ecuador)
Gómez-Arbeláez, Diego (Colombia)
Hernández, Erick (Colombia)
Higuera, Juan D. (Colombia)
Huertas, Diego (Colombia)
Jaramillo, Sergio (Colombia)
Jáuregui, Isabel (Colombia)
Lanas, Fernando (Chile)
Lara, Joffre (Ecuador)
Lizcano, Fernando (Colombia)
Machado, Livia (Venezuela)
Manrique, Helard (Perú)
Manzur, Fernando (Colombia)
Márquez, Álvaro (Colombia)
Márquez, Gustavo (Colombia)
Martínez, Javier (Colombia)
Martínez, Luz X. (Colombia)
Medina, Félix (Perú)
Medina, Roberto (México)
Melgarejo, Enrique (Colombia)
Merchán, Alonso (Colombia)
Miranda, Harold (Colombia)
Molina, Dora I. (Colombia)
Navarrete, Solón (Colombia)
Parra, Gustavo (Colombia)
Parra Carrillo, José Z. (México)
Pasquel, Miguel (Ecuador)
Peña, Jesús Alirio (Colombia)
Peñaherrera, Ernesto (Ecuador)
Perez, Maritza (Colombia)
Pineda, Belkis (Colombia)
Piskorz, Daniel (Argentina)
Ponte, Carlos (Venezuela)
Prat, Hernán (Chile)
Rey, Juan José (Colombia)
Rodríguez, Jesús (Colombia)
Rodríguez, Patricia (Colombia)
Sánchez, Gregorio (Colombia)
Sierra, Iván D. (Colombia)
Sotomayor, Arístides (Colombia)
Synay, Isaac (Argentina)
Uribe, Juan Carlos (Colombia)
Urina, Manuel (Colombia)
Vargas, Ricardo (Chile)
Vesga, Boris (Colombia)
Velandia, Carlos (Colombia)
Villar, Raúl (Chile)
Villarreal, Eduardo (Colombia)
Yenes, Alejandro (Chile)
Este artículo ha sido publicado previamente en J Hypertens. 2013;31:223-38. Reproducido con permiso del autor y del editor.