La técnica de la reconstrucción pancreática tras duodenopancreatectomía cefálica con conservación del píloro mediante bipartición gástrica (DPC-BG) parece asociarse a una mejor evolución postoperatoria en comparación con la pancreaticoyeyunostomía convencional en el marco de un estudio aleatorizado prospectivo. El objetivo de este estudio es evaluar aún más el resultado quirúrgico en una serie de 129 pacientes consecutivos.
MétodosEntre 2007 y junio de 2013, se analizaron retrospectivamente un total de 129 pacientes con tumores periampulares tratados quirúrgicamente con DPC-BG. Se analizaron los resultados a partir de las complicaciones precoces quirúrgicas (escala de Clavien-Dindo), así como las complicaciones relacionadas y no relacionadas con el páncreas.
ResultadosLa tasa de complicación postoperatoria global fue del 77%, aunque el 50% de las complicaciones se clasificaron I-II en la clasificación Clavien-Dindo. La incidencia de la fístula pancreática clínicamente relevante fue del 18% (tipo ISGFP B: 12%, tipo ISGFP C: 6%). Otras complicaciones específicas del páncreas tales como retraso del vaciamiento gástrico y hemorragia pospancreatectomía fueron del 27 y del 15%, respectivamente, similares a los resultados publicados en la literatura. La tasa de mortalidad perioperatoria global fue del 4,6%.
ConclusiónLos resultados de la DPC-BG muestran que es una técnica segura, con una morbilidad aceptable, baja mortalidad y tasa de fístula pancreática similar a otras técnicas actualmente descritas de reconstrucción pancreaticoentérica.
Pylorus-preserving pancreatoduodenectomy with gastric partition (PPPD-GP) seems to be associated to a better postoperative outcome than conventional pancreaticojejunostomy in the setting of a prospective-randomized study. The aim of this study is to further evaluate the surgical outcome in a series of 129 consecutive patients.
MethodsBetween 2007 and June 2013, 129 patients with periampullary tumors surgically treated with PPPD-GP were retrospectively analyzed. Surgical complications (Clavien-Dindo score), as well as pancreatic and non-pancreas related complications were analyzed.
ResultsOverall postoperative complication rate was 77%, although 50% of complications were graded I-II by the Clavien-Dindo classification. Incidence of clinically relevant pancreatic fistula was 18%: ISGFP type B: 12%, and type C: 6%. Other pancreas specific complications such as delayed gastric emptying and pospancreatectomy haemorrhage were 27 and 15%, respectively, similar to results published in the literature. Overall perioperative mortality rate was 4.6%.
ConclusionPPPD-GP results show that it is a technique with an acceptable morbidity, low mortality and pancreatic fistula rate similar to other techniques currently described of pancreaticoenteric reconstruction.
Las neoplasias de páncreas han demostrado una prevalencia creciente en los últimos años. En 2011, el cáncer de páncreas fue diagnosticado de forma reciente en 8.773 personas y fue responsable de 8.320 muertes en el Reino Unido, con una supervivencia global a los 5 años del 3,7% en 2005-20091. En los EE. UU., las estimaciones de los nuevos casos diagnosticados y de las muertes para el 2014 eran de 46.420 y 39.590, respectivamente2.
Sin embargo, el tratamiento quirúrgico de las neoplasias pancreáticas ha sido clásicamente considerado un desafío, debido principalmente a 2 factores importantes: por un lado, la supervivencia de los pacientes con adenocarcinoma ductal del páncreas después de un adecuado tratamiento quirúrgico y oncológico es pobre, con una supervivencia a los 5 años alrededor del 20% en la mayoría de las series. Por otra parte, las complicaciones después de la cirugía de páncreas son frecuentes. En todas las series de pacientes con resección del páncreas, las complicaciones específicas de páncreas como retraso del vaciamiento gástrico (RVG), hemorragia o fístula pancreática (FP) constituyen una fuente importante de morbilidad que en última instancia puede afectar los resultados. Con la intención de evitar o minimizar estas complicaciones, los esfuerzos se han concentrado con el fin de modificar esta situación. Dado que una de las fuentes principales de morbilidad es la aparición de una FP, se han descrito diferentes técnicas de reconstrucción pancreaticoentérica. Hoy en día, el uso variado de distintos tipos de anastomosis pancreática en función de cada centro refleja que falta una técnica consistente y fiable. Clásicamente el sitio preferido de la anastomosis pancreática después de una duodenopancreatectomía (DP) ha sido el yeyuno (anastomosis pancreaticoyeyunal [APY]), pero en los últimos años hay una tendencia cada vez mayor por el uso de una anastomosis pancreaticogástrica (APG), debido a la aparición de varios estudios aleatorizados y controlados, así como de metaanálisis que apoyan la superioridad de la APG.
En 2007 describimos nuestra técnica de reconstrucción pancreática utilizando una APG tras una bipartición gástrica después de una DP con preservación pilórica (DPC-BG), en forma de un ensayo controlado aleatorizado que mostró su superioridad en comparación con la APY convencional.
En este trabajo, nuestro objetivo es describir los resultados en el período 2007-2013 de los 129 pacientes tratados mediante una DPC-BG.
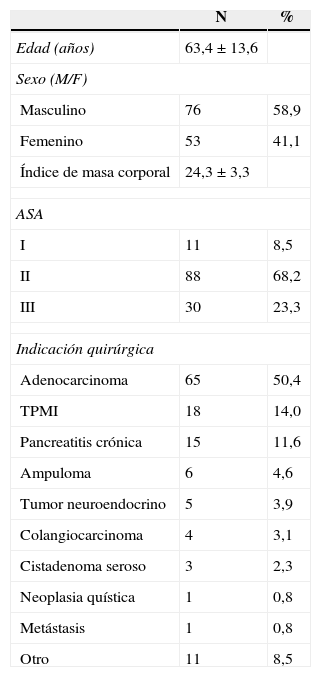
MétodosPacientesEste artículo es un análisis retrospectivo de una base de datos recopilada prospectivamente. De 2007 a 2013, 129 pacientes fueron tratados mediante DPC-BG debido a hallazgos patológicos en la cabeza del páncreas. La indicación quirúrgica de estos pacientes se basó en la presencia de lesiones situadas a la derecha de los vasos mesentéricos, sintomáticas o no, y fue corroborada por un comité multidisciplinar. Los datos demográficos de estos pacientes se muestran en la tabla 1.
Datos demográficos de los pacientes incluidos (n=129)
| N | % | |
|---|---|---|
| Edad (años) | 63,4 ± 13,6 | |
| Sexo (M/F) | ||
| Masculino | 76 | 58,9 |
| Femenino | 53 | 41,1 |
| Índice de masa corporal | 24,3±3,3 | |
| ASA | ||
| I | 11 | 8,5 |
| II | 88 | 68,2 |
| III | 30 | 23,3 |
| Indicación quirúrgica | ||
| Adenocarcinoma | 65 | 50,4 |
| TPMI | 18 | 14,0 |
| Pancreatitis crónica | 15 | 11,6 |
| Ampuloma | 6 | 4,6 |
| Tumor neuroendocrino | 5 | 3,9 |
| Colangiocarcinoma | 4 | 3,1 |
| Cistadenoma seroso | 3 | 2,3 |
| Neoplasia quística | 1 | 0,8 |
| Metástasis | 1 | 0,8 |
| Otro | 11 | 8,5 |
Durante el período de tiempo comprendido entre 2007 y 2013, las intervenciones quirúrgicas fueron realizadas por 5 cirujanos (LFC, SSC, MLB, JF, DC), todos ellos con la misma técnica quirúrgica, previamente descrita3. Brevemente, la fase de la disección de la intervención es un procedimiento estándar con preservación del píloro. La sección pancreática se realiza mediante bisturí eléctrico hasta la identificación del conducto pancreático principal, que se secciona con tijeras. Una linfadenectomía estándar4 se llevó a cabo en los territorios de la arteria hepática común, pedículo hepático, parte derecha de la arteria mesentérica superior y tronco celíaco. El conducto biliar principal se seccionó justo por encima del conducto cístico, y se ocluyó temporalmente mediante una pinza para evitar el derrame de bilis a la cavidad peritoneal durante la intervención.
La fase de reconstrucción comienza con la preparación de la anastomosis pancreática. Para asegurar la mejor anastomosis posible y la óptima vascularización del muñón pancreático, el remanente de páncreas solo se separa unos 2-3cm de la vena esplénica. A continuación, la curvatura mayor del estómago se prepara para la anastomosis. Comenzando en la parte superior de la curvatura mayor, y habiendo identificado con cuidado y conservado la arcada gastroepiploica, la partición gástrica se prepara con 3 disparos de endograpadora de 60mm. Después de comprobar la hemostasia, una sutura continua de polipropileno 5/0 se realiza en el estómago para evitar la hemorragia postoperatoria. Entonces, una anastomosis Wirsung-gástrica de 2 capas se realiza mediante suturas no reabsorbibles con la colocación de un stent interno de forma rutinaria. El drenaje interno se omitió solo en pacientes con conducto pancreático mayor que 3mm; además, durante este período, un drenaje pancreático externo se colocó en 63 pacientes (48,8%) debido a un estudio prospectivo que tuvo por objeto aclarar el efecto de la administración de octeótrido postoperatorio en el jugo pancreático5. Después de la terminación de la anastomosis pancreática, un duodenoyeyunostomía terminolateral con una sutura continua no absorbible de 2 capas, y finalmente un hepaticoyeyunostomía a unos 40cm de la anastomosis duodenal se llevan a cabo con una sutura de polidioxanona 5/0. Dos drenajes de Jackson-Pratt se colocaron anterior y posteriormente a la anastomosis pancreática, y otro se colocó cerca de la anastomosis biliar y la reconstrucción entérica.
Después de la cirugía, todos los pacientes fueron trasladados a la UCI, donde pasaron los primeros días después de la cirugía. La movilización precoz del paciente se intentó desde el primer día postoperatorio. La sonda nasogástrica de rutina se mantuvo hasta el reinicio normal del peristaltismo y una aspiración diaria menor de 400ml, con una media de 4,2±3,3 días. Se utilizó la nutrición parenteral total durante la primera semana después de la cirugía. Tras la retirada de la sonda nasogástrica se reintrodujo la alimentación oral.
Se realizó detección de amilasa y lipasa en el drenaje de forma rutinaria en el primero, tercero y quinto días después de la intervención. Al quinto día, si no se encontró evidencia analítica o clínica de la FP o de la fístula biliar, se retiraron los drenajes.
DefinicionesLas complicaciones de los pacientes fueron anotadas prospectivamente tras el alta clínica. Las complicaciones específicas pancreáticas como la FP, RVG y hemorragia pospancreatectomía (HP) fueron clasificados utilizando las definiciones publicadas por el Grupo Internacional de Estudios sobre la Fístula Pancreática (ISGFP)6 y el Grupo Internacional de Estudio de Cirugía de Páncreas (ISGPS)7,8.
Las complicaciones generales después de la cirugía fueron clasificadas mediante la puntuación Clavien-Dindo modificada9.
Análisis estadísticoLos datos se expresan como media±desviación estándar. Para la comparación de los datos entre los grupos se utilizó una prueba de chi cuadrado. Una medida fue considerada estadísticamente significativa si p < 0,05. El análisis estadístico de los datos se realizó mediante el programa informático SPSS Statistics 18.0 (SPSS, Chicago, IL, EE. UU.).
ResultadosDatos clínicos de los pacientesLa tabla 1 muestra los principales aspectos demográficos de los pacientes. La edad media fue de 63,4±13,6 años, y la proporción de sexos fue de 1,4/1 (M/F). La principal indicación para la realización de una DPC-BG fue un adenocarcinoma ductal de páncreas, en 65 de 129 pacientes (50,4%). Los otros 64 pacientes tenían diversos diagnósticos, como se muestra en la tabla 1. Los más frecuentes fueron un TPMI de la cabeza del páncreas (18 pacientes, 14%), pancreatitis crónica (15 pacientes; 11,6%), neoplasias de la ampolla de Vater (6 pacientes; 4,6%) y colangiocarcinoma distal (4 pacientes; 3,1%).
Los principales manifestaciones clínicas en las de los pacientes fueron ictericia (71 pacientes; 55%), dolor abdominal (67 pacientes; 51,9%), pérdida de peso (41 pacientes; 31,8%), diarrea (11 pacientes; 8,5%) y la diabetes de nueva aparición (2 pacientes; 1,6%). Antes de la operación, 26 pacientes con ictericia fueron tratados endoscópicamente con la colocación de un stent biliar, en la mayoría de los casos, plástico.
La estancia mediana después de la DPC-BG fue de 18 días (rango 3-197) (media de 23,7±22,1 días), y la estancia en UCI fue en el 92% de las veces inferior a 3 días, con una estancia media de 1,9±0,8 días, y hasta el 8% de los pacientes fueron directamente a la hospitalización normal después de la cirugía.
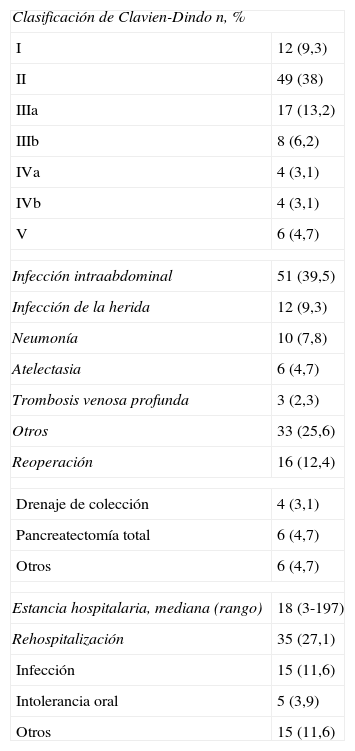
Complicaciones globales después de la cirugíaAplicando de forma estricta la clasificación de Clavien-Dindo, un 77,5% de los pacientes presentaron al menos una complicación después de la cirugía. Sin embargo, a pesar de esta alta proporción de complicaciones, la gran mayoría de ellos (86%) fueron clasificados entre los grupos I y III, con casi el 50% de las complicaciones de tipo II. Aun así, la mortalidad global a los 30 días fue del 4,7%.
Las complicaciones más frecuentes fueron infección intraabdominal (51 pacientes; 39,5%), seguida de las complicaciones pulmonares (16 pacientes; 12,5%), infección de la herida (12 pacientes; 9,3%) y trombosis venosa profunda (3 pacientes; 2,3%).
Un total de 16 pacientes tuvieron que ser reintervenidos debido a complicaciones. Entre ellos, la reintervención más frecuente fue la totalización de la pancreatectomía, que fue finalmente llevada a cabo en 7 casos (5,4%), seguida de drenaje de colecciones peripancreáticas en 4 pacientes (3,1%). Las principales causas de reintervención de los restantes pacientes fueron fuga biliar (2 pacientes), perforación gástrica independiente de la bipartición (un paciente), hematoma subdural como consecuencia del catéter peridural que requirió una laminectomía (un paciente) y una hemorragia vesical que fue tratada por vía transuretral (un paciente). Finalmente, 35 pacientes (27,1%) fueron rehospitalizados, debido a complicaciones infecciosas en 15 pacientes y en 5 casos a intolerancia de la dieta oral. La tabla 2 muestra las complicaciones generales para los 129 pacientes incluidos en este estudio y para cada grupo.
Complicaciones quirúrgicas globales tras DPC-BC
| Clasificación de Clavien-Dindo n, % | |
| I | 12 (9,3) |
| II | 49 (38) |
| IIIa | 17 (13,2) |
| IIIb | 8 (6,2) |
| IVa | 4 (3,1) |
| IVb | 4 (3,1) |
| V | 6 (4,7) |
| Infección intraabdominal | 51 (39,5) |
| Infección de la herida | 12 (9,3) |
| Neumonía | 10 (7,8) |
| Atelectasia | 6 (4,7) |
| Trombosis venosa profunda | 3 (2,3) |
| Otros | 33 (25,6) |
| Reoperación | 16 (12,4) |
| Drenaje de colección | 4 (3,1) |
| Pancreatectomía total | 6 (4,7) |
| Otros | 6 (4,7) |
| Estancia hospitalaria, mediana (rango) | 18 (3-197) |
| Rehospitalización | 35 (27,1) |
| Infección | 15 (11,6) |
| Intolerancia oral | 5 (3,9) |
| Otros | 15 (11,6) |
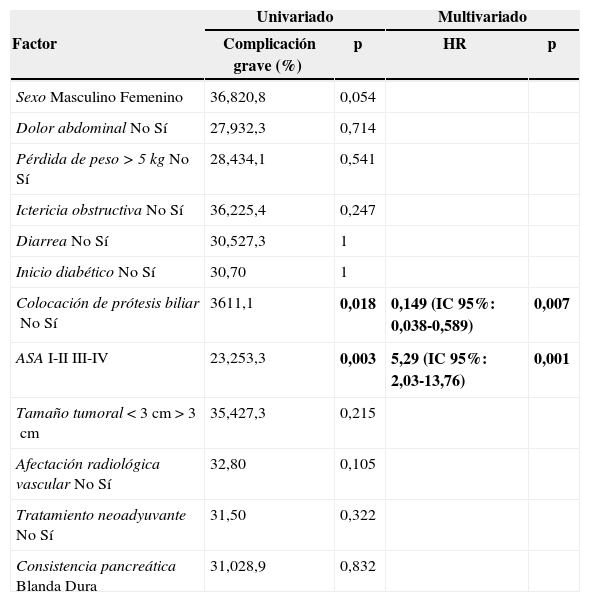
Realizamos un análisis univariado y multivariado de los factores preoperatorios con relación a la aparición de complicaciones postoperatorias mayores (clasificadas como Clavien-Dindo III o superior), que se muestra en la tabla 3. De entre ellos, destacan 2 factores: en primer lugar, la colocación preoperatoria de una prótesis biliar se asoció en nuestra experiencia a una reducción de las complicaciones mayores postoperatorias, tanto en el análisis univariado (36 vs. 11,1%; p=0,018) como en el multivariado (0,149; IC 95%: 0,038-0,589). En segundo lugar, la clasificación de los pacientes como ASA III-IV supone un factor de riesgo significativo para la aparición de complicaciones mayores, tanto en el estudio univariado (23,2 vs. 53,3%; p=0,003), como en el multivariado (5,29; IC 95%: 2,03-13,76).
Análisis univariado y multivariado de factores preoperatorios con la presencia de complicaciones mayores en el periodo postoperatorio (Dindo-Clavien >III)
| Univariado | Multivariado | |||
|---|---|---|---|---|
| Factor | Complicación grave (%) | p | HR | p |
| SexoMasculinoFemenino | 36,820,8 | 0,054 | ||
| Dolor abdominalNoSí | 27,932,3 | 0,714 | ||
| Pérdida de peso>5kgNoSí | 28,434,1 | 0,541 | ||
| Ictericia obstructivaNoSí | 36,225,4 | 0,247 | ||
| DiarreaNoSí | 30,527,3 | 1 | ||
| Inicio diabéticoNoSí | 30,70 | 1 | ||
| Colocación de prótesis biliarNoSí | 3611,1 | 0,018 | 0,149 (IC 95%: 0,038-0,589) | 0,007 |
| ASAI-IIIII-IV | 23,253,3 | 0,003 | 5,29 (IC 95%: 2,03-13,76) | 0,001 |
| Tamaño tumoral< 3cm> 3cm | 35,427,3 | 0,215 | ||
| Afectación radiológica vascularNoSí | 32,80 | 0,105 | ||
| Tratamiento neoadyuvanteNoSí | 31,50 | 0,322 | ||
| Consistencia pancreáticaBlandaDura | 31,028,9 | 0,832 | ||
Negrita significa p<0,05.
Un total de 45 pacientes presentaron algún tipo de FP, con una tasa global del 34,8%. Sin embargo, en casi la mitad de los casos se trató de una fístula tipo A y, por tanto, sin consecuencias clínicas. Un total de 24 pacientes (18,6%) presentaron una fístula clínicamente significativa (grados B-C). Los pacientes con un grado C de FP tenían una complicación Clavien-Dindo IV-V en un 50% de los casos, una diferencia significativa con respecto a los pacientes sin FP o con FP tipo A/B (p=0,024). Además, la presencia de una FP clínicamente significativa se asoció a la necesidad de reintervención quirúrgica en una proporción mayor en comparación con el resto de los pacientes (41,7 frente a 5,7%; p < 0,001). Concretamente, los pacientes con una FP grado C tuvieron que ser reintervenidos para completar la pancreatectomía en 6 casos (75%), mientras que todos los pacientes con una FP tipo B fueron tratados de forma conservadora. Curiosamente, y en contraste con los datos actuales publicados, no se encontró asociación estadística entre la aparición de FP y el diámetro del conducto pancreático (<3: 34,7 vs. ≥3mm: 34,5%; p=1), la rigidez de páncreas (blando: 31,6 vs. duro: 37,7%; p=0,64), el uso de un stent pancreático interno/externo transanastomótico (interno: 32,1 vs. externo: 41,3%; p=0,34) ni en función del origen de la lesión (adenocarcinoma de páncreas 33,8 vs. otros diagnósticos: 35,9%, p=0,86). De forma interesante, entre los pacientes que presentaron una FP no pudimos encontrar ninguna asociación entre estos factores y un grado de FP B/C.
Un RVG se diagnosticó en 35 (27,1%) de los pacientes, siendo la mayoría de los casos de grado A, con solo un caso (0,8% de los pacientes) con un grado C de RVG. La media de días con sonda nasogástrica fue de 4,2±3,3 días. Contrariamente a la FP, la aparición de un RVG no se correlacionó con una peor clasificación en la escala de Clavien-Dindo, sino más bien con una tendencia a un aumento de la estancia hospitalaria, aunque no significativa (no RVG: 21,2±21,0 días; RVG A: 31,2±28,6 días; RVG B: 27,8±13,7 días; RVG C: 51 días; p=ns).
La HP estaba presente en el 14,7% de los pacientes, de nuevo con una gran proporción de grado A. Probablemente debido al relativamente bajo número de casos, no existen diferencias en los grupos de HP y clasificación Clavien, a pesar de que el grado C asocia a un 50% de complicaciones Clavien-Dindo IV-V.
La presencia de otras dehiscencias anastomóticas, aunque menos frecuentes, no fueron despreciables: una fuga biliar se produjo en el 7,8% de los pacientes y 6 pacientes (4,7%) fueron diagnosticados de una fuga de la anastomosis duodeno-yeyunal. Ningún paciente presentó una fuga en relación con la línea de transección del estómago de esta técnica específica. La tabla 4 muestra las complicaciones específicas pancreáticas.
DiscusiónEl tratamiento quirúrgico de las enfermedades en la cabeza de páncreas se convierte en un reto para el cirujano, por muchas razones. Entre ellas están la complejidad inherente al procedimiento quirúrgico (aún hoy con la morbimortalidad preoperatoria muy superior a otros procedimientos abdominales), la alta tasa de complicaciones quirúrgicas y, para la mayoría de los pacientes, un pronóstico sombrío debido al adenocarcinoma de páncreas.
Sin embargo, la morbilidad después de la DP, especialmente FP, se ha convertido en una de las complicaciones que los cirujanos tienen teóricamente la posibilidad de modificar. Se han propuesto muchos factores en la génesis de esta complicación específica: la vascularización óptima del muñón pancreático, el diámetro del conducto pancreático o la rigidez del páncreas. Sin embargo, la técnica quirúrgica sigue siendo uno de los factores más importantes, y el debate hoy en día es cómo realizar la anastomosis del remanente pancreático: ¿utilización del yeyuno o del estómago?
Muchos estudios han tratado de abordar este tema en particular. En concreto, 6 ensayos controlados aleatorizados (ECA) bien diseñados se han realizado en los últimos 20 años10–15. Su objetivo principal fue evaluar la no inferioridad de la APG contra la APY. Sin embargo, y a pesar de las diferencias relevantes que se encuentran algunos estudios, otros demostraron que la APG se asoció a una menor tasa de FP y complicaciones en general. En 2008 nuestro grupo publicó los resultados de un ECA que comparó la APY con una APG modificada, la DPC-BG, que mostró un claro beneficio para el segundo en términos de FP.
Nuestro objetivo en este estudio ha sido describir los resultados de la DPC-BG fuera de los límites de un ECA, y su aplicabilidad general. Hay 3 diferencias principales en este estudio con respecto a las condiciones en las que se realizó el ECA: el procedimiento se ha realizado por 5 cirujanos diferentes, a diferencia de los primeros resultados, en los que solamente un cirujano efectuó todas las intervenciones; en 63 casos, un conducto pancreático transanstomótico externo se colocó a fin de obtener el jugo pancreático para su examen ulterior; finalmente, en la técnica original descrita, el conducto pancreático se anastomosa a una abertura en la mucosa gástrica de un diámetro aproximado al que presenta el conducto pancreático. Esta técnica fue posteriormente modificada y en el presente estudio la abertura en la mucosa gástrica era más grande, alrededor de 2-3cm, por lo que se realizó una pancreatogastrostomía terminolateral (y no Wirsung-gastrostomía).
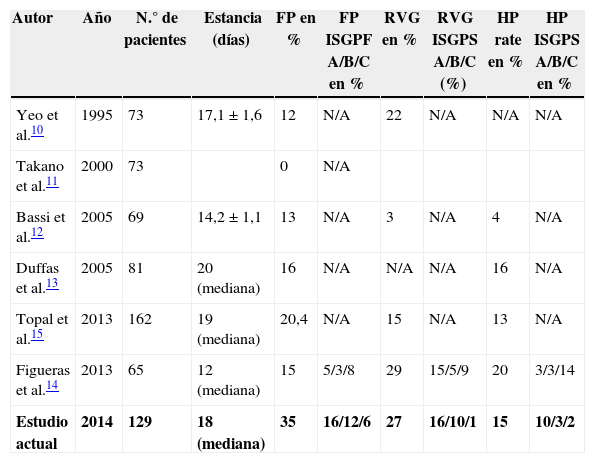
Por lo tanto, ¿son los resultados de la DPC-BG comparables a otras series publicadas de la PGA, que muestran globalmente mejores resultados que PJA? La comparación directa de estas series se ve obstaculizada por diferentes criterios diagnósticos utilizados para la clasificación de las complicaciones. Muchos de estos estudios se publicaron antes de la adopción de las clasificaciones de la ISGPF e ISGPS, que quedaron universalmente adoptadas, e incluso un ECA reciente no publicó todos los datos relativos a dichas complicaciones. Sin embargo, la estancia hospitalaria postoperatoria y las tasas de RVG-HP fueron totalmente comparables a las de otras series publicadas en la literatura (tabla 5). En cuanto a FP, nuestra tasa es del 34,8%, con una tasa de fístula clínicamente significativa del 18,6%. Analizando estos datos, los 2 únicos estudios que clasifican la FP de acuerdo con los criterios ISGFP demuestran que la FP clínica postoperatoria fue del 8% en el trabajo de Topal et al. y del 11% en el trabajo de Figueras et al., cifras próximas a las nuestras. Además, en nuestro análisis no hemos encontrado una correlación entre esta tasa de FP elevada y otros posibles factores de FP publicados, como el diámetro del conducto de Wirsung, un páncreas blando o la colocación de un stent interno/externo en el conducto pancreático, ni el origen de la lesión pancreática.
Comparación entre DPC-BG y otros resultados publicados de APG
| Autor | Año | N.° de pacientes | Estancia (días) | FP en % | FP ISGPF A/B/C en % | RVG en % | RVG ISGPS A/B/C (%) | HP rate en % | HP ISGPS A/B/C en % |
|---|---|---|---|---|---|---|---|---|---|
| Yeo et al.10 | 1995 | 73 | 17,1±1,6 | 12 | N/A | 22 | N/A | N/A | N/A |
| Takano et al.11 | 2000 | 73 | 0 | N/A | |||||
| Bassi et al.12 | 2005 | 69 | 14,2±1,1 | 13 | N/A | 3 | N/A | 4 | N/A |
| Duffas et al.13 | 2005 | 81 | 20 (mediana) | 16 | N/A | N/A | N/A | 16 | N/A |
| Topal et al.15 | 2013 | 162 | 19 (mediana) | 20,4 | N/A | 15 | N/A | 13 | N/A |
| Figueras et al.14 | 2013 | 65 | 12 (mediana) | 15 | 5/3/8 | 29 | 15/5/9 | 20 | 3/3/14 |
| Estudio actual | 2014 | 129 | 18 (mediana) | 35 | 16/12/6 | 27 | 16/10/1 | 15 | 10/3/2 |
Desde la aparición de los resultados positivos del ECA realizado en nuestra institución, la DPC-BG ha sido adoptada como el procedimiento quirúrgico de elección. El presente estudio muestra los resultados obtenidos mediante la aplicación de esta técnica quirúrgica en particular en la base del día a día. Puesto que hay factores que no estaban presentes en el momento en el que se realizó el ECA y que la situación no es tan controlada, los presentamos como la realidad de la cirugía de la cabeza del páncreas en nuestra institución. En nuestra opinión, la DPC-BG ofrece otras ventajas sobre la APY, principalmente debido a que la anastomosis pancreática no está en contacto directo con el tracto intestinal, con mucho menor grado de contaminación bacteriana en caso de dehiscencia y con la facilidad de gestión en caso de reintervención quirúrgica a causa de una FP clínicamente relevante. Esto permite una revisión de la anastomosis pancreática técnicamente fácil y, si es necesario, una totalización de la pancreatectomía relativamente sencilla. Además, en comparación con una APG convencional, la ventaja de la DPC-BG radica en que la zona de la partición gástrica se encuentra relativamente excluida del tránsito alimentario, por lo que su manejo en caso de complicaciones graves es más sencillo.
En conclusión, los resultados de la DPC-BG en el escenario del mundo real son esencialmente comparables a los publicados en la literatura obtenidos en el escenario de un ECA, y pueden constituir un recurso valioso para los cirujanos de páncreas.
Conflicto de interesesLos autores niegan la presencia de conflicto de intereses.