La gastrectomía total es una cirugía con importante morbimortalidad perioperatoria que es considerada el tratamiento de elección en el cáncer gástrico proximal. Descrita por primera vez en 1980, nuestro grupo describió y estandarizó la gastrectomía 95% totalmente laparoscópica en 2014. Esta técnica pretende disminuir las complicaciones de la gastrectomía total sin descuidar la radicalidad oncológica de la misma. Se presentan los primeros resultados de una cohorte de casos consecutivos tras 4 años realizando la técnica en 2 centros hospitalarios.
MétodosSe ha llevado a cabo un estudio prospectivo observacional en 67 pacientes con gastrectomía 95% laparoscópica realizadas entre 2014 y 2017. El objetivo principal ha sido la detección de complicaciones (Clavien Dindo>IIIa), centrándose en la fuga anastomótica como la más importante. Objetivo secundario fue valorar la calidad de la cirugía oncológica.
ResultadosSe incluyeron 67 pacientes consecutivos en los que se realizó gastrectomía 95% totalmente laparoscópica. No existió ningún caso de fuga anastomótica, 2 pacientes (2,98%) presentaron una o más complicaciones Clavien Dindo≥IIIa. La estancia total fue de 6 (3-13) días. Se realizó resección radical R0 en todos los pacientes.
ConclusionesLa gastrectomía 95% permite en pacientes seleccionados cumplir los estándares oncológicos de resección en el cáncer gástrico proximal de manera reproductible y segura, disminuyendo los riesgos perioperatorios como la fuga anastomótica. Se trata de un estudio prospectivo observacional no comparativo, por lo que son necesarios más estudios para valorar la estandarización de la técnica.
Total gastrectomy is a surgery with significant perioperative morbidity and mortality, being considered the treatment of choice in proximal gastric cancer. First described in 1980, our group reported and standardized totally laparoscopic 95% gastrectomy in 2014. This technique aims to reduce the complications of total gastrectomy while maintaining oncological radicality. We present the initial results from a cohort of consecutive cases after performing the technique for 4 years at 2 hospital centers.
MethodsA prospective observational study was carried out in 67 patients with laparoscopic 95% gastrectomy between 2014 and 2017. The main objective has been to detect complications (Clavien Dindo> IIIa), focusing on anastomotic leaks as the most important. The secondary objective was to assess the quality of oncological surgery.
ResultsSixty-seven consecutive patients were included, in whom 95% totally laparoscopic gastrectomy was performed. There was no case of anastomotic leak. Two patients (2.98%) had one or more Clavien Dindo complications equal to or greater than IIIa. The total hospital stay was 6 (3-13) days. R0 radical resection was performed in all patients.
Conclusions95% gastrectomy allows selected patients to meet the oncological standards of resection in proximal gastric cancer in a reproducible and safe manner, reducing perioperative risks such as anastomotic leakage. It is a non-comparative observational prospective study, so more studies are needed to assess the standardization of the technique.
La gastrectomía total es el tratamiento de elección en el cáncer gástrico proximal y según algunos autores de aquellos con infiltración difusa. Se trata de una cirugía agresiva con importante morbimortalidad perioperatoria y no exenta de alteraciones en la calidad de vida futura. El objetivo de dicha intervención es la realización de una cirugía oncológicamente satisfactoria o R0. Descrita en 1980, la gastrectomía 95% pretende disminuir las complicaciones de la gastrectomía total sin descuidar la radicalidad oncológica de la misma. Nuestro grupo describió la técnica en 20141. Se presentan los primeros resultados de una cohorte de casos consecutivos tras 4 años realizando la técnica en 2 centros hospitalarios.
MétodosSe ha llevado a cabo un estudio prospectivo observacional en pacientes con gastrectomía 95% laparoscópica realizada en 2 centros, hospital CHL en Luxemburgo y Galdakao ospitalea en Bizkaia, entre el 1 de enero de 2014 y el 31 de diciembre de 2017. Han sido incluidos todos los pacientes con cáncer gástrico (cT1–4 N0–3M0) localizado en antro o cuerpo gástrico, en los cuales se ha propuesto realizar una gastrectomía curativa mediante cirugía laparoscópica con objetivo R0. Los pacientes con tumores que infiltran la unión esofagogástrica, menores de 18 años o que hayan recibido una cirugía paliativa han sido excluidos. Todos los pacientes han sido intervenidos por los mismos 3 cirujanos.
ObjetivosEl objetivo principal ha sido la detección de complicaciones (Clavien Dindo), centrándose en la fuga anastomótica como la principal. El objetivo secundario fue la calidad de la cirugía oncológica, considerando como tal la indemnidad microscópica de los márgenes de resección (longitudinal y radial), el número de ganglios resecados y la recidiva local precoz. Se recogieron todas las complicaciones ocurridas en los primeros 60 días posoperatorios, así como los resultados de anatomía patológica, incluyendo el número de ganglios linfáticos resecados y afectos, la diferenciación tumoral, el tipo de la clasificación de Lauren y el estadio pTNM.
Estadificación tumoralBasándose en las guías clínicas internacionales, los pacientes en los que se sospechó cáncer gástrico fueron estudiados mediante gastroscopia y TAC toracoabdominal. Se realizó una ecoendoscopia en los pacientes en los que se sospechó infiltración de la unión esofagogástrica o de otros órganos vecinos. En tumores avanzados T3-4/N+ se realizó tratamiento neoadyuvante mediante quimioterapia.
TratamientoTodos los pacientes operables (cT1-4 N0-3M0) se incluyeron para gastrectomía totalmente laparoscópica con intención curativa. Todos los pacientes con enfermedad superior a cT1N0 recibieron quimioterapia preoperatoria mediante 4 ciclos de 5-fluorouracilo, oxiloplatino y taxotere, salvo que la condición del paciente o condiciones del tumor lo desaconsejaran por obstrucción o sangrado.
Técnica quirúrgicaA las 4-6 semanas tras el tratamiento neoadyuvante, a los pacientes se les realizó una gastrectomía casi total 95% totalmente laparoscópica y una linfadenectomía D2 según la técnica que ya ha sido descrita previamente en otra publiocación1. Tras la resección se realizó una reconstrucción en Y de Roux. En los primeros 20 casos se realizó omentectomía total que fue analizada de manera independiente, en las que no se encontró ningún ganglio linfático ni implante tumoral en el epiplón mayor. En los siguientes casos se realizó omentectomía parcial, comenzando la resección 4cm distal a los vasos gastroepiploicos.
Análisis estadísticoAl tratarse de una cohorte observacional, únicamente se ha realizado un análisis descriptivo de los datos, recogidos prospectivamente en bases de datos de Microsoft Excel y analizados mediante SPSS® versión 22.0. Las variables continuas han sido tratadas mediante la media (rango).
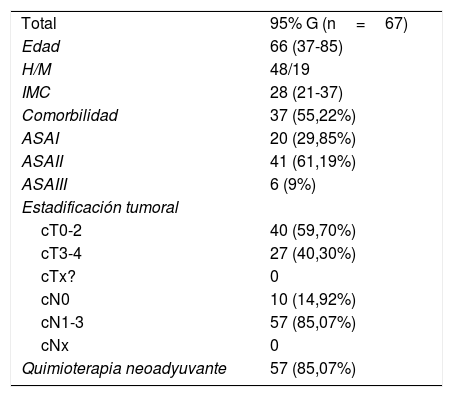
ResultadosDurante el periodo de estudio se incluyeron 67 pacientes consecutivos con gastrectomías por cáncer gástrico con intención curativa. Las características clínicas de los pacientes se detallan en la tabla 1. Se operaron 16 casos en 2014, 21 en 2015, 19 en 2016 y 11 en 2017, de los cuales 10 fueron cáncer gástrico precoz y 57 cáncer gástrico avanzado. La duración del seguimiento ha sido de entre 4 y 48 meses en los cuales se han perdido 6 pacientes, 3 de los cuales han fallecido por otra causa no relacionada con el cáncer.
Datos preoperatorios de los pacientes
| Total | 95% G (n=67) |
| Edad | 66 (37-85) |
| H/M | 48/19 |
| IMC | 28 (21-37) |
| Comorbilidad | 37 (55,22%) |
| ASAI | 20 (29,85%) |
| ASAII | 41 (61,19%) |
| ASAIII | 6 (9%) |
| Estadificación tumoral | |
| cT0-2 | 40 (59,70%) |
| cT3-4 | 27 (40,30%) |
| cTx? | 0 |
| cN0 | 10 (14,92%) |
| cN1-3 | 57 (85,07%) |
| cNx | 0 |
| Quimioterapia neoadyuvante | 57 (85,07%) |
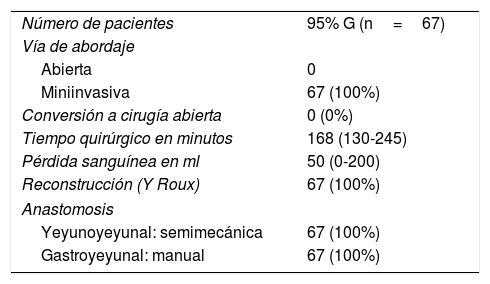
Los resultados intraoperatorios se resumen en la tabla 2. Se realizó gastrectomía 95% en 67 pacientes (67;100%) y reconstrucción en Y de Roux mediante anastomosis entre el muñón gástrico y el yeyuno manual con sutura barbada y pie de asa yeyuno-yeyunal laterolateral semimecánica en 67 pacientes (67;100%). Todos los pacientes fueron intervenidos por laparoscopia (67;100%), con una tasa de conversión nula. La pieza quirúrgica se extrajo protegida en bolsa plástica extractora mediante incisión de Pfannenstiel y doble aro protector de herida en todos los casos.
Detalle de las cirugías
| Número de pacientes | 95% G (n=67) |
| Vía de abordaje | |
| Abierta | 0 |
| Miniinvasiva | 67 (100%) |
| Conversión a cirugía abierta | 0 (0%) |
| Tiempo quirúrgico en minutos | 168 (130-245) |
| Pérdida sanguínea en ml | 50 (0-200) |
| Reconstrucción (Y Roux) | 67 (100%) |
| Anastomosis | |
| Yeyunoyeyunal: semimecánica | 67 (100%) |
| Gastroyeyunal: manual | 67 (100%) |
No hubo ningún fallecimiento en los 60 primeros días posoperatorios. Dos pacientes (2,98%) presentaron una o más complicaciones Clavien Dindo≥IIIa (tabla 3). Un paciente reingresó el 10.o día posquirúrgico por hemorragia digestiva siendo tratado mediante endoscopia y el otro precisó reintervención por obstrucción intestinal causada por hernia interna el 52.o día posoperatorio. Cuatro (5,97%) pacientes presentaron complicaciones Clavien Dindo˂IIIa, correspondiéndose con 2 infecciones cutáneas, un caso de hemorragia digestiva autolimitada y una infección respiratoria. La estancia media en reanimación fue de un día en los 6 pacientes que precisaron cuidados intensivos por enfermedades relevantes asociadas. La estancia total fue de 6 (3-13) días. Los últimos 31 pacientes fueron incluidos en el protocolo de rehabilitación multimodal «fast track» realizado en nuestro centro, por lo que no portaron drenajes, sonda nasogástrica, ni vesical y presentaron movilización inmediata mediante la utilización de analgésicos y antieméticos adaptada2.
Datos posoperatorios
| Número de pacientes | 95% G (n=67) |
| Complicaciones postoperatorias (CD≥IIIa) | 2 (2,98%) |
| • Fuga anastomótica | 0 |
| Complicaciones postoperatorias (CD<IIIa) | 4 (5,97%) |
| Fuga muñón duodenal | 0 |
| Hemorragia digestiva | 1 (1,49%) |
| Infección cutánea | 2 (2,98%) |
| Complicaciones médicas | 1 (1,49%) |
| Mortalidad a 60 días | 0 |
| Estancia hospitalaria | 6 (3-13) |
| Estancia en UCI | 6 pacientes (1 día) |
| Reingreso a 60 días | 2 (2,98%) |
| Quimioterapia adyuvante posoperatoria | 48 (71,63%) |
Los resultados de las piezas analizadas se muestran en la tabla 4. Se realizó resección radical R0 en los 67 pacientes (67;100%) y ni el margen proximal ni el distal fue positivo en ningún paciente (67;0%). Se analizaron de media 41 (26-58) ganglios de los cuales 5 (0-21) fueron positivos. No se encontraron ganglios linfáticos ni implantes peritoneales en las piezas quirúrgicas de los primeros 20 pacientes en los que se realizó omentectomía total.
Detalle de la anatomía patológica y estadificación tumoral
| Número de pacientes | 95% G (n=67) |
| Resección radical (R0) | 67 (100%) |
| R1 | 0 (100%) |
| Margen proximal positivo | 0 |
| Margen distal positivo | 0 |
| Afectación de margen radial | 0 |
| Respuesta completa patológica | 0 |
| Localización tumoral | |
| Tercio proximal | 4 (6%) |
| Cuerpo gástrico (tercio medio) | 21 (31,34%) |
| Tercio distal | 42 (62,69%) |
| Subtipo histológico (Clasificación de Laurén) | |
| Adenocarcinoma intestinal | 54 (80,6%) |
| Carcinoma difuso o mixto | 13 (19,4%) |
| Grado de diferenciación tumoral | |
| G1 | 14 (29,25%) |
| G2 | 36 (53,73%) |
| G3 | 7 (10,45%) |
| Extensión tumoral local | |
| (y)pT1-2 | 27 (40,23%) |
| (y)pT3-4 | 40 (59,70%) |
| Extensión ganglionar | |
| (y)pN0 | 6 (8,95%) |
| (y)pN1 | 23 (34,33%) |
| (y)Pn2 | 26 (38,81%) |
| (y)Pn3 | 12 (17,91%) |
| Enfermedad metastásica (y)pM1 | 0 |
| N.ode ganglios linfáticos resecados | 41 (26-58) |
| N.ode ganglios linfáticos positivos | 5 (0-21) |
| Ganglios linfáticos en epiplón | 0/20 |
| Implantes tumorales en epiplón | 0/20 |
| Estadio tumoral (TNM 8.aedición) | |
| Ia | 0 |
| Ib | 5 (7,46%) |
| IIa | 17 (25,37%) |
| IIb | 29 (43,28%) |
| IIIa | 13 (19,40%) |
| IIIb | 3 (4,48%) |
| IIIc | 0 |
| IV | 0 |
La duración del seguimiento ha sido de entre 4 y 48 meses. Seis pacientes se han perdido en el seguimiento, de los cuales 3 han fallecido por otra causa no relacionada con el cáncer. Siete (11,47%) pacientes han presentado diseminación generalizada de la enfermedad en este periodo de tiempo de los cuales 2 han fallecido (3,28%). No se ha detectado ningún caso de recidiva local aislada.
DiscusiónActualmente el tratamiento del cáncer gástrico se engloba dentro de un tratamiento multidisciplinar en el que se incluye la cirugía como pilar fundamental de tratamiento con intención curativa, apoyada por tratamientos adyuvantes como la quimioterapia y la radioterapia3. Uno de los puntos clave en dicho tratamiento quirúrgico, además de la magnitud de la linfadenectomía es la extensión de la resección gástrica en cada caso, bien gastrectomía total o subtotal4. Las guías clínicas internacionales recomiendan la gastrectomía total para el tratamiento del cáncer gástrico proximal y en caso de cáncer gástrico difuso con el objetivo de conseguir un margen oncológico de seguridad de entre 5-8cm5,6.
La gastrectomía total presenta una morbimortalidad elevada hasta en manos muy experimentadas y puede ser factor de mortalidad independiente respecto a otras gastrectomías7. La complicación más temida es la fuga de la anastomosis esofagoyeyunal, habiendo sido reflejado en las más recientes y amplias series entre 5-15%8,9, mientras que en la gastrectomía subtotal la fuga gastroyeyunal se presenta entre el 0,5 y 3% de los casos10. Además, la mortalidad asociada a la fuga anastomótica es elevada, pudiendo causar la muerte de uno de cada 3 pacientes11.
La gastrectomía casi total fue descrita en 1954 y posteriormente ha sufrido diferentes descripciones y modificaciones hasta que en 2013 se describió en Japón con la gastrectomía 95% laparoscópica para cáncer gástrico precoz12. Tal y como ya ha sido descrito previamente, nuestro grupo describió y estandarizó la técnica modificada en 20141. Posteriormente se ha ampliado la indicación a casos seleccionados de cáncer gástrico avanzado en los que la unión esofagogástrica no se encuentra afectada.
Además de disminuir las complicaciones de la gastrectomía total, esta gastrectomía pretende mantener la radicalidad oncológica, asociando, a diferencia de la gastrectomía 7/8, la completa resección del fundus gástrico mediante la preservación de un pequeño muñón gástrico de solo 1-2cm. El remanente gástrico permite realizar mediante laparoscopia una reproductible anastomosis manual intracorpórea con seguridad, para lo cual se utiliza una sutura barbada. Los resultados quirúrgicos obtenidos mediante esta técnica son equiparables a los de la gastrectomía subtotal en cuanto a número de complicaciones, recuperación y calidad de vida postoperatorias. Por otro lado, no se ha detectado ningún margen proximal positivo ni recidiva local alguna hasta la fecha de seguimiento.
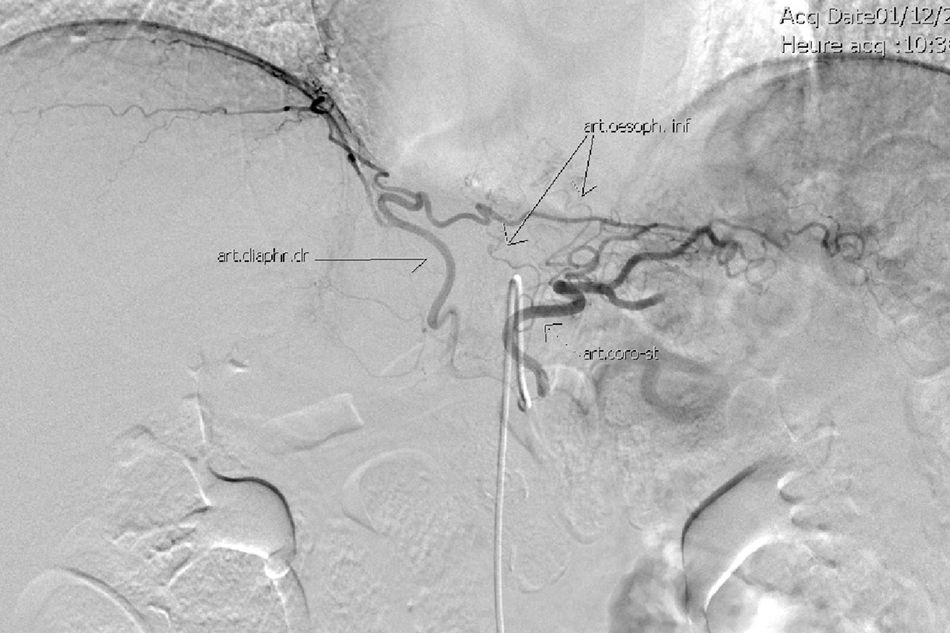
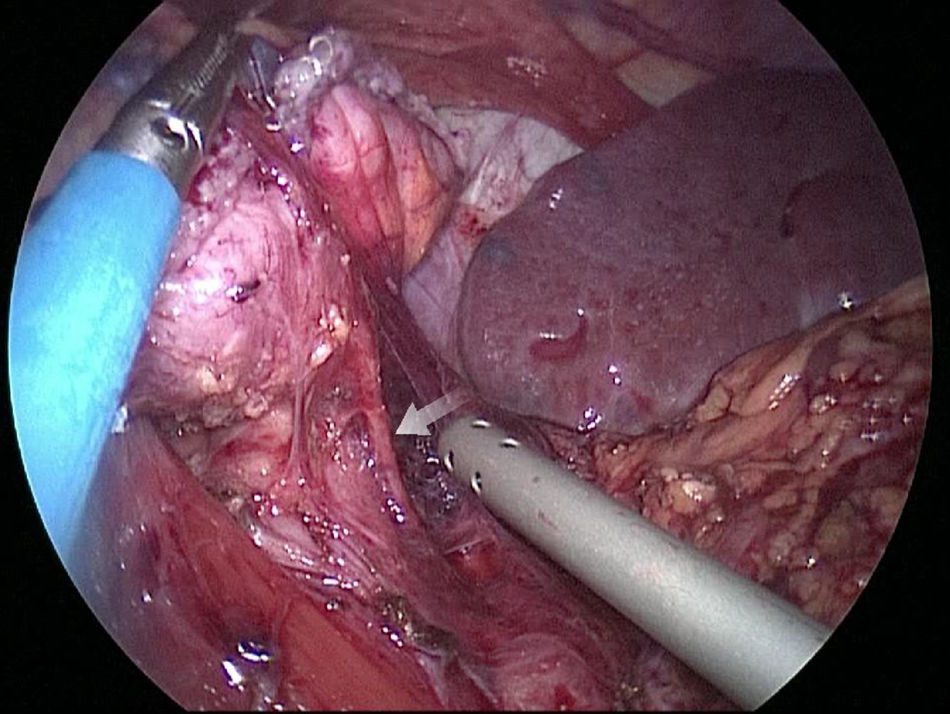
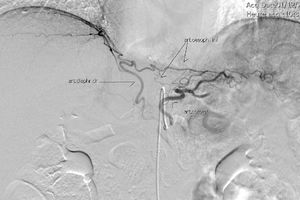
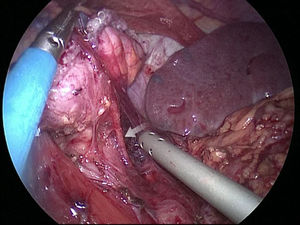
El muñón gástrico presenta vascularización mediante vasos subserosos de la vascularización metamérica esofágica (rama inferior de arteria esofágica mayor) y provenientes de los vasos diafragmáticos y de la arteria esplénica, tal y como se ha podido evidenciar en diferentes estudios arteriográficos (fig. 1) y en las propias intervenciones quirúrgicas (fig. 2)13. Esto permite una anastomosis entre el muñón gástrico y el yeyuno bien vascularizada y sin riesgo de isquemia, lo que consigue unos resultados quirúrgicos óptimos, con complicaciones relacionadas con las anastomosis casi inexistentes.
La linfadenectomía recomendada en el cáncer gástrico proximal avanzado es la D23–6. Mediante esta gastrectomía es posible realizar con garantías una extensa linfadenectomía laparoscópica, incluso de los grupos paracardiales (n.o 1 y 2), sin riesgo de devascularización del muñón gástrico.
Por último, la minimización de las complicaciones permite a un mayor número de pacientes cumplir un programa de rehabilitación multimodal y mantener un mejor estado funcional y nutricional14. Con todo ello más pacientes pueden beneficiarse de cumplimentar el tratamiento adyuvante postoperatorio, con lo que el pronóstico de estos pacientes puede mejorar15.
Por lo tanto, se concluye que la gastrectomía 95% totalmente laparoscópica permite en pacientes seleccionados cumplir los estándares oncológicos de resección en el cáncer gástrico proximal de manera reproductible y segura, disminuyendo los riesgos perioperatorios como la fuga anastomótica. A su vez permite una mejor recuperación postoperatoria y un mejor estado nutricional, que posibilita un mayor porcentaje de pacientes que recibirán quimioterapia adyuvante. Se trata de un estudio prospectivo observacional no comparativo, con los sesgos que ello conlleva, que únicamente pretende mostrar la seguridad del procedimiento sin aparente compromiso oncológico. La gastrectomía 95% es una técnica descrita y aceptada para el tratamiento del cáncer gástrico proximal, pero son necesarios estudios prospectivos aleatorizados con mayor plazo de seguimiento para valorar la estandarización de la misma16,17.
FinanciaciónNo se han recibido apoyos para la realización del estudio en forma de becas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.