El objetivo del estudio fue valorar la relación entre la administración preoperatoria de regímenes de quimioterapia basados en irinotecán u oxaliplatino con el desarrollo de enfermedad hepática grasa no alcohólica (EHGNA) o el síndrome de obstrucción sinusoidal (SOS) y la influencia de estas alteraciones histológicas sobre la evolución de los pacientes tras la intervención quirúrgica.
Pacientes y métodoEstudio prospectivo en el que se incluyeron 45 pacientes sometidos a intervención quirúrgica por metástasis hepáticas de cáncer colorrectal entre mayo de 2005 y julio de 2009. Se recogieron variables demográficas, preoperatorias, de la intervención quirúrgica y de la evolución postoperatoria. Se obtuvo una muestra de la pieza de resección para su análisis histológico siguiendo los parámetros de clasificación de la EHGNA (índice NAS) y del SOS.
ResultadosEn 22 casos se administró quimioterapia neoadyuvante previa a la resección (grupo de estudio) y 23 pacientes formaban parte del grupo control (no quimioterapia). En 4 de los 7 pacientes (57,2%) en los que se administró de forma preoperatoria irinotecán, se observó esteatohepatitis borderline o diagnóstica (p=0,001). Siete de los 15 pacientes tratados con oxaliplatino (46,7%) desarrollaron un SOS moderado o grave (p=0,002). No hubo diferencias en cuanto a la morbimortalidad en función del grado de EHGNA, pero sí hubo una mayor tasa de complicaciones hepáticas y mayor estancia media en los pacientes con SOS moderado/intenso (p=0,004 y p=0,021 respectivamente).
ConclusionesLa administración de irinotecán se relacionó de forma significativa con un aumento en la incidencia de esteatohepatitis, sin que esto aumentara la morbimortalidad. Los pacientes tratados con oxaliplatino tuvieron una mayor incidencia de SOS y existió un aumento de las complicaciones hepáticas y de la estancia media.
The aim of the study was to evaluate the relationship between the pre-surgical administration of a chemotherapy regime based on irinotecan or oxaliplatin and the development of non-alcoholic fatty liver disease (NAFLD) or sinusoidal obstruction syndrome (SOS), and the influence of these histological changes on the outcome of patients after surgical intervention.
Patients and methodA prospective study which included 45 patients surgically intervened due to colorectal cancer liver metastases between May 2005 and July 2009. Demographic data and the variables before during and after the operation were collected. A specimen of the resection was obtained for histological analysis following the classification parameters of the NAFLD (NASH index) and SOS scale.
ResultsNeoadjuvant chemotherapy was given before the resection in 22 cases (study group) and 23 patients made up the control group (no chemotherapy). Borderline or diagnostic steatohepatitis was observed in 4 of the 7 patients (57.2%) who were given preoperative irinotecan (P=0.001). Seven of the 15 patients (46.7%) treated with oxaliplatin developed a moderate or severe SOS (P=0.002). There were no differences in morbidity or mortality associated to the NAFLD grade, but there was a higher rate of liver complications and longer mean hospital stay in patients with moderate/severe SOS (P=0.004 and P=0.021, respectively).
ConclusionsTreatment with irinotecan was significantly associated with an increase in the incidence of steatohepatitis, but did not increase the morbidity or mortality. Patients treated with oxaliplatin had a higher incidence of SOS, an increase in liver complications and a longer mean hospital stay.
El hígado es el lugar más frecuente de metástasis del carcinoma colorrectal (CCR). La resección hepática es el único tratamiento que actualmente ofrece una posibilidad de supervivencia a largo plazo en pacientes con metástasis hepáticas (MH) de CCR. No obstante, aunque aproximadamente el 30% de los pacientes con MH tiene enfermedad limitada al hígado, la resección hepática ha sido históricamente una opción terapéutica en solo el 10 al 25% de estos pacientes1,2.
La aparición de nuevos agentes quimioterápicos y sus combinaciones ofrece a pacientes con metástasis inicialmente irresecables, la posibilidad de una cirugía de rescate con intención curativa y ha mejorado de forma sustancial la esperanza de vida de los pacientes con CCR metastásico. Los esquemas de quimioterapia estándar con 5-FU más leucovorina en combinación con irinotecán (FOLFIRI) u oxaliplatino (FOLFOX) han demostrado la posibilidad de una cirugía de rescate con intención curativa en el 9–40% de metástasis inicialmente irresecables3. En los últimos tiempos un gran número de estudios sugieren el efecto negativo sobre el parénquima hepático, principalmente en lo que a la enfermedad hepática grasa no alcohólica (EHGNA) y el síndrome de obstrucción sinusoidal (SOS) se refiere, de algunos fármacos usados en quimioterapia en el CCR metastásico, en concreto el irinotecán y el oxaliplatino4–11.
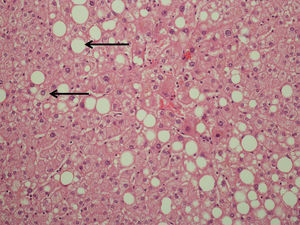
La EHGNA es un proceso caracterizado por la acumulación de sustancia lipídica en el hígado. Este concepto incluye la esteatosis hepática simple, la esteatohepatitis no alcohólica y finalmente la cirrosis hepática. Aunque el mecanismo de la EHGNA no ha sido aclarado por completo, existen evidencias que apoyan la resistencia a la insulina como el principal mecanismo implicado. En una segunda etapa, una fuente adicional de estrés oxidativo es capaz de superar los mecanismos de defensa celulares, dando como consecuencia un proceso inflamatorio, degeneración y fibrosis12. Aunque se acepta que la esteatohepatitis es parte de la EHGNA, en ocasiones es difícil para los patólogos el diferenciar o definir una esteatosis con inflamación del parénquima hepático de una esteatohepatitis. Por ello Kleiner et al13 propusieron un sistema de gradación (NAS: Nonalcoholic Fatty Liver Disease Activity Score) para determinar la gravedad de la esteatohepatitis en función de estas características. Este sistema de puntuación se basó en las características asociadas de forma significativa con el diagnóstico de esteatohepatitis: la extensión de la esteatosis, la inflamación lobular y el balonamiento hepatocelular. El propósito de este sistema de clasificación fue proporcionar un método válido semicuantitativo para unificar criterios en los diferentes estudios clínicos. Cada una de estas características de la esteatohepatitis ha demostrado una correlación independiente con el diagnóstico de dicha enfermedad hepática.
Por su parte, en la fisiopatología del SOS, se ha implicado la despolimeración de la F-actina de las células endoteliales de los sinusoides, la activación de metaloproteasas y la inducción de estrés oxidativo. Las células de la pared de los sinusoides se desprenden y penetran en la circulación, embolizando y obstruyendo el flujo sanguíneo sinusoidal. Fueron Rubbia-Brandt et al7 los primeros en comunicar un aumento en la prevalencia del SOS en tejido hepático de pacientes que habían recibido tratamiento con oxaliplatino para las MH de CCR.
El objetivo del presente estudio es valorar la relación entre la administración preoperatoria de regímenes de quimioterapia basados en irinotecán u oxaliplatino con el desarrollo de EHGNA y SOS, y la influencia de estas alteraciones histológicas sobre la evolución de los pacientes tras la intervención quirúrgica.
Pacientes y métodosSelección de los pacientesSe trata de un estudio de cohortes prospectivo en el que se incluyeron todos los pacientes sometidos a intervención quirúrgica por MH de CCR en la Unidad de Cirugía Hepatobiliopancreática del Servicio de Cirugía General y del Aparato Digestivo del Hospital Universitario de La Princesa de Madrid entre mayo de 2005 y julio de 2009. La decisión de tratamiento quirúrgico y resecabilidad de las MH fue tomada en una reunión multidisciplinar del Comité de Tumores del Hospital Universitario de La Princesa. Todos los pacientes firmaron el consentimiento informado aceptando la toma de biopsia hepática previo al tratamiento quirúrgico y el estudio fue aprobado por el Comité Ético del hospital.
Los pacientes fueron divididos en dos grupos: grupo de estudio y grupo control. Los criterios de inclusión para el grupo de estudio fueron pacientes con CCR y MH que recibieron quimioterapia preoperatoria según los protocolos del Hospital Universitario de La Princesa con un intervalo entre el final de la quimioterapia y la cirugía entre 4 y 6 semanas, sometidos a resección hepática anatómica o no anatómica, con o sin oclusión vascular y con ausencia de enfermedad hepática crónica. En cuanto al grupo control los criterios de inclusión incluyeron pacientes con MH que no habían recibido ningún tipo de quimioterapia en los 6 meses previos a la cirugía, sometidos a resección hepática y con ausencia de enfermedad hepática crónica. El grupo de estudio se dividió en función del tratamiento quimioterápico administrado: pacientes que recibieron terapia basada en irinotecán (FOLFIRI) y pacientes con terapia basada en oxaliplatino (FOLFOX).
Se excluyeron del estudio aquellos pacientes con MH irresecables, con enfermedad hepática crónica, y los pacientes sometidos a embolización venosa portal preoperatoria puesto que la embolización portal produce isquemia intensa con probables cambios en los sinusoides.
En todos los casos se recogió la información clínica de modo prospectivo incluyendo variables demográficas (sexo, edad, índice de masa corporal [IMC], antecedentes personales incluyendo HTA, DM, dislipemia [colesterol total >200 y/o TG >150]), preoperatorias respecto a las características de las MH (número, localización [unilateral/bilateral], sincrónica/metacrónica, tamaño de la lesión mayor), CEA al diagnóstico, tiempo entre la cirugía del tumor primario y la resección de la metástasis, tipo de quimioterapia (tiempo, número de ciclos y toxicidad), de la cirugía (tiempo operatorio, requerimientos de transfusión intraoperatoria, tipo de hepatectomía, resección anatómica/no anatómica, clampaje vascular y duración, número de metástasis resecadas) y del postoperatorio (analíticos: tiempo de protrombina, bilirrubina, niveles de transaminasas (GOT/AST, GPT/ALT), fosfatasa alcalina y GGT, en los días 1, 3, 5 y 7; complicaciones hepáticas (fístula biliar, hemorragia, absceso, colección no infectada e insuficiencia hepática) y las complicaciones médicas (pulmonar, cardíaca, renal e infecciosa), la necesidad de reintervención o de drenaje percutáneo, la duración de la estancia hospitalaria y la mortalidad postoperatoria a 30 días. Se definió fallo hepático como alteración mental asociada con coagulopatía (INR>1,5) en pacientes sin cirrosis preexistente.
Tratamiento quirúrgicoTodas las resecciones hepáticas se realizaron con intención curativa. La cavidad peritoneal se revisó inicialmente para descartar enfermedad extrahepática. Posteriormente, se llevó a cabo una exploración completa del hígado mediante palpación y ECOI para determinar la localización de las lesiones, su relación con las estructuras vasculares y descartar lesiones ocultas no descubiertas en las pruebas de imagen preoperatorias. La transección hepática se llevó a cabo mediante disector ultrasónico CUSA® (Valleylab, Boulder, Colorado, EE.UU.). Para la hemostasia durante la transección se empleó Tissuelink® (TissuelinK Medical Inc., Dover, NH, EE.UU.). Cuando fue necesario se empleó clampaje vascular de la triada portal (maniobra de Pringle). Se consideró resección anatómica cuando se siguieron para llevar a cabo la resección las cisuras que marcan los límites anatómicos y que son las que define la clasificación de Brisbane14. Las resecciones no anatómicas o atípicas fueron aquellas que no seguían dicha clasificación.
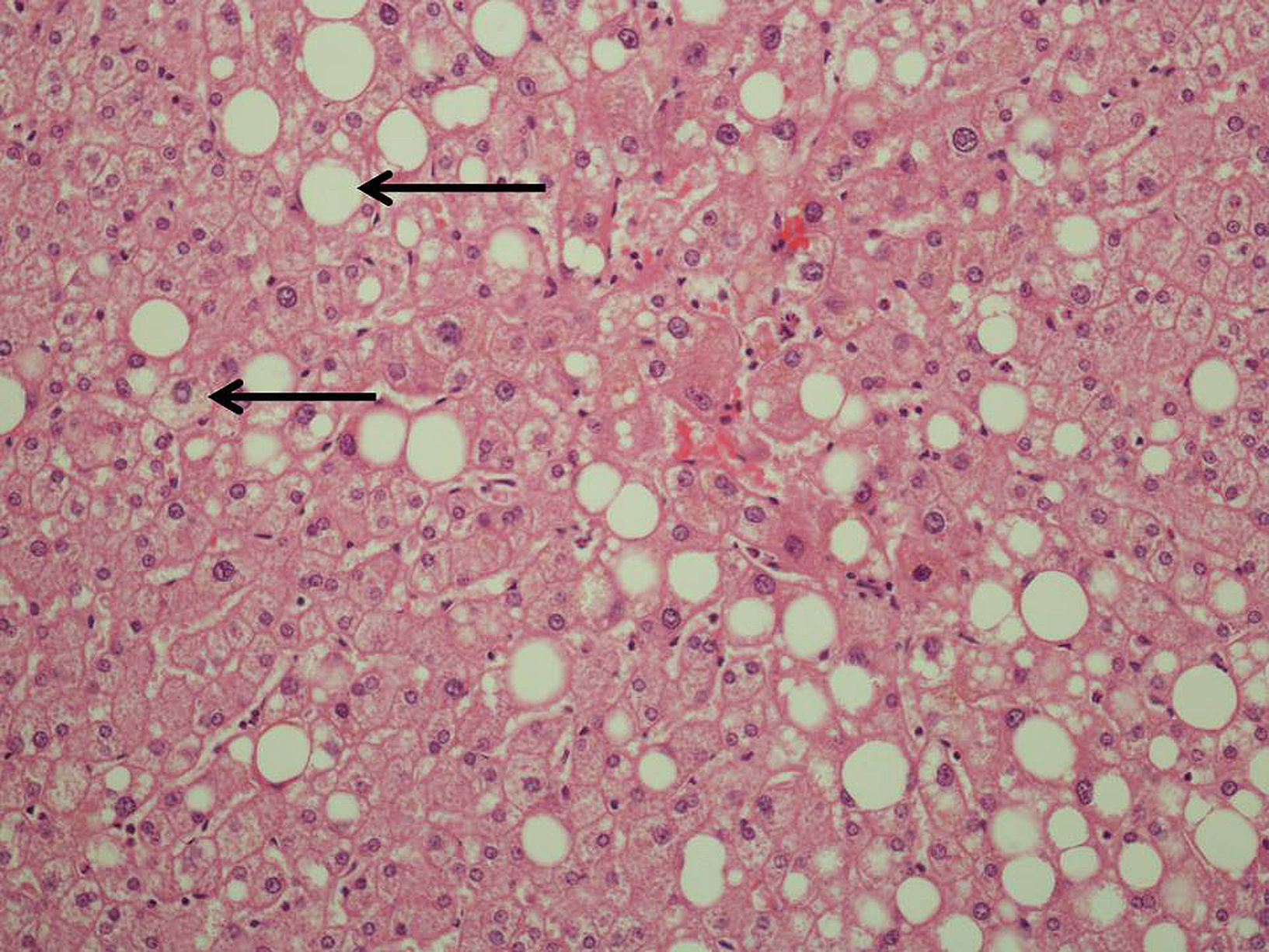
Estudio histopatológicoDe la pieza quirúrgica de resección, se obtuvo una muestra de 1×1cm de tejido hepático distante del tumor para su análisis histológico mediante Hematoxilina-Eosina y tricrómico de Masson. Dicha muestra se analizó siguiendo los parámetros de clasificación de la EHGNA (índice NAS)13 (esteatosis, inflamación lobular y balonamiento hepatocelular) (tabla 1) (fig. 1). Para el diagnóstico de esteatohepatitis, se consideraron las siguientes puntuaciones: 0–2: no diagnóstico de esteatohepatitis; 3–4: borderline, y 5–8: diagnóstico de esteatohepatitis.
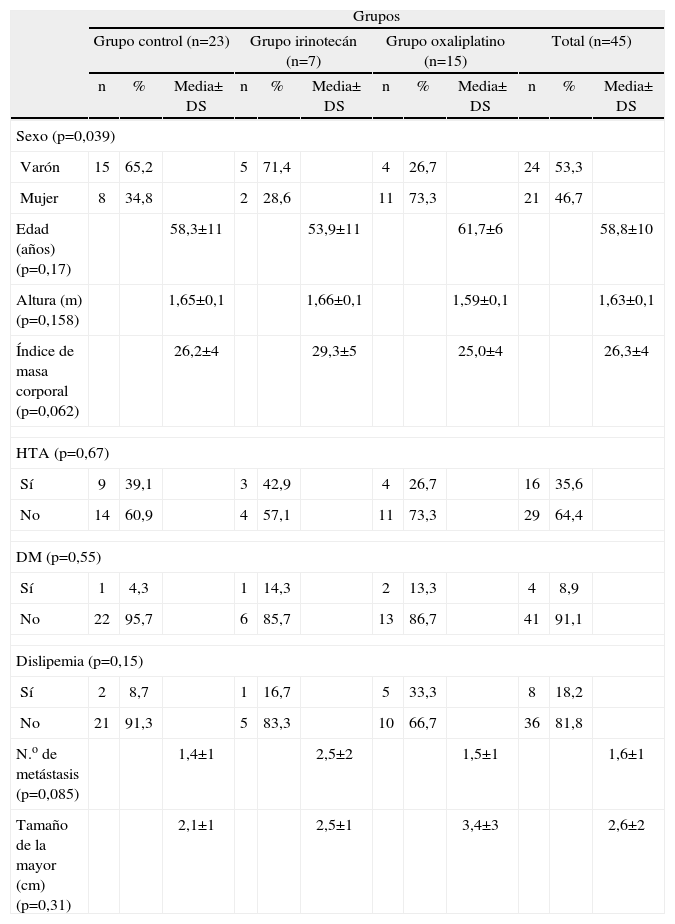
Antecedentes personales según grupo de tratamiento
| Grupos | ||||||||||||
| Grupo control (n=23) | Grupo irinotecán (n=7) | Grupo oxaliplatino (n=15) | Total (n=45) | |||||||||
| n | % | Media± DS | n | % | Media± DS | n | % | Media± DS | n | % | Media± DS | |
| Sexo (p=0,039) | ||||||||||||
| Varón | 15 | 65,2 | 5 | 71,4 | 4 | 26,7 | 24 | 53,3 | ||||
| Mujer | 8 | 34,8 | 2 | 28,6 | 11 | 73,3 | 21 | 46,7 | ||||
| Edad (años) (p=0,17) | 58,3±11 | 53,9±11 | 61,7±6 | 58,8±10 | ||||||||
| Altura (m) (p=0,158) | 1,65±0,1 | 1,66±0,1 | 1,59±0,1 | 1,63±0,1 | ||||||||
| Índice de masa corporal (p=0,062) | 26,2±4 | 29,3±5 | 25,0±4 | 26,3±4 | ||||||||
| HTA (p=0,67) | ||||||||||||
| Sí | 9 | 39,1 | 3 | 42,9 | 4 | 26,7 | 16 | 35,6 | ||||
| No | 14 | 60,9 | 4 | 57,1 | 11 | 73,3 | 29 | 64,4 | ||||
| DM (p=0,55) | ||||||||||||
| Sí | 1 | 4,3 | 1 | 14,3 | 2 | 13,3 | 4 | 8,9 | ||||
| No | 22 | 95,7 | 6 | 85,7 | 13 | 86,7 | 41 | 91,1 | ||||
| Dislipemia (p=0,15) | ||||||||||||
| Sí | 2 | 8,7 | 1 | 16,7 | 5 | 33,3 | 8 | 18,2 | ||||
| No | 21 | 91,3 | 5 | 83,3 | 10 | 66,7 | 36 | 81,8 | ||||
| N.o de metástasis (p=0,085) | 1,4±1 | 2,5±2 | 1,5±1 | 1,6±1 | ||||||||
| Tamaño de la mayor (cm) (p=0,31) | 2,1±1 | 2,5±1 | 3,4±3 | 2,6±2 | ||||||||
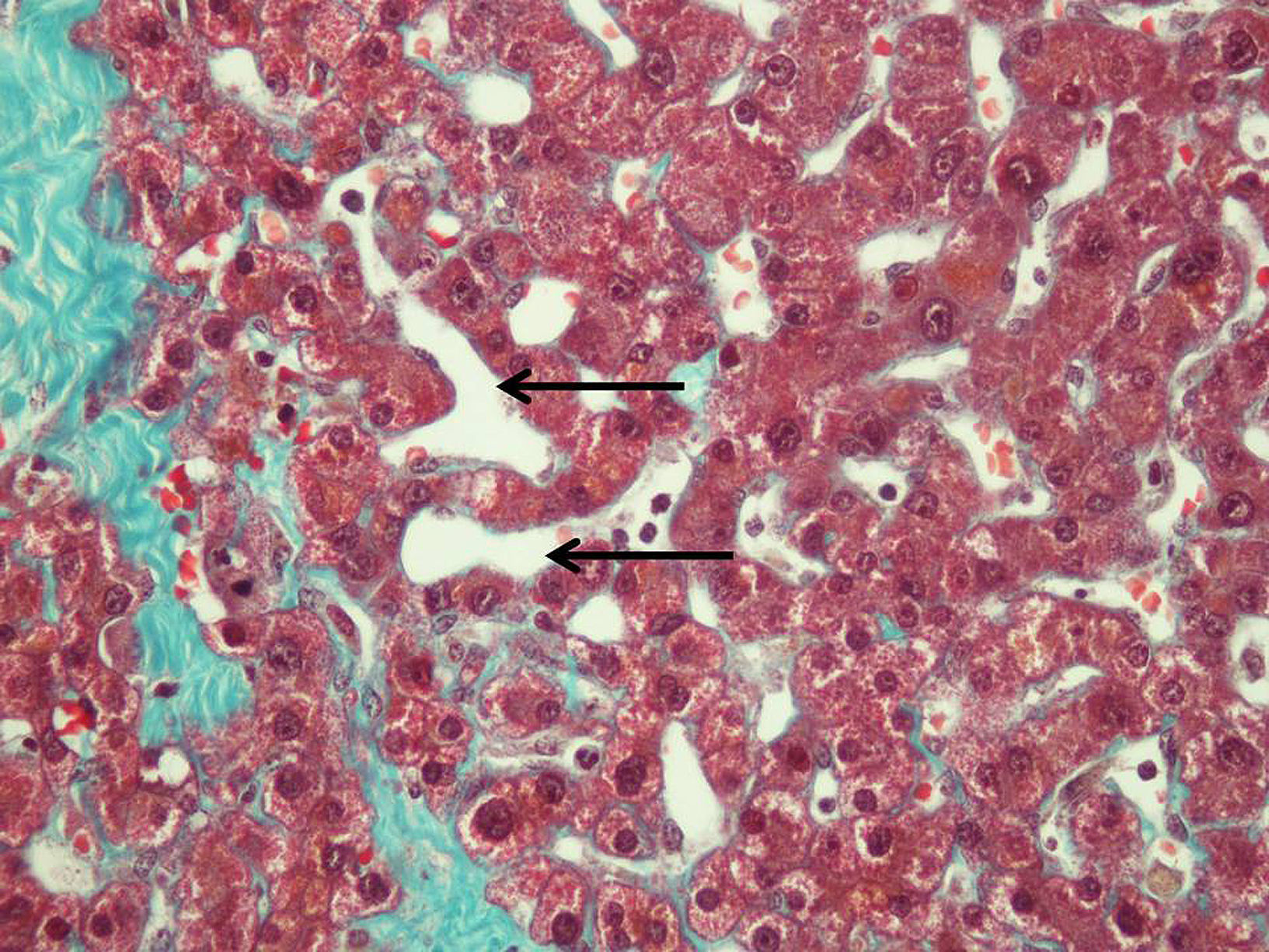
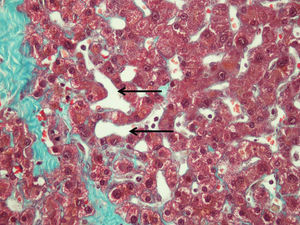
El grado de dilatación sinusoidal (SOS) se valoró según la clasificación de Rubbia-Brandt et al7 como 0: ausente; 1: ligera (afectación centrolobular, limitada a 1/3 de la superficie lobular); 2: moderada (centrolobular, extendiéndose a los 2/3 de la superficie lobular), y 3: intensa (afectación de toda la superficie lobular). El grado de fibrosis se clasificó como: 0: no fibrosis; 1: perisinusoidal o periportal: 1A: leve, perisinusoidal, 1B: moderada, perisinusoidal, 1C: portal/periportal sin perisinusoidal; 2: perisinusoidal y periportal/portal; 3: puentes fibrosos, y 4: cirrosis (fig. 2). Se relacionó tipo de quimioterapia administrada, efecto sobre el parénquima hepático y morbimortalidad tras la intervención quirúrgica.
Análisis estadísticoLos datos fueron introducidos en una base de datos y el análisis de los mismos se realizó con el programa de datos estadístico SPSS 15.a ed® (SPSS, Chicago, Illinois, EE.UU.). Las variables cuantitativas que seguían una distribución normal fueron definidas por media, desviación típica e intervalo de valores. En aquellas variables que no seguían una distribución gaussiana se utilizó la mediana en lugar de la media como medida de tendencia central. Las variables cualitativas fueron definidas por el número de casos y el porcentaje. La comparación de variables cuantitativas con cualitativas se realizó mediante el método t de Student para muestras independientes (comparación de dos medias) y ANOVA (comparación de más de dos medias) cuando las variables cuantitativas seguían una distribución normal. Cuando las variables cuantitativas no seguían una distribución gaussiana, se empleó el test de Mann-Whitney para comparar dos medias o el test de Kruskal-Wallis para comparar más de dos medias. En el caso de comparar dos variables discretas, se utilizó el test de χ2. Cuando el valor esperado fue menor de 5 en alguna de las casillas de la tabla de contingencia, fue necesario utilizar el test exacto de Fisher. El análisis de 2 variables cuantitativas normales, se llevó a cabo mediante el método de comparación de Pearson, mientras que cuando alguna de las dos variables, o las dos, no seguían una distribución gaussiana, se utilizó el test de Spearman. Se consideraron como significativos valores de p<0,05.
ResultadosCaracterísticas demográficasDurante el período de estudio, 45 pacientes (24 hombres y 21 mujeres) cumplieron los criterios de inclusión y han formado parte del estudio. De los 45 pacientes, en 22 casos se ha administrado algún tipo de fármaco de forma neoadyuvante entre las 4 y la 6 semanas previas a la resección (grupo de estudio) y en 23 pacientes no se administró quimioterapia de forma previa a la resección (grupo control). En el grupo de estudio en 7 pacientes se administró quimioterapia basada en el irinotecán (FOLFIRI, en 2 casos se añadió cetuximab y en otro bevacizumab), y en 15 pacientes terapia basada en oxaliplatino (FOLFOX, en 4 pacientes se añadió cetuximab y en 2 bevacizumab).
La distribución de los antecedentes personales según el grupo control y los diferentes grupos de tratamiento se muestran en la tabla 1.
Evaluación histológicaEHGNAEn nuestro estudio se comprobó relación entre la existencia de esteatosis e inflamación lobular y la administración de irinotecán como agente quimioterápico administrado de forma previa a la cirugía. El 57,2% de los pacientes tratados con irinotecán presentaron esteatosis hepática moderada o grave (>33%) (p=0,001). Solamente un paciente del grupo control y ninguno del grupo tratado con oxaliplatino desarrolló el mismo grado de esteatosis hepática. Asimismo, la presencia de inflamación lobular se relacionó con la administración de irinotecán, existiendo en el 71,4% de estos pacientes (p=0,02), por el 13% del grupo control y el 26,7% del grupo tratado con oxaliplatino.
Al calcular el índice NAS (tabla 2), observamos una clara relación entre la existencia de esteatohepatitis borderline o diagnóstica y el régimen quimioterápico administrado, observándose esta alteración histológica en 4 de los 7 pacientes (57,2%) en los que se administró irinotecán de forma previa a la intervención quirúrgica (p=0,001).
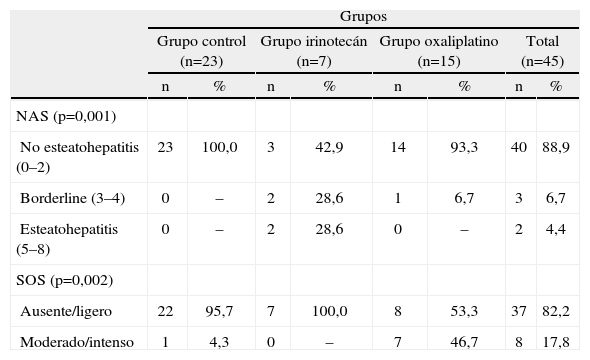
EHGNA (Índice NAS) y SOS según grupo de tratamiento
| Grupos | ||||||||
| Grupo control (n=23) | Grupo irinotecán (n=7) | Grupo oxaliplatino (n=15) | Total (n=45) | |||||
| n | % | n | % | n | % | n | % | |
| NAS (p=0,001) | ||||||||
| No esteatohepatitis (0–2) | 23 | 100,0 | 3 | 42,9 | 14 | 93,3 | 40 | 88,9 |
| Borderline (3–4) | 0 | – | 2 | 28,6 | 1 | 6,7 | 3 | 6,7 |
| Esteatohepatitis (5–8) | 0 | – | 2 | 28,6 | 0 | – | 2 | 4,4 |
| SOS (p=0,002) | ||||||||
| Ausente/ligero | 22 | 95,7 | 7 | 100,0 | 8 | 53,3 | 37 | 82,2 |
| Moderado/intenso | 1 | 4,3 | 0 | – | 7 | 46,7 | 8 | 17,8 |
Al analizar el grado de dilatación sinusoidal (tabla 2), se comprobó una clara relación entre la administración de oxaliplatino como régimen quimioterápico neoadyuvante y la existencia de dilatación sinusoidal moderada o intensa en el tejido hepático. Siete de los 15 pacientes tratados con regímenes de quimioterapia basados en oxaliplatino (46,7%) desarrollaron un SOS moderado o grave. Por el contrario, solamente un paciente del grupo control y ninguno del grupo tratado con irinotecán desarrollaron alteraciones histológicas similares (p=0,002).
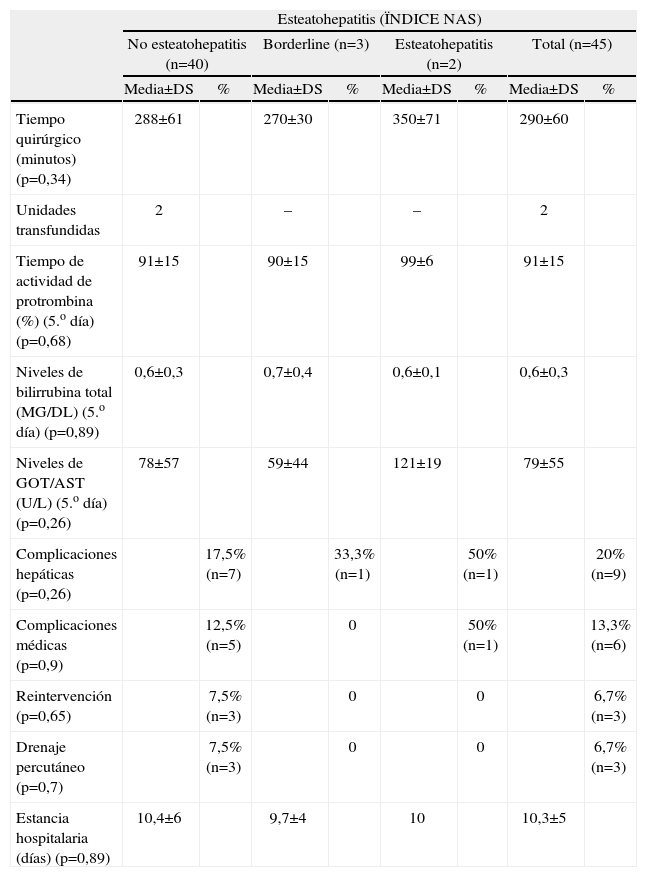
Morbimortalidad en función de EHGNALos parámetros medidos durante la intervención quirúrgica fueron similares entre grupos a pesar del grado de EHGNA. También lo fueron las pruebas de función hepática en el postoperatorio inmediato, y la tasa de complicaciones médicas, hepáticas o la necesidad de reintervención o drenaje percutáneo. No hubo ningún caso de mortalidad en estos pacientes, y la estancia media fue similar a la del grupo control (tabla 3). El tipo de hepatectomía realizada (mayor o menor) fue similar, sin diferencias estadísticas entre los diferentes grupos.
Morbimortalidad y estancia media en función del grado de EHGNA (Índice NAS)
| Esteatohepatitis (ÏNDICE NAS) | ||||||||
| No esteatohepatitis (n=40) | Borderline (n=3) | Esteatohepatitis (n=2) | Total (n=45) | |||||
| Media±DS | % | Media±DS | % | Media±DS | % | Media±DS | % | |
| Tiempo quirúrgico (minutos) (p=0,34) | 288±61 | 270±30 | 350±71 | 290±60 | ||||
| Unidades transfundidas | 2 | – | – | 2 | ||||
| Tiempo de actividad de protrombina (%) (5.o día) (p=0,68) | 91±15 | 90±15 | 99±6 | 91±15 | ||||
| Niveles de bilirrubina total (MG/DL) (5.o día) (p=0,89) | 0,6±0,3 | 0,7±0,4 | 0,6±0,1 | 0,6±0,3 | ||||
| Niveles de GOT/AST (U/L) (5.o día) (p=0,26) | 78±57 | 59±44 | 121±19 | 79±55 | ||||
| Complicaciones hepáticas (p=0,26) | 17,5% (n=7) | 33,3% (n=1) | 50% (n=1) | 20% (n=9) | ||||
| Complicaciones médicas (p=0,9) | 12,5% (n=5) | 0 | 50% (n=1) | 13,3% (n=6) | ||||
| Reintervención (p=0,65) | 7,5% (n=3) | 0 | 0 | 6,7% (n=3) | ||||
| Drenaje percutáneo (p=0,7) | 7,5% (n=3) | 0 | 0 | 6,7% (n=3) | ||||
| Estancia hospitalaria (días) (p=0,89) | 10,4±6 | 9,7±4 | 10 | 10,3±5 | ||||
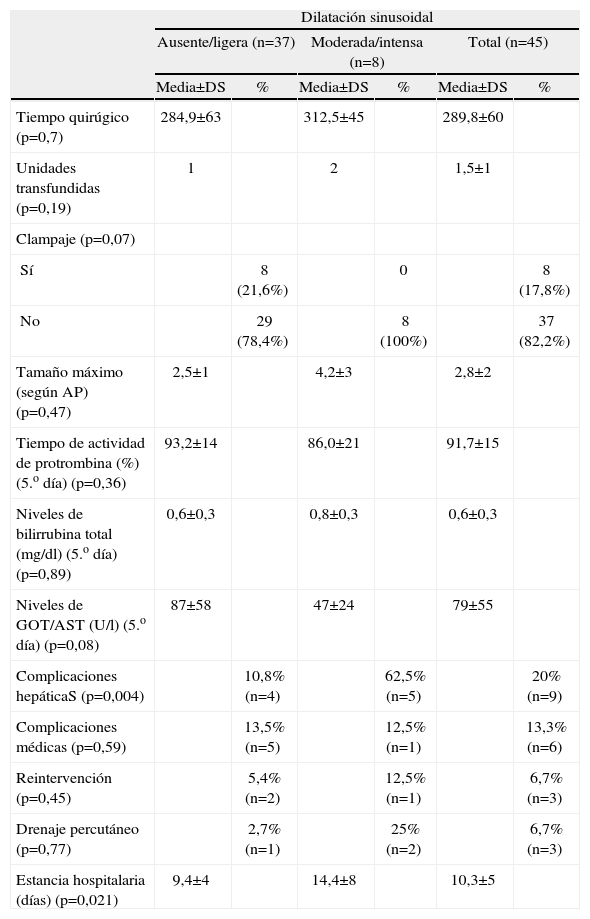
El tiempo quirúrgico, la necesidad de clampaje vascular o las unidades transfundidas no se vieron afectados por la existencia de un grado de dilatación sinusoidal moderado o intenso, de la misma forma que no lo hicieron las pruebas de función hepática. Sí hubo una mayor tasa de complicaciones hepáticas en los pacientes con daño sinusoidal moderado/intenso (p=0,004). En este grupo, 3 pacientes tuvieron una colección no infectada y en 2 de ellos se objetivó un absceso en el lecho quirúrgico. Aunque no hubo diferencias en la tasa de complicaciones médicas, necesidad de reintervención o drenaje percutáneo, la estancia media de estos pacientes fue significativamente mayor (14,4±8 días en el grupo con daño sinusoidal intenso versus 9,4±4 días en el grupo sin alteraciones histológicas, p=0,021) (tabla 4). De la misma forma que en el apartado anterior, no hubo diferencias significativas en cuanto al tipo de cirugía realizada.
Morbimortalidad y estancia media en función del grado de SOS
| Dilatación sinusoidal | ||||||
| Ausente/ligera (n=37) | Moderada/intensa (n=8) | Total (n=45) | ||||
| Media±DS | % | Media±DS | % | Media±DS | % | |
| Tiempo quirúgico (p=0,7) | 284,9±63 | 312,5±45 | 289,8±60 | |||
| Unidades transfundidas (p=0,19) | 1 | 2 | 1,5±1 | |||
| Clampaje (p=0,07) | ||||||
| Sí | 8 (21,6%) | 0 | 8 (17,8%) | |||
| No | 29 (78,4%) | 8 (100%) | 37 (82,2%) | |||
| Tamaño máximo (según AP) (p=0,47) | 2,5±1 | 4,2±3 | 2,8±2 | |||
| Tiempo de actividad de protrombina (%) (5.o día) (p=0,36) | 93,2±14 | 86,0±21 | 91,7±15 | |||
| Niveles de bilirrubina total (mg/dl) (5.o día) (p=0,89) | 0,6±0,3 | 0,8±0,3 | 0,6±0,3 | |||
| Niveles de GOT/AST (U/l) (5.o día) (p=0,08) | 87±58 | 47±24 | 79±55 | |||
| Complicaciones hepáticaS (p=0,004) | 10,8% (n=4) | 62,5% (n=5) | 20% (n=9) | |||
| Complicaciones médicas (p=0,59) | 13,5% (n=5) | 12,5% (n=1) | 13,3% (n=6) | |||
| Reintervención (p=0,45) | 5,4% (n=2) | 12,5% (n=1) | 6,7% (n=3) | |||
| Drenaje percutáneo (p=0,77) | 2,7% (n=1) | 25% (n=2) | 6,7% (n=3) | |||
| Estancia hospitalaria (días) (p=0,021) | 9,4±4 | 14,4±8 | 10,3±5 | |||
En los últimos años, se ha comprobado como la combinación de quimioterapia y cirugía es la estrategia óptima para mejorar la supervivencia de los pacientes con MH de CCR inicialmente irresecables. La esteatohepatitis como complicación del tratamiento con quimioterapia fue descrita por primera vez en una pequeña serie por Fernández et al4. En su trabajo los autores describieron un aumento significativo de esteatohepatitis en los pacientes sometidos a cirugía tras tratamiento con irinotecán. La duración del tratamiento y la dosis total no se correlacionó con el grado de esteatohepatitis, pero sí el índice de masa corporal (IMC). Posteriormente Vauthey et al5 en un estudio multicéntrico retrospectivo de 406 pacientes sometidos a hepatectomía por metástasis, comprobaron que el 20% de los pacientes tratados con regímenes de quimioterapia basados en irinotecán presentaron esteatohepatitis. El riesgo fue mayor en pacientes con IMC superior a 25kg/m2.
En nuestro estudio al calcular el índice NAS, comprobamos que el desarrollo de esteatohepatitis borderline (Kleiner 3-4) o esteatohepatitis (Kleiner 5-8) se asoció de forma significativa con la administración previa de irinotecán (p=0,001). La duración del tratamiento previo a la cirugía fue similar entre todos los grupos. Además, en nuestro trabajo, los pacientes con esteatohepatitis grave tenían un IMC significativamente mayor que aquellos sin alteraciones del parénquima hepático (p=0,015). Aunque las diferencias entre grupos no son significativas, es importante resaltar que los pacientes que recibieron terapia basada en irinotecán, tenían un IMC discretamente superior al resto de los grupos (tabla 1), así como el porcentaje de pacientes diabéticos y dislipémicos era discretatmente superior. Este hecho aunque en nuestro estudio no tiene relevancia estadística merece tenerlo en cuenta ya que se menciona en la mayoría de los trabajos como factor influyente en el desarrollo de EHGNA.
Hasta la fecha, existen pocos estudios que relacionen el impacto de la esteatohepatitis sobre la morbimortalidad tras la resección hepática. En el estudio ya comentado de Vauthey et al5, han sido los únicos en observar que los pacientes con esteatohepatitis presentaron una mayor tasa de mortalidad a 90 días tras cirugía que los pacientes sin esteatohepatitis (14,7 vs 1,6%, p<0,001). Además, la presencia de esteatohepatitis se asoció con un riesgo significativamente mayor de mortalidad por fallo hepático comparado con los otros pacientes (6 vs. 1%, p<0,01). Por el contrario, otros estudios de pequeñas series quirúrgicas no mostraron diferencias en la morbilidad y mortalidad en pacientes tratados preoperatoriamente con esquemas de quimioterapia conteniendo irinotecán. Así, Pawlik et al6 en un estudio retrospectivo sobre 212 pacientes no encontraron un mayor número de complicaciones tras la cirugía al analizar los diferentes grupos en función del grado de EHGNA, aunque no pudieron evaluarlo de forma significativa debido al escaso número de pacientes con esteatohepatitis (n=3).
Nuestros resultados apoyan el hecho de que la EHGNA, incluso en estadios avanzados, no influye en la morbilidad perioperatoria de los pacientes o en la mortalidad, si bien dado el bajo número de casos obtenidos en nuestro estudio (solamente dos casos de esteatohepatitis y tres de enfermedad borderline), hace que el análisis de estos datos no sea todo concluyente.
En relación con los efectos del oxaliplatino, como ya se ha comentado fue el estudio de Rubbia-Brandt et al7 el primero en relacionar la administración de oxaliplatino como agente citotóxico para las MH del CCR y el desarrollo del síndrome de dilatación y obstrucción sinusoidal en el tejido hepático. En su estudio retrospectivo encontraron que el 79% de los pacientes tratados con oxaliplatino desarrollaron lesiones perisinusoidales que incluyeron dilatación y congestión con fibrosis y oclusión venosa. Esta relación fue independiente de la dosis administrada y persistió al menos 4 meses tras el último ciclo. Otros trabajos realizados posteriormente han confirmado esta relación5,6,8–11,15,16.
En todos estos estudios existe una clara tendencia a relacionar el uso de oxaliplatino con el daño sinusoidal. Nuestros resultados van en consonancia con todos estos trabajos. De los 15 pacientes tratados con terapia basada en oxaliplatino de forma previa a la cirugía, en 7 casos (47%) se encontró un grado de dilatación sinusoidal moderado o intenso, siguiendo los criterios propuestos por Rubbia-Brandt et al7 (p=0,002). Solamente un paciente del grupo control y ninguno del grupo de tratamiento de irinotecán, desarrolló unas alteraciones histológicas similares.
La mayoría de los trabajos publicados en la literatura relacionan el uso de quimioterapia basada en oxaliplatino con el desarrollo del SOS o con un aumento en la morbimortalidad, pero son pocos los trabajos que relacionan entre sí estas dos variables.
En nuestro estudio, el tiempo quirúrgico, la necesidad de clampaje vascular o las unidades transfundidas no se vieron afectados por la existencia de una dilatación sinusoidal moderada o intensa, de la misma forma que no lo hicieron las pruebas de función hepática. Sí hubo una mayor tasa de complicaciones hepáticas en los pacientes con daño sinusoidal moderado/intenso (p=0,004). Además, como se ha viso, la estancia media de estos pacientes fue significativamente mayor (14,4±8 vs 9,4±4 días en el grupo sin alteraciones histológicas, p=0,021).
En el estudio de Nakano et al9, de la misma forma que en los resultados descritos en nuestro trabajo, describen una estancia media aumentada en pacientes con daño sinusoidal (14,7 días vs 11,7, p=0,02) en su serie de 90 pacientes tratados con quimioterapia preoperatoria. Al analizar el subgrupo de 36 pacientes sometidos a una hepatectomía mayor, encuentran una mayor tasa de complicaciones hepáticas en el grupo con daño sinusoidal (40 vs 6,3%; p=0,026). En este estudio, los autores sugieren la utilidad de la biopsia hepática preoperatoria en pacientes de riesgo sometidos a quimioterapia previa.
Por el contrario, diversos trabajos no han observado un aumento de complicaciones en pacientes con SOS. Vauthey et al5 observaron que la lesión sinusoidal no se asociaba con mayores tasas de morbilidad ni mortalidad tras hepatectomía. Igualmente, un análisis patológico de 57 pacientes del estudio EORTC 4098317 que comparó el parénquima hepático de pacientes asignados de forma aleatorizada a recibir quimioterapia preoperatoria o cirugía solo, no encontró un aumento en las tasas de morbilidad en pacientes con daño sinusoidal. Kandutsch et al10 al relacionar la existencia de SOS con la evolución de los pacientes tras la cirugía, no encontraron que el daño sinusoidal sea factor de riesgo en la recuperación de estos pacientes. Tampoco en el estudio de Hubert et al18 la presencia de lesiones hepáticas graves tuvo impacto clínico en la evolución de los pacientes.
Como hallazgo interesante, en varios estudios recientes19,20, se ha puesto de manifiesto un potencial efecto de protección de la lesión sinusoidal de la terapia con bevacizumab al añadirse al oxaliplatino como tratamiento neoadyuvante. Este efecto protector del bevacizumab se observó por primera vez por Ribero et al19 y posteriormente ha sido descrito también por Klinger et al20. Sin embargo, hasta la fecha no se sabe si las lesiones parenquimatosas graves asociadas con oxaliplatino, como la hiperplasia regenerativa nodular y el SOS, son reversibles con bevacizumab y estos resultados deben ser confirmados por otros estudios, ya que en otros trabajos publicados no han encontrado este efecto protector del bevacizumab5.
En nuestro trabajo, únicamente dos pacientes han sido tratados con terapia basada en oxaliplatino y bevacizumab (uno de ellos presentaba una dilatación sinusoidal leve y el otro moderada/intensa) por lo que no hemos podido evaluar esta relación.
Uno de los problemas al revisar la información sobre la correlación entre la quimioterapia, la potencial lesión hepática producida por la misma y su impacto en la evolución de los pacientes es que existen diferencias en las definiciones de las patologías específicas y los resultados postoperatorios. En ocasiones los patólogos están en desacuerdo sobre la distinción entre esteatosis y esteatohepatitis. Otras veces, algunos trabajos muestran todos los casos de dilatación sinusoidal, mientras que otros publican solo casos graves. Además, la definición de mortalidad postoperatoria también es diferente, ya que algunos autores dan solo las cifras de mortalidad a 30 días mientras que otros dan mortalidades en intervalos largos de tiempo desde la cirugía. Estas diferencias probablemente hacen que los resultados sean heterogéneos y las conclusiones diferentes.
Tal y como afirman Chun et al en una reciente revisión publicada21, creemos que los tratamiento citotóxicos deben ser evaluados e individualizados para cada paciente por un comité multidisciplinar, ya que se ha comprobado como determinados agentes, en particular el oxaliplatino, pueden influir en la recuperación de los pacientes tras la intervención quirúrgica, si bien, como queda demostrado en el estudio multicéntrico EORTC 4098322, los beneficios de esta terapia (en los pacientes adecuados y con las precauciones debidas) superan de forma amplia a los posibles inconvenientes o complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentados resultados preliminares (comunicación oral) en: XXVII CONGRESO NACIONAL DE CIRUGÍA. Madrid, Noviembre 2008.