Determinar el impacto de la linfadenectomía axilar sobre la recurrencia regional, la supervivencia global y libre de enfermedad y la morbilidad del miembro superior en pacientes con cáncer de mama y ganglio centinela (GC) negativo.
Pacientes y métodosCiento sesenta y seis pacientes con cáncer de mama y GC negativo (pN0sn) fueron aleatorizados a linfadenectomía (Grupo I) o solo observación (Grupo II). Se utilizó una técnica triple para identificar y extirpar el GC. El seguimiento se realizó cada 3 meses durante los 3 primeros años y, posteriormente, cada 6 meses, hasta los 5 años. Se registraron el dolor, entumecimiento (parestesias), la limitación de movilidad del hombro y el edema del brazo.
ResultadosTras un seguimiento mínimo de 60 meses, no se detectó recurrencia ganglionar axilar en los pacientes del Grupo II. La supervivencia global y la libre de enfermedad fueron similares en ambos grupos. La proporción de pacientes con morbilidad y los que tuvieron más de dos complicaciones fue significativamente mayor en el Grupo I.
ConclusionesSe puede evitar la linfadenectomía axilar en pacientes con GC negativo sin comprometer el estudio de extensión ganglionar o los resultados del tratamiento. La linfadenectomía axilar se asocia a una más elevada morbilidad de la extremidad superior en comparación a la biopsia del GC.
To determine the impact of axillary lymphadenectomy on regional recurrence, the overall and disease free survival, and upper limb morbidity in patients with breast cancer and negative sentinel node (SN).
Patients and methodsA total of 176 patients with breast cancer and negative SN (pN0sn) were either randomised to lymphadenectomy (Group I) or to observation only (Group II). The triple technique was used to identify and remove the SN. Follow-up was carried out every 3 months for the first 3years, and then every 6 months up to 5years. Pain, numbness (paresthesia), limitations in shoulder mobility, and arm oedema were recorded.
ResultsNo axillary lymph node recurrence was detected in the patients of Group II after 60 months follow up. The overall and disease free survival was similar in both groups. The proportion of patients with morbidity and who had more than two complications was significantly higher in Group I.
ConclusionsAxillary lymphadenectomy may be avoided in patients with negative SN without compromising lymph node extension studies and the patient treatment results. Axillary lymphadenectomy is associated with a higher morbidity of the upper limb compared to SN biopsy.
La presencia de metástasis ganglionares en la axila sigue siendo el factor pronóstico más importante en el cáncer de mama (CM)1,2. La presencia o ausencia de metástasis en los ganglios axilares se confirma con el análisis anatomopatológico de los ganglios linfáticos extirpados mediante la linfadenectomía axilar tradicional (LA). Sin embargo, la LA es un procedimiento que conlleva algunos riesgos. El análisis de varias series de pacientes con CM revela que en el 40-60% de los casos en los que se realiza LA no se demuestra afectación metastásica y, por tanto, podría ser considerado un gesto quirúrgico innecesario3.
El concepto de ganglio centinela (GC), descrito por Morton et al4, ha sido aplicado a pacientes con CM a partir de 19932,5. Numerosos artículos publicados han estudiado y validado los aspectos técnicos, en los que la mayoría de los investigadores identifican el GC en más del 90% de los casos con tasas de falsos negativos alrededor del 5%6–9. La identificación y biopsia del GC puede sustituir a la LA como procedimiento para el estudio de extensión regional en el CM, ya que evita su morbilidad asociada y mejora la valoración de la extensión ganglionar.
Algunos centros dedicados al CM han realizado ensayos clínicos para valorar el concepto de GC, en los que no se realiza la LA cuando el GC no tiene metástasis10–13. La gran novedad del concepto de GC ha sido la disminución de la morbilidad clásicamente asociada a LA, con o sin radioterapia adyuvante: linfedema (LE), alteraciones sensitivas en el brazo (entumecimiento), dolor o malestar y la disminución de la movilidad del hombro14.
Mientras que las tasas de supervivencia en CM han mejorado durante las últimas décadas15, se incrementa el interés por evaluar la calidad de vida y la morbilidad. La LA causa morbilidad en un 25-40% de los pacientes16,17, siendo el LE la complicación más temida. Es posible que la aplicación del concepto del GC disminuya esas cifras.
Los objetivos de este trabajo son los siguientes:
- a)
Probar que el índice de recurrencia axilar en pacientes sin LA y GC negativo no es superior al de pacientes sometidos a LA y GC negativo.
- b)
Demostrar que las tasas de supervivencia global y libre de enfermedad en pacientes con LA-GC negativo no son superiores a las de pacientes sin LA y GC negativo.
- c)
Demostrar que la morbilidad en los pacientes con GC negativo y sin LA es inferior a la de los pacientes con GC negativo y sometidos a LA.
En el Departamento de Oncología Quirúrgica del Instituto Portugués de Oncología Francisco Gentil, Centro do Porto (IPO-P), un centro integral para el tratamiento del cáncer, hemos desarrollado un estudio controlado, prospectivo, unicéntrico y de no superioridad, aprobado por la Junta de Revisión Institucional de Ética. Los criterios de admisión incluyeron pacientes entre 18 y 80 años de edad, con diagnóstico de CM invasivo con un diámetro inferior a 30mm, o carcinoma ductal in situ (CDIS) de más de 40mm, y sin ganglios axilares palpables. El tamaño tumoral fue evaluado mediante exploración física, ultrasonografía o mamografía. Los criterios de exclusión fueron: embarazo, tratamiento neoadyuvante y cirugía axilar anterior.
La fase de admisión se desarrolló entre abril de 2001 y junio de 2003. Todos los pacientes firmaron el consentimiento informado.
Técnica de identificaciónLa técnica utilizada para la identificación del GC combina la inyección peritumoral de sulfuro coloidal -99mTc (37 MBq), la colección de imágenes en una gamma-cámara fija e inyección subareolar del plexo de Sappey de un colorante vital (azul patente V, Laboratorios Guerbet, Aulnay-sous-Bois, Francia)18. La inyección de radioisótopos fue efectuada preferentemente el día antes de la intervención quirúrgica o en la misma mañana de la intervención. El colorante vital se inyectó en el quirófano, después de la inducción anestésica.
El GC es identificado por medios visuales (color azul) y auditivos (según la cantidad de radiactividad), con la ayuda de una sonda detectora manual (Neoprobe 1000/2000, Neoprobe Corporation, Dublin, Ohio, EE.UU.).
El GC se define como un ganglio de color azul, un ganglio adyacente a un vaso linfático azul, un ganglio caliente (ganglio de mayor actividad y los ganglios que presentan una actividad hasta el 10% de aquel) y todos aquellos ganglios axilares sospechosos (a la observación o palpación). Tras su extirpación, el GC fue enviado de inmediato al Departamento de Anatomía Patológica, se seccionó en dos mitades y se analizaron los resultados citológicos. Si había metástasis, el cirujano realizaba la LA; si no las había, el caso se aleatorizaba mediante un programa informático: LA (grupo 1, grupo control) u observación (grupo 2, el grupo del estudio). La aleatorización se estratificó según la edad (menos de 50 años o más de 50 años), estadio tumoral TNM (cT1a vs cT1b vs cT1c vs T2) y patrón de invasión (invasivo vs in situ).
El diagnóstico patológico definitivo se realizó mediante la inclusión total del GC y cortes múltiples de 2mm teñidos con hematoxilina-eosina (HE). Los ganglios negativos fueron evaluados en un único corte con HE. No se realizó inmunohistoquímica.
Técnica de la disección axilar y seguimiento postoperatorioLa técnica de LA utilizada en el Departamento de Oncología Quirúrgica incluye la exéresis de los niveles I y II de Berg, y sólo en casos de afectación ganglionar extensa se extirpa el nivel III. Los cirujanos realizan la disección del tronco principal de la vena axilar, el nervio largo torácico y el haz neuro-vascular toraco-dorsal; los nervios sensitivos costo-braquiales, en general, no se conservan.
Tras la mastectomía total con/sin LA se colocan dos drenajes aspirativos tipo Redon en el lecho quirúrgico. Los drenajes se retiran cuando el débito es menor o igual a 40 cc/día o en el 6.° día postoperatorio. La fisioterapia se inicia tras retirada del drenaje y los pacientes son instruidos para mantener los ejercicios en el domicilio diariamente.
El seguimiento y evaluación de la morbilidadLos pacientes fueron seguidos en la clínica de mama cada 3 meses en los 3 primeros años y después cada 6 meses hasta el 5.° año. La evaluación clínica se basó sólo en la palpación axilar; la ecografía axilar se solicitó en casos dudosos.
En cada consulta se evaluó el incremento de volumen del brazo (LE), deterioro de la función del hombro, dolor y adormecimiento (disestesias/parestesias). A efectos del estudio, se consideraron los resultados a los 6, 12, 24 y 48 meses. El incremento de volumen del brazo (LE) se definió como un aumento de más de 2cm comparando la circunferencia de la extremidad superior operada (en tres puntos: la muñeca el punto medio del antebrazo y en el punto medio del brazo) con la extremidad contralateral (no operada). A los pacientes se les solicitó que levantasen el brazo operado (abducción máxima posible): la abducción igual o superior a 90° se consideró adecuada; abducción inferior a 90° se consideró anormal (deterioro articular del hombro). Se les pidió que respondieran a dos preguntas: a) ¿tiene dolor en el brazo en reposo? (sí o no) y b), ¿tiene entumecimiento en la cara interna del brazo? (sí o no).
La planificación del tratamiento adyuvante se realizó en la reunión multidisciplinaria, de acuerdo con los criterios institucionales, independientemente del grupo del estudio al que la paciente fue asignada; las pacientes pN0 no recibieron radioterapia axilar.
Análisis estadísticoLas pruebas estadísticas utilizadas fueron la U de Mann-Whitney (para comparar las medianas), la prueba exacta de Fisher y la chi-cuadrado de Pearson (para comparar las proporciones). Se evaluó la probabilidad de supervivencia con el método de Kaplan-Meier y se realizaron las comparaciones con el test de log-rank. Las pruebas estadísticas analizaron a los pacientes de los Grupos 1 y 2 (pacientes pN0). Se utilizó SPSS 13.0 (SPSS Inc., Chicago, Illinois, EE.UU.).
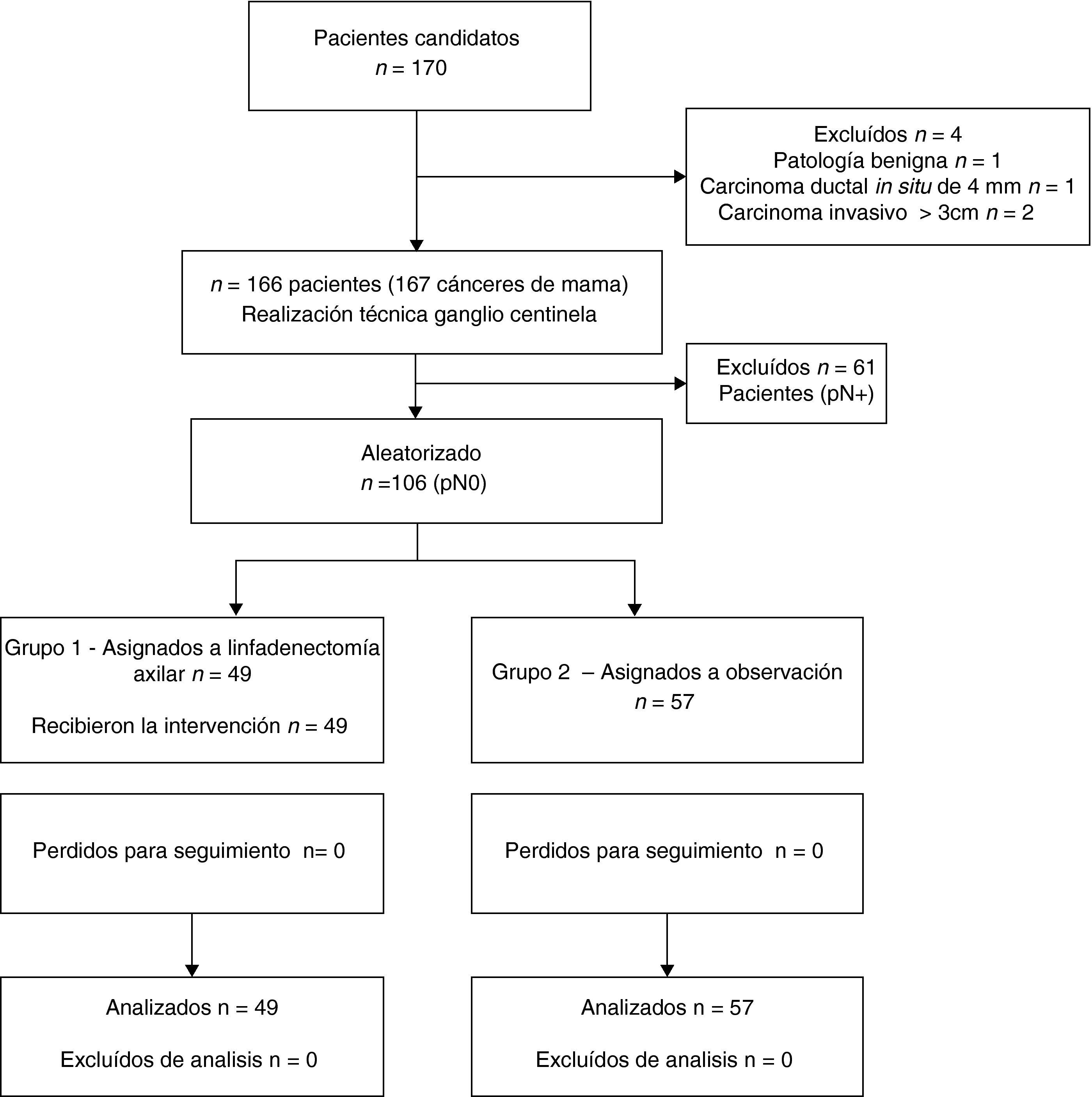
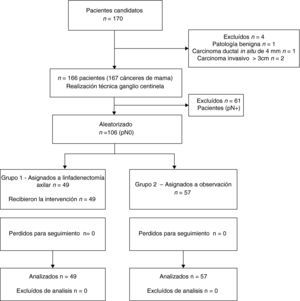
ResultadosDatos generalesDurante el periodo del estudio, 170 pacientes con CM fueron diagnosticadas en nuestra institución, de las cuales 4 fueron excluidas (fig. 1). Finalmente, un total de 166 pacientes con 167 CM fueron potencialmente elegibles para el estudio. La mediana de edad fue 54 años (rango: 31-78). El diagnóstico se realizó mediante biopsia con aguja en el 83,5% de los casos. La mediana de tiempo de seguimiento fue de 72 meses (rango: 62-87).
La gammagrafía (GG) fue negativa (sin hot-spot) en 12 casos (7,2%), sin embargo, fue posible identificar un GC en 11 de ellos. En el 50,3% de los casos la GG reveló únicamente un punto caliente; la mediana de puntos calientes fue 1 (rango: 0-7). La tasa de identificación del GC fue de 99,4%. El número medio de GC extirpados fue 1,9 (desviación estándar 1,0) para el grupo 1, 1,7 (1,1) para el grupo 2 y 1,6 (0,9) para el grupo GC positivo. La tasa de falsos negativos de la técnica fue de 6,6% (4 casos). La tasa de falsos negativos de la sección congelada fue del 15% (9 casos). Observamos drenaje a la cadena de la arteria mamaria interna (AMI) en 22 casos (13,2%), de la que extirpamos el GC en 17. Uno de los casos se presentó con metástasis en exclusiva en la cadena de AMI.
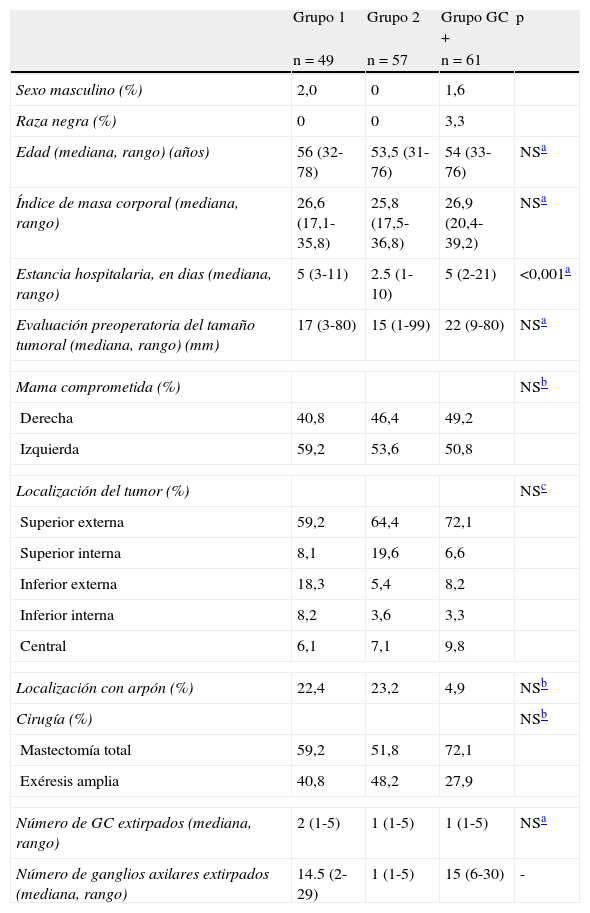
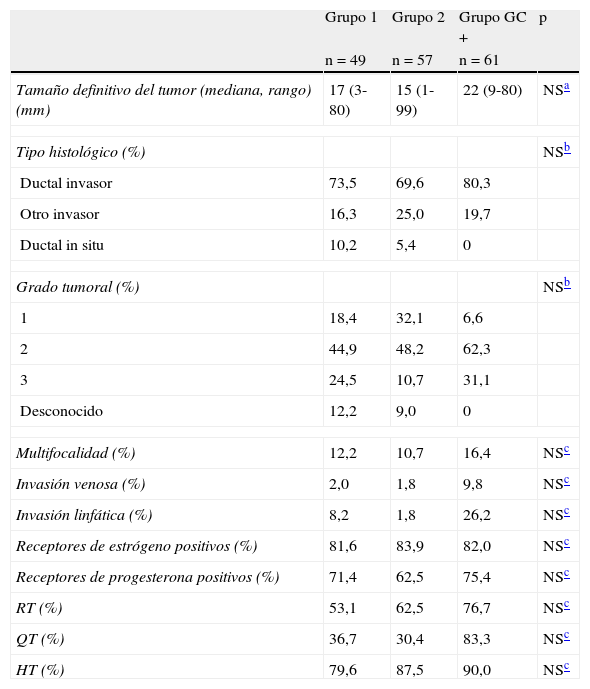
En 61 de los 167 (37,1%) cánceres de mama había metástasis en el GC; de los 106 casos restantes con GC negativo, 49 fueron aleatorizados al grupo 1 y 57 al grupo 2 (fig. 1). Las características demográficas, técnicas y patológicas y los tratamientos adyuvantes se muestran en las tablas 1 y 2.
Datos generales
| Grupo 1 | Grupo 2 | Grupo GC + | p | |
| n=49 | n=57 | n=61 | ||
| Sexo masculino (%) | 2,0 | 0 | 1,6 | |
| Raza negra (%) | 0 | 0 | 3,3 | |
| Edad (mediana, rango) (años) | 56 (32-78) | 53,5 (31-76) | 54 (33-76) | NSa |
| Índice de masa corporal (mediana, rango) | 26,6 (17,1-35,8) | 25,8 (17,5-36,8) | 26,9 (20,4-39,2) | NSa |
| Estancia hospitalaria, en dias (mediana, rango) | 5 (3-11) | 2.5 (1-10) | 5 (2-21) | <0,001a |
| Evaluación preoperatoria del tamaño tumoral (mediana, rango) (mm) | 17 (3-80) | 15 (1-99) | 22 (9-80) | NSa |
| Mama comprometida (%) | NSb | |||
| Derecha | 40,8 | 46,4 | 49,2 | |
| Izquierda | 59,2 | 53,6 | 50,8 | |
| Localización del tumor (%) | NSc | |||
| Superior externa | 59,2 | 64,4 | 72,1 | |
| Superior interna | 8,1 | 19,6 | 6,6 | |
| Inferior externa | 18,3 | 5,4 | 8,2 | |
| Inferior interna | 8,2 | 3,6 | 3,3 | |
| Central | 6,1 | 7,1 | 9,8 | |
| Localización con arpón (%) | 22,4 | 23,2 | 4,9 | NSb |
| Cirugía (%) | NSb | |||
| Mastectomía total | 59,2 | 51,8 | 72,1 | |
| Exéresis amplia | 40,8 | 48,2 | 27,9 | |
| Número de GC extirpados (mediana, rango) | 2 (1-5) | 1 (1-5) | 1 (1-5) | NSa |
| Número de ganglios axilares extirpados (mediana, rango) | 14.5 (2-29) | 1 (1-5) | 15 (6-30) | - |
QT: quimioterapia; GC: ganglio centinela: RT: radioterapia; GG: linfogammagrafia mamaria; HT: hormonoterapia.
Características histológicas y tratamientos adyuvantes
| Grupo 1 | Grupo 2 | Grupo GC + | p | |
| n=49 | n=57 | n=61 | ||
| Tamaño definitivo del tumor (mediana, rango) (mm) | 17 (3-80) | 15 (1-99) | 22 (9-80) | NSa |
| Tipo histológico (%) | NSb | |||
| Ductal invasor | 73,5 | 69,6 | 80,3 | |
| Otro invasor | 16,3 | 25,0 | 19,7 | |
| Ductal in situ | 10,2 | 5,4 | 0 | |
| Grado tumoral (%) | NSb | |||
| 1 | 18,4 | 32,1 | 6,6 | |
| 2 | 44,9 | 48,2 | 62,3 | |
| 3 | 24,5 | 10,7 | 31,1 | |
| Desconocido | 12,2 | 9,0 | 0 | |
| Multifocalidad (%) | 12,2 | 10,7 | 16,4 | NSc |
| Invasión venosa (%) | 2,0 | 1,8 | 9,8 | NSc |
| Invasión linfática (%) | 8,2 | 1,8 | 26,2 | NSc |
| Receptores de estrógeno positivos (%) | 81,6 | 83,9 | 82,0 | NSc |
| Receptores de progesterona positivos (%) | 71,4 | 62,5 | 75,4 | NSc |
| RT (%) | 53,1 | 62,5 | 76,7 | NSc |
| QT (%) | 36,7 | 30,4 | 83,3 | NSc |
| HT (%) | 79,6 | 87,5 | 90,0 | NSc |
QT: quimioterapia; GC: ganglio centinela: RT: radioterapia; GG: linfogammagrafia mamaria; HT: hormonoterapia.
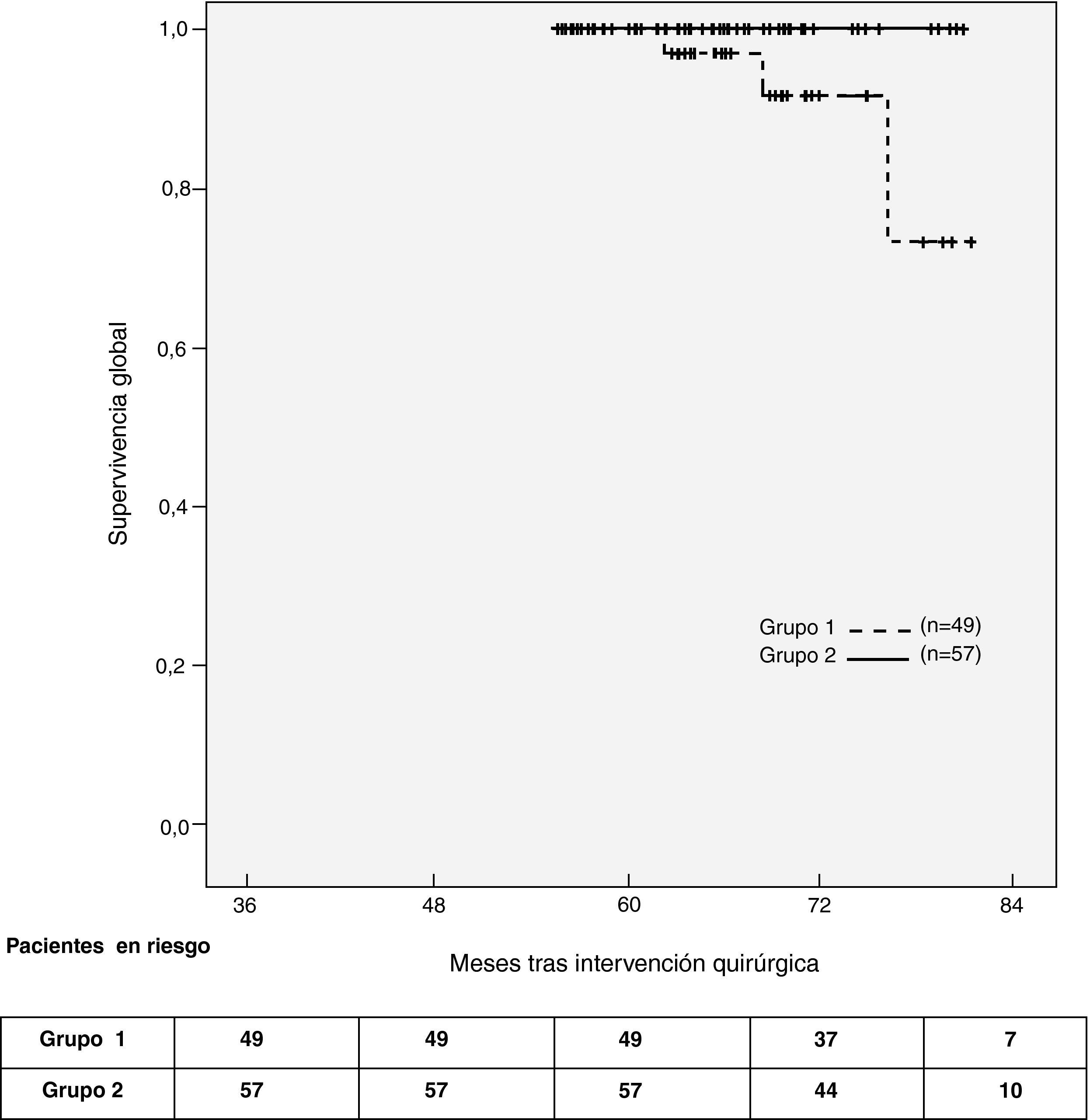
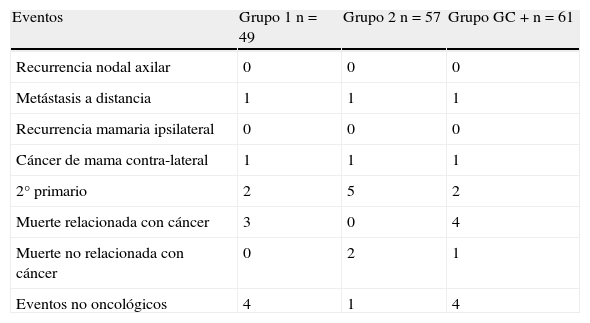
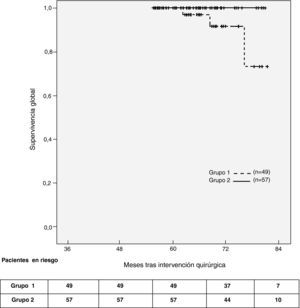
Treinta y cuatro pacientes experimentaron problemas graves durante el seguimiento; de los cuales el 12% fueron de carácter oncológico (tabla 3). No se detectó recurrencia ganglionar axilar durante el seguimiento en ambos grupos del estudio. La supervivencia acumulada a los 60 meses de seguimiento fue del 94% en los pacientes del grupo 1 y del 100% en los del grupo 2. La supervivencia global (p[log-rank] = 0,06) (fig. 2) y la supervivencia libre de enfermedad (p[log-rank] = 0,4) fueron similares en ambos grupos.
Número de eventos en cada grupo
| Eventos | Grupo 1 n=49 | Grupo 2 n=57 | Grupo GC + n=61 |
| Recurrencia nodal axilar | 0 | 0 | 0 |
| Metástasis a distancia | 1 | 1 | 1 |
| Recurrencia mamaria ipsilateral | 0 | 0 | 0 |
| Cáncer de mama contra-lateral | 1 | 1 | 1 |
| 2° primario | 2 | 5 | 2 |
| Muerte relacionada con cáncer | 3 | 0 | 4 |
| Muerte no relacionada con cáncer | 0 | 2 | 1 |
| Eventos no oncológicos | 4 | 1 | 4 |
Grupo GC +: ganglio centinela metastatizado.
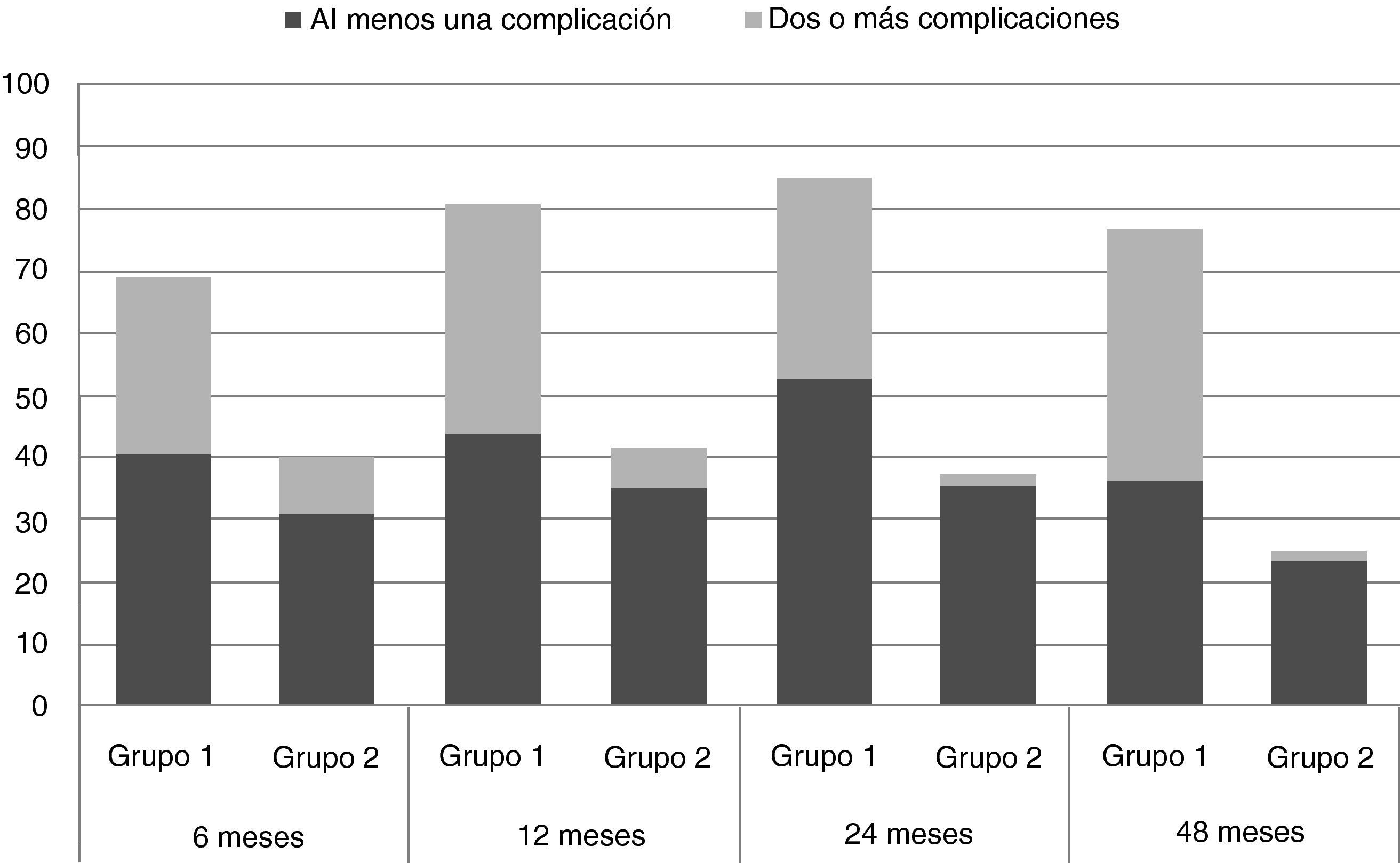
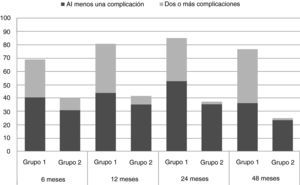
La proporción de pacientes con morbilidad y los que presentaron más de 2 complicaciones fue significativamente mayor en los pacientes del grupo de LA que en los pacientes con biopsia de GC y sin linfadenectomía asociada (fig. 3).
En general, a los 12 meses de la operación, el LE estuvo presente en el 22,1% de los pacientes; este porcentaje se estabilizó a los 48 meses en un 21,4%. Después de los 12 meses, se observó que algunos pacientes de LA presentaban más de 5cm de diferencia en la circunferencia del brazo (2,6, 2,1 y 4,3% de los pacientes, a los 12, 24 y 48 meses de seguimiento); ningún paciente del grupo 2 tuvo tanta diferencia en las mediciones de la circunferencia del brazo. El LE fue más frecuente y más grave en el grupo de LA. El 59,6% del total de pacientes aquejaron algún tipo de complicación durante los primeros 12 meses, disminuyendo a 48,5% a los 48 meses. Las complicaciones fueron más frecuentes en pacientes sometidos a LA durante todo el estudio en cada consulta de seguimiento: el 2% de los pacientes con LA presentan un máximo de 13 complicaciones en el período de 48 meses frente al 3,5% de pacientes sin LA que tenían un máximo de 6 complicaciones. Durante el mismo período, sólo el 8,2% de los pacientes con LA no tuvieron ninguna complicación, en comparación con 26,3% del grupo sin LA.
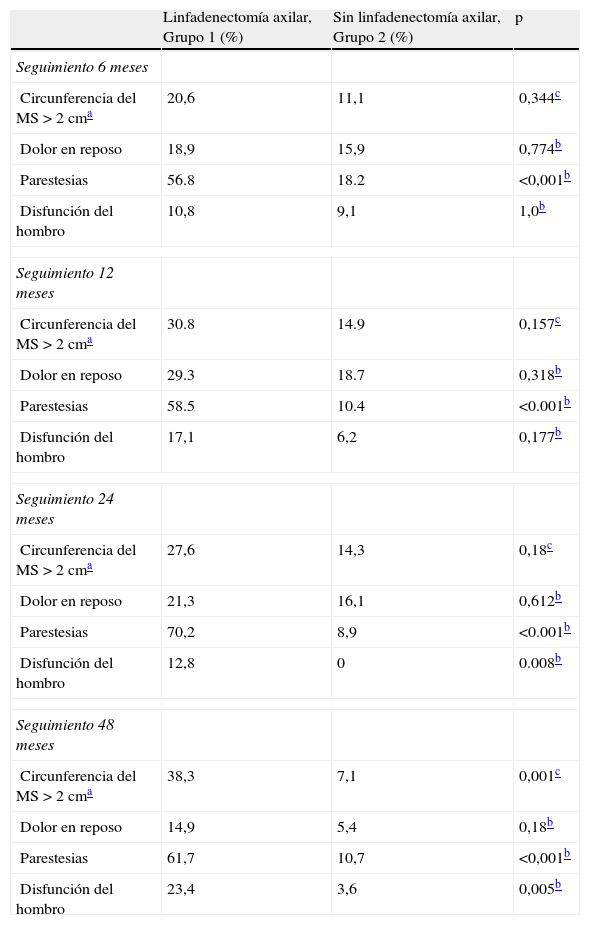
En la tabla 4 se presentan los resultados de la morbilidad teniendo en cuenta las cuatro complicaciones estudiadas (diferencias en la circunferencia del brazo/LE, dolor del miembro superior en reposo, el deterioro de sensibilidad del brazo y la disfunción de la articulación del hombro), en cada período de consultas de seguimiento, para comparar los pacientes con y sin LA.
Morbilidad en pacientes con ganglio centinela negativo en función de la realización o no de disección axilar
| Linfadenectomía axilar, Grupo 1 (%) | Sin linfadenectomía axilar, Grupo 2 (%) | p | |
| Seguimiento 6 meses | |||
| Circunferencia del MS > 2cma | 20,6 | 11,1 | 0,344c |
| Dolor en reposo | 18,9 | 15,9 | 0,774b |
| Parestesias | 56.8 | 18.2 | <0,001b |
| Disfunción del hombro | 10,8 | 9,1 | 1,0b |
| Seguimiento 12 meses | |||
| Circunferencia del MS > 2cma | 30.8 | 14.9 | 0,157c |
| Dolor en reposo | 29.3 | 18.7 | 0,318b |
| Parestesias | 58.5 | 10.4 | <0.001b |
| Disfunción del hombro | 17,1 | 6,2 | 0,177b |
| Seguimiento 24 meses | |||
| Circunferencia del MS > 2cma | 27,6 | 14,3 | 0,18c |
| Dolor en reposo | 21,3 | 16,1 | 0,612b |
| Parestesias | 70,2 | 8,9 | <0.001b |
| Disfunción del hombro | 12,8 | 0 | 0.008b |
| Seguimiento 48 meses | |||
| Circunferencia del MS > 2cma | 38,3 | 7,1 | 0,001c |
| Dolor en reposo | 14,9 | 5,4 | 0,18b |
| Parestesias | 61,7 | 10,7 | <0,001b |
| Disfunción del hombro | 23,4 | 3,6 | 0,005b |
MS: miembro superior.
El objetivo de este ensayo fue evaluar las consecuencias de no realizar la linfadenectomía axilar cuando el GC está libre de metástasis, en términos de recurrencia ganglionar regional (axilar, periclavicular), de supervivencia global y libre de enfermedad y de morbilidad de la extremidad superior.
El papel de la biopsia del GC axilar, como factor predictivo del estado del resto de ganglios axilares ha sido confirmado en un gran número de ensayos clínicos. Estos ensayos han demostrado que el concepto de GC es capaz de promover y mejorar la estadificación ganglionar en pacientes con CM, a pesar de la conocida y temida tasa de falsos negativos, que van desde 5 hasta 10%19–21.
El presente estudio comenzó en abril de 2001, tras una fase de validación que terminó en febrero de 2001 e involucró a 105 pacientes y 4 cirujanos. Hemos obtenido una tasa de identificación del GC del 97% y una tasa de falsos negativos del 7,1%, consolidando el uso de la técnica triple22. Estos resultados son similares a los mejores publicados en términos de tasas de identificación y de falsos negativos23,24.
Los dos grupos del estudio fueron comparables en la demografía y los resultados técnicos. Debemos destacar la reducción significativa en la estancia hospitalaria, para los pacientes del grupo 2 (tabla 2). Veronesi et al en el primer ensayo aleatorizado publicado sobre este asunto, encontraron resultados similares25. Este hallazgo es aún más notable si se comparan únicamente las pacientes sometidas a cirugía de conservación de la mama, y tiene el potencial de reducir los costes asociados al tratamiento quirúrgico del cáncer de mama26.
El pequeño número de pacientes en el ensayo, así como el reducido período de seguimiento (cinco años), podría disminuir su impacto clínico. Sin embargo, el estudio refleja la realidad de la Institución; sus cifras encarnan el equilibrio entre el número de pacientes tratados en el IPO-P y un tiempo de admisión razonable. Además, cabe destacar que la mayoría de los eventos relacionados con CM aparecen durante los primeros 3 años de seguimiento. Con una similar mediana de seguimiento, Veronesi et al25 han publicado una tasa de eventos oncológicos del 8,1%, inferior a la tasa que observamos en nuestro trabajo.
La gran ventaja planteada por el concepto del GC es una mejor estadificación ganglionar. Durante las últimas décadas, los ganglios linfáticos fuera de la axila han sido obviados por los cirujanos, a pesar de la bien conocida anatomía y fisiología del drenaje linfático de la mama, así como la historia natural del CM. La GG mamaria permite la identificación de las zonas de drenaje linfático de cada tumor en concreto y el cirujano puede identificar y recuperar todos los GC, independientemente de la zona anatómica donde residen. En este grupo de pacientes se observó el drenaje a la cadena de AMI en 22 casos, con una tasa de identificación del 77,3%. En un único caso, sólo el GC de AMI presentaba metástasis. A pesar de la baja incidencia de este evento (0,6%), su ocurrencia tuvo un impacto significativo en la evaluación de la extensión ganglionar del CM, ya que modificó el plan de tratamiento, que incluyó quimioterapia sistémica y radioterapia paraesternal. Otros autores encontraron resultados similares en su series27,28.
En el grupo 1 se detectaron 4 falsos negativos. Esperando tener el mismo número de recidivas axilares ipsilaterales que en las pacientes del grupo 2 con una mediana de seguimiento de 72 meses, hasta junio de 2008, no hemos tenido ningún caso de recidiva ganglionar. Las tasas de recurrencia axilar son generalmente muy bajas29.
Las curvas de supervivencia global y la prueba de log-rank no muestran ninguna ventaja de un grupo sobre el otro (se puede observar, incluso, una pequeña ventaja para el grupo 2, un hallazgo destacado también por Veronesi25).
El LE del brazo es la más grave y temida complicación del tratamiento del CM. Su prevalencia varía de 0 a más del 50% de las pacientes con CM17,30; una estimación media podría ser que una de cada cuatro mujeres desarrollará LE después del tratamiento. En nuestro estudio, la prevalencia de LE en la pacientes a las que se les realizó la linfadenectomía fue del 38,3%.
La alta prevalencia de LE puede deberse a una definición más exigente para establecer su diagnóstico y a la técnica utilizada para cuantificarlo, lo que dificulta la comparación entre los estudios. Algunos autores utilizan métodos complejos para calcular el incremento de volumen de la extremidad, como la evaluación directa de volumen de la extremidad (desplazamiento de agua) o los cálculos indirectos de volumen (técnica de tronco)31–33. Nuestra intención era aplicar un método sencillo e inmediato, barato y reproducible, como la medición de la circunferencia de la extremidad superior, en tres lugares diferentes: el brazo, el antebrazo y la muñeca. Además, para efectos de la definición del LE, consideramos la diferencia en el perímetro de 2cm entre el lado tratado y el lado contralateral (en el lugar de mayor diferencia)34,35. Otros autores aceptan sólo 1cm de diferencia como sinónimo de LE32.
Creemos que el intervalo de tiempo para la evaluación de la morbilidad en nuestro estudio (4 años) puede considerarse adecuado. Petrek et al36 encontraron que casi el 80% de los pacientes desarrollaron LE en los 3 primeros años después del tratamiento y Werner37 comprobó que el 97% de los pacientes desarrollaron LE en un intervalo de 4 años después del tratamiento.
Uno de los factores de riesgo bien conocidos para la aparición del edema del brazo es la asociación de la disección y radioterapia axilar17. En nuestro estudio sólo se comparan las distintas técnicas quirúrgicas, ya que ninguna de las pacientes pN0 recibió irradiación axilar. Estaba claro, desde el inicio del estudio, que existía un porcentaje reducido de pacientes con incremento de circunferencia del brazo en el grupo 2, en comparación con el grupo de LA. Este hallazgo, que alcanza significación estadística en el cuarto año de seguimiento, confirma las observaciones de los demás: el concepto de GC reduce el riesgo de edema en el brazo después de un tratamiento por CM33,38–44. Del 2.° al 4.° año de seguimiento se puede ver una reducción en el porcentaje de pacientes con LE, en el grupo 2, mientras que en el grupo 1 las pacientes muestran un aumento del porcentaje de LE.
El dolor en el brazo es otro síntoma estrechamente asociado con el tratamiento por CM. En nuestro estudio hemos comprobado una tendencia hacia una menor incidencia de dolor del miembro superior en reposo en las pacientes sin LA, sin embargo, este hecho no alcanzó significación estadística. Otros autores fueron capaces de demostrar esta asociación, también35,45.Las parestesias de la cara interna del brazo son también un síntoma asociado al tratamiento del CM. Es previsible dado que durante la disección axilar se realiza la sección de los nervios sensitivos costo-braquiales. Por ello, es de esperar, y reportado por otros autores33,39,42,43, desde el inicio del estudio una asociación fuerte entre la ausencia de parestesias y la ausencia de la LA. La disfunción del hombro, se encontró más frecuentemente en el grupo de LA, en particular en la evaluación a largo plazo (dos o más años de seguimiento). Es un signo de morbilidad tras el tratamiento por CM, a menudo relacionado con la LA, la radioterapia axilar, o ambos40. Otros estudios asocian mejorías en la movilidad del hombro a la ausencia de disección axilar30,35,40,43.
En general, los pacientes del grupo 2 presentaron las tasas de morbilidad más bajas y, cuando están presentes, con menos intensidad de síntomas que las pacientes de LA (grupo 1). Uno de cada cuatro pacientes del grupo 2 no tuvo ningún síntoma durante todo el tiempo de seguimiento, en comparación con sólo una de cada diez pacientes del grupo 1.
Sin embargo, el concepto mínimamente invasivo del GC no está exento de morbilidad46; en algunas circunstancias, la tasa de morbilidad en la biopsia del GC puede ser inaceptable47. Los cirujanos deben ser conscientes del riesgo de dolor, edema del brazo y parestesias en la cara interior del mismo y, por otro lado, deben ser motivados a su vez hacia la biopsia del GC como procedimiento verdaderamente mínimamente invasivo. Al igual que las tasas de identificación y falsos negativos, la tasa de morbilidad debe considerarse una medida de la eficacia del concepto del GC.
En definitiva, los resultados de nuestro estudio sugieren que cuando el GC está libre de metástasis, no esta justificada la realización de una linfadenectomía para evaluar el estadio ganglionar en el CM. Este planteamiento no pone en peligro dicha valoración ni los resultados del tratamiento de este grupo de pacientes y disminuye el riesgo de desarrollar, a largo plazo, complicaciones en la extremidad superior.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Noemí López González y a la Dra. Ana Agrelo, por el asesoramiento en la edición del texto en español.
Trabajo presentado en parte en el 7th European Breast Cancer Conference (EBCC 7), Barcelona, España, marzo 2010.