Esta guía de práctica clínica (GPC) surge como iniciativa del comité científico de la Sociedad Española de Cirugía Torácica.
Para elaborar dicha GPC se han formulado las preguntas PICO (paciente, intervención, comparación y outcome o variable resultado) sobre distintos aspectos del neumotórax espontáneo.
Para la evaluación de la calidad de la evidencia y elaboración de las recomendaciones se han seguido las directrices del grupo de trabajo Grading of Recommendations, Assessent, Development and Evaluation (GRADE).
This clinical practice guideline (CPG) emerges as an initiative of the scientific committee of the Spanish Society of Thoracic Surgery.
We formulated PICO (patient, intervention, comparison, and outcome) questions on various aspects of spontaneous pneumothorax.
For the evaluation of the quality of evidence and preparation of recommendations we followed the guidelines of the Grading of recommendations, Assessment, Development and Evaluation (GRADE) working group.
Revisión externa:
- -
Comité científico SECT: Raúl Embún, Néstor Martínez, Sergi Call, Ricard Ramos, Beatriz de Olaiz
- -
Nicolás Moreno. Hospital Universitario Vírgen del Rocío (Sevilla)
- -
Laureano Molins. Hospital Universitario Clínic (Barcelona)
El neumotórax representa una de las enfermedades pleurales más frecuentes atendidas en los hospitales de todo el mundo, siendo el responsable del 20% de los ingresos en un Servicio de Cirugía Torácica1.
Su incidencia es muy variada, existiendo cifras ajustadas por edad para primarios que oscilan desde los 16,8 casos por 100.000 habitantes/año (varones: 24 y mujeres 9,8)2 recogidas en Inglaterra hasta los 4,2 casos por 100.000 habitantes año en EE. UU.3, o los 3,8 por 100.000 habitantes del neumotórax secundario (varones: 6,3 y mujeres: 2).
La elaboración de esta guía de práctica clínica (GPC) se justifica, en primer lugar, por la elevada incidencia del neumotórax espontáneo (NE) en la población general (y laboralmente activa), junto con el consumo de recursos que puede suponer su abordaje inicial. Por otro lado, un mismo paciente con NE puede ser diagnosticado y tratado de diversas maneras dependiendo del centro o del médico al que haya acudido. Todo ello puede producir distintos resultados clínicos, un consumo de recursos desigual y cierto desconcierto en los pacientes que consulten a distintos profesionales para obtener una segunda opinión. La población diana de esta GPC incluye pacientes con NE primario (NEP) y secundario (NES).
Las características de este problema de salud conllevan la necesidad de una adecuada coordinación entre diferentes especialistas encargados de la atención de los pacientes con neumotórax y precisamente son ellos, el público objetivo, al que se dirige esta GPC, ya que según el sistema sanitario de cada comunidad autónoma serán atendidos por diferentes profesionales, como por ejemplo: médicos de urgencias generales y atención primaria, cirujanos torácicos, neumólogos o cirujanos generales. Además, los pacientes pueden ser tratados y seguidos en su evolución por cualquiera de los profesionales antes citados, por lo que la guía pretende homogeneizar los criterios de actuación entre los diferentes profesionales y crear un clima fluido de comunicación y de entendimiento entre ellos, siendo el principal objetivo de esta GPC sintetizar la mejor evidencia disponible en la actualidad.
MetodologíaEsta GPC surge como iniciativa del comité científico de la Sociedad Española de Cirugía Torácica (SECT). Se han formulado las preguntas PICO (paciente, intervención, comparación y outcome o variable resultado) sobre distintos aspectos del NE. Se ha realizado una búsqueda utilizando las plataformas TRIP database, Cochrane Database of Systematic Reviews (The Cochrane Library) y OVID utilizando los recursos de MEDLINE y EMBASE. Se ha realizado un diagrama de flujo para cada pregunta PICO. El proceso de búsqueda se realizó hasta mayo del 2015 y no fue limitado por ningún idioma.
Para la evaluación de la calidad de la evidencia y la elaboración de las recomendaciones se han seguido las directrices del grupo de trabajo GRADE4 (anexo 1).
Está prevista una actualización de la guía en plazos de 3a 5años como máximo, o en un plazo inferior si aparece nueva evidencia científica que pueda modificar algunas de las recomendaciones ofrecidas en esta guía.
ResultadosEtiopatogeniaMuchos son los estudios que han intentado relacionar la aparición de un neumotórax con distintos factores. Por un lado, tenemos aspectos antropológicos, como son la edad, la talla o el peso5. Por otro, la presencia de factores tóxicos, como el tabaco y su acción destructora sobre el parénquima pulmonar que hacen que el riesgo de desarrollar un neumotórax pueda incrementarse hasta unas 20 veces más6. (Recomendación GRADE 1B). Igualmente, la presencia de enfermedades pulmonares, tales como la enfermedad pulmonar obstructiva crónica, la fibrosis quística o las enfermedades pulmonares intersticiales, entre otras, se han relacionado con la aparición de neumotórax secundario7. Cabe destacar estudios que han intentado interrelacionar la aparición de los NE con los cambios de presión atmosférica8–11, sin llegar a resultados concluyentes.
Por último, podemos destacar que los mecanismos fisiopatológicos del NE permanecen desconocidos, aunque se asume en el primario que es resultado de la formación y posterior rotura de blebs subpleurales o ampollas12. Existen hipótesis como la de los cambios estructurales en el parénquima (cambios enfisematoides): debido a que el gradiente de presión en los vértices es superior, se genera una mayor distensión de los alvéolos subpleurales apicales con la consiguiente formación de blebs y su posterior rotura12 (nivel de evidencia bajo).
De todos modos, la fisiopatología es multifactorial y permanece desconocida, dando lugar a la entrada de aire en la cavidad pleural según el mecanismo propio de cada enfermedad de base3,13.
EvoluciónLo que sí parece estar claro es la tendencia a la recidiva de esta enfermedad según el tratamiento y el periodo de seguimiento empleado12, aunque no podemos predecir su evolución. Se estima que el número de recidivas del NEP está en torno al 30% con un rango entre el 16 y el 52%, y en el neumotórax secundario del 40 al 56%5,12,14,15. Generalmente, la recidiva suele ocurrir en los primeros 6 meses tras el primer episodio. Después de un segundo neumotórax y sin un tratamiento adecuado, la posibilidad de un tercer episodio llega casi a un 80%16.
Dentro de los factores relacionados con la recidiva encontramos la fibrosis pulmonar detectada en un estudio radiológico, la edad mayor de 60 años o el índice de masa corporal elevado5 (nivel de evidencia bajo). Se ha puesto de manifiesto que la permanencia en el consumo de tabaco se halla relacionada con la existencia de un mayor número de episodios de neumotórax7. (Recomendación GRADE 1B).
MortalidadLa mortalidad del neumotórax es baja, cifrándose la tasa de mortalidad, por ejemplo, en el Reino Unido, en 0,62 por millón de habitantes/año para las mujeres y de 1,26 para los hombres3.
Dividiéndolo por tipos, en el NEP la tasa se estima en 0,09% en varones y 0,06% en mujeres3, mientras que en el secundario la tasa de mortalidad es mayor debido a la enfermedad pulmonar de base, así como la menor reserva funcional respiratoria.
DiagnósticoHabitualmente, la adecuada anamnesis junto a una correcta exploración física son suficientes para establecer el diagnóstico de NE. Las exploraciones complementarias (como la radiología simple de tórax) se indican cuando es necesario confirmar el diagnóstico o en determinadas circunstancias particulares que veremos más adelante.
El síntoma más característico es el dolor pleurítico ipsolateral, frecuentemente acompañado de cierto grado de disnea y tos irritativa13; si el neumotórax es pequeño, estos síntomas pueden desaparecer en las 24h siguientes, incluso sin que el cuadro esté resuelto17. Sin embargo, la clínica no parece ser un indicador fiable del tamaño del neumotórax (nivel de evidencia bajo)7, ya que los síntomas que refiere el paciente están más relacionados con la reserva funcional respiratoria que con el grado de colapso pulmonar. Se han propuesto distintos criterios18 para valorar la estabilidad clínica de los enfermos, siendo la disnea evidente un dato importante a la hora de decidir el manejo clínico más apropiado (nivel de evidencia bajo)7.
La ACCP define como estabilidad clínica cuando la frecuencia respiratoria es menor de 24 respiraciones/min, la frecuencia cardíaca se encuentra entre 60 y 120 latidos/min, la presión arterial sistémica está en el rango de la normalidad, la saturación arterial de oxígeno respirando aire ambiente es mayor del 90% y el paciente puede pronunciar frases completas entre respiraciones18. La BTS añade la ausencia de disnea a estos criterios de estabilidad7. Todo paciente que no cumpla uno de los parámetros previamente citados será considerado clínicamente inestable.
La coexistencia de episodios previos de neumotórax (homo o contralaterales), enfermedad pulmonar de base o determinados hábitos tóxicos (p. ej., tabaquismo) influye sobre la evolución del cuadro y su probabilidad de recidiva, por lo que también posee implicaciones terapéuticas. Finalmente, existen algunos casos especiales (neumotórax de repetición en mujeres jóvenes en edad gestacional) en los que la presencia de infertilidad, cirugía uterina previa y más raramente hemoptisis o hemotórax en relación con la menstruación pueden orientar hacia un origen catamenial19,20.
Si bien la exploración física puede ser anodina (cuando el neumotórax es pequeño), la norma suele ser el hallazgo de taquicardia sinusal junto a disminución de la motilidad del hemitórax afectado, reducción o ausencia del murmullo vesicular, aumento de la resonancia a la percusión y disminución de la transmisión de la voz17, a veces con enfisema subcutáneo.
La realización sistemática de electrocardiograma, gasometría arterial basal o pruebas de función respiratoria no está indicada en pacientes con NE. (Recomendación GRADE 1C)1. El uso de técnicas de diagnóstico por imagen se justifica principalmente por la necesidad de confirmación diagnóstica del episodio y en menor medida por otras causas que seguidamente veremos. Además, las técnicas de imagen permiten clasificar los neumotórax según su tamaño.
La diversidad de métodos publicados para cuantificar el tamaño del neumotórax21-23 refleja la falta de consenso sobre el sistema a emplear, pues la conformación inconstante y poco uniforme del parénquima pulmonar durante el episodio generalmente conduce a subestimar el volumen del neumotórax. Para la cuantificación del tamaño del neumotórax los índices más utilizados para la medición del colapso pulmonar son el de Rhea et al.21, Light22 y Collins et al.23. Consideramos que la clasificación propuesta por la SEPAR es la que mejor se adapta al uso clínico (tabla 1).
Diferentes clasificaciones según tamaño del neumotórax
| Clasificación según tamaño | |
|---|---|
| ACCP | Pequeño: < 3cm de distancia interpleural en el ápex Grande: > 3cm de distancia interpleural en el ápex |
| BTS | Pequeño: < 2cm de distancia interpleural a la altura del hilio Grande: > 2cm de distancia interpleural a la altura del hilio |
| SEPAR | Parcial: separación de la pleura visceral en parte de la cavidad pleural Completo: separación de la pleura visceral en toda la cavidad pleural Total: formación uniforme de muñón pulmonar |
Radiografía simple tórax: suele ser la prueba de elección por su disponibilidad, inocuidad y bajo coste. Normalmente, basta con realizar una proyección estándar (posteroanterior, bipedestación y en inspiración forzada), ya que las diferentes guías publicadas no recomiendan de forma sistemática la maniobra de espiración forzada durante su realización. (Recomendación GRADE 1B)7,18,24,25. Suele identificarse una línea nítida hiperdensa (correspondiente a la línea de la pleura visceral), con ausencia de trama broncopulmonar distal a ella, si bien hay que ser cautelosos ante la posibilidad de imágenes de «falso neumotórax» debidas a pliegues cutáneos, alteraciones de la pared torácica o lesiones parenquimatosas como quistes o ampollas. Deberíamos ser igualmente cautelosos al emplear imágenes digitalizadas (PACS), ya que pequeños neumotórax pueden no ser muy aparentes en las mismas, pasando incluso desapercibidos7. En el diagnóstico de neumotórax a tensión se observa colapso pulmonar completo con desviación mediastínica contralateral e inversión del hemidiafragma homolateral26.
Entre un 10 y un 20% de los casos asocian derrame pleural eosinofílico, secundario a la irritación de la pleura parietal por el aire; de forma infrecuente, puede cursar con hemotórax, normalmente secundario a rotura de adherencias pleurales vascularizadas durante el colapso pulmonar.
Ecografía: por su posibilidad de empleo a pie de cama, mayor sensibilidad e igual especificidad que la radiología convencional, se ha propuesto como alternativa a esta para el diagnóstico del neumotórax27, si bien su precisión parece altamente dependiente del operador que la realice28 y de la existencia de enfermedad pulmonar subyacente. En cualquier caso, y una vez detectado el neumotórax mediante ecografía, parece prudente realizar una radiografía simple para cuantificar su tamaño y detectar posible comorbilidad torácica subyacente29. Así, parece razonable el uso de la ecografía como complemento diagnóstico a la radiografía convencional o con fines evolutivos del neumotórax por parte de clínicos o radiológicos con experiencia. (Recomendación GRADE 2C).
Tomografía computarizada (TAC) torácica: la realización de una TAC no se recomienda de forma sistemática para todo paciente con un primer episodio de NE (recomendación GRADE 1B)18, quedando limitada su indicación a ciertos casos concretos. Así, podría ser útil en alguna de las siguientes situaciones7:
- –
Detección de neumotórax de pequeño tamaño.
- –
Estimación del tamaño real de un neumotórax, siendo esta la técnica ideal para dicha determinación. (Recomendación GRADE 2A)7.
- –
Existencia de enfisema o enfermedad bullosa con posible indicación de cirugía.
- –
Confirmar o descartar malposición del drenaje torácico.
- –
Diagnóstico de otras enfermedades pulmonares subyacentes.
- –
Pacientes con episodios recurrentes para intentar filiar la etiología del neumotórax; por ejemplo, en los casos de neumotórax catamenial aparecen en ocasiones neumoperitoneo, implantes endometriales en diafragma o rotura diafragmática total o parcial19,20.
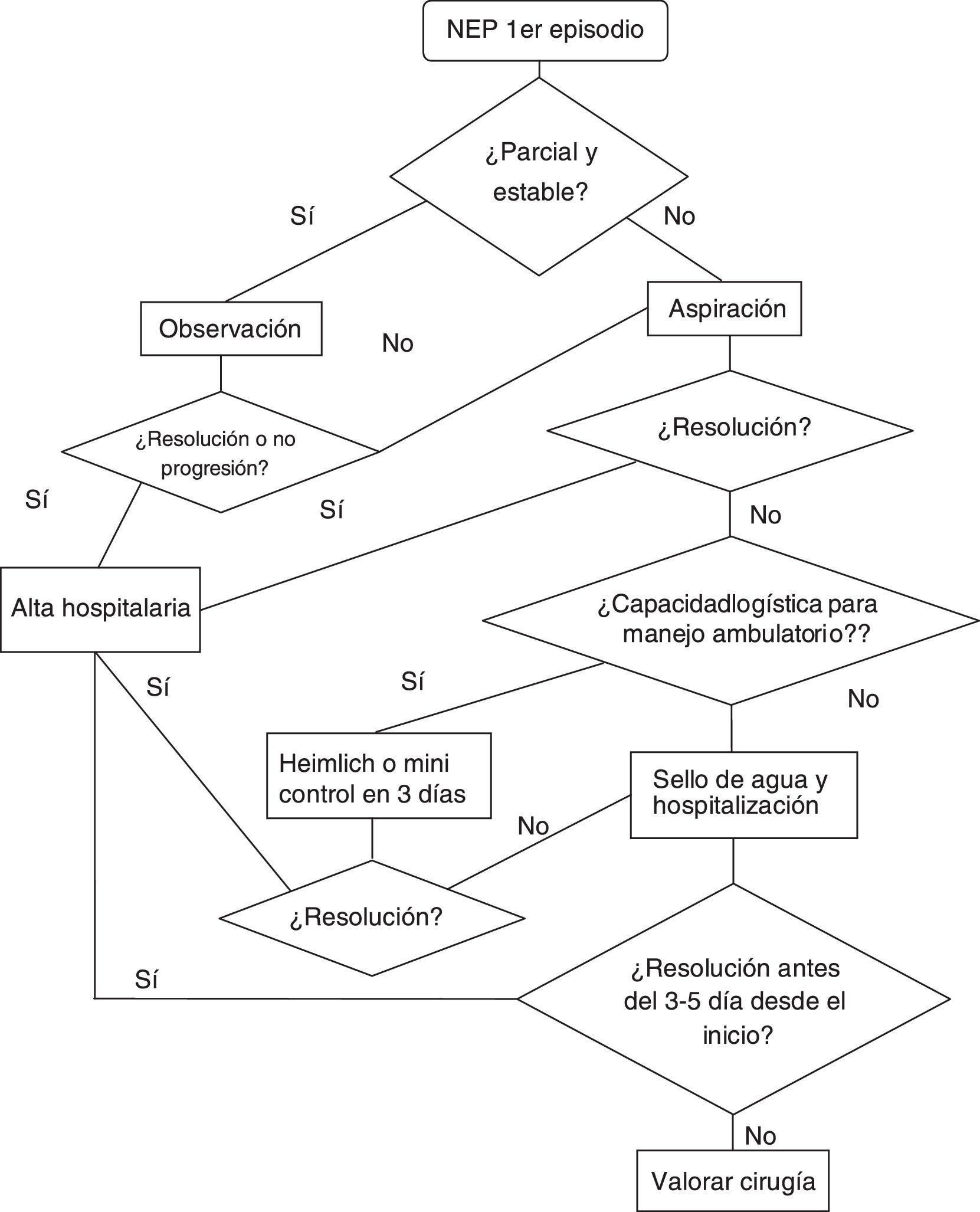
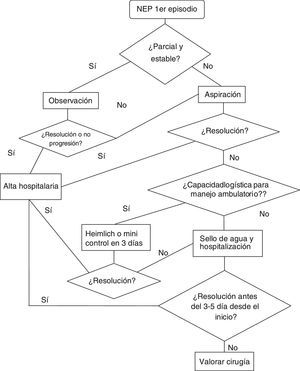
En pacientes con primer episodio de NEP y en los que no hay ninguna otra indicación que requiera una intervención seguiremos la siguiente estrategia:
- a.
Neumotórax parcial y paciente estable: observación. Así, en estos pacientes se puede realizar únicamente observación durante las primeras 4-6h en la sala de Urgencias. Si no hay empeoramiento clínico o radiológico, se podrá proceder al alta con control (< 1semana). En caso de empeoramiento, se tratará como un neumotórax completo/total o inestables.
- b.
Neumotórax no parcial o inestable: debemos de actuar para drenar el aire. En el figura 1 se presenta un algoritmo de tratamiento del NEP.
Existe suficiente evidencia sobre la punción-aspiración como estrategia ambulatoria de estos pacientes sin empeoramiento de necesidades de reingreso ni en cuanto a resoluciones de neumotórax. (Recomendación GRADE1A)30,31. Debido a que los estudios en los que se basa esta recomendación excluyen a los pacientes con hemoneumotórax, neumotórax a tensión y el neumotórax bilateral, creemos razonable no aplicar esta recomendación en estas situaciones. Así mismo, se han realizado 2revisiones sistemáticas comparando la punción-aspiración frente al ingreso con drenaje que concluyen que la punción-aspiración debiera ser el primer paso en los casos con indicación de evacuación del aire32,33. A pesar de la numerosa bibliografía, en muchos países no es la estrategia de elección ante un primer episodio de NEP1,34.
Para ello, se realiza la punción-aspiración y tras 2-4h se realiza una radiografía de control para objetivar la resolución. Si no se resuelve, se procede al ingreso en planta de hospitalización con sistema de sello y si a los 3-5 días la fuga persiste, se valora la cirugía.
Otra estrategia ambulatoria se basa en el manejo con válvula de Heimlich/minidrenaje. Existe un ensayo clínico donde se comparan ambas estrategias ambulatorias con índices de éxito y satisfacción similares35 (recomendación GRADE 2A).
Además, hay que valorar los recursos logísticos del hospital y del paciente, ya que esta estrategia requiere de un control ambulatorio de estos pacientes.
Si se ha procedido al alta con drenaje portátil y al tercer día persiste fuga, se procede al ingreso y se valora cirugía (3-5 días desde el inicio del episodio).
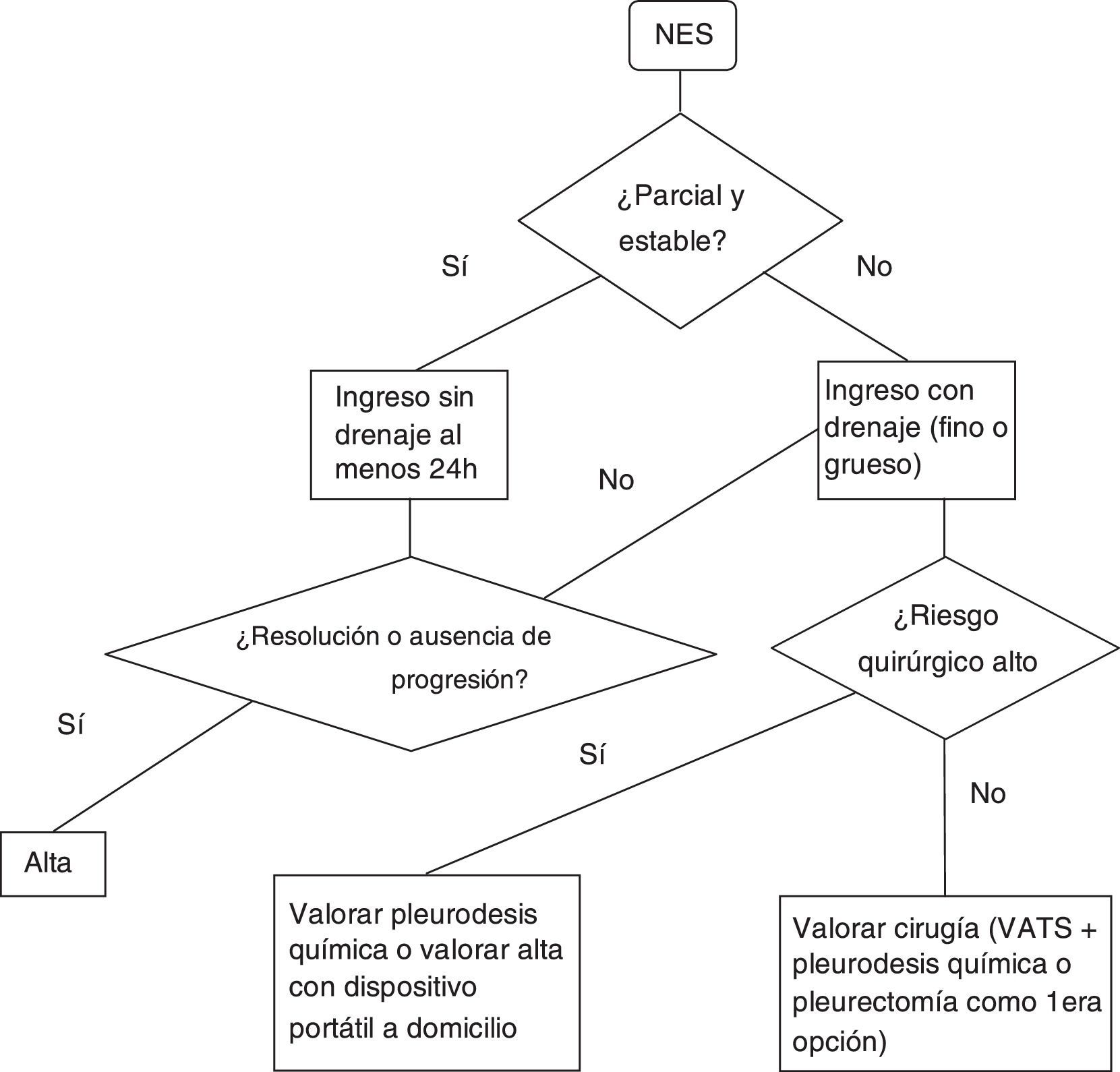
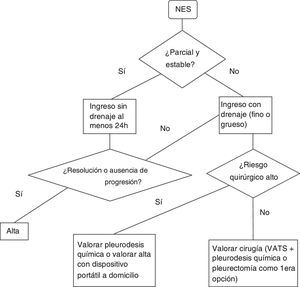
Neumotórax espontáneo secundarioSe recomienda el ingreso hospitalario al menos 24h para control del neumotórax y la enfermedad de base7. (Recomendación GRADE 1C). No está claro el tipo de drenaje que se debe emplear en el tratamiento de estos episodios. La guía de la BTS del 2010 recomienda (grado de recomendación B) el uso de drenaje de calibre fino basándose en el estudio publicado por Tsai et al.36, donde concluyen que el drenaje de calibre fino debe ser utilizado inicialmente en los NES ya que observan un índice de éxito (definido éxito como la no necesidad de otro drenaje o cirugía) similar comparándolo con el grupo de drenaje de calibre grueso (definido éxito como la no necesidad de cirugía).
En otro trabajo37 retrospectivo se compara el uso del catéter de calibre fino con el catéter de calibre grueso en pacientes con neumotórax primario y secundario. En el grupo de los secundarios se observa un fracaso (necesidad de un drenaje grueso tras la no resolución del caso con uno fino) del 52% (recomendación GRADE 2C)
En el figura 2 se encontrará un algoritmo de tratamiento del NES.
Tratamiento quirúrgico del neumotóraxEn la actualidad, las indicaciones quirúrgicas del tratamiento del neumotórax reconocidas ampliamente son1,17:
- –
No resolución del neumotórax con la estrategia descrita por fuga aérea prolongada (3-5 días) o imposibilidad de reexpansión pulmonar.
- –
Segundo episodio (ipsolateral o contralateral).
- –
Episodio bilateral sincrónico.
- –
Hemotórax asociado a neumotórax38,39.
- –
Profesiones de riesgo (pilotos de aviación, buceadores).
Si bien estas son las indicaciones formales en el caso de NEP, en el caso de NES las indicaciones descritas deben ser tomadas con cautela, ya que en este caso los pacientes presentan baja reserva funcional respiratoria para tolerar la ventilación unipulmonar, más comorbilidades asociadas, con un parénquima pulmonar marcadamente bulloso, sin una zona diana concreta y con posibilidad de amplias adherencias pleuropulmonares que pueden dificultar la cirugía. De tal modo, en los pacientes con NES en los que el balance beneficio-riesgo de la intervención no sea tan evidente o presenten contraindicación formal para la cirugía, debe valorarse de manera individualizada y valorar tratamientos no quirúrgicos para evitar recidivas como pleurodesis química a través del drenaje y en el caso de fugas aéreas persistentes valorar el manejo ambulante con drenaje a domicilio con sistemas portátiles (Pneumostat, Minipleurevac, válvula de Heimlich, etc.)40.
En la actualidad, la técnica quirúrgica se basa en la identificación y la resección de zonas diana o zonas bullosas mediante grapadoras y asociar una técnica de pleurodesis, ya sea abrasión mecánica sobre la pleura parietal, química o mediante pleurectomía apical41–44. Pueden usarse materiales como pericardio bovino o PTFE como refuerzos de las suturas mecánicas en parénquimas muy bullosos para minimizar la fuga aérea en la zona de sutura45.
La cirugía VATS se ha demostrado como un procedimiento seguro con bajas complicaciones y ofrece ventajas en cuanto a mejor recuperación postoperatoria, mejor control del dolor, menor estancia hospitalaria y mejor resultado estético respecto de los abordajes mediante toracotomía46–51. En un metaanálisis52 de la literatura se cifra un riesgo de recidiva del neumotórax en cirugía toracoscópica 4 veces mayor que por cirugía abierta (aproximadamente un 1% en cirugía abierta frente alrededor del 5% en VATS) cuando en ambas se realiza similar tipo de pleurodesis; sin embargo, el asumible índice de recidiva a través de la vía toracoscópica asociado a las ventajas postoperatorias que ofrece este abordaje en comparación con la toracotomía justifica su uso como primera opción7,52–54 con mayor evidencia científica en el caso de los neumotórax primarios (recomendación GRADE 1A) que en los secundarios (recomendación GRADE 1-B). Los resultados de la base de datos francesa con 7.396 pacientes van en la misma dirección con menor estancia hospitalaria pero con mayor índice de recurrencia (3,8% frente al 1,8% de la toracotomía)55.
Por otro lado, la cirugía de resección bullosa debe conllevar asociada una pleurodesis que disminuya la probabilidad de recidiva, ya que la recidiva en pacientes intervenidos mediante VATS sin pleurodesis asociada puede llegar hasta el 24%56, aunque en otros trabajos se han objetivado cifras muy inferiores en pacientes en lo que no se ha asociado ninguna técnica de pleurodesis (6,3%)57.
Las técnicas de pleurodesis se dividen en mécanicas o químicas.Mecánicas:
- a.
Abrasión: producción de una reacción inflamatoria sobre la pleura parietal que facilite la sínfisis pleural una vez reestablecida la reexpansión pulmonar57.
- b.
Pleurectomía: la extirpación total o parcial de la pleura parietal. La pleurectomía VATS ha demostrado ser comparable con la pleurectomía mediante toracotomía en el tratamiento de NE. Una revisión sistemática muestra menor estancia hospitalaria y necesidad de analgésicos en la opción VATS53.
- a.
Talco: el talco se instila de manera pulverizada sobre la cavidad pleural una vez realizada la resección bullosa produciendo una reacción inflamatoria a cuerpo extraño sobre la cavidad pleural.
- b.
Otros agentes, la doxiciclina, la minociclina, la bleomicina, la povidona iodada y el Picibanil (OK-432)58, producen una reacción inflamatoria en la cavidad pleural.
Existe gran controversia sobre qué pleurodesis ha de realizarse ya que en la literatura podemos encontrar trabajos que concluyen en distintas direcciones.
En 2ensayos clínicos recientes donde se compara la abrasión mecánica tras la resección bullosa frente a no añadir ninguna técnica de pleurodesis y frente a utilizar un refuerzo en la sutura de grapas con malla de celulosa absorbible y cola de fibrina. Ambos concluyen que la abrasión no mejora los resultados en cuanto al índice de recidivas. En el estudio donde se compara la abrasión con el recubrimiento con cola59 se observan recidivas hasta en un 9,3% en el grupo de recubrimiento frente al 11,4% en el grupo de abrasión. En el estudio donde se compara no añadir ninguna técnica se observan recidivas en el 5,5% del grupo de abrasión y el 6,3% en el grupo sin abrasión60.
En otro ensayo clínico se compara la abrasión mecánica frente a la pleurectomía, concluyendo que ambas tienen un índice de recidivas similar (6,2% en el grupo de abrasión y 4,6% en el grupo pleurectomía) y que la abrasión presenta menos complicaciones (sangrado) que la pleurectomía61. En cambio, otros trabajos concluyen que el número de complicaciones entre la pleurectomía y la abrasión son similares y que la pleurectomía presenta menor índice de recidivas62,63.
También se ha comparado la pleurodesis mecánica con la pleurodesis química. En un trabajo retrospectivo de 432 pacientes consecutivos con pleurectomía y con uso del talco se concluye que el beneficio del uso del talco por menor índice de recidivas (1,8% frente a 9.1%)64. En un ensayo clínico reciente donde se ha aleatorizado a pacientes con alto riesgo de recidiva; se han comparado la pleurectomía frente a la abrasión mecánica añadiendo instilación de minociclina, observando bajos y similares índices de recidivas (3,8% en ambos grupos)65.
Con todo ello, y con la cautela necesaria debido a los diferentes resultados, podemos concluir que no está claro que la abrasión mecánica aporte ningún beneficio y que la pleurectomía parece obtener mejor resultados en cuanto a las recidivas, si bien en algún trabajo ha mostrado mayor índice de sangrado. En cuanto a la pleurodesis química el talco parece reducir el número de recidivas, aunque hay muchos grupos que no la utilizan por sus efectos secundarios y la minociclina tras la abrasión presenta resultados similares a la pleurectomía.
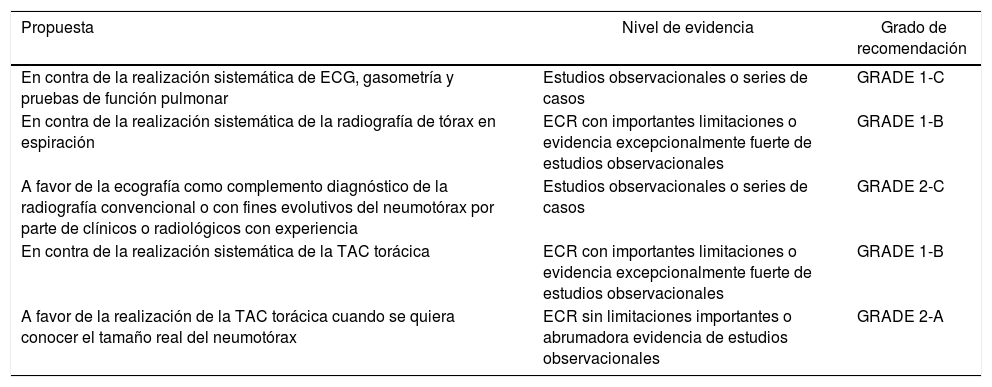
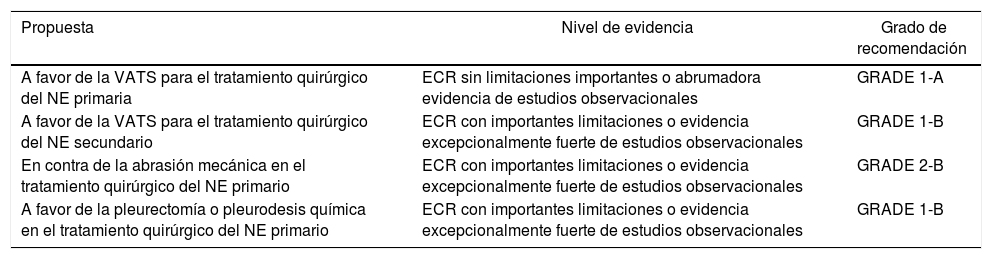
Resumen de las recomendacionesEtiopatogeniaDiagnóstico| Propuesta | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| En contra de la realización sistemática de ECG, gasometría y pruebas de función pulmonar | Estudios observacionales o series de casos | GRADE 1-C |
| En contra de la realización sistemática de la radiografía de tórax en espiración | ECR con importantes limitaciones o evidencia excepcionalmente fuerte de estudios observacionales | GRADE 1-B |
| A favor de la ecografía como complemento diagnóstico de la radiografía convencional o con fines evolutivos del neumotórax por parte de clínicos o radiológicos con experiencia | Estudios observacionales o series de casos | GRADE 2-C |
| En contra de la realización sistemática de la TAC torácica | ECR con importantes limitaciones o evidencia excepcionalmente fuerte de estudios observacionales | GRADE 1-B |
| A favor de la realización de la TAC torácica cuando se quiera conocer el tamaño real del neumotórax | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales | GRADE 2-A |
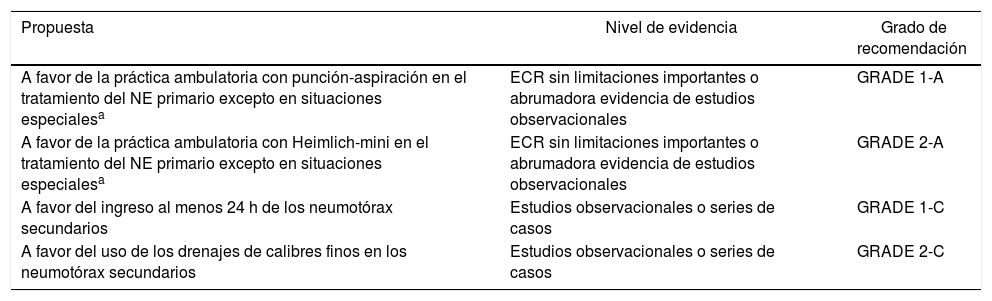
| Propuesta | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| A favor de la práctica ambulatoria con punción-aspiración en el tratamiento del NE primario excepto en situaciones especialesa | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales | GRADE 1-A |
| A favor de la práctica ambulatoria con Heimlich-mini en el tratamiento del NE primario excepto en situaciones especialesa | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales | GRADE 2-A |
| A favor del ingreso al menos 24 h de los neumotórax secundarios | Estudios observacionales o series de casos | GRADE 1-C |
| A favor del uso de los drenajes de calibres finos en los neumotórax secundarios | Estudios observacionales o series de casos | GRADE 2-C |
| Propuesta | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| A favor de la VATS para el tratamiento quirúrgico del NE primaria | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales | GRADE 1-A |
| A favor de la VATS para el tratamiento quirúrgico del NE secundario | ECR con importantes limitaciones o evidencia excepcionalmente fuerte de estudios observacionales | GRADE 1-B |
| En contra de la abrasión mecánica en el tratamiento quirúrgico del NE primario | ECR con importantes limitaciones o evidencia excepcionalmente fuerte de estudios observacionales | GRADE 2-B |
| A favor de la pleurectomía o pleurodesis química en el tratamiento quirúrgico del NE primario | ECR con importantes limitaciones o evidencia excepcionalmente fuerte de estudios observacionales | GRADE 1-B |
Los autores declaran no tener ningún conflict de interés.
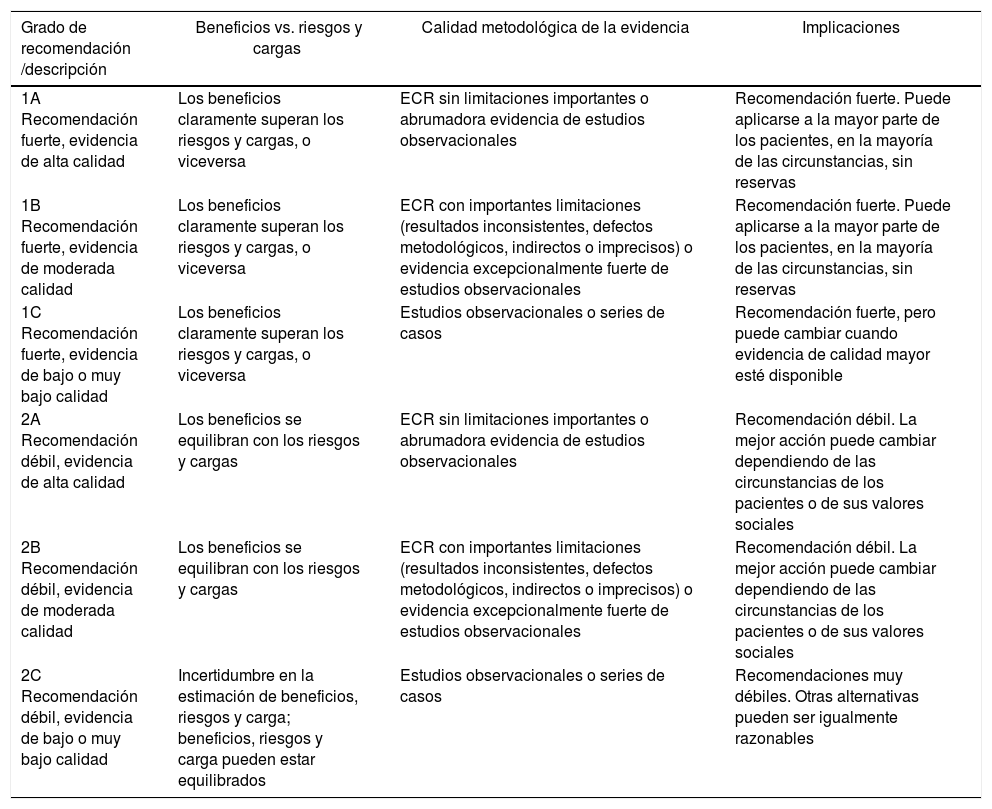
| Grado de recomendación /descripción | Beneficios vs. riesgos y cargas | Calidad metodológica de la evidencia | Implicaciones |
|---|---|---|---|
| 1A Recomendación fuerte, evidencia de alta calidad | Los beneficios claramente superan los riesgos y cargas, o viceversa | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales | Recomendación fuerte. Puede aplicarse a la mayor parte de los pacientes, en la mayoría de las circunstancias, sin reservas |
| 1B Recomendación fuerte, evidencia de moderada calidad | Los beneficios claramente superan los riesgos y cargas, o viceversa | ECR con importantes limitaciones (resultados inconsistentes, defectos metodológicos, indirectos o imprecisos) o evidencia excepcionalmente fuerte de estudios observacionales | Recomendación fuerte. Puede aplicarse a la mayor parte de los pacientes, en la mayoría de las circunstancias, sin reservas |
| 1C Recomendación fuerte, evidencia de bajo o muy bajo calidad | Los beneficios claramente superan los riesgos y cargas, o viceversa | Estudios observacionales o series de casos | Recomendación fuerte, pero puede cambiar cuando evidencia de calidad mayor esté disponible |
| 2A Recomendación débil, evidencia de alta calidad | Los beneficios se equilibran con los riesgos y cargas | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales | Recomendación débil. La mejor acción puede cambiar dependiendo de las circunstancias de los pacientes o de sus valores sociales |
| 2B Recomendación débil, evidencia de moderada calidad | Los beneficios se equilibran con los riesgos y cargas | ECR con importantes limitaciones (resultados inconsistentes, defectos metodológicos, indirectos o imprecisos) o evidencia excepcionalmente fuerte de estudios observacionales | Recomendación débil. La mejor acción puede cambiar dependiendo de las circunstancias de los pacientes o de sus valores sociales |
| 2C Recomendación débil, evidencia de bajo o muy bajo calidad | Incertidumbre en la estimación de beneficios, riesgos y carga; beneficios, riesgos y carga pueden estar equilibrados | Estudios observacionales o series de casos | Recomendaciones muy débiles. Otras alternativas pueden ser igualmente razonables |
Esta guía ha sido avalada por el comité científico de la Sociedad Española de Cirugía Torácica.