En comparación con otras áreas quirúrgicas, la resección hepática laparoscópica (RHL) no se ha aplicado de forma generalizada y en la actualidad menos del 20% de las hepatectomías se realiza por vía laparoscópica en todo el mundo. El objetivo de nuestro estudio fue evaluar la aplicabilidad y la proporción de RHL en nuestro departamento.
Métodos Los datos de morbimortalidad y supervivencia se extrajeron de una base de datos prospectiva con 749 resecciones hepáticas realizadas durante un período de 10 años en un solo centro.
ResultadosEntre 2005 y 2015 se realizaron 150 RHL. En el 87% de los pacientes la indicación fue la presencia de tumores hepáticos primarios o metastásicos. Se realizaron 30 hepatectomías mayores (20%) y el 80% fueron resecciones menores, realizadas en todos los segmentos del hígado. Doce pacientes fueron operados 2veces y 2 pacientes tuvieron una tercera RHL. La proporción de RHL aumentó del 12% en 2011 al 62% en el último año. La tasa de conversión fue del 9%. En general, la tasa de morbilidad fue del 36%, pero solo 1/3 se clasificaron como graves. La tasa de mortalidad a los 90 días fue del 1%. La mediana de estancia fue de 4 días y la tasa de reingresos fue del 6%.
ConclusionesLa aplicación de RHL ha sido rápida y progresiva, con resultados de morbimortalidad comparables a las de las series publicadas en la literatura. En los últimos 2 años más de la mitad de las hepatectomías se realiza por vía laparoscópica en nuestro centro.
Compared to other surgical areas, laparoscopic liver resection (LLR) has not been widely implemented and currently less than 20% of hepatectomies are performed laparoscopically worldwide. The aim of our study was to evaluate the feasibility, and the ratio of implementation of LLR in our department.
MethodsWe analyzed a prospectively maintained database of 749 liver resections performed during the last 10-year period in a single centre.
ResultsA total of 150 (20%) consecutive pure LLR were performed between 2005 and 2015. In 87% of patients the indication was the presence ofprimary or metastatic liver malignancy. We performed 30 major hepatectomies (20%) and (80%) were minor resections, performed in all liver segments. Twelve patients were operated twice and 2 patients underwent a third LLR. The proportion of LLR increased from 12% in 2011 to 62% in the last year. Conversion rate was 9%. Overall morbidity rate was 36% but only one third were classified as severe. The 90-day mortality rate was 1%. Median hospital stay was 4 days and the rate of readmissions was 6%.
ConclusionsThe implementation of LLR has been fast with morbidity and mortality comparable to other published series. In the last 2 years more than half of the hepatectomies are performed laparoscopically in our centre.
La resección hepática laparoscópica (RHL) está actualmente en rápida expansión1,2. En la mayoría de los centros, este abordaje quirúrgico se limita a resecciones pequeñas o segmentarias y la aplicación de la laparoscopia en los últimos años ha sido lenta, incluso en países en los que esta está bien desarrollada3. Cada vez hay mayor evidencia de que la cirugía mínimamente invasiva del hígado ofrece ventajas significativas a corto plazo, con menor dolor, estancia hospitalaria y requerimientos de hemoderivados, con una recuperación más rápida y mejores resultados estéticos en comparación con la cirugía abierta (RHA)4–6. Por otra parte, un estudio reciente señala una menor respuesta inflamatoria después de RHL en comparación con la RHA7. Numerosas series actuales han avalado la seguridad tanto en términos de morbilidad peroperatoria como en oncológica de la cirugía laparoscópica en comparación con la cirugía abierta8–11.
Hace algunos años, Vigano12 estableció la curva de aprendizaje para RHL en 60 casos. Sin embargo, recientemente este concepto ha sido reevaluado por el mismo grupo, que se ha centrado en la importancia no solo de la curva de aprendizaje del cirujano, sino de la institución, sobre todo en hepatectomías mayores (HM)13. Sin embargo, la aplicación de laparoscopia en el hígado no ha sido tan popular como en otras áreas anatómicas. En una publicación reciente, basada en registros del sistema nacional francés de salud que analizaba más de 40.000 hepatectomías, menos del 20% de los casos fueron RHL3.
En nuestro centro, la primera RHL se realizó en 2005. En 2010 iniciamos un entrenamiento específico para este abordaje y, progresivamente, hemos aumentado de manera significativa la proporción de RHL. El objetivo de nuestro estudio fue evaluar la aplicabilidad y la implementación del abordaje laparoscópico en las hepatectomías realizadas en nuestra Unidad Hepatobiliopancreática (HPB) durante un periodo de 10 años.
MétodosLos datos demográficos, de indicación quirúrgica y de morbimortalidad se extrajeron de una base de datos prospectiva.
Todos los pacientes con lesiones hepáticas fueron evaluados por un comité multidisciplinario semanal y la indicación quirúrgica se estableció en consonancia con los estándares oncológicos actuales14 de acuerdo con el radiólogo, oncólogo radioterapeuta y oncólogo médico. La indicación de abordaje laparoscópico se discutió en el seno del equipo quirúrgico. Desde el inicio hemos optado por una técnica quirúrgica puramente laparoscópica y las técnicas híbrida o asistida con la mano se realizaron cada una en un caso, como hemos publicado recientemente15. Hemos ido ampliando de forma progresiva las indicaciones del abordaje laparoscópico a segmentos posteriores y a HM.
Asimismo, nuestra técnica de HM ha evolucionado a través de los casos. Para la hepatectomía izquierda, desde el inicio optamos por un abordaje extraglissoniano con resección en bloque del pedículo izquierdo16 y control extrahepático de la vena hepática izquierda, seguida de la transección hepática, pero en los 2últimos casos hemos introducido el abordaje dorsal de la vena hepática media y su exposición desde la raíz hasta la periferia, como describe Okuda17. En cuanto a la hepatectomía derecha, en los primeros casos se comenzaba movilizando el hígado, con disección del pedículo y ligadura selectiva de sus elementos, seguido de la transección. Después del 5.° caso se introdujo el abordaje extraglissoniano del pedículo derecho, según la técnica descrita por Cho, ya que era nuestro abordaje de elección en RHA18–20. Asimismo, a partir del 8.° caso adoptamos el abordaje caudal, de forma que la movilización del hígado derecho se realizó al final de la transección, e incorporamos a partir del decimosegundo caso la disección proximal de la vena hepática media descrita por Honda et al.21.
Nuestra técnica de ecografía intraoperatoria, transección hepática, pinzamiento hiliar y extracción de la pieza ha sido ya descrita15. Las pérdidas hemáticas se estimaron midiendo el líquido aspirado del campo quirúrgico y el peso de las gasas quirúrgicas.
No dejamos drenajes abdominales de forma rutinaria tras RHL o RHA22.
La morbilidad específica como insuficiencia hepática, fístula biliar o hemorragia postoperatoria se recogió de forma sistemática, según las definiciones del International Group for the Study of Liver Surgery23–25. Se recogieron otras complicaciones generales como infecciones quirúrgicas superficiales y profundas, infecciones de espacio y complicaciones respiratorias, durante la visita diaria o durante la consulta ambulatoria postoperatoria. La infección del espacio quirúrgico se definió como cualquier colección intraabdominal que necesite drenaje endoscópico, percutáneo o quirúrgico o asociada con el síndrome de respuesta inflamatoria sistémica y que requiera tratamiento con antibióticos26. Las complicaciones postoperatorias fueron estratificadas según la clasificación de Dindo-Clavien27. Las complicaciones de grado iiia o superiores fueron consideradas como morbilidad grave.
Todos los pacientes oncológicos fueron seguidos por un miembro del equipo HPB una semana después del alta, y después cada 3-6 meses con marcadores tumorales y con TC toracoabdominal.
Nuestro comité de ética aprobó el presente estudio.
Análisis estadísticoLas variables cualitativas se expresan en número y porcentaje. Las variables cuantitativas se expresan mediante la mediana y rango. Todos los resultados se analizaron mediante el paquete estadístico SPSS versión 20.0 (IBM SPSS Statistics, Chicago IL, EE. UU.).
ResultadosEntre mayo de 2005 y noviembre de 2015, realizamos 749 resecciones hepáticas en nuestro hospital. Entre ellas se analizaron el total de 150 RHL realizadas en 136 pacientes.
Los datos demográficos de los pacientes y los resultados definitivos de la anatomía patológica se enumeran en la Tabla 1: el 87% correspondieron a enfermedad maligna y solo el 13% a enfermedad benigna.
Características de los pacientes y anatomía patológica
| Edad mediana (rango) | 64 (24–86) años |
| Sexo mujer:hombre | 52:98 |
| IMC mediana (rango) | 26 (18–43) |
| ASA grado (i:ii:iii:iv) | 7:32:106:5 |
| Anatomía patológica | |
| Malignos | n=131 |
| Metástasis de cáncer colorrectal | 93 |
| Hepatocarcinoma | 27 |
| Colangiocarcinoma | 2 |
| Otras metástasis | 9 |
| Benignos | n=19 |
| Adenoma | 5 |
| Hiperplasia nodular focala | 5 |
| Hidatidosis | 5 |
| Hemangiomab | 1 |
| Poliquistosis | 1 |
| Nódulo fibrosob | 1 |
| Ascariomab | 1 |
ASA: clasificación de la Asociación Americana de Anestesia; IMC: índice de masa corporal.
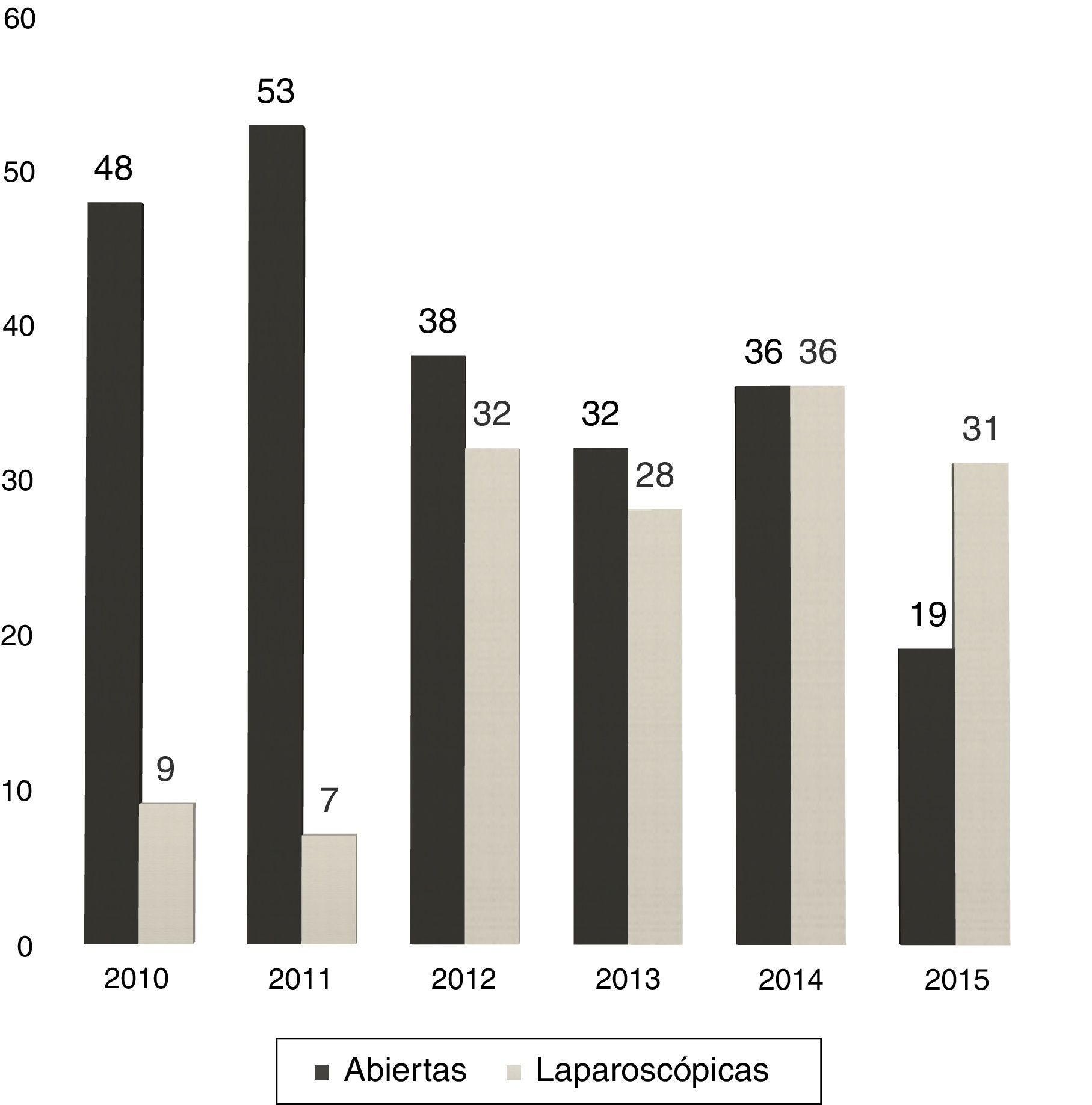
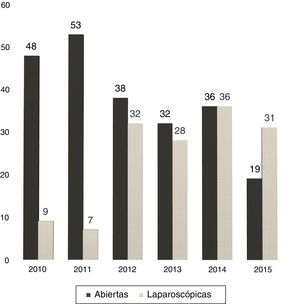
Entre 2005 y 2010 la utilización de RHL fue casi anecdótica, pero, en los últimos 5 años, sin variar la indicación quirúrgica, hemos experimentado un incremento progresivo en el porcentaje de RHL: del 16 en 2010 al 62% en la actualidad (fig. 1).
Se realizaron 30 HM (20%) y 120 (80%) fueron resecciones menores (Hm). Los detalles del tipo de resección se resumen en la Tabla 2. Las Hm se realizaron en todos los segmentos hepáticos, incluyendo segmentos posteriores (es decir, vii, viii y iva) en 20 de 89 casos. Doce pacientes fueron operados 2veces y 2 pacientes fueron intervenidos con una tercera RHL, todos por recidiva de MCCR. Tres pacientes fueron intervenidos mediante una RHL después de una RHA previa. En un caso particular, se llevó a cabo una resección limitada de MCCR después de una hepatectomía derecha extendida con la sustitución de la vena cava inferior y la reconstrucción de la vena hepática izquierda bajo perfusión hipotérmica in situ, practicada un año antes.
Datos operatorios
| Técnica | |
|---|---|
| Hepatectomía mayor | n=30 |
| Hepatectomía derecha | 14 |
| Hepatectomía derecha + resección contralateral | 3 |
| Hepatectomía izquierda | 13 |
| Hepatectomía menor | n=120 |
| Bisegmentectomías | 31 |
| Segmentectomía/resección atípica | 89 |
| Tiempo operatorio mediana (rango) en min | 300 (110-600) |
| Pérdidas hemáticas mediana (rango) en ml | 345 (150-2.813) |
| Transfusión operatoria n (%) | 11 (7,3) |
| Tiempo de pinzamiento mediana (rango) en min | 33 (5-150) |
| Conversión n (%) | 13 (8,6) |
min: minutos; ml: mililitros.
En 5 pacientes la RHL se realizó simultáneamente con la resección del tumor primario: gastrectomía total en 2 casos y una colectomía derecha en 3 casos. En otro realizamos durante el mismo procedimiento una resección parcial del segmento viii y una resección atípica pulmonar toracoscópica derecha. En 11 pacientes se realizó ablación por radiofrecuencia complementaria de lesiones pequeñas profundas, tanto por vía percutánea antes del neumoperitoneo como de forma intraoperatoria.
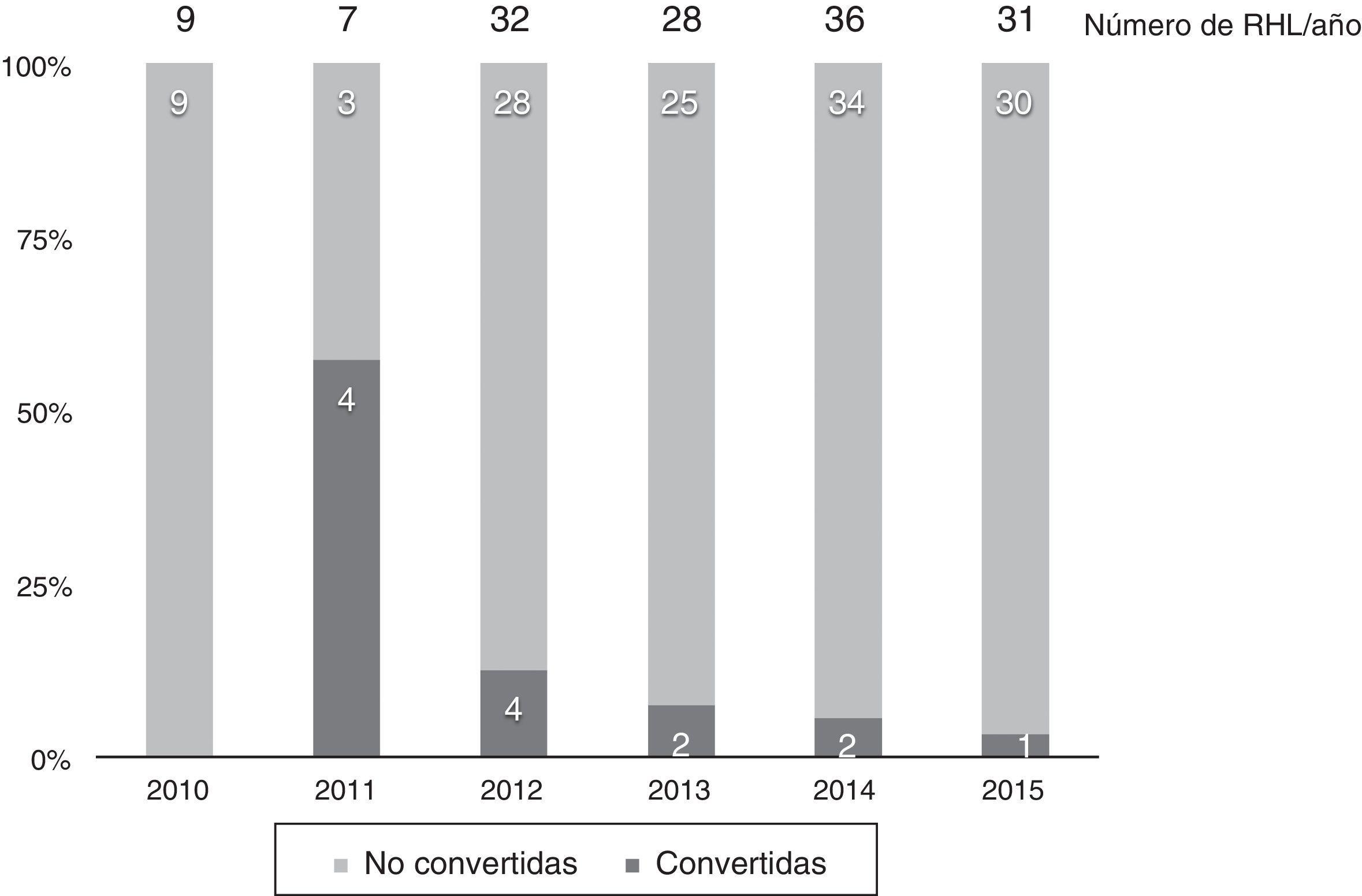
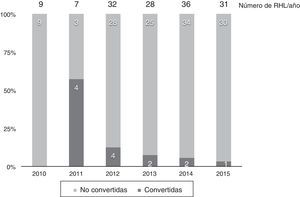
En 13 casos (8,6%) se convirtió a laparotomía durante la RHL, por dificultad para la progresión (6 casos), sangrado excesivo (6 casos) o por presencia de adherencias densas en un caso. La tasa de conversión fue disminuyendo progresivamente: en el último año fue del 3% (fig. 2).
El tiempo quirúrgico promedio fue de 5h y la mayoría de los pacientes (77%) necesitaron por lo menos un periodo de pinzamiento. Nuestra tasa de transfusión intraoperatoria fue baja (7,3%), con una transfusión global del 12% (tabla 2).
Nuestra política de ahorro parenquimatoso se traduce en una tendencia a márgenes quirúrgicos estrechos, lo que logra, en casos malignos, un margen mediano de 0,4 (0-5) cm. Diez pacientes (6,7%) fueron clasificados como R1 después del informe patológico final.
En general, la tasa de morbilidad fue del 36%, pero solo el 13% tuvieron una complicación grave (≥iiia), según la clasificación de Dindo-Clavien (tabla 3). Siete pacientes precisaron una reoperación: 2casos por las complicaciones de la gastrectomía total realizada simultáneamente (fuga y oclusión), 2 casos por hemorragia postoperatoria, uno debido a una lesión duodenal intraoperatoria inadvertida y otros 2casos para retirar un packing.
Datos postoperatorios
| Mortalidad 90 días n (%) | 2 (1,3) |
| Morbilidad global n (%) | 54 (36) |
| Grado de morbilidad (i:ii:iiia:iiib:iva:ivb:v) | 15:19:10:4:1:3:2 |
| Fístula biliar n (%) | 6 (4) |
| Insuficiencia hepática n (%) | 7 (4,7) |
| Hemoperitoneo n (%) | 10 (6,7) |
| Colección intraabdominal n (%) | 11 (7,3) |
| Reintervención n (%) | 7 (4,7) |
| Estancia hospitalaria mediana en días (rango) | 4 (1–60) |
| Reingresos n (%) | 10 (6,7) |
Dos pacientes (1%) murieron después de RHL: un hombre de 82 años con una metástasis metacrónica que requirió una hepatectomía derecha después de embolización portal y quimioterapia prolongada. Presentó insuficiencia hepática progresiva con ascitis, hemorragia varicosa y encefalopatía, y falleció después de 24 días por sepsis relacionada con la infección de la ascitis. El segundo caso era una mujer de 74 años con una gran metástasis y respuesta parcial tras quimioterapia, intervenida mediante una hepatectomía izquierda, que necesitó un drenaje percutáneo para tratar una colección biliar postoperatoria. Presentó un sangrado tardío en el biloma que necesitó una laparotomía para lograr el control hemostático. Después de la reintervención, la paciente presentó una neumonía necrosante bilateral y murió el día postoperatorio 123.°.
La mediana de estancia fue de 4días y la tasa de reingresos fue muy baja (7%). Diez pacientes presentaron estancia prolongada postoperatoria relacionada con el desarrollo de colecciones (9 casos) y otro paciente con enfermedad pulmonar obstructiva crónica, por una neumonía.
DiscusiónEl abordaje laparoscópico se ha convertido en el «abordaje de elección» en varios procedimientos quirúrgicos como la colecistectomía, fundoplicaturas, esplenectomía y adrenalectomía28–31. Sin embargo, la implementación de la resección hepática es baja. En un estudio retrospectivo, sobre más de 40.000 hepatectomías, solo 1/5 parte de los casos se realizó por laparoscopia. De hecho, los hospitales con el mayor número de casos anuales presentan el menor porcentaje de RHL3. Dentro de la segunda Conferencia Internacional de Consenso sobre Cirugía Laparoscópica de Hígado celebrada en Morioka en 2014, se presentó una encuesta realizada a cirujanos de todo el mundo. En esta revisión se describe que, aunque el 86% de los cirujanos declaró un incremento de RHL en los 5años anteriores en sus centros, solo el 13,5% realizan más del 40% de las hepatectomías por vía laparoscópica32. En esta conferencia se concluyó que la RHL menor es hoy una práctica estándar (IDEAL 3) y que las RHL mayores son todavía procedimientos innovadores en fase de exploración (IDEAL 2)33,34.
En nuestro centro, la proporción de RHL ha crecido del 12% en 2011 al 62% en 2015 (31 de 50 hepatectomías).
En la primera conferencia de consenso celebrada en Louisville en 2008 se declaró que la indicación más favorable para la RHL es una lesión solitaria, menor de 5cm, localizada en segmentos favorables (comprendidos entre II a VI), y que las resecciones de segmentos I, VII y VIII y HM quedan «reservadas a cirujanos con experiencia y dominio de resecciones laparoscópicas más limitadas»35. Sin embargo, en nuestra experiencia logramos estos hitos al principio de la curva de aprendizaje. Nuestra primera RHL de segmentos posteriores se realizó después de 15 RHL, la primera hepatectomía derecha después del 29 y nuestra primera hepatectomía izquierda después de 41 RHL.
Una de las preocupaciones de la declaración de Louisville fue la posibilidad de que la laparoscopia incrementase la indicación de resección en lesiones benignas. Nuestra serie es partícipe de ese principio, ya que solo el 13% de las resecciones se realizaron por lesiones benignas, algunas diagnosticadas preoperatoriamente como malignas.
Cuatro de cada 5de nuestras RHL son menores, lo que es coherente con el ahorro del parénquima36, que es actualmente la política preferida por nuestro equipo en el tratamiento de las MCCR. En nuestra serie, las MCCR representan el 60% de la indicación para RHL y es perfectamente accesible por vía laparoscópica37,38. Sin embargo, en algunos pacientes es necesario realizar hepatectomías derechas e izquierdas regladas. En este escenario, un ensayo aleatorizado demostró la seguridad de un abordaje extraglissoniano18 y nos sentimos muy seguros con esta técnica, incluso para el pinzamiento selectivo en las Hm39,40. También encontramos extremadamente útil este abordaje después de la embolización portal derecha, donde es habitual encontrar importantes cambios inflamatorios en el interior de la vaina glissoniana que dificultan la disección de las estructuras vasculares. En la 8.ª hepatectomía derecha evolucionamos hacia el llamado «abordaje caudal»41: realizamos la movilización hepática después de finalizar la transección del parénquima y de la exposición de la vena cava inferior. En los 2últimos casos se ha utilizado la exposición proximal de la vena hepática media al principio de la transección, tal como describe Honda21 en la seccionectomía anterior derecha y la transección del parénquima desde el plano caudal hacia la superficie. La justificación sería mejorar el margen quirúrgico en casos con lesiones próximas a grandes vasos (es decir, la vena hepática media) y reducir la incidencia de lesiones vasculares complejas, principalmente de afluentes principales de las venas hepáticas. Este abordaje también tendría un beneficio oncológico, al evitar la movilización del hígado, como preconiza Fan en la RHA42. La ecografia intraoperatoria es esencial para definir claramente la anatomía vascular.
Este abordaje «orientado en los vasos» es útil con el fin de ser muy conservador en la cantidad de parénquima resecado. En los casos de proximidad de la lesión a venas hepáticas o pedículos glissonianos, tratamos de garantizar su preservación, asumiendo la posibilidad de resección R1. De hecho, la resección R1 es todavía un tema de debate entre algunos grupos importantes. En la era de la quimioterapia moderna, existe controversia en si existen diferencias en la supervivencia libre de recurrencia y en la global entre los grupos R0 y R1 realizados «por necesidad43–46» y actualmente existen grupos que preconizan los márgenes libres siempre47,48. Desafortunadamente, dado que 2/3 de nuestros pacientes han sido operados en los 2 últimos años, el seguimiento es escaso y no permite realizar un análisis concluyente de los parámetros oncológicos a largo plazo (supervivencia global y libre de recidiva) en nuestra serie.
El objetivo principal del abordaje laparoscópico es reducir la agresividad de la intervención quirúrgica, que se reflejaría en la reducción de la morbilidad y, consecuentemente, en una menor estancia. Nuestra tasa de morbilidad podría considerarse alta si se compara con otras series49-52. Sin embargo, nuestro riguroso método, que ha registrado prospectivamente todas las complicaciones médicas y quirúrgicas, podría explicar este hecho. Es más, nuestra estancia mediana es comparable, si no menor, a otras series. De hecho, más importante que la validación externa es evaluar nuestros propios resultados de la experiencia previa en las resecciones hepáticas abiertas. Recientemente hemos publicado la comparación de nuestras primeras 50 RHL consecutivas con un grupo bien apareado de 100 RHA realizadas en nuestra unidad durante el mismo período de tiempo. Hemos podido observar una disminución en la tasa de complicaciones, sobre todo infecciosas, y una reducción significativa de la estancia15. En la actualidad, nuestra tasa de morbimortalidad se mantiene en el mismo nivel, después de haber triplicado nuestra experiencia y aumentado la complejidad de los casos tratados por laparoscopia.
La adopción del abordaje laparoscópico para las resecciones hepáticas en nuestro centro se ha logrado a un ritmo elevado, sobre todo en los últimos 5años. Un constante refinamiento de la técnica quirúrgica laparoscópica nos ha permitido aumentar progresivamente la complejidad de los procedimientos, manteniendo una baja morbilidad y estancia hospitalaria. En los últimos 2años, hemos sido capaces de realizar más de la mitad de las hepatectomías por laparoscopia y la limitación actual a la indicación de abordaje laparoscópico sería el colangiocarcinoma hiliar, la necesidad de reconstrucción vascular y la planificación de 4o más resecciones limitadas simultáneas.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de interés.
AgradecimientosLos autores agradecen la revisión crítica del estudio realizada por el Dr. Fernando Rotellar Sastre, cirujano hepatobiliar de la Clínica Universitaria de Navarra.