Evaluar la efectividad de un protocolo para la prevención de la infección de localización quirúrgica (ILQ) en cirugía colorrectal.
Pacientes y métodosEvaluación de 2 cohortes de pacientes intervenidos de colon y recto en un hospital público de tercer nivel: una cohorte histórica (2008-2011) y otra prospectiva (posterior a la implementación del programa en 2012). Las principales medidas establecidas fueron: adecuación de la profilaxis antimicrobiana prequirúrgica, mantenimiento de la normotermia del paciente en el quirófano y adecuación del cambio de guante durante la intervención. Se determinó la comparabilidad de ambas cohortes mediante un análisis bivariable de la edad, sexo, factores e índices de riesgo (índice NNIS, índice ASA, tiempos quirúrgicos, transfusión periquirúrgica, diagnóstico, diabetes, insuficiencia renal).
ResultadosSe evaluó a 342 pacientes (256 intervenidos de colon y 86 de recto), distribuidos en 2 cohortes: periodo previo (218) y periodo postimplementación del programa (124). La incidencia acumulada de ILQ de la primera cohorte fue del 27,5% (IC 95% = 21,6-33,4), y de la cohorte postintervención 16,9% (IC 95%=10,3-23,5; p=0,03). La mortalidad postoperatoria fue del 9,2% (IC 95%=5,4-13) en la primera cohorte y del 3,2% (IC 95%=0,1-6,3) en la cohorte postintervención (p=0,04). La administración inadecuada de la profilaxis disminuyó del 37,4% (IC 95%=30,4-44,6) al 18,9% (IC 95% = 11,9-26,1; p=0,001).
ConclusionesTras la implementación de un protocolo para la prevención de la infección quirúrgica en cirugía colorrectal se verifica una disminución significativa de la frecuencia de ILQ, de la mortalidad posquirúrgica y de la profilaxis antimicrobiana inadecuada.
To assess the effectiveness of a protocol for prevention of surgical site infection (SSI) in colorectal surgery.
Patients and methodsEvaluation of 2 cohorts of patients undergoing colon and rectal surgery in a tertiary public hospital: A historical cohort (2008-2011) and a prospective one (after the implementation of the program in 2012). The main measures established were: Adequacy of preoperative antimicrobial prophylaxis, maintaining patient normothermia and appropriate glove change during the intervention. Comparability of the two cohorts was determined by a bivariate analysis of age, sex, NNIS index, ASA index, surgical time, perioperative transfusion, diagnosis, diabetes and renal failure.
ResultsWe assessed 342 patients (256 underwent colon surgery and 86 rectal surgery), divided into 2 cohorts: prior period (218), and post-implementation period (124). The cumulative incidence of SSI in the first cohort was 27.5% (95% CI, 21.6- 33.4), and in the post-intervention cohort 16.9% (95% CI, 10.3-23.5, P=.03). Postoperative mortality was 9.2% (95% CI, 5.4-13) in the first cohort and 3.2% (95% CI, 0.1-6.3) in the post-intervention cohort (P=.04). The inadequacy of prophylaxis decreased from 37.4% (95% CI, 30.4-44.6) to 18.9% (95% CI, 11.9- 26.1) (P=.001).
ConclusionA significant decrease in the frequency of SSI, post-surgical mortality and inadequate antimicrobial prophylaxis is verified after the implementation of a protocol in colorectal surgery
A pesar de las mejoras de las técnicas quirúrgicas surgidas en los últimos años, las infecciones de localización quirúrgica (ILQ) continúan siendo una complicación frecuente. Se estima que algo más del 5% de los pacientes tratados mediante cualquier cirugía sufrirán una ILQ1,2.
Dentro de este tipo de infección, las tasas más altas las presenta la cirugía colorrectal, aunque en la literatura encontramos una amplia variabilidad. Por ejemplo, en un estudio realizado en Inglaterra con seguimiento tras el alta hospitalaria a los 30 días de pacientes tratados mediante cirugía colorrectal3, se registró una incidencia de ILQ del 27%; otro estudio multicéntrico realizado en 140 hospitales ingleses en el que se evaluaron 6.528 procedimientos quirúrgicos de colon4 muestra una incidencia de ILQ del 10% (IC 95% = 9,3-10,8), siendo el 40,6% infecciones de órgano/espacio.
Sin embargo, existen estudios en cirugía de colon y recto que han demostrado que determinadas iniciativas pueden tener un impacto positivo para hacer frente a este problema. Por ejemplo, Hedrick et al.5 implementaron un protocolo multidisciplinar basado en 4 actuaciones: administración adecuada de la profilaxis, evitar prolongar la profilaxis más de 24h, registro y mantenimiento de la normotermia del paciente y control perioperatorio de la glucemia (< 200mg/dL). Con esta intervención lograron un importante descenso de la incidencia de ILQ (de un 25,6 previo a un 15,9% [p<0,05]). Otro ejemplo lo tenemos en la publicación de Forbes et al.6 que realizaron un estudio prospectivo sobre 2 cohortes preintervención y postintervención de pacientes de cirugía colorrectal y hepatobiliar. La intervención consistió en la implementación de una guía de práctica clínica (GPC) para la prevención de ILQ. Evaluaron la adherencia de los profesionales a la GPC y las tasas de ILQ, y lograron un descenso de la incidencia de ILQ de un 14,3 a un 8,7% (p=0,21).
Además de estos ejemplos, diversas publicaciones han demostrado que una monitorización de los procedimientos quirúrgicos, basada en el conocimiento de los resultados (feedback) por los cirujanos, puede disminuir de manera significativa las tasas de infección7–10.
El objetivo de este estudio ha sido valorar el impacto de un programa de mejora de la ILQ en cirugía de colon y recto sobre la frecuencia de infección quirúrgica, las complicaciones derivadas de la misma y la estancia media hospitalaria después de un año y medio de su implementación.
Pacientes y métodosPoblación de estudioEstudio cuasiexperimental, que compara una cohorte prospectiva (postimplementación del protocolo) con una cohorte histórica. La cohorte histórica consta de 218 pacientes, intervenidos en 2 periodos (primer semestre de 2008 y primer semestre de 2011). La cohorte postimplementación del protocolo consta de 124 pacientes, intervenidos en el segundo semestre de 2012.
Este estudio se llevó a cabo en el Servicio de Cirugía General del Hospital Universitario La Paz de Madrid (HULP) que realiza unas 3.000 intervenciones con ingreso al año y está dividido en secciones por especialidad. Se incluyó a pacientes ingresados más de 48 h en el Servicio de Cirugía General del HULP y tratados mediante cirugía mayor de colon y recto. Los pacientes con estancias inferiores a 48 h fueron excluidos del estudio.
Se realizó un muestreo no probabilístico, por conveniencia, y se recogió a todos los pacientes que cumplieron los criterios de inclusión en los periodos de tiempo previamente definidos. El proyecto de evaluación fue aprobado por el CEIC del hospital.
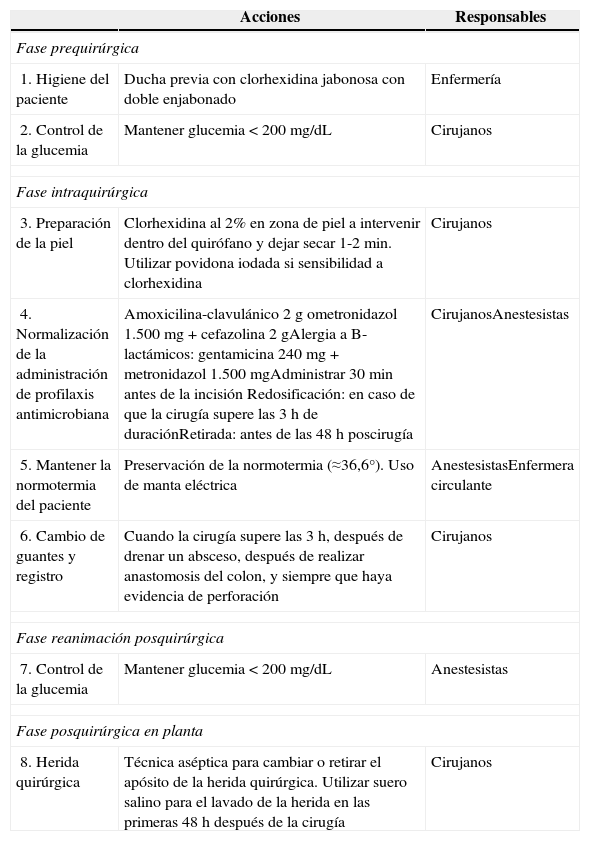
ProtocoloLa tabla 1 muestra el protocolo de prevención de infección de localización quirúrgica en cirugía colorrectal. Para su realización se revisaron las principales guías de práctica clínica:
Protocolo de prevención de infección de localización quirúrgica en cirugía colorrectal
| Acciones | Responsables | |
|---|---|---|
| Fase prequirúrgica | ||
| 1. Higiene del paciente | Ducha previa con clorhexidina jabonosa con doble enjabonado | Enfermería |
| 2. Control de la glucemia | Mantener glucemia<200mg/dL | Cirujanos |
| Fase intraquirúrgica | ||
| 3. Preparación de la piel | Clorhexidina al 2% en zona de piel a intervenir dentro del quirófano y dejar secar 1-2min. Utilizar povidona iodada si sensibilidad a clorhexidina | Cirujanos |
| 4. Normalización de la administración de profilaxis antimicrobiana | Amoxicilina-clavulánico 2g ometronidazol 1.500 mg+cefazolina 2gAlergia a B-lactámicos: gentamicina 240 mg+metronidazol 1.500mgAdministrar 30min antes de la incisión Redosificación: en caso de que la cirugía supere las 3h de duraciónRetirada: antes de las 48h poscirugía | CirujanosAnestesistas |
| 5. Mantener la normotermia del paciente | Preservación de la normotermia (≈36,6°). Uso de manta eléctrica | AnestesistasEnfermera circulante |
| 6. Cambio de guantes y registro | Cuando la cirugía supere las 3h, después de drenar un absceso, después de realizar anastomosis del colon, y siempre que haya evidencia de perforación | Cirujanos |
| Fase reanimación posquirúrgica | ||
| 7. Control de la glucemia | Mantener glucemia<200mg/dL | Anestesistas |
| Fase posquirúrgica en planta | ||
| 8. Herida quirúrgica | Técnica aséptica para cambiar o retirar el apósito de la herida quirúrgica. Utilizar suero salino para el lavado de la herida en las primeras 48 h después de la cirugía | Cirujanos |
- a.
Ducha antiséptica. Está recomendada en algunas guías, si bien algunos autores consideran insuficiente la evidencia frente a la ducha con jabón normal. En la mayoría se recomienda ducha con jabón, o con jabón con clorhexidina el mismo día de la intervención11.
- b.
Preparación del campo quirúrgico: la evidencia actual se decanta por una preparación prequirúrgica de la piel con clorhexidina o soluciones de clorhexidina alcohólica como la clorhexidina 2% en alcohol isopropílico. Es importante dejar tiempo para actuar (al menos 1 minuto) y dejar secar al aire12.
La profilaxis antimicrobiana quirúrgica consiste en la administración, preferiblemente única, de al menos un antibiótico, previamente a la intervención con el fin de reducir la contaminación microbiana intraoperatoria de forma que no supere los mecanismos de defensa del paciente. La vía intravenosa es la vía más frecuente. La administración debe realizarse de 30 a 60 min antes de la incisión y en dosis suficientes para que el antimicrobiano iguale o supere la concentración mínima inhibitoria del microorganismo. Dichos niveles se deben mantener durante toda la intervención y hasta algunas horas después, por lo que los procedimientos prolongados pueden requerir dosis adicionales. En el caso de la cirugía de colon y recto, la profilaxis debe administrarse siempre, pues es una cirugía como mínimo, contaminada13.
En algunos casos, será cirugía sucia, es decir, infectada, por lo que la administración de antibiótico sería pautada como terapia empírica. Este sería el caso, por ejemplo, de una perforación de colon con peritonitis asociada.
La cirugía de colon y de recto requiere asociaciones que cubran los microorganismos más frecuentes: bacilos gramnegativos y anaerobios. En nuestro protocolo, hemos tenido en cuenta las guías locales e internacionales14.
Los antibióticos por vía oral no se recomiendan en las guías actuales, ya que no aportan mejores resultados y pueden asociarse a vómitos y dolor abdominal15,16.
Control de la glucemia pre- y posquirúrgicaEstudios de cirugía cardiovascular demostraron que el mantenimiento de niveles perioperatorios de glucosa <200mg/dL se traducía en una menor incidencia de ILQ que en los pacientes controles17,18.
Sin embargo, el control estricto de la glucemia no se recomienda como una práctica quirúrgica habitual en las GPC actuales, por el riesgo de hipoglucemia11. En nuestro caso se recomienda mantener una glucemia <200mg/dL en las 24 h previas y posteriores a la cirugía.
Cambio de guantesEl cambio de guantes siempre que la cirugía supere las 3h, después de drenar un absceso, después de realizar anastomosis del colon y siempre que haya evidencia de perforación, son medidas propuestas por estudios observacionales19–21.
Partecke et al.19 demuestran que a partir de los 91-150min, en el 18,1% de los casos estudiados, al menos uno de los guantes estaba perforado. A partir de los 150min, este porcentaje ascendía al 23,7%. De todos los guantes perforados, el 66,7% eran de la mano no dominante, y la microperforación se halló con mayor frecuencia en el dedo índice de esta mano. Las cirugías mayores abdominales, cirugías vasculares y cardiacas fueron en las que más perforaciones se encontraron19. Por otra parte, Misteli et al. demostraron que la perforación del guante quirúrgico aumenta el riesgo de ILQ21.
Mantenimiento de la normotermia del paciente en el quirófanoLa hipotermia genera vasoconstricción, disminuye el oxígeno tisular y puede disminuir la respuesta inmune. Varios estudios han demostrado una disminución en la incidencia de ILQ en pacientes en los que se controla la normotermia durante la intervención y en el periodo posquirúrgico22–24.
Esta medida está recomendada actualmente en varias GPC11,25.
Por último, cabe comentar que otras intervenciones que se realizaban hace años, como la preparación mecánica del colon, han sido descartadas por la evidencia actual, ya que existen estudios que demuestran que esta no disminuye la concentración de microorganismos fecales en la luz del colon y además puede trasformar las heces sólidas en líquidas, lo que podría facilitar el flujo de bacterias hacia la herida y hacia la cavidad peritoneal26,27.
En la actualidad, la preparación mecánica del colon está contraindicada como medida rutinaria28.
Implementación del protocolo y variables independientes y de resultadoEl protocolo fue presentado en 2 sesiones clínicas del Servicio de Anestesia y de la Sección de Cirugía Colorrectal. Se recogieron variables demográficas, clínicas, epidemiológicas, microbiológicas y variables relacionadas con el cumplimiento del protocolo. Para el diagnóstico de infección se siguieron los criterios del CDC29.
Análisis estadísticoLas variables cuantitativas se describen como media, mediana y desviación estándar (DE). Las variables cualitativas, mediante frecuencias absolutas y relativas. Las comparaciones entre variables cuantitativas se realizaron mediante el test de Mann-Whitney. Para comparaciones entre variables cualitativas se utilizó el test de la Chi-cuadrado o el test de Fisher. El análisis se realizó mediante el programa PASW Statistics 18.
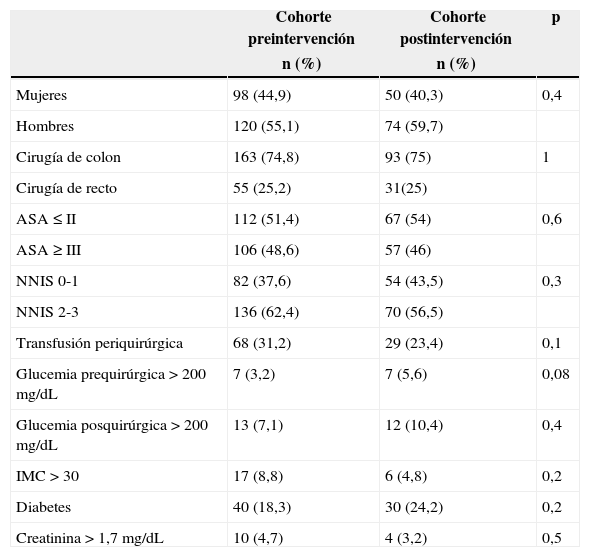
ResultadosSe evaluó a un total de 342 pacientes intervenidos de colon (256) y recto (86), divididos en 2 cohortes: una basal de 218 pacientes (años 2008-2011) y otra posterior a la implementación del programa (año 2012) de 124. El estudio descriptivo de las principales variables de ambas cohortes y la comparación entre ellas se presenta en la tabla 2. Como puede observarse, no existen diferencias estadísticamente significativas entre ambas cohortes.
Estudio bivariable de comparabilidad basal de ambas cohortes
| Cohorte preintervención | Cohorte postintervención | p | |
|---|---|---|---|
| n (%) | n (%) | ||
| Mujeres | 98 (44,9) | 50 (40,3) | 0,4 |
| Hombres | 120 (55,1) | 74 (59,7) | |
| Cirugía de colon | 163 (74,8) | 93 (75) | 1 |
| Cirugía de recto | 55 (25,2) | 31(25) | |
| ASA ≤ II | 112 (51,4) | 67 (54) | 0,6 |
| ASA ≥ III | 106 (48,6) | 57 (46) | |
| NNIS 0-1 | 82 (37,6) | 54 (43,5) | 0,3 |
| NNIS 2-3 | 136 (62,4) | 70 (56,5) | |
| Transfusión periquirúrgica | 68 (31,2) | 29 (23,4) | 0,1 |
| Glucemia prequirúrgica>200mg/dL | 7 (3,2) | 7 (5,6) | 0,08 |
| Glucemia posquirúrgica>200mg/dL | 13 (7,1) | 12 (10,4) | 0,4 |
| IMC>30 | 17 (8,8) | 6 (4,8) | 0,2 |
| Diabetes | 40 (18,3) | 30 (24,2) | 0,2 |
| Creatinina>1,7mg/dL | 10 (4,7) | 4 (3,2) | 0,5 |
| Media (DE) | Media (DE) | ||
|---|---|---|---|
| Edad | 68,3 (13,1) | 69,7 (13,1) | 0,3 |
| Tiempo quirúrgico | 172,3 (68,3) | 180,4 (62,8) | 0,2 |
DE: desviación estándar; IMC: índice de masa corporal; NNIS: National Nosocomial Infection System.
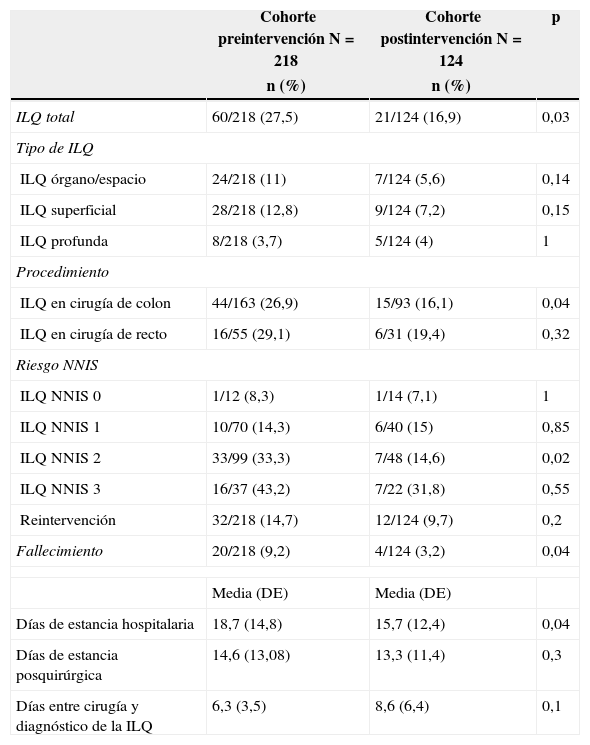
La tabla 3 muestra las incidencias acumuladas de ILQ total y según la localización de la misma, para todos los pacientes y por procedimiento. El resultado principal, la incidencia de ILQ total, desciende de manera significativa tras la implementación del protocolo. En el caso de ILQ de órgano/espacio, la incidencia desciende, si bien no de forma estadísticamente significativa.
Principales variables de resultado obtenidas al comparar ambas cohortes
| Cohorte preintervención N=218 | Cohorte postintervención N=124 | p | |
|---|---|---|---|
| n (%) | n (%) | ||
| ILQ total | 60/218 (27,5) | 21/124 (16,9) | 0,03 |
| Tipo de ILQ | |||
| ILQ órgano/espacio | 24/218 (11) | 7/124 (5,6) | 0,14 |
| ILQ superficial | 28/218 (12,8) | 9/124 (7,2) | 0,15 |
| ILQ profunda | 8/218 (3,7) | 5/124 (4) | 1 |
| Procedimiento | |||
| ILQ en cirugía de colon | 44/163 (26,9) | 15/93 (16,1) | 0,04 |
| ILQ en cirugía de recto | 16/55 (29,1) | 6/31 (19,4) | 0,32 |
| Riesgo NNIS | |||
| ILQ NNIS 0 | 1/12 (8,3) | 1/14 (7,1) | 1 |
| ILQ NNIS 1 | 10/70 (14,3) | 6/40 (15) | 0,85 |
| ILQ NNIS 2 | 33/99 (33,3) | 7/48 (14,6) | 0,02 |
| ILQ NNIS 3 | 16/37 (43,2) | 7/22 (31,8) | 0,55 |
| Reintervención | 32/218 (14,7) | 12/124 (9,7) | 0,2 |
| Fallecimiento | 20/218 (9,2) | 4/124 (3,2) | 0,04 |
| Media (DE) | Media (DE) | ||
| Días de estancia hospitalaria | 18,7 (14,8) | 15,7 (12,4) | 0,04 |
| Días de estancia posquirúrgica | 14,6 (13,08) | 13,3 (11,4) | 0,3 |
| Días entre cirugía y diagnóstico de la ILQ | 6,3 (3,5) | 8,6 (6,4) | 0,1 |
DE: desviación estándar; ILQ: infección de localización quirúrgica; NNIS: National Nosocomial Infection System;
La mortalidad postoperatoria disminuyó también de forma estadísticamente significativa. En el análisis multivariante, realizado posteriormente mediante un modelo de regresión logística binaria, la existencia previa de una ILQ se identificó como factor predictivo independiente de riesgo de mortalidad postoperatoria (OR: 2,80; IC 95%: 1,02-7,63; p = 0,04).
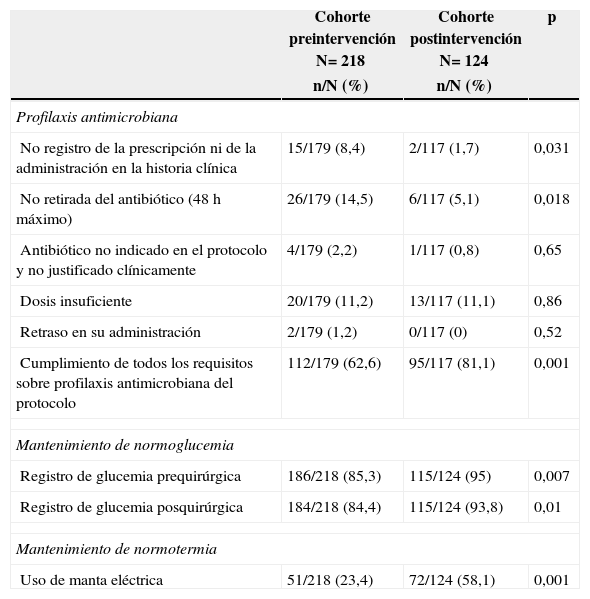
Por último, los resultados de la evaluación de la adherencia al protocolo se muestran en la tabla 4.
Evaluación de la adherencia al protocolo
| Cohorte preintervención N= 218 | Cohorte postintervención N= 124 | p | |
|---|---|---|---|
| n/N (%) | n/N (%) | ||
| Profilaxis antimicrobiana | |||
| No registro de la prescripción ni de la administración en la historia clínica | 15/179 (8,4) | 2/117 (1,7) | 0,031 |
| No retirada del antibiótico (48h máximo) | 26/179 (14,5) | 6/117 (5,1) | 0,018 |
| Antibiótico no indicado en el protocolo y no justificado clínicamente | 4/179 (2,2) | 1/117 (0,8) | 0,65 |
| Dosis insuficiente | 20/179 (11,2) | 13/117 (11,1) | 0,86 |
| Retraso en su administración | 2/179 (1,2) | 0/117 (0) | 0,52 |
| Cumplimiento de todos los requisitos sobre profilaxis antimicrobiana del protocolo | 112/179 (62,6) | 95/117 (81,1) | 0,001 |
| Mantenimiento de normoglucemia | |||
| Registro de glucemia prequirúrgica | 186/218 (85,3) | 115/124 (95) | 0,007 |
| Registro de glucemia posquirúrgica | 184/218 (84,4) | 115/124 (93,8) | 0,01 |
| Mantenimiento de normotermia | |||
| Uso de manta eléctrica | 51/218 (23,4) | 72/124 (58,1) | 0,001 |
La implementación en nuestro hospital de un protocolo para la prevención de ILQ ha logrado un descenso del 27,5 al 16,9% de la frecuencia total de la misma, descenso similar al descrito por otros autores5,30–33.
Por ejemplo, Hendrick et al.5 logran una disminución de la ILQ en cirugía colorrectal de un 25,6 a un 15,9% (p<0,05) tras la implementación de un protocolo multidisciplinar, con aumento en el porcentaje de profilaxis administrada de forma adecuada desde un 68 hasta un 91% (p<0,001), entre otras medidas. También destaca el trabajo de Wick et al.32 que demuestra una disminución de la ILQ en cirugía colorrectal del 33,3% a los 12 meses de implementar un programa basado en la higiene prequirúrgica del paciente con clorhexidina, la estandarización de la preparación quirúrgica de la piel, el mantenimiento de la normotermia del paciente y la administración adecuada de la profilaxis antibiótica.
En nuestro caso, las medidas del protocolo se implementaron también en forma de care bundle, es decir, medidas sencillas, que deben realizarse en conjunto, y que se potencian de esta manera. Una de las medidas fue la protocolización de la profilaxis antibiótica. La efectividad de esta en procesos quirúrgicos fue demostrada hace tiempo y es, por lo tanto, una medida aplicada en los hospitales de nuestro entorno. No obstante, su adecuación en todos los parámetros (tipo de antimicrobiano, momento de administración y momento de retirada) no es uniforme en todos los centros, e incluso dentro de un mismo hospital puede diferir entre servicios o entre profesionales. Nosotros consideramos que no era admisible una variabilidad no justificada, y fuimos muy exigentes al considerar como «no adecuada» una profilaxis por no cumplir con el protocolo en todos los parámetros propuestos.
Además de los resultados positivos sobre infección, nuestro estudio demuestra una disminución significativa de la mortalidad posquirúrgica. El que ambos resultados hayan ido de la mano no es de extrañar, pues hay publicaciones que lo demostraban previamente19,31: destacamos la publicación de Crolla et al.31, que determina una disminución similar a la nuestra en ILQ, estancia media y mortalidad tras la implementación de un bundle. Por nuestra parte, como mostramos en el apartado de resultados, realizamos un estudio de factores de riesgo para la mortalidad posquirúrgica con todos los pacientes evaluados y tanto la aparición de una ILQ de cualquier tipo como la ILQ de órgano/espacio demostraron ser factores de riesgo independientes. Respecto a la estancia hospitalaria, en nuestro estudio, también disminuyó en el grupo postintervención una media de 3 días.
La adherencia al protocolo se ha evaluado mediante una serie de variables relacionadas con el cumplimiento de las principales medidas. Como se observa en la tabla 4, la mayoría de los ítems mejoran de forma significativa. No obstante, no se pudieron evaluar todas las medidas; por ejemplo, no se pudo registrar la temperatura durante la intervención, aunque sí se registró de forma satisfactoria la utilización de manta eléctrica. Tampoco logramos que se registrase el cambio de guante, por lo que desconocemos la adherencia a esta medida y no podemos cuantificar su impacto en los resultados finales.
Sobre la adherencia al protocolo, cabe comentar, por último, que la principal ventaja con la que hemos contado es que las medidas no han requerido gastos y la mayoría estaban ya parcialmente implantadas, por lo que su sistematización no ha supuesto ningún tipo de reorganización extra.
Para terminar con la discusión de resultados, debemos comentar que existen estudios en los que los autores no han determinado mejoras en las tasas de ILQ tras implementar medidas similares. Respecto a datos de nuestro entorno, destaca la publicación de un estudio multicéntrico realizado en 19 hospitales de Cataluña. Los autores registran una incidencia de ILQ en cirugías de cáncer de colon del 23,2% (IC 95%: 18,9-27,6), que no varía tras aplicar un bundle de medidas de prevención34.
Respecto a las limitaciones del estudio, debemos destacar que, debido al diseño de la evaluación de resultados, en la que se comparan pacientes de unos años antes, no podemos afirmar que estos resultados se hayan debido únicamente al protocolo, ya que pueden existir otros factores no controlados que hayan contribuido a ello. Por ejemplo, la experiencia de cada cirujano o las mejoras técnicas que hayan sucedido a lo largo de los años son factores difícilmente controlables. La mejoría con el tiempo del conocimiento de factores asociados a la ILQ o, en nuestro caso, la especialización al reorganizarse el Servicio de Cirugía General en secciones, son otros factores que han podido influir en los resultados.
También habría que señalar que, aunque la cohorte de control o histórica fue recogida en su día de forma prospectiva, algunas variables se recogieron de forma retrospectiva para la evaluación. Esto implica que algunos datos no se han podido recoger en todos los pacientes, por ejemplo, la altura y el peso del paciente para calcular el IMC.
Otra limitación que tendríamos que tener en cuenta es el «sesgo de observación», pues tras implementar el protocolo y las sesiones clínicas que se dieron en los servicios, los profesionales sabían que, con alta probabilidad, iban a ser auditados, pues nos habíamos comprometido a la retroalimentación de resultados al menos 2 veces al año.
No obstante, y a pesar de las limitaciones metodológicas comentadas, creemos que la implementación de recomendaciones basadas en la evidencia, sencillas y factibles, acompañadas de un liderazgo sólido de los responsables clínicos implicados, son herramientas útiles para la mejora de la seguridad del paciente quirúrgico, y así lo demostramos a nivel local. Nos apoyamos para realizar esta afirmación en el análisis presentado, en el que se verifica una disminución significativa de la frecuencia de ILQ, de mortalidad posquirúrgica y de inadecuación de la profilaxis antimicrobiana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.