Introducción
El mejor abordaje para el tratamiento del cáncer de esófago sigue siendo controvertido, aunque las 2 vías más usadas son la transtorácica y la transhiatal. La primera permite realizar mejor la lifadenectomía y asegura una mejor hemostasia de la zona, mientras que la segunda puede disminuir la aparición de complicaciones respiratorias. La esofagectomía por una enfermedad benigna
o maligna sigue estando asociada a unas cifras importantes de morbilidad y mortalidad.
La cirugía videoasistida ha sido uno de los mayores avances registrados en los últimos tiempos. Su amplia y rápida expansión ha permitido que, en la actualidad, la mayoría de las intervenciones puedan realizarse mediante esta técnica. No obstante, está por demostrar en muchos casos la eficiencia y efectividad real de estos procedimientos1 .
Presentamos la técnica quirúrgica y los primeros resultados obtenidos en nuestra unidad de cirugía esofagogástrica tras la introducción de la cirugía videoasistida en los protocolos de tratamiento de cáncer de esófago.
Pacientes y método
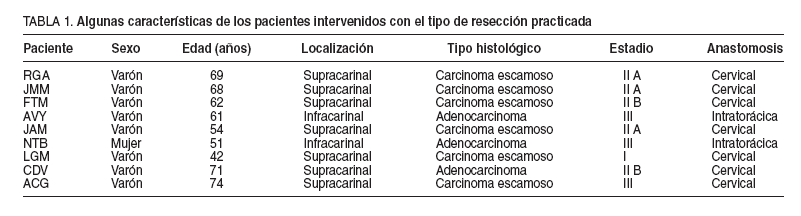
En noviembre de 2002 introdujimos el uso de la laparoscopia en el protocolo de actuación quirúrgica del cáncer de esófago en nuestra unidad. El número de pacientes sometidos a este nuevo procedimiento ha sido de 12 sobre un total de 20 enfermos intervenidos por cáncer de esófago. Los criterios seguidos para la inclusión de pacientes en este grupo han seguido razones de tipo oncológico (tumores no exteriorizados, sin invasión de estructuras vecinas, etc.) y anatómico (evitar pacientes con obesidad). En 3 (25%), pacientes todos ellos del período inicial de nuestra experiencia, se ha procedido a una reconversión temprana de la cirugía laparoscópica debido a dificultades técnicas (cirugía abdominal previa). En los 9 restantes (tabla 1), se ha sustituido por completo el tiempo abdominal realizado a través de una laparotomía convencional por una técnica exclusivamente laparoscópica. El estudio histológico de los tumores resecados ha mostrado un carcinoma escamoso en 6 pacientes y un adenocarcinoma en otros 3.
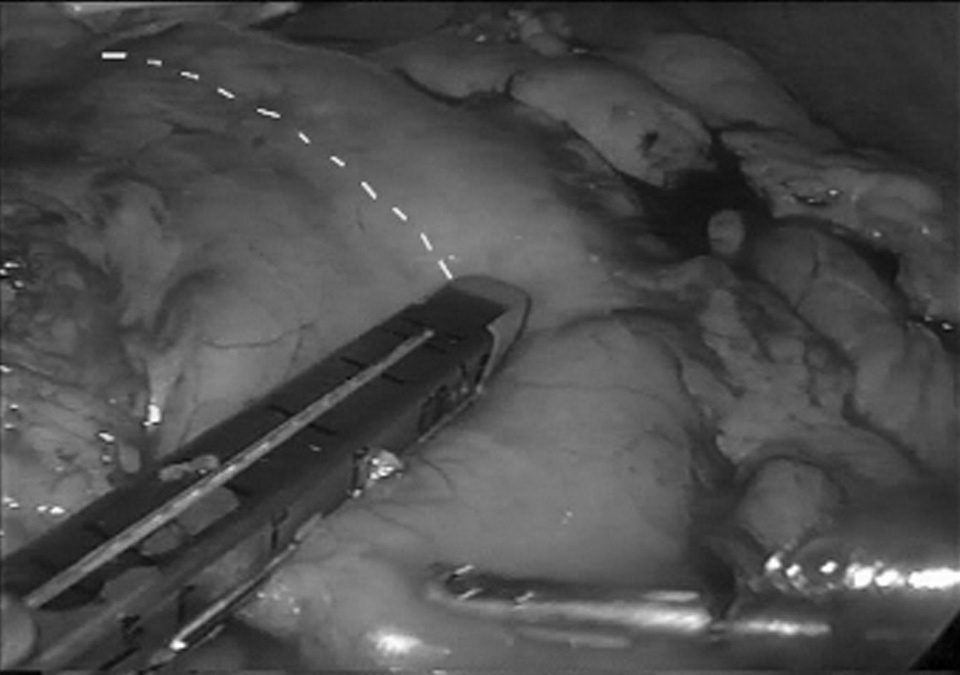
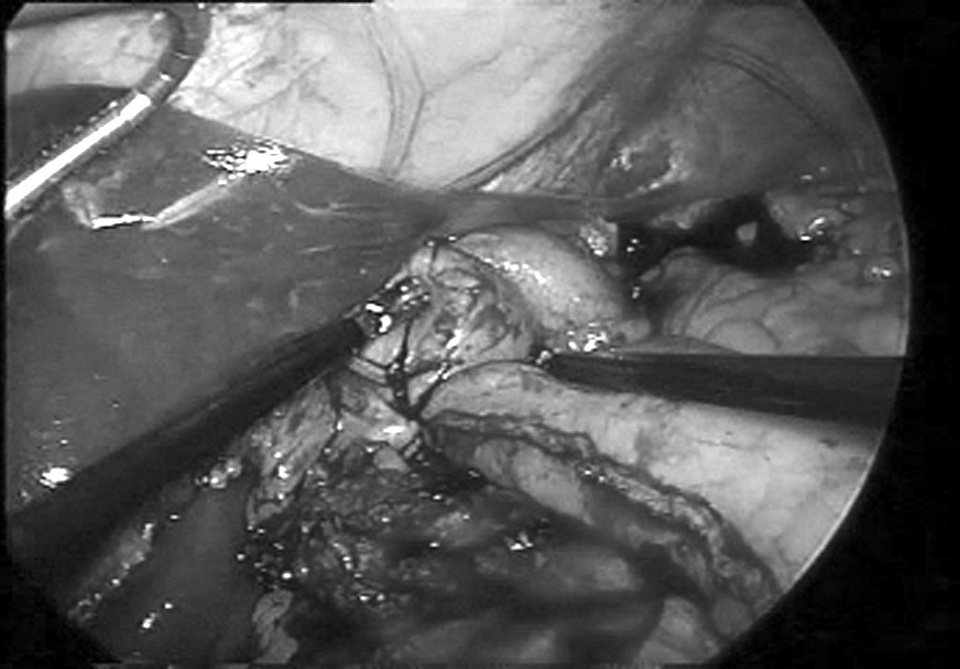
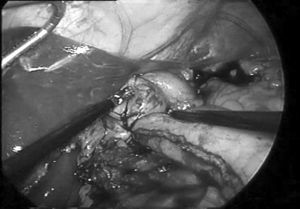
En los 7 pacientes con la tumoración en una localización torácica alta –a la altura de la carina traqueal o por encima– se ha efectuado una cirugía en 3 tiempos. En un primer momento se realiza una toracotomía derecha por el quinto espacio intercostal con abordaje del mediastino posterior y sección del cayado de la vena ácigos. Se diseca completamente el esófago torácico con una linfadenectomía estándar y con posterioridad se cierra el tórax para colocar al paciente en decúbito supino. El siguiente paso es la realización de una laparoscopia con 5 trocares supraumbilicales. Se sigue un procedimiento sistemático que se inicia con la movilización duodenal hasta hacer visible la vena cava inferior. A continuación se libera la curvatura mayor gástrica mediante una sección del ligamento gastroesplénico, respetando la arteria gastroepiploica derecha y todo el arco vascular que nutrirá el futuro tubular gástrico. Se seccionan la arteria gastroepiploica izquierda y los vasos cortos gastroesplénicos. Se disecan la región hiatal hasta hacer evidentes los pilares diafragmáticos y el esófago abdominal. Posteriormente se levanta el estómago para proceder a la disección de los vasos gástricos izquierdos, que se seccionan en su origen. Por último, se escoge un punto en la curvatura menor gástrica, unos 5 cm por encima del píloro, para seccionar la arcada vascular y, con la ayuda de la sutura mecánica (endoghia con carga azul), se elabora el tubular gástrico siguiendo una línea paralela a la curvatura mayor (fig. 1). No se llega hasta la zona más alta, sino que se finaliza 4 o 5 cm por debajo del cardias. La última maniobra abdominal será la sección, con un bisturí armónico, de los pilares diafragmáticos y del diafragma yuxtapericárdico para permitir el fácil ascenso de la plastia (fig. 2). De manera simultánea, un segundo equipo quirúrgico efectúa una cervicotomía lateral izquierda y, por ella, diseca el esófago cervical para seccionarlo. Con una suave tracción se va extrayendo la pieza a la vez que, bajo supervisión laparoscópica, se observa el ascenso de la plastia gástrica hasta que se aloja en el mediastino posterior, asomando su extremo proximal por el cuello. Entonces se completa la sección del tubular y se anastomosa al cabo esofágico.
Fig. 1. Confección del tubular gástrico.
Fig. 2. Ascenso de la plastia.
En los 2 pacientes en que la tumoración se ha situado en una localización más baja –a una altura inferior a la de la carina traqueal–, el procedimiento ha sido diferente. En un primer tiempo se realiza una laparoscopia siguiendo los mismos pasos descritos para los de localización alta. Una vez se ha finalizado la confección del tubular gástrico y se ha seccionado el diafragma, se pone fin a la laparoscopia y se coloca al paciente en decúbito lateral para proceder a una toracotomía derecha en el quinto espacio intercostal. En esta fase torácica se diseca el esófago tumoral y se completa la linfadenectomía mediastínica. Mediante una tracción suave del cabo distal, se hace ascender la plastia realizada por laparoscopia para efectuar una anastomosis esofagogástrica intrapleural alta con sutura manual o mecánica. La presencia de metástasis hepáticas o carcinomatosis no apreciada antes de la intervención frenaría la cirugía en la fase abdominal en tumores de localización infracarinal (antes de pasar a la toracotomía). La presencia de un tumor irresecable local en la fase torácica de un tumor infracarinal (tras la laparoscopia) no se ha dado nunca. Se efectúan 2 estadificaciones con 2 meses de separación, antes y después del tratamiento neoadyuvante, y se es muy selectivo para no operar tumores con infiltración conocida de otras estructuras mediastínicas.
TABLA 1. Algunas características de los pacientes intervenidos con el tipo de resección practicada
Resultados
Los resultados atribuibles directamente a la nueva vía de acceso empleada (laparoscopia) son aún poco valorables, dado el reducido número de pacientes operados. No obstante, la morbilidad se sitúa en el 38,3%. Disminuye la incidencia de infecciones de la pared abdominal (1 caso), mientras que las fístulas digestivas cervicales (3 casos) y las enfermedades respiratorias (3 casos) mantienen incidencias similares a las de la cirugía abierta. La mortalidad de la serie ha sido nula. La duración media de la intervención se sitúa en un tiempo medio de 4 h y 50 min. En 5 pacientes ha sido preciso transfundir alguna unidad de concentrado de hematíes. Los requerimientos de sangre peroperatoria son de 0,9 unidades/pa-ciente de media y la estancia postoperatoria es de sólo 19 días (rango, 14-24 días). También se constata un descenso en los requerimientos analgésicos postoperatorios al utilizar la vía laparoscópica. Este último parámetro nos ha permitido obviar la colocación del catéter de analgesia peridural que manteníamos en los días iniciales del postoperatorio y utilizar sólo analgesia convencional por vía intravenosa.
Discusión
Las 4 vías más utilizadas para la cirugía esofágica son la transhiatal, la transtorácica (Ibor Lewis), la triincisional y la torácica izquierda para los tumores bajos de esófago. El sustitutivo preferido sigue siendo el estómago por su buena vascularización, fácil llegada al cuello y por requerir una sola anastomosis digestiva para restablecer la continuidad2 . La vía transhiatal fue descrita y popularizada por Orringer3 en un intento de paliar las complicaciones respiratorias propias de la vía transtorácica, pero son varios los autores que no han demostrado diferencias en la morbilidad entre la vía transhiatal y la torácica4,5 .
Los primeros procedimientos de cirugía mínimamente invasiva consistieron en una esofagectomía realizada por toracoscopia combinada con una laparotomía media y anastomosis esofagogástrica cervical6,7 . Posteriormente, otros autores han demostrado la posibilidad técnica de practicar con seguridad una cirugía mínimamente invasiva total. DePaula et al8 y Swanstrom et al9 fueron los primeros en publicar la realización de una esofagectomía transhiatal por vía laparoscópica con una técnica similar a la utilizada por vía abierta. Un poco después, Luketich et al10 comunicaron la realización de una esofagectomía mediante toracoscopia y laparoscopia combinadas, uniendo 2 procedimientos independientes ya realizados por separado.
Un primer paso en la cirugía mínimamente invasiva de esófago era demostrar que era factible, pero eso por sí solo no es suficiente. Un segundo paso importante es saber si comporta beneficios clínicos al paciente. Los escasos autores que a escala mundial han prodigado esta técnica en los pocos años en que se está realizando han comunicado beneficios cuantificables. Hay una disminución de la pérdida hemática media de los pacientes intervenidos por cirugía mínimamente invasiva de unos 300 ml, frente a los 500-600 ml como mínimo de las intervenciones convencionales11,12 . También disminuye la estancia postoperatoria a menos de 11 días en comparación con los 16 días o más de la cirugía convencional13,14 . La morbilidad es similar a la de la cirugía abierta para algunos autores15,16 , en tanto que otros refieren una reducción en las complicaciones postoperatorias17 , pero todos ellos presentan cifras de mortalidad menores que las de las series convencionales. En nuestro caso, la morbilidad global ha descendido hasta el 38,3% en los 9 casos en los que hemos usado la laparoscopia en la fase abdominal del protocolo terapéutico del cáncer de esófago, frente a un 46% en la serie anterior. La mortalidad del grupo previo es del 7,6% y en la reducida serie laparoscópica no se han producido fallecimientos debidos a la cirugía.
Los tiempos operatorios medios de los que realizan toda la intervención por cirugía videoasistida oscilan entre los 51016 y los 350 min17 . Los que realizan la parte abdominal por laparotomía y sólo se ayudan de la cirugía videoasistida en el tórax emplean una media de 110 min en esa fase18 . Nuestra experiencia actual nos permite realizar la intervención completa en un tiempo medio de 290 min, considerando que sólo estamos realizando cirugía videoasistida en la fase abdominal. La utilización de este tipo de abordaje en el abdomen para la cirugía de la neoplasia de esófago es muy útil para la introducción progresiva de la técnica videoasistida en todo el procedimiento quirúrgico. Sus ventajas se multiplican al no precisar incisiones adicionales para la extracción de la pieza operatoria. El índice de reconversiones tiene poco interés cuando se está iniciando un nuevo procedimiento por cirugía laparoscópica, pues en ocasiones sólo pone de manifiesto la prudencia de los equipos quirúrgicos ante un procedimiento que aún no se domina. En fases más avanzadas y con equipos ya formados en la técnica, asumirá un valor real. En nuestra breve experiencia, hemos iniciado en 3 pacientes más la cirugía laparoscópica, que se ha reconvertido en fases precoces por diferentes causas.
El volumen de intervenciones que es preciso realizar para superar el aprendizaje básico de una técnica laparoscópica compleja como ésta es difícil de precisar. No obstante, hay algún grupo que utilizando la cirugía video-asistida únicamente en la fase torácica ha fijado en torno a las 35 intervenciones el período básico de formación19 . Para ello analizan de manera simultánea diferentes factores: curvas de pérdida hemática por intervención, tiempo quirúrgico por procedimiento, número de ganglios extraídos, incidencia de morbilidad postoperatoria, etc.
Un requerimiento básico exigible a este nuevo acceso en una enfermedad tumoral es que no comporte un riesgo oncológico superior al convencional. Los primeros trabajos revisados no aportan dudas razonables a su seguridad17 y sólo esporádicamente se ha descrito algún caso de metástasis en una puerta de entrada20 . En este nuevo procedimiento quirúrgico se deben seguir los mismos principios oncológicos que en el modelo clásico, minimizando la manipulación de la lesión. En la cirugía video-asistida del tórax siempre será necesario utilizar trocares para evitar el contacto directo de los instrumentos con la pared torácica, y se realizará la extracción por la cervicotomía con protección de la zona para evitar el contacto directo de la pieza con los márgenes quirúrgicos 21 .
TABLA 2. Relación de autores que han publicado su experiencia en cirugía videoasistida para la neoplasia de esófago
El beneficio de centralizar el tratamiento de la enfermedad neoplásica de esófago en unidades especializadas de enfermedades esofagogástricas ha quedado patente en múltiples estudios22-25 . Se constata una relación inversa entre el volumen de intervenciones practicadas y la morbilidad asociada a la técnica. En la cirugía mínima-mente invasiva, esta relación aún se hace más evidente. En la tabla 2 se ofrece una relación de la experiencia disponible en la actualidad en la cirugía videoasistida para el cáncer de esófago. Salvo en algún grupo aislado, la experiencia comunicada en la literatura médica está en una fase muy inicial. En nuestro país aún no hay experiencia de grupos con este método de tratamiento.
La selección adecuada de los pacientes candidatos a la resección esofágica, en especial si han recibido tratamiento neoadyuvante, como efectuamos en nuestra unidad, y la utilización de un protocolo sistematizado para la esofagectomía y el control postoperatorio, influyen de manera positiva en los resultados clínicos26 . La cirugía mínimamente invasiva para los tumores de esófago es fácilmente reproducible y está demostrando que aporta seguridad en el procedimiento cuando se realiza en centros con experiencia. No contribuye aún a un sustancial descenso de las cifras de morbilidad y mortalidad, pero mejora otros aspectos (requerimientos de sangre, mejor control analgésico, disminución de estancias, etc.) además de comportar ventajas clínicas (suprime amplias incisiones minimizando la agresión operatoria y favorece su recuperación posterior). Su elevada complejidad técnica requiere una sólida preparación del equipo quirúrgico, un amplio conocimiento de las enfermedades esofagogástricas y una excelente formación en cirugía laparoscópica, por lo que en la actualidad queda limitada a un reducido número de unidades y centros. Faltaría resolver algunas cuestiones de supervivencia a medio y largo plazo tras la sistematización de este tipo de abordaje. Para ello es preciso esperar los resultados de seguimiento en los centros con unidades especializadas que tengan un programa de trabajo en cirugía esofágica videoasistida.
Correspondencia: Dr. J. Roig García. Oriol Martorell, 40, 4. o , 3. a . 17003 Girona. España. Correo electrónico: jroigg@tiscali.es
Recibido el 3-1-2004 y aceptado el 27-7-2004.