El objetivo del estudio es analizar nuestra experiencia en el uso de la biopsia del ganglio centinela (BGC) en el melanoma y determinar la existencia de factores predictores de resultado positivo y de drenaje múltiple.
Material y métodosEstudio retrospectivo y analítico de aquellos pacientes a los que se les realizó BGC por melanoma, en el período entre agosto de 2000 y febrero de 2013.
ResultadosSe incluyó a 125 pacientes con una media de edad de 55,6 (± 15) años. La distribución anatómica de los ganglios centinelas (GC) fue: 44 (35,2%) en miembros inferiores, 24 (19,2%) en miembros superiores, 53 (42,4%) en tronco y 3 (2,4%) en cabeza y cuello. La mediana del índice de Breslow fue de 1,81 (0,45-5). El número de ganglios aislados fue entre 1 y 6, siendo en 98 casos (78,4%) de localización única y en 27 (21,6%) múltiple, de los que 25 (92,6%) se localizaron en el tronco. El estudio definitivo de la BGC fue positivo en 18 casos (7,1%), siendo el factor predictivo relacionado el espesor tumoral (p = 0,01).
ConclusionesLa BGC seleccionó de forma adecuada a los candidatos a linfadenectomía. El melanoma de tronco fue la principal localización de drenaje múltiple. El único factor predictor de resultado positivo del GC fue el espesor tumoral.
The objective of this study is to analyze our experience in the use of sentinel node biopsy (SNB) in melanoma and identify the predictive factors of positive SNB and multiple drainage.
Material and methodsRetrospective study of patients who underwent SNB for melanoma between August of 2000 and February of 2013.
ResultsSNB was performed in 125 patients with a median of age of 55,6 (±15) years. The anatomic distribution was: 44 (35,2%) in legs, 24 (19,2%) in arms, 53 (42,4%) trunk and 3 (2,4%) in head and neck. The median Breslow index was 1,81 (0,45-5). Between 1 and 6 nodes were isolated. The drainage was unique in 98 (78,4%) and multiple in 27 (21,6%). The trunk was the localization of 25 (92,6%) nodes with multiple drainage. The definitive result of sentinel node (SN) was positive in 18 cases (7,1%). Breslow thickness (p=0,01) was statistically significant predictor of a positive SNB.
ConclusionsThe SNB allows patients to be selected for lymphadenectomy. Melanoma of the trunk was the principle location of multiple drainage. The only predictive factor of positive SNB was Breslow thickness.
La incidencia del melanoma ha aumentado de forma rápida en los últimos años. Dado que afecta a personas jóvenes y con una tasa de mortalidad no despreciable, supone un problema de salud pública en el mundo1–3.
En 1992, Morton et al. publicaron el primer trabajo sobre la utilización de la biopsia del ganglio centinela (BGC) en el melanoma. La técnica se basa en la hipótesis de que las metástasis linfáticas siguen una progresión ordenada, secuencial y no aleatoria. Por tanto el estudio del ganglio centinela (GC), primera estación de drenaje linfático, reflejaría de forma segura el estado del resto de los ganglios linfáticos regionales2,4. Es un método, mínimamente invasivo, para identificar a aquellos pacientes con metástasis ganglionares ocultas y evitar la linfadenectomía a un gran número de pacientes sin afectación ganglionar4.
La BGC aporta una importante información para estadificar el tumor, permitiendo detectar micrometástasis5. Está indicada en pacientes con enfermedad localizada (estadios I-II). Los pacientes con un melanoma menor de 0,75mm tienen un riesgo de afectación ganglionar del 1% y no se recomienda la realización de la misma3. Otros autores defienden incluir a pacientes con un espesor < 1mm con factores asociados a mayor riesgo de micrometástasis como son la ulceración del tumor primario, el índice mitótico ≥ 1/mm2 o nivel Clark IV/V5.
La linfogammagrafía ha cambiado el concepto clásico de drenaje linfático de Sappey, que divide la anatomía en 4 cuadrantes mediante 2 líneas perpendiculares que atraviesan el ombligo, las cuales marcan el límite que teóricamente no podía atravesar el drenaje linfático de lesiones situadas en dichos cuadrantes2. La linfogammagrafía preoperatoria ha permitido demostrar gran discordancia entre la localización anatómica y el flujo real del drenaje, sobre todo en el tronco, siendo dicha prueba imprescindible para la correcta localización del GC3.
El objetivo del estudio es analizar nuestra experiencia en el uso de BGC en el melanoma y determinar la existencia de factores predictores de resultado positivo y de drenaje múltiple.
Material y métodosEstudio retrospectivo, analítico, observacional, de aquellos pacientes a los que se les realizó BGC por melanoma en nuestro centro, en el período comprendido entre agosto del 2000 y febrero del 2013. En nuestro centro se realiza la BGC de pacientes derivados de otros centros que carecen de dicha técnica, por lo que en algunos apartados no hemos conseguido el 100% de los datos.
Los datos de los pacientes fueron obtenidos mediante revisión de las historias clínicas. Los criterios de inclusión empleados fueron: estadio Ia con factores de riesgo (satelitosis, invasión vascular, ulceración, Clark IV-V, regresión tumoral > 75% o extirpación incompleta con margen profundo afecto), Ib, IIa, IIb y IIc (si buen estado general). Tras haber descartado afectación ganglionar mediante exploración y, en caso de duda, estudio histológico tras punción. Todos los casos se incluyeron para BGC una vez discutidos en un comité multidisciplinar. En aquellos con metástasis en GC se realizó posteriormente linfadenectomía.
El protocolo de estudio anatomopatológico incluyó BCG diferido, secciones seriadas de 4 μ; en cada nivel se realizaron 4 cortes: 2 para tinción con hematoxilina-eosina (HE) y 2 para inmunohistoquímica (IHQ) proteína S-100 y HMB-45, hasta agotar la muestra.
El estudio linfogammagráfico se realiza con 1,5 mCi de 99mTc-nanocoloide de albúmina, que se inyecta perilesionalmente el día de la intervención. A los 5 min se obtienen imágenes planares en proyecciones anteroposteriores de ingles, abdomen y axilas. En caso de positividad se realiza proyección lateral en ingles y abdomen, y oblicua en las axilas. Se realiza el mismo estudio seriado cada 15 min hasta su positividad. En quirófano se identifica el GC mediante sonda gamma manual.
Las variables analizadas fueron la edad, sexo, antecedentes personales, características del melanoma primario (localización, estudiando la localización BANS de forma independiente (back: parte superior de la espalda, arm: zona posterior de los brazos, neck: parte posterior y lateral del cuello, scalp: zona posterior y superior del cuello cabelludo), espesor tumoral de Breslow y GC.
Los datos fueron analizados mediante el programa informático SPSS versión 15.0 para Windows, empleando para las variables cuantitativas la prueba de Mann-Whitney, para las cualitativas el test de Chi cuadrado, la prueba exacta de Fisher en el análisis univariante y la regresión logística binaria en el multivariante. Se consideró resultado estadísticamente significativo cuando p < 0,05. El cálculo del tamaño muestral necesario para dicho estudio fue de 252 GC a analizar.
ResultadosNuestro estudio incluyó a 125 pacientes con una media de edad de 55,6 ± 15 años, de los que 64 (51,2%) fueron mujeres y 61 (48,8%) hombres. Presentaron algún tipo de comorbilidad 55 (44%), de las que las más frecuentes fueron 35 (28%) hipertensión arterial, 6 (4,8%) diabetes mellitus, 6 (4,8%) cardiopatía, 5 (4%) neumopatía y 2 (1,6%) inmunosupresión activa (corticoterapia crónica).
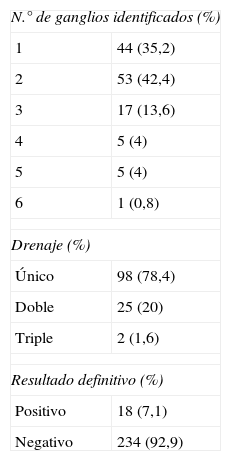
La tabla 1 recoge las características del melanoma. El estadio tumoral de nuestros pacientes se dividió de la siguiente forma: Ia (T1aN0), 19 (15,2%); Ib (T1b-T2aN0) 49 (39,2%); IIa (T2b-T3aN0) 27 (21,6%); IIb (T3b-T4aN0) 17 (13,6%) y IIc (T4bN0) 12 (9,6%). La tabla 2 muestra el estudio de las características del GC.
Características del melanoma
| Tamaño del melanoma (cm) | 1,31 (± 0,6) |
| Tipo de crecimiento (n = 89) (%) | |
| Radial | 10 (8) |
| Vertical | 79 (63,2) |
| Localización (%) | |
| Piel | 124 (99,2) |
| Mucosas | 1 (0,8) |
| Localización cutánea (n = 124) (%) | |
| Miembros inferiores | 44 (35,2) |
| Miembros superiores | 24 (19,2) |
| Tronco | 53 (42,4) |
| Cabeza y cuello | 3 (2,4) |
| Distribución (%) | |
| Glúteo | 6 (4,8) |
| Muslo | 7 (5,6) |
| Pierna | 24 (19,2) |
| Pie | 7 (5,6) |
| Hombro | 8 (6,4) |
| Brazo | 13 (10,4) |
| Antebrazo | 3 (2,4) |
| Pectoral | 6 (4,8) |
| Abdominal | 5 (4) |
| Espalda alta | 31 (24,8) |
| Espalda baja | 8 (6,4) |
| Cara | 3 (2,4) |
| Mama | 3 (2,4) |
| Anorrectal | 1 (0,8) |
| Localización BANS (%) | |
| No | 91 (72,8) |
| Sí | 34 (27,2) |
| Espesor Breslow (mm) | 1,81 (0,45-5) |
| Nivel Clark (n = 117) (%) | |
| I | 1 (0,8) |
| II | 7 (5,6) |
| III | 59 (47,2) |
| IV | 47 (37,6) |
| V | 3 (2,4) |
| Ulceración (n = 124) (%) | |
| No | 90 (72) |
| Sí | 34 (27,2) |
El estudio analítico se dividió en:
- a)
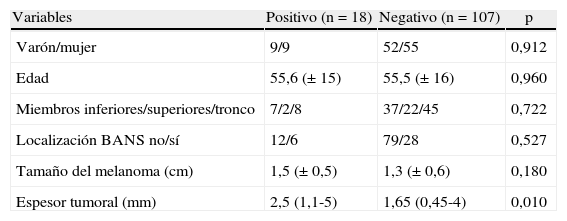
Factores predictores en la positividad del GC (tabla 3). La odds ratio para positividad en el GC para melanoma Breslow 2-4mm fue de 1,797 (0,557-5,798; p = 0,327) y para los de Breslow ≥ 4mm fue de 4,643 (1,232-17,498; p = 0,023).
Tabla 3.Factores asociados a positividad del ganglio centinela
Variables Positivo (n = 18) Negativo (n = 107) p Varón/mujer 9/9 52/55 0,912 Edad 55,6 (± 15) 55,5 (± 16) 0,960 Miembros inferiores/superiores/tronco 7/2/8 37/22/45 0,722 Localización BANS no/sí 12/6 79/28 0,527 Tamaño del melanoma (cm) 1,5 (± 0,5) 1,3 (± 0,6) 0,180 Espesor tumoral (mm) 2,5 (1,1-5) 1,65 (0,45-4) 0,010 Niveles Clark: (n = 117) n (%) n (%) p I 0 (0) 1 (100) 0,163 II 0 (0) 7 (100) III 9 (15,3) 50 (84,7) IV 6 (12,8) 41 (87,2) V 2 (66,7) 1 (33,3) Ulceración no/sí (n = 124) 12/6 78/28 0,543 - b)
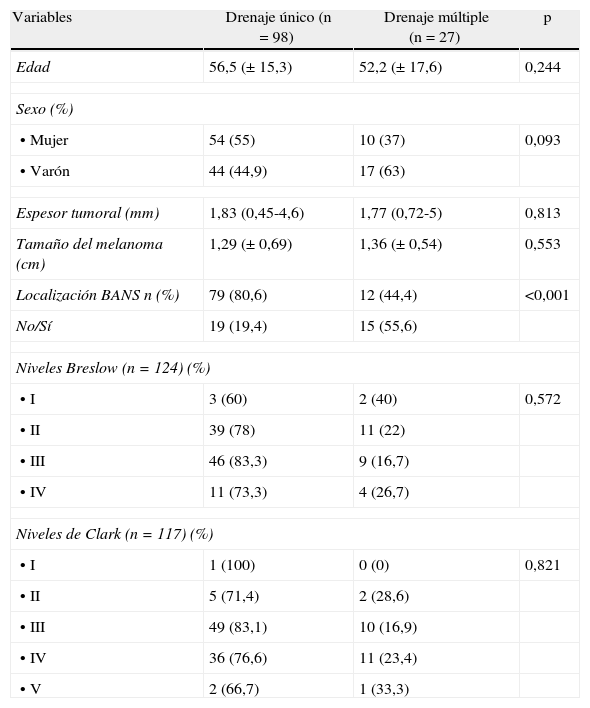
Factores predictores de drenaje múltiple del GC (tabla 4). En la tabla 5 se refleja la distribución anatómica de los melanomas con drenaje múltiple.
Tabla 4.Factores asociados a drenaje múltiple del melanoma
Variables Drenaje único (n = 98) Drenaje múltiple (n = 27) p Edad 56,5 (± 15,3) 52,2 (± 17,6) 0,244 Sexo (%) • Mujer 54 (55) 10 (37) 0,093 • Varón 44 (44,9) 17 (63) Espesor tumoral (mm) 1,83 (0,45-4,6) 1,77 (0,72-5) 0,813 Tamaño del melanoma (cm) 1,29 (± 0,69) 1,36 (± 0,54) 0,553 Localización BANS n (%) 79 (80,6) 12 (44,4) <0,001 No/Sí 19 (19,4) 15 (55,6) Niveles Breslow (n = 124) (%) • I 3 (60) 2 (40) 0,572 • II 39 (78) 11 (22) • III 46 (83,3) 9 (16,7) • IV 11 (73,3) 4 (26,7) Niveles de Clark (n = 117) (%) • I 1 (100) 0 (0) 0,821 • II 5 (71,4) 2 (28,6) • III 49 (83,1) 10 (16,9) • IV 36 (76,6) 11 (23,4) • V 2 (66,7) 1 (33,3) Tabla 5.Distribución anatómica de los melanomas con drenaje múltiple
Localización del melanoma Área de drenaje (%) Frecuencia (%) Tronco 25 (92,6) Espalda alta (escapular) Axilar bilateral: 9 casos (60)Axilar+clavicular: 3 casos (20)Axilar+laterocervical: 1 caso (6,6)Cervical+clavicular: 1 caso (6,6)Axilar+pared costal: 1 caso (6,6) 15 (55,6) Espalda baja (lumbar) Inguinal bilateral: 2 casos (33)Axilar+inguinal: 1 caso (16,6)Axilar bilateral: 2 casos (33)Axilar+submamario: 1 caso (16,6) 6 (22,2) Pectoral Axilar bilateral: 2 casos 2 (7,4) Abdominal Axilar bilateral: 1 caso (50)Axilar+inguinal: 1 caso (50) 2 (7,4) Miembro superior (brazo) Axilar+subescapular: 1 caso 1 (3,7) Miembro inferior (pie) Inguinal+poplíteo: 1 caso 1 (3,7)
El tratamiento del melanoma es quirúrgico. Hay acuerdo general en que la lesión primitiva debe ser extirpada, pero no sobre qué hacer con los ganglios linfáticos regionales. La linfadenectomía terapéutica en los pacientes con melanoma estadio III, una vez descartada las metástasis a distancia, ha demostrado mejorar la supervivencia3. La mayor polémica reside en la indicación de la misma en los pacientes con estadio I y II, con enfermedad clínicamente localizada, centrándose el debate en los melanomas de grosor intermedio 0,76-4mm, puesto que los < 0,76mm presentan una buena tasa de supervivencia a 5 años (96-99%) mientras que los > 4mm presentan un elevado riesgo de desarrollar metástasis sistémicas, reduciéndose el beneficio de la linfadenectomía electiva2. Varios estudios se diseñaron para discernir si la linfadenectomía profiláctica mejoraba el pronóstico, llegando a la conclusión de que únicamente aquellos pacientes con metástasis ocultas presentaban mejoría en la supervivencia. La BGC supone una herramienta que permite localizar metástasis6. La información temprana de la presencia de micrometástasis ganglionares permite realizar inmediatamente la linfadenectomía regional, influyendo en la supervivencia de los enfermos3.
El concepto del GC consiste en que cada zona de piel presenta una vía de drenaje linfático específica y secuencial, por lo tanto, el análisis del primer ganglio permitiría descartar metástasis en el resto. Se publicó en 1992 el primer trabajo de su empleo para el melanoma6. La BGC es la técnica menos agresiva y más efectiva con una sensibilidad del 94,4% y una especificidad cerca del 100%3. En la literatura existe variabilidad en la positividad del GC (10-27%), dependiendo de la utilización únicamente con técnicas de HE, empleadas inicialmente, o con técnicas de IHQ, que forman parte del protocolo actual de estudio anatomopatológico, precisando su estudio diferido6. En nuestra serie tan solo el 7,1% de los pacientes precisaron linfadenectomía, al presentar positividad la BCG, evitando así la morbilidad que supone esta en el 92,9% de los pacientes. La tasa de falsos negativos alcanza el 6% en la literatura. En nuestro caso fue imposible calcularla por el carácter retrospectivo del estudio, dado que los pacientes proceden de distintos centros y realizan su seguimiento postoperatorio en ellos6. Cabe destacar que presentamos un 8,8% de casos en los que se localizan más de 3 ganglios, probablemente en relación con el elevado porcentaje de casos con drenaje múltiple (21,6%) de nuestra serie.
La introducción de la linfogammagrafía preoperatoria cambió el concepto clásico de drenaje linfático de Sappey, por el de que una lesión puede tener más de un área de drenaje y ser distinta de la esperada3. La mayor diversidad en el drenaje lo presentan los melanomas situados en el tronco en sus diferentes subdivisiones, principalmente los situados en la espalda alta, y en cabeza y cuello6–8. En nuestra serie observamos que el 21,6% presentaron drenaje múltiple, siendo los pacientes con melanoma en tronco los que presentan una elevada tasa de drenaje múltiple (47,2%), lo que pone de manifiesto la importancia de la linfogammagrafía preoperatoria para la correcta localización del drenaje linfático. Solo se realizaron 3 casos con melanoma en cabeza y cuello: dada la complejidad del drenaje linfático en esta área, tuvimos mayor dificultad para la localización del GC como ya describen otros autores7–9.
Respecto a los factores pronósticos de la enfermedad, junto al Breslow, la afectación ganglionar es la más importante. El único factor predictor de resultado positivo del GC fue el espesor tumoral. En distintos estudios se observa el mismo fenómeno, de manera que a medida que aumenta el espesor también lo hace la proporción de GC positivos10–12.
En nuestra serie se observa una tendencia a aumentar la positividad del GC conforme aumenta el nivel de Clark, aunque sin alcanzar diferencias significativas. Aunque el nivel de Clark ha sido considerado factor pronóstico, incluyéndose en los distintos sistemas de clasificación tumoral, no se han conseguido reproducir los resultados con la misma fiabilidad que para el espesor tumoral12.
Analizamos la ulceración como factor de positividad, sin objetivar diferencias significativas, probablemente debido al pequeño tamaño muestral. La presencia de ulceración conlleva mayor tiempo de evolución. Muchos estudios demuestran que su presencia supone una mayor agresividad, con mayor riesgo de metástasis y un peor pronóstico12.
En otros estudios se ha observado asociación con otros factores, como por ejemplo la edad, que alcanzó diferencias significativas en los estudios de Rosseau y McMaster, encontrando mayor proporción de casos positivos en los menores de 50 años, en el de van Akkooi en los menores de 60 años, y en el estudio multicéntrico italiano de Testori en el grupo entre 40 y 60 años13–16. En nuestra serie no se encontraron diferencias significativas respecto a la edad para la positividad del GC. Probablemente, en parte sea debido a nuestro pequeño tamaño muestral, aunque tampoco existe unanimidad en cuanto a la edad de riesgo en los distintos estudios publicados.
La BGC supone una herramienta de gran importancia para la localización de micrometástasis, al evitar la morbilidad que supone una linfadenectomía. Para su correcta localización es útil el uso de la linfogammagrafía, ya que las vías de drenaje linfático no son tan predecibles. El único factor que, en nuestra serie, fue predictor de resultado positivo fue el espesor tumoral.
Conflicto de interesesNo existe conflicto de intereses.
Trabajo presentado como póster en el 29 Congreso Nacional de Cirugía, del 12 al 15 de noviembre de 2012, Madrid.