El síndrome doloroso regional complejo se caracteriza por dolor espontáneo o inducido, desproporcionado con relación al evento inicial y que se acompaña de una gran variedad de alteraciones autonómicas y motoras, dando lugar a una gran variedad de presentaciones clínicas. Con frecuencia se asocia a cirugías y a traumatismos menores.
FisiopatologíaSe postulan 3 mecanismos: cambios por inflamación postraumática, disfunción vasomotora periférica y cambios funcionales y estructurales del sistema nervioso central secundarios a una mala adaptación.
DiagnósticoSe realiza tomando como base los criterios de Budapest. El paciente debe presentar un síntoma de cada criterio al momento del diagnóstico: dolor continuo, desproporcionado en relación con cualquier evento desencadenante. Un signo y un síntoma: sensorial, vasomotor, edema y cambio motor / trófico. Por último, estos no se explican por otro diagnóstico o causa.
TratamientoSe sugiere que sea multimodal. No existe un estándar de oro. En fase temprana se pueden utilizar AINE o esteroides. Se han indicado fármacos utilizados para tratamiento de dolor neuropático, pero ninguno de estos posee suficiente evidencia. Hay baja evidencia de la efectividad de que los bifosfonatos, la calcitonina, la ketamina y la terapia en espejo sean efectivos comparados con placebo. El tratamiento intervencionista debe ser escalonado de bloqueo peridural, neuroestimulación, bomba intratecal hasta las terapias experimentales en caso de dolor refractario a tratamiento.
DiscusiónA pesar de que el síndrome doloroso regional complejo es una entidad reconocida desde hace más de 100 años, todavía no existe evidencia clara en las primeras elecciones terapéuticas, aunque hay nuevas tecnologías aplicables en su tratamiento.
Complex regional pain syndrome is characterized by spontaneous or induced pain disproportionate in relation to the initial event and is accompanied by a variety of regional and motor disturbances, leading to a variety of clinical presentations. It is often associated with surgery and minor trauma.
PathophysiologyThree mechanisms are postulated: changes secondary to post traumatic inflammation, peripheral vasomotor dysfunction and structural and functional changes of the central nervous system as a result of maladaptation.
Diagnosismade based on the criteria of Budapest. The patient must have one symptom and sign of each criterion at diagnosis: Continuing pain, disproportionate to any inciting event. A sensory, vasomotor, oedema and motor/trophic change sign and symptoms that are not explained by another diagnosis or cause.
TreatmentMultimodal treatment is suggested. There is no gold standard. In early stage NSAIDs or steroids can be used. Drugs used for neuropathic pain treatment have been suggested, but there is not enough evidence for any of these. There is low evidence that bisphosphonates, calcitonin, ketamine and mirror therapy are effective compared to placebo. Interventional treatment should be stepped from epidural block, neurostimulation, intrathecal pump to experimental therapies in case of intractable pain.
DiscussionAlthough complex regional pain syndrome has been a recognized entity for over 100 years, no clear evidence exists for first-line treatments; however, new technologies that are applicable in complex regional pain syndrome treatment have been developed.
En 1851, Claude Bernard describió por primera vez un síndrome doloroso secundario a cambios en el sistema nervioso simpático1. Trece años después, en 1864 Mitchell, Morehouse y Keen2,3 realizaron una publicación detallada de un dolor ardoroso, acompañado de edema, cambios en la coloración y temperatura de la piel, hiperalgesia y rigidez articular pacientes con herida de arma de fuego, al cual le denominaron causalgia. A inicio del siglo xx Sudeck reportó cuadros clínicos dolorosos de progresión rápida, acompañados de atrofia ósea, con una presentación clínica similar a la causalgia, posterior a una lesión de tejidos blandos y otros tipos de trauma4.
Este síndrome se ha conocido a lo largo del tiempo como causalgia, atrofia o distrofia de Sudeck, algodistrofia, algoneurodistrofia, síndrome hombro-mano distrofia neurovascular refleja, causalgia y distrofia simpática refleja5,6. En 1946 Evans utilizó por primera vez el término distrofia simpática para englobar estas entidades. En el 2001, Schott propuso el termino síndrome doloroso regional complejo (SDRC), siendo aceptado por la Asociación Internacional para el Estudio del Dolor (IASP, por sus siglas en inglés), y hasta la fecha es el término médico más aceptado para este cuadro clínico7.
El SDRC es definido por la IASP como una alteración que se caracteriza por dolor espontáneo o inducido, desproporcionado con relación al evento inicial y que se acompaña de una gran variedad de alteraciones autonómicas y motoras, dando lugar a una gran diversidad de presentaciones clínicas8.
La incidencia anual varía dependiendo de la población y del estudio en un rango de 5.47-26.2 casos/100,000 personas. La menor incidencia reportada es de 5.46/100,000 habitantes en un estudio realizado en EE. UU. entre 1989 y 19998. Mientras que en países bajos el SDRC tuvo una incidencia de 20/100,000 habitantes9.
En cuanto a la relación de género, se reporta de 3:1, 4:1, siendo siempre predominante en las mujeres. El SDRC se cataloga en 2 tipos, conforme si existe un daño o lesión nerviosa previa o no. En cuanto al subtipo, se ha reportado que alrededor del 85% de los casos son tipo 1 donde no es posible identificar una lesión nerviosa, y solo el 13% del tipo 2. Debido al desconocimiento claro de su fisiopatología, se ha llegado a cuestionar si el SDRC consiste en muchos subtipos, todos con diferentes etiologías y patogénesis, pero con una presentación similar, englobada dentro de dos síndromes dolorosos10. Puede estar relacionado a pacientes intervenidos quirúrgicamente de síndrome del túnel carpiano o síndrome de Dupuytren.
Se han postulado como factores de riesgo potenciales para desarrollar SDRC tipo 1 el sexo femenino, especialmente en la etapa posmenopáusica, dislocación del tobillo o su fractura intraarticular, inmovilización y dolor severo presente en etapa temprana del trauma11.
FisiopatologíaSon 3 los mecanismos fisiopatológicos postulados del SDRC. El primero le proporciona un rol sumamente importante a los cambios por inflamación postraumática, el segundo expone una disfunción vasomotora periférica y la tercera teoría refiere que el sistema nervioso central presenta cambios funcionales y estructurales secundarios a una mala adaptación ante la presencia de dolor crónico12.
Inflamación postraumáticaLa mayoría de los cambios inflamatorios en este síndrome son mediados por el péptido relacionado con el gen de la calcitonina (CGRP) y a la sustancia P, puesto que en pacientes con SDRC, las concentraciones de estos péptidos se encuentran más altas que en individuos sanos. El aumento en el CGRP pudiera ser responsable del aumento en la hiperexcitabilidad neuronal. La inflamación neurogénica, mecanismo por el cual se impide la inactivación de neuropéptidos y aumenta la disponibilidad de los receptores pudiera presentarse por señalización posneuronal y extravasación de proteínas. In vitro, la sustancia P estimula los queratinocitos para expresar citocinas proinflamatorias, por lo que la facilitación en la señalización cutánea de neuropéptidos contribuye directamente a inflamación, extravasación, edema de la extremidad y subsecuente aumento en la expresión de citocinas inflamatorias.
El alza de factor de necrosis tumoral alfa y de inteleucina-6 en las biopsias de piel del miembro afectado no se han relacionado con signos clínicos ni duración de la enfermedad, pero sí con la extensión del fenómeno de hiperalgesia mecánica, es decir, con la respuesta exagerada al dolor provocado por presión.
La hiperalgesia mecánica, presente en el SDRC, es un sello distintivo en la sensibilización central. Las citocinas inflamatorias probablemente actúen más allá del miembro afectado, es decir, en la médula espinal. Aquí pudieran sensibilizar neuronas nociceptivas secundarias o mediante interacción neurona-glía. En 2 estudios se ha encontrado aumento en las concentraciones de interleucina-1β e inteleucina-6 a nivel de líquido cefalorraquídeo en pacientes con SDRC crónico (7-8 años de duración)13.
Asimismo, se ha propuesto un mecanismo autoinmune, debido a que un 35% de los pacientes presentan autoanticuerpos de unión de superficie contra neuronas del plexo simpático y mesentérico; sin embargo, su relevancia clínica no está determinada.
Disfunción vasomotoraLos cambios en la temperatura que puede presentar la extremidad afectada en pacientes con este síndrome indican cambios en las neuronas vasoconstrictoras a lo largo del tiempo. Se identifican 3 distintos patrones de temperatura.
El caliente, dado por aparente falla en el enfriamiento del cuerpo debido a la imposibilidad de activación de las neuronas vasoconstrictoras; el intermedio, patrón característico de los pacientes con SDRC de 28 meses de evolución, en donde la extremidad puede estar más caliente o más fría dependiendo del grado de activación simpática. Por último, el patrón frío, en donde la temperatura y perfusión de la extremidad afectada es menor que el lado contralateral. Este último probablemente se debe a la inhibición unilateral de neuronas vasoconstrictoras simpáticas cutáneas, causada por cambios funcionales a nivel de médula espinal y/o cerebral, desencadenado con el trauma inicial. Los niveles de norepinefrina pudieran no estar relacionados con el fenómeno de vasoconstricción debido a que no se han encontrado diferencias en la concentración de esta catecolamina entre el lado afectado y el sano. Sin embargo, el acoplamiento simpático-aferente, es decir, la norepinefrina liberada por las fibras nerviosas simpáticas que activa o sensibiliza las neuronas aferentes pudiera producir el fenómeno de dolor de mantenimiento simpático.
En pacientes con SDRC también existen cambios en la función endotelial asociados a una disminución en la liberación de óxido nítrico, que origina vasoconstricción sostenida.
Sensibilización centralEl proceso de sensibilización distorsiona o suprime las sensaciones no nociceptivas. La pérdida del flujo inhibitorio generado por las sensaciones normales cutáneas en el miembro afectado potencia la excitabilidad de la vía nociceptiva talamocortical, lo cual crea una perpetuación de dolor entre la disminución de la influencia inhibitoria y la facilitación de los sistemas excitatorios que proyectan a la médula rostroventral.
La distonía, el síntoma más prevalente del SDRC, y presente desde las etapas tempranas de la enfermedad, se caracteriza por posturas de flexión e inversión persistente. Debido a que la distonía no responde a la infusión de ketamina intravenosa se piensa que esta es secundaria a cambios en la neuroplasticidad resultante en una plasticidad neuronal maladaptativa. La naturaleza de este mecanismo no se entiende bien, pero el receptor GABA tipo B pudiera desempeñar un papel importante debido a que la administración de su agonista, baclofen, mejora la distonía en los pacientes con SDRC.
En técnicas de imagen funcional, se observa reorganización del mapa somatotópico dentro de la corteza somatosensorial primaria (S1) contralateral al miembro afectado. La representación S1 de la mano afectada es menor que en la mano sana. El grado de estos cambios se relaciona con dolor espontáneo e hiperalgesia mecánica. En los pacientes que inician tratamiento y mejora el dolor, se puede ver reorganización cortical S1. También se observa disminución de los mecanismos inhibitorios y aumento en la excitabilidad de la corteza motora primaria contralateral en los pacientes con SDRC14.
Muy probablemente, los cambios en la función cortical contribuyen al deterioro sensitivo observado frecuentemente en los pacientes con SDRC. Sin embargo, la reorganización cortical demostrada en pacientes con SDRC crónico no es suficiente como para dirigir el blanco terapéutico a dicho proceso patológico. Lo cierto es que el mecanismo fisiopatológico de este síndrome todavía no está totalmente esclarecido15, lo mismo que la gran gama de manifestaciones clínicas y de causas tan evidentes como la presentación de un cuadro de SDRC tras un procedimiento quirúrgico o traumatismo o causas tan únicas y poco frecuentes de presentación como tras una disquectomía láser16.
DiagnósticoPara realizar el diagnóstico no existe un estándar de oro, por lo que hacer un diagnóstico definitivo de SDRC es difícil. Este principalmente se realiza basado en la clínica. Actualmente la manera más aceptada para el diagnóstico de SDRC es mediante la aplicación de criterios de Budapest. El Consenso de Budapest introduce los siguientes criterios para identificar a los pacientes con SDRC y excluir otras condiciones neuropáticas17.
El comité de la IASP recientemente aprobó y codificó la taxonomía de estos llamados criterios de Budapest como «los nuevos criterios de la IASP», que se describen en la tabla 1.
Criterios diagnósticos de Budapest para el SDRC
| 1) Dolor continuo, desproporcionado en relación con cualquier evento desencadenante |
| 2) El paciente debe informar al menos un síntoma en 3 de las 4 categorías siguientes |
| Sensoriales: Informes de hiperalgesia y/o alodinia |
| Vasomotores: Informes de asimetría de la temperatura y/o cambios en el color de la piel y/o asimetría color de la piel |
| Sudomotor/Edema: Informes de edema y/o sudoración cambios y/o sudoración asimetría |
| Motor/trófico: Informes de la disminución de la amplitud de movimiento y/o disfunción motora (debilidad, temblor, distonía) y/o cambios tróficos (pelo, uñas, piel) |
| 3) Debe mostrar al menos un signo en el momento de la evaluación en 2 o más de las siguientes categorías |
| Sensorial: Evidencia de hiperalgesia (al pinchazo) y/o alodinia (al tacto suave y/o presión somática profunda y/o el movimiento de las articulaciones) |
| Vasomotora: Evidencia de asimetría de la temperatura y/o cambios de color de la piel y/o asimetría |
| Sudomotor/Edema: Evidencia de edema y/o sudoración cambios y/o sudoración asimetría |
| Motor/trófico: Evidencia de disminución de la amplitud de movimiento y/o disfunción motora (debilidad, temblor, distonía) y/o cambios tróficos (pelo, uñas, piel) |
| 4) No hay otro diagnóstico que explique mejor los signos y síntomas |
Dentro de los criterios diagnósticos clínicos de Budapest para SDRC, se debe de tener en cuenta que los signos o síntomas deben de estar presentes al momento del diagnóstico. El paciente debe reportar uno de los síntomas en cada una de las 4 categorías para realizar el diagnóstico clínico18. Los criterios diagnósticos se pueden observar en la tabla 1.
La intención de los criterios de Budapest es maximizar la especificidad (minimizar los falsos positivos) a expensas de la sensibilidad. Tienen una alta especificidad pero una baja sensibilidad.
La ausencia de un estándar de oro hace que la validación de los criterios diagnósticos sea difícil.
En las diferentes etapas del SDRC se puede hacer uso de estudios de gabinete para apoyar el diagnóstico. Para valorar los cambios vasomotores, se utiliza el termómetro y doppler del tono vasomotor. La densitometría ósea y biopsia de piel son útiles para medir la atrofia y disminución de la densidad de nervios. Estudios reumatológicos evalúan la artritis inflamatoria. Las pruebas de electrodiagnóstico sirven para evaluar el sistema nervioso periférico, que puede ayudar en el diagnóstico de SDRC tipo 2. Las radiografías simples pueden revelar osteoporosis avanzada o fractura en la extremidad sintomática con SDRC. La resonancia magnética evalúa las lesiones de los tejidos blandos y edema óseo.
Dentro del diagnóstico diferencial se encuentran: artritis infecciosas, artritis reumáticas, artropatía inflamatoria, arteriopatía periférica y trombosis venosa profunda. En fase crónica (con secuelas), con la enfermedad de Dupuytren, esclerodermia y fascitis plantar. En afectaciones de la cadera conviene descartar coxitis y osteonecrosis. Si existe desmineralización ósea será recomendable descartar fracturas de estrés, osteoporosis y tumores óseos benignos y malignos19.
TratamientoEl tratamiento del SDRC es multimodal, incluyendo manejo conservador, farmacológico e intervencionista. Existe controversia en el tratamiento de elección ya que no hay evidencia suficiente que sustente alguno como el de primera elección.
Tratamiento no farmacológicoEn Malibú, California en 1997 se realizó el consenso del tratamiento para la rehabilitación funcional del SRDC. En él se plantea como tratamiento inicial la terapia física y ocupacional, dejando como segunda línea las terapias farmacológicas, psicológicas y opciones intervencionistas18.
El objetivo de la terapia física y ocupacional es minimizar el edema, desensibilizar el dolor de extremidad y normalizar sensibilidad, promover posiciones normales, disminuir la pérdida de masa muscular y aumentar la función de la extremidad.
Para la disminución del edema se utilizan vendajes o mangas compresivas además de técnicas manuales para movilización de edema. La terapia acuática también ha mostrado disminución del edema y mejora en la capacidad para cargar peso19.
Medidas conservadoras. Rehabilitación y otras terapiasLa rehabilitación temprana tiene como objetivo evitar la discapacidad y limitación en la movilidad asociada a dolor. Una de las terapias más utilizadas es la cinesiterapia activa y pasiva, que consiste en la realización de movimientos suaves y aumento de estímulos sensoriales como el roce con objetos de diferentes texturas o temperatura. La fisioterapia y la rehabilitación son efectivas, y tienen una fuerte evidencia dentro de la mejoría funcional y de dolor en los pacientes con SDRC. La terapia de imaginación motora gradual tiene una fuerte evidencia en pacientes con síndrome regional complejo posterior a fractura de muñeca. Por sí sola, la efectividad de la terapia con espejo tiene una evidencia moderada.
La terapia ocupacional tiene efectos positivos sobre la limitación funcional y el nivel de actividad. La electroterapia o estimulación eléctrica nerviosa transcutánea también ha sido recomendada para la mejoría del dolor, aunque con un menor nivel de evidencia comparado con la cinesiterapia y la terapia ocupacional, ya que la evidencia es insuficiente con el uso de estimulación eléctrica nerviosa transcutánea19.
En las tablas 2 y 3 se pueden observan las distintas terapias conservadoras y farmacológicas con su grado de recomendación y su nivel de evidencia18,20. Los niveles de recomendación se describen a continuación: A (revisiones sistemáticas y metaanálisis de ensayos clínicos y ensayos clínicos individuales con intervalos de confianza estrechos), B (revisiones sistemáticas de estudios de cohortes y de casos y controles, estudios de cohortes y de casos y controles individuales, y ensayos clínicos de menor calidad), C (series de casos y estudios de cohortes y de casos y controles de mala calidad), D (opiniones de expertos). El nivel de evidencia 1 se refiere a metaanálisis y revisiones sistemáticas; el nivel 2 a uno o más estudios aleatorizados, controlados con una buena muestra; el 3 a estudios retrospectivos o pilotos y el 4 a casos clínicos, anecdóticos y a experiencia clínica.
Terapias conservadores en SDRC
| Tipo de terapia | Área de impacto | Recomendación | Nivel de evidencia |
|---|---|---|---|
| Terapia física | Mejora funcionalidad y movilidad de la extremidad | B | 2a |
| Imaginación motora gradual | Tiene efectos positivos en la funcionalidad | B | 2a |
| Retroalimentación visual de espejo | Se han demostrado efectos a corto plazo | C | 3b |
| Terapia de estrés de carga o cinesiterapia | Mejora la funcionalidad y desensibilización | C | 3b |
| Terapia ocupacional | Tiene efectos positivos en la funcionalidad, se ha visto en miembro superior | B | 2a |
| Estimulación eléctrica nerviosa transcutánea | No se ha visto una mejoría clara | C | 3b |
| Terapia antiedema | Mejora funcionalidad en etapas tempranas | C | 3b |
| Terapia psicológica | Disminuye el miedo a moverse así como aceptación de la dolencia | B | 3a |
| Estimulación eléctrica medular | Control del dolor a largo plazo para ofrecer una mejor relación costo beneficio | C | 3b |
| Estimulación transcraneal magnética de corteza motora | Mejoría de funcionalidad y movilidad | C | 3b |
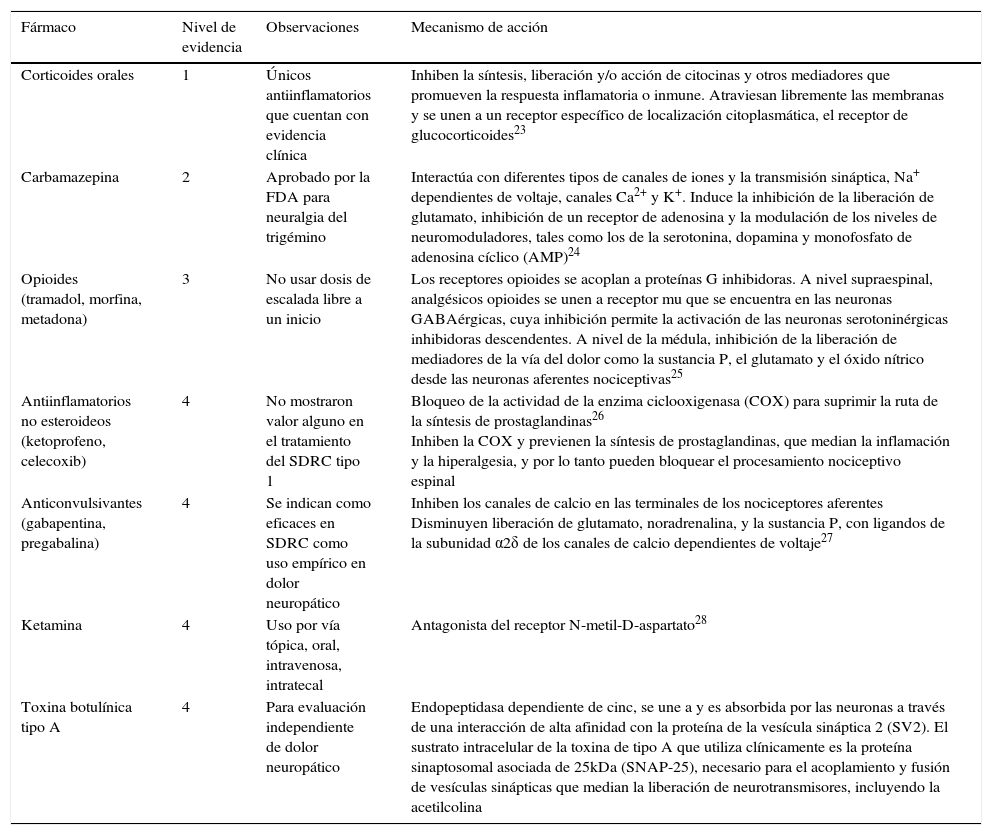
Farmacoterapia en SDRC
| Fármaco | Nivel de evidencia | Observaciones | Mecanismo de acción |
|---|---|---|---|
| Corticoides orales | 1 | Únicos antiinflamatorios que cuentan con evidencia clínica | Inhiben la síntesis, liberación y/o acción de citocinas y otros mediadores que promueven la respuesta inflamatoria o inmune. Atraviesan libremente las membranas y se unen a un receptor específico de localización citoplasmática, el receptor de glucocorticoides23 |
| Carbamazepina | 2 | Aprobado por la FDA para neuralgia del trigémino | Interactúa con diferentes tipos de canales de iones y la transmisión sináptica, Na+ dependientes de voltaje, canales Ca2+ y K+. Induce la inhibición de la liberación de glutamato, inhibición de un receptor de adenosina y la modulación de los niveles de neuromoduladores, tales como los de la serotonina, dopamina y monofosfato de adenosina cíclico (AMP)24 |
| Opioides (tramadol, morfina, metadona) | 3 | No usar dosis de escalada libre a un inicio | Los receptores opioides se acoplan a proteínas G inhibidoras. A nivel supraespinal, analgésicos opioides se unen a receptor mu que se encuentra en las neuronas GABAérgicas, cuya inhibición permite la activación de las neuronas serotoninérgicas inhibidoras descendentes. A nivel de la médula, inhibición de la liberación de mediadores de la vía del dolor como la sustancia P, el glutamato y el óxido nítrico desde las neuronas aferentes nociceptivas25 |
| Antiinflamatorios no esteroideos (ketoprofeno, celecoxib) | 4 | No mostraron valor alguno en el tratamiento del SDRC tipo 1 | Bloqueo de la actividad de la enzima ciclooxigenasa (COX) para suprimir la ruta de la síntesis de prostaglandinas26 Inhiben la COX y previenen la síntesis de prostaglandinas, que median la inflamación y la hiperalgesia, y por lo tanto pueden bloquear el procesamiento nociceptivo espinal |
| Anticonvulsivantes (gabapentina, pregabalina) | 4 | Se indican como eficaces en SDRC como uso empírico en dolor neuropático | Inhiben los canales de calcio en las terminales de los nociceptores aferentes Disminuyen liberación de glutamato, noradrenalina, y la sustancia P, con ligandos de la subunidad α2δ de los canales de calcio dependientes de voltaje27 |
| Ketamina | 4 | Uso por vía tópica, oral, intravenosa, intratecal | Antagonista del receptor N-metil-D-aspartato28 |
| Toxina botulínica tipo A | 4 | Para evaluación independiente de dolor neuropático | Endopeptidasa dependiente de cinc, se une a y es absorbida por las neuronas a través de una interacción de alta afinidad con la proteína de la vesícula sináptica 2 (SV2). El sustrato intracelular de la toxina de tipo A que utiliza clínicamente es la proteína sinaptosomal asociada de 25kDa (SNAP-25), necesario para el acoplamiento y fusión de vesículas sinápticas que median la liberación de neurotransmisores, incluyendo la acetilcolina |
La ausencia de una prueba diagnóstica estándar de oro o de un sistema de diagnóstico específico basado mecánicamente ha impedido en gran medida ensayos bien diseñados, y existe escasa evidencia para guiar el tratamiento de los pacientes.
Se postula la presencia de dolor óseo neuropático por lo que han sido estudiados medicamentos usados específicamente para el SDRC que intervienen en el metabolismo óseo, en especial, la inhibición de los osteoclastos, encargados de la resorción ósea, incluyendo calcitonina y bifosfonatos21. También se han empleado otros fármacos como corticoides, y más recientemente, la inmunoglobulina intravenosa.
Los tratamientos más estudiados en otras neuralgias relacionadas incluyen los tricíclicos, gabapentina y pregabalina, carbamazepina, opioides, clonidina, nifedipino, los antagonistas α-adrenérgicos, 5% parche de lidocaína y la capsaicina tópica18.
Los medicamentos antiinflamatorios no esteroideos, corticoides, la ciclooxigenasa -2 inhibidores y captadores de radicales se utilizan para el dolor con la intención de tratar además la afectación inflamatoria en SDRC.
Los antiinflamatorios no esteroideos no mostraron valor alguno en el tratamiento del SDRC 1. Los inhibidores selectivos de la ciclooxigenasa-2 (por ejemplo, celecoxib), no se han probado en el SDRC, aunque anecdóticamente se han reportado que son de alguna utilidad (nivel de evidencia 4)22.
Los corticosteroides orales son los únicos medicamentos anti-inflamatorios para los cuales hay evidencia clínica de prueba directa en CRPS (evidencia de nivel 1)18,19.
Los neuromoduladores como gabapentina y pregabalina se sugieren eficaces en SDRC (nivel de evidencia 4) como uso empírico para muchos síndromes de dolor neuropático.
La carbamazepina tiene un lugar tradicional en el tratamiento de la neuralgia del trigémino. Un estudio aleatorizado controlado de pacientes con SDRC encontró que 600mg/día de carbamazepina, tomada más de 8 días, produce una considerable reducción del dolor en comparación con el placebo (nivel 2 de pruebas).
Existe un creciente consenso en que si bien los opiáceos son una segunda o tercera línea de tratamiento como opción razonable para tratar, no deben utilizarse inicialmente y no deben ser de escalada libre. La metadona tiene ventajas teóricas para el dolor neuropático debido a su putativo N-metil-D-aspartato antagonismo, así como la ventaja práctica de bajo costo, y el tramadol puede ser útil debido a su bloqueo en la recaptación de serotonina/norepinefrina concomitante.
La ketamina, un antagonista del receptor de N-metil-D-aspartato se ha utilizado por vía tópica, por vía oral y por vía intravenosa (y recientemente, intratecal, sin ningún apoyo de pruebas) en varias dosis para tratar el dolor neuropático, particularmente el SDRCCRPS18.
En la tabla 3 se resumen los diferentes fármacos utilizados para el manejo del SDRC conforme las últimas guías de Harden et al.18.
La toxina botulínica tipo A utilizada durante años para debilitar los músculos específicos en trastornos del movimiento y espasticidad mediante el bloqueo de la liberación de acetilcolina en las sinapsis colinérgicas, también inhibe los neurotransmisores colinérgicos (por ejemplo, glutamato) y neuropéptidos (sustancia P y el péptido relacionado con el gen de la calcitonina [CGRP], relacionado con las terminales nerviosas aferentes primarias, proporcionando los fundamentos para la evaluación independiente en el dolor neuropático. Sin embargo en SDRC no existe suficiente evidencia de que la toxina botulínica sea efectiva para tratar la distonía29.
Tratamiento intervencionistaEn la 4.a edición de Guías del SDRC, de Harden et al.18 se revisó la evidencia de las siguientes intervenciones: bloqueos del sistema nervioso simpático, bloqueo peridural con anestésico local, y neuromodulación.
Cuando la afectación se presenta en miembros torácicos, el bloqueo se realiza a nivel del ganglio estrellado y a nivel de miembros pélvicos se bloquea la cadena simpática lumbar.
No existen realmente indicaciones con criterios establecidos para la realización de este tipo de procedimientos.
Esta revisión sistemática reveló la escasez de pruebas publicadas que apoyan el uso de anestesia local en el bloqueo simpático como estándar de oro en el SDRC. Los 2 estudios aleatorizados que cumplían con los criterios de inclusión tenían pequeños tamaños de muestra, por consiguiente, no se pudieron extraer conclusiones sobre la efectividad de este procedimiento. Es necesario realizar ensayos controlados aleatorizados para poder evaluar la utilidad del bloqueo simpático con anestésicos locales para el tratamiento del SDRC30,31.
Bloqueos de plexo braquial y espinalLa colocación de un catéter a nivel de plexo braquial por un lapso de 3 semanas y la administración continua de anestésico local, clonidina, opioides y otros agentes han reportado mejor control del dolor, con un nivel 4 de evidencia18.
Bloqueo simpático con neurolíticos químicos y térmicosLa ablación por radiofrecuencia fue retomada recientemente en series de casos, obteniendo un nivel 3 de evidencia32. De acuerdo a Cochrane, la práctica de la simpatectomía química y quirúrgica para el dolor neuropático y el SDRC se basa en muy pocas pruebas de alta calidad. La simpatectomía debe utilizarse con cautela en la práctica clínica, en pacientes cuidadosamente seleccionados y probablemente solo después del fracaso de otras opciones de tratamiento, en especial a nivel cervical33.
Estimulación del ganglio de la raíz dorsalSe postula que los cambios fisiopatológicos en el ganglio de la raíz dorsal pudieran ser un factor contribuyente en el desarrollo del SDRC, y por ende, su estimulación pudiera tener cierto beneficio terapéutico. En esta alternativa terapéutica, se colocan los electrodos de estimulación a la altura del foramen intervertebral, es decir adyacentes al ganglio de la raíz dorsal17. Recientemente se publicó una serie33 de casos en donde a 8 pacientes con diagnóstico de SDRC conforme los criterios de Budapest se les colocó el sistema de neuromodulación a nivel del ganglio de la raíz dorsal después de un periodo de prueba con disminución del dolor mayor o igual al 50%. Aunque los resultados fueron variables, todos los sujetos presentaron mejoría del dolor a un año y algunos remisión de síntomas de mantenimiento simpático34,35.
NeuroestimulaciónLa estimulación de los cordones posteriores se basa en la teoría de la compuerta que establece que estímulos no nocivos como las parestesias viajan a través de fibras largas de conducción rápida, inhibiendo los impulsos de fibras de diámetro pequeño (como las del dolor). La estimulación de los cordones espinales puede mejorar el dolor no nociceptivo aumentando la actividad GABAérgica en la columna dorsal, reduciendo así la excitación sensitiva periférica y aumentando la vasodilatación periférica.
Kemler et al. publicaron un estudio aleatorizado de pacientes con manejo conservador, únicamente pacientes con neuroestimulación, con seguimiento a 6 meses, reportando una reducción mayor del dolor y del impacto subjetivo de mejoría y calidad de vida del paciente, sin embargo no demostraron una mejoría en su estado funcional36.
Existe evidencia limitada de la respuesta a largo plazo a los sistemas de implantación. En un estudio con seguimiento 5 años después de la implantación, un 40% de los pacientes a 11 años persistían con un 30% de mejoría del dolor37.
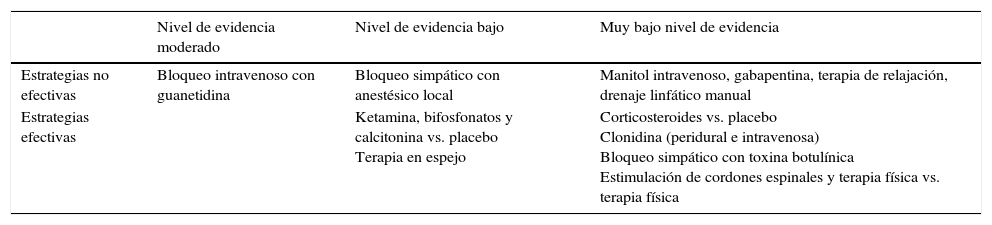
De acuerdo a la última revisión de Cochrane38 acerca de las intervenciones para mejorar la capacidad en pacientes con SDRC, las opciones intervencionistas se pueden clasificar conforme la tabla 4.
Procedimientos mínimamente invasivos para el tratamiento del SDRC
| Nivel de evidencia moderado | Nivel de evidencia bajo | Muy bajo nivel de evidencia | |
|---|---|---|---|
| Estrategias no efectivas | Bloqueo intravenoso con guanetidina | Bloqueo simpático con anestésico local | Manitol intravenoso, gabapentina, terapia de relajación, drenaje linfático manual |
| Estrategias efectivas | Ketamina, bifosfonatos y calcitonina vs. placebo Terapia en espejo | Corticosteroides vs. placebo Clonidina (peridural e intravenosa) Bloqueo simpático con toxina botulínica Estimulación de cordones espinales y terapia física vs. terapia física |
Existen casos clínicos donde se ha reportado una buena respuesta a la implantación de células madre autólogas y plasma rico en plaquetas, con un seguimiento a 30 días39.
A pesar de que el pronóstico de los pacientes con SDRC es muy difícil de predecir, un diagnóstico y un tratamiento tempranos aumentan la probabilidad de un resultado exitoso. Los casos leves responden a la terapia física, mientras que los casos moderados pueden requerir analgésicos adyuvantes, tales como gabapentinoides y/o antidepresivos2.
DiscusiónA pesar de que el SDRC es una entidad reconocida desde hace más de 100 años, todavía no existe evidencia clara en las primeras elecciones terapéuticas, ya sean no farmacológicas, farmacológicas o intervencionistas, aunque se debe mencionar que en la actualidad hay nuevas tecnologías aplicables en su tratamiento que son prometedoras. La medicina se encuentra en constante evolución, como es el caso en este padecimiento; por ejemplo, las pruebas diagnósticas consideradas anteriormente como las más fiables para realizar el diagnóstico de componente simpático, como la inhibición simpática con fentolamina, actualmente no se recomiendan por los eventos adversos que implican17,40. Adicionalmente, el reconocimiento de la dinámica de la evolución científica de la medicina nos lleva a la necesidad de identificar que las futuras investigaciones en este y otros campos nos brindarán evidencias para una mejor toma de decisiones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.