La neuromonitorización intraoperatoria del nervio laríngeo recurrente facilita la identificación de las estructuras anatómicas en cirugía endocrina cervical, disminuyendo así la frecuencia de parálisis de las cuerdas vocales.
ObjetivoEstudiar los valores electrofisiológicos normales de los nervios vagos y recurrentes, antes y después de la cirugía tiroidea. Comparar la tasa de lesiones de los nervios recurrentes antes y después de la introducción de la neuromonitorización en la cirugía tiroidea.
Material y métodosEstudio observacional, descriptivo, y prospectivo en el que se incluyeron un total de 490 pacientes. Entre los años 2003 y 2010, se intervienen 411 pacientes (703 nervios en riesgo), con identificación sistemática de nervios laríngeos recurrentes. Entre 2010-2011, además realizamos la neuromonitorización sistemáticamente de los mismos en 79 pacientes.
ResultadosAntes de la neuromonitorización, de 704 nervios en riesgo, hubo 14 lesiones de nervio laríngeo recurrente. Desde 2010, de 135 nervios en riesgo no se ha identificado ninguna lesión nerviosa.
ConclusionesConsideramos que el «estándar de oro» en la cirugía tiroidea debe ser la identificación sistemática del nervio laríngeo recurrente, y la neuromonitorización de los mismos nunca debe sustituirla, sino complementarla.
Intraoperative neuromonitoring of the recurrent laryngeal nerve in thyroid surgery facilitates the identification of anatomical structures in cervical endocrine surgery reducing the frequency of vocal cord paralysis.
ObjectiveTo study the normal electrophysiological values of the vague and recurrent laryngeal nerves before and after thyroid surgery. To compare rates of injury of recurrent nerve before and after the introduction of the intraoperative neuromonitoring in thyroid surgery.
Material and methodsAn observational, descriptive and prospective study in which a total of 490 patients were included. Between 2003-2010, surgery was performed on 411 patients (703 nerves at risk) with systematic identification of recurrent laryngeal nerves. Between 2010-2011 neuromonitorization was also systematically performed on 79 patients.
ResultsBefore the introduction of intraoperative neuromonitoring of 704 nerves at risk, there were 14 recurrent laryngeal nerve injuries. Since 2010, after the introduction of the intraoperative neuromonitoring in thyroid surgery, there has been no nerve injury in 135 nerves at risk.
ConclusionsWe consider the systematic identification of the recurrent laryngeal nerve is the ‘gold standard’ in thyroid surgery and the intraoperative neuromonitoring of nerves can never replace surgery but can complement it.
A pesar de los muchos avances en técnicas quirúrgicas en las últimas décadas, el riesgo de lesión del nervio laríngeo recurrente en la cirugía tiroidea y paratiroidea se ha visto disminuido, pero no ha desparecido. Lahey y Hoover1, y posteriormente Ridell2, describieron una técnica para la tiroidectomía con la que se intentó identificar el nervio laríngeo recurrente en todos los casos, en lugar de seguir el enfoque tradicional de evitar identificarlo. La superioridad de este enfoque ha sido informada por Hermann et al.3, quienes revisaron las tiroidectomías para enfermedades benignas desde 1979 a 1990, en las que los nervios no fueron identificados (n=15,865), y desde 1991 a 1998, cuando se realizó la visualización del nervio laríngeo recurrente y esta fue la práctica estándar (n=10,548). Estos autores muestran que el riesgo de lesión permanente del nervio laríngeo recurrente en el primer grupo fue del 1.1%, mientras que en el último grupo, en el que se visualizaba el nervio laríngeo recurrente de forma estándar, se redujo hasta en un 0.4%.
La mayoría de cirujanos tratan de identificar el nervio laríngeo recurrente, minimizando así el riesgo de lesionarlo. A pesar de esta técnica, hay descritas diversas circunstancias que pueden aumentar el riesgo de lesión. Thomusch et al.4 llevaron a cabo un análisis multivariado en el que se analizaron los factores de riesgo para pacientes sometidos a tiroidectomía por enfermedad benigna, y encontraron que un grado de resección amplia y el bocio recurrente fueron las variables independientes que contribuían a aumentar la probabilidad de lesión del nervio laríngeo recurrente. Además, Dralle et al.5 identificaron la anatomía alterada, la enfermedad grande tiroidea, y la inexperiencia quirúrgica, como factores de riesgo adicionales de lesión del nervio laríngeo recurrente. El enfoque de la identificación rutinaria del nervio laríngeo recurrente ha sido adoptado por la mayoría de los cirujanos, y se corresponde con un riesgo de lesión permanente por debajo del 2%. A pesar de ello, esta complicación continúa siendo problemática para pacientes y cirujanos. La morbilidad de la disfonía permanente es evidente y está documentada6. No es de extrañar que las lesiones nerviosas continúen siendo una fuente de frecuentes demandas por mala praxis médica contra el cirujano7. La monitorización del nervio es un intento de reducir el riesgo de lesión nerviosa durante la cirugía tiroidea y paratiroidea, que ha ganado mayor interés en los últimos años, aunque ya se había intentado en décadas anteriores. A principios de los años 608, algunos clínicos exploraron el uso de la estimulación eléctrica del nervio laríngeo recurrente, como medio de identificación y preservación del mismo9. Sin embargo, solo en los últimos años ha llegado a usarse de forma habitual y se encuentra disponible, por lo que el uso de la monitorización ha sido establecido. Estos cambios han conllevado numerosos estudios en la última década que describen la monitorización intraoperatoria del nervio durante la cirugía tiroidea.
Los fundamentos de la tecnología de la monitorización intraoperatoria implican 2 componentes: un método de estimulación del nervio laríngeo recurrente intraoperatorio y un método para evaluar la respuesta de las cuerdas vocales a la estimulación. La estimulación nerviosa se realiza por estimulación a baja tensión de los tejidos cerca del nervio laríngeo recurrente o indirectamente, mediante la estimulación del nervio vago. La monitorización de la respuesta a la estimulación del nervio ha incluido técnicas diferentes. Varios grupos han descrito la palpación digital del músculo cricoaritenoideo durante la estimulación nerviosa, como un método de demostración de que el nervio está intacto10. Riddell11 y después Eltzschig et al.12 describieron la monitorización de la función nerviosa mediante la observación de la cuerda vocal por laringoscopia directa y de fibra óptica. Esta técnica de monitorización es efectiva, pero requiere de habilidad y experiencia para colocar adecuadamente los electrodos. Aunque menos común, el uso de electrodos en la superficie poscricoidea también ha sido descrito y parece ser efectivo. El método más ampliamente utilizado en los últimos años de la neuromonitorización ha sido el uso de electrodos en la superficie del tubo endotraqueal, en parte gracias a la facilidad del manejo y a la disponibilidad comercial. No se requiere de ninguna habilidad especial o experiencia para colocar el electrodo en la posición correcta. En cambio, con intubación de fibra óptica, la colocación adecuada de los electrodos en contacto con las cuerdas vocales suele ser más difícil.
Los 3 sistemas de neuromonitorización más utilizados del nervio laríngeo recurrente son el monitor de integridad nerviosa (NIM), sistema fabricado por Medtronic Xomed® (Minneapolis, Minnesota, Estados Unidos), el sistema Nerveana fabricado por Neurovision Médica® (Ventura, California, Estados Unidos), y el sistema Avalanche® XT Monitor fabricado por Dr. Langer Medical (Waldkirch, Alemania).
El sistema Avalanche® usa para la estimulación unas sondas de mano que pueden ser monopolares o bipolares, y la toma de señales mediante diferentes electrodos. La sonda de estimulación transmite al tejido impulsos de corriente muy pequeños que generan un potencial de acción en el músculo vocal, cuando el nervio ha sido identificado y está intacto. Entonces el cirujano percibe el potencial de acción muscular a través de una señal visual y acústica única. El potencial de acción muscular se conduce con electrodos especiales a través del tubo endotraqueal, utilizado para la anestesia, o mediante un electrodo de aguja dispuesto de forma transligamentaria en el músculo vocal correspondiente.
En la sonda monopolar, la corriente eléctrica fluye desde la punta de la sonda a través del tejido, hacia el electrodo de referencia que está colocado en los músculos circundantes del cuello. En la sonda bipolar, cuando toca el tejido, la corriente eléctrica orbicular fluye de un polo al otro a través del tejido. En comparación con las sondas monopolares, las sondas bipolares mantendrían un campo de estimulación relativamente pequeño, permitiendo la localización del nervio de manera absoluta.
Cuando la neuromonitorización se lleva a cabo usando algún tipo de sensor de electromiografía o cuando se usa la palpación laríngea, el bloqueo neuromuscular se evita durante la inducción de la anestesia general endotraqueal. Si se requiere bloqueo neuromuscular durante la inducción anestésica, generalmente se recomienda un agente de acción corta. Marusch et al.13 han informado que la monitorización del nervio laríngeo recurrente puede llevarse a cabo incluso en presencia de bloqueantes neuromusculares, al menos cuando se usen necesariamente electrodos en el músculo vocal para monitorizar los potenciales de acción. Sin embargo, y a pesar de este informe, el bloqueo neuromuscular debe evitarse cuando se usan electrodos en la superficie del tubo endotraqueal.
ObjetivoLos objetivos de nuestro estudio son:
- 1.
Estudiar los valores electrofisiológicos normales de los nervios vagos y recurrentes, antes y después de la cirugía tiroidea.
- 2.
Comparar la tasa de lesiones de los nervios recurrentes antes y después de la introducción de la neuromonitorización en la cirugía tiroidea.
Se realizó un estudio observacional, descriptivo, y prospectivo, en el que se analizaron los resultados de la neuromonitorización intraoperatoria de los nervios vago y laríngeo recurrente, aplicada a pacientes intervenidos de patología tiroidea o paratiroidea, durante el período comprendido entre el 1 enero de 2003 y el 31 diciembre de 2011. Todos los pacientes fueron vistos en consultas externas por parte de alguno de los miembros de la unidad de endocrino del servicio de cirugía general e incluidos en el estudio. Los pacientes fueron incorporados al estudio de forma consecutiva, siendo valorados por el servicio de anestesiología.
Todos los casos fueron intervenidos por el mismo equipo de cirujanos. En todos los pacientes, se realizó la identificación sistemática de ambos nervios recurrentes, en todo su recorrido.
Además, en aquellos casos en los que se realizó neuroestimulación (IONM), se llevó a cabo la colocación del electrodo en la superficie del tubo endotraqueal Mallinckrodt® calibre 5.5mm y de todo el sistema Avalanche® TX Monitor, Dr. Langer Medical (Waldkirch, Alemania).
Todos los pacientes fueron sometidos a intubación y anestesia general balanceada realizada por el mismo equipo de 2 anestesistas.
En los pacientes en los que realizamos neuromonitorización, se empleó el rocuronio a 0.5mg/kg i.v. como relajante muscular de forma estándar en todos ellos. Se trata de un fármaco que compite por los receptores colinérgicos nicotínicos de la placa motora terminal, con acción intermedia, y comienzo de acción rápida.
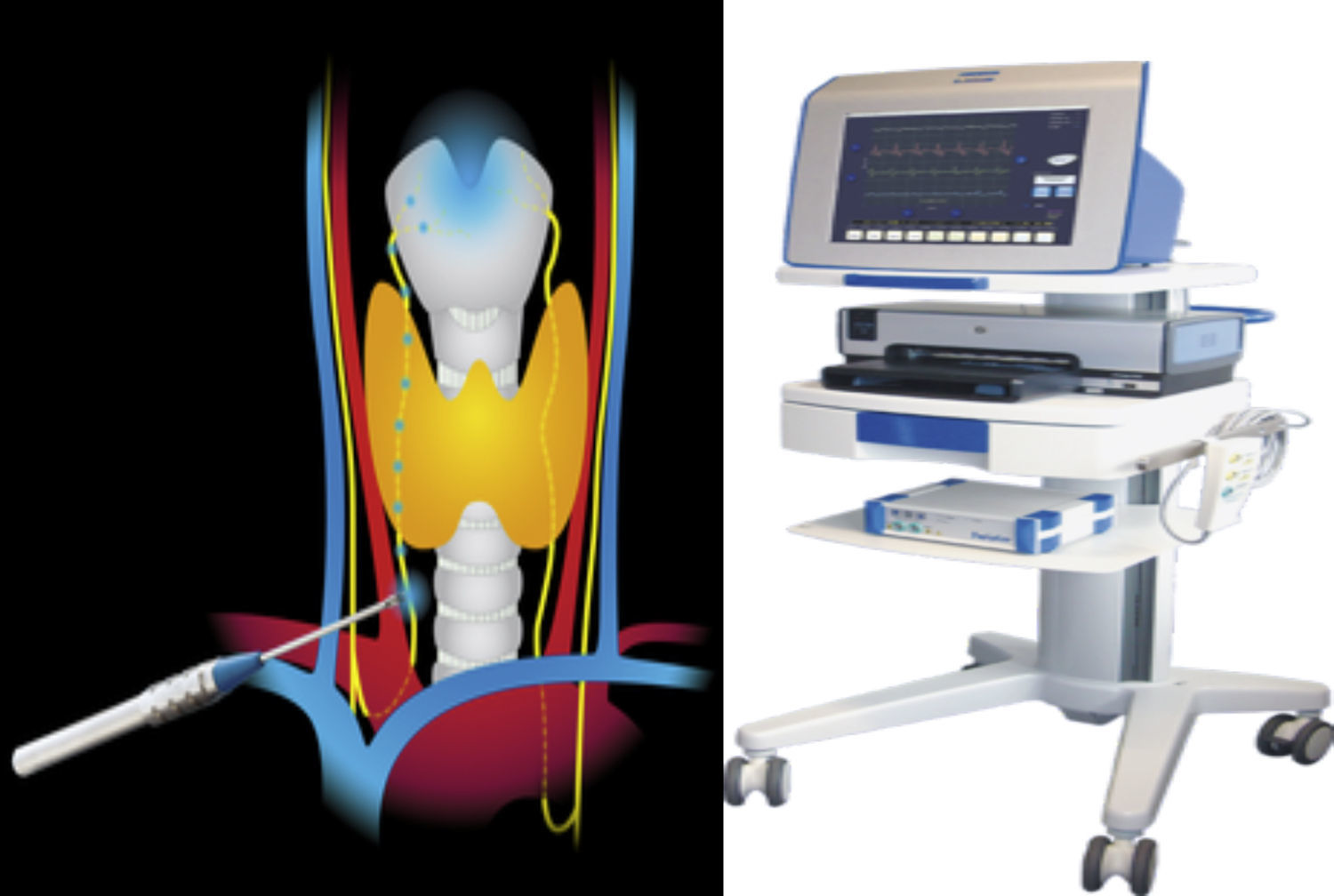
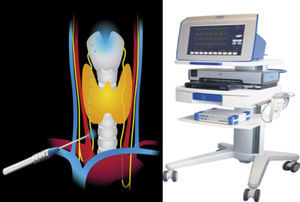
El sistema Avalanche® usa para la estimulación unas sondas de mano, que pueden ser monopolares o bipolares, y la toma de señales mediante diferentes electrodos. La sonda de estimulación transmite al tejido impulsos de corriente muy pequeños que generan un potencial de acción en el músculo vocal, cuando el nervio ha sido identificado y está intacto. Entonces el cirujano percibe el potencial de acción muscular a través de una señal visual y acústica única. El potencial de acción muscular se conduce con electrodos especiales a través del tubo endotraqueal utilizado para la anestesia. Utilizamos la sonda bipolar en que, al mantener en contacto con el tejido, la corriente eléctrica orbicular fluye de un polo al otro a través del tejido. Las sondas bipolares mantienen un campo de estimulación relativamente pequeño permitiendo la localización del nervio de manera absoluta (fig. 1).
Técnica de neuromonitorización14Se colocó al paciente en posición de decúbito supino, con moderada hiperextensión cervical. Se realizó incisión de Kocher entre los bordes internos de ambos músculos esternocleidomastoideos; apertura por planos y preparación de colgajos miocutáneos. Abrimos la musculatura por la línea media y disecamos dicha musculatura de la cápsula tiroidea. Disecamos el paquete vasculonervioso (compuesto por la arteria carótida por dentro, la vena yugular interna por fuera y el nervio vago por detrás) antes de disecar la glándula tiroidea.
Primer paso. Estimulación del nervio vago al inicio de la cirugía, que denominaremos como vago 1 (V1). Disección de aproximadamente 1-3cm entre la vaina carotídea y la yugular, antes de realizar ningún acto quirúrgico y de identificar el nervio laríngeo recurrente, con el fin de localizar el nervio vago. Estimulación del mismo con 0.5 miliamperios, tocándolo directamente con la sonda bipolar. Si no recibimos señal, subimos a 0.8 miliamperios. Consideramos fallo del equipo cuando no recibimos señal después de estimularlo a 1.0 miliamperios y comprobar la colocación del electrodo endotraqueal y las conexiones. Al resultado de esta medición, lo denominamos V1. Esto valida por un lado el funcionamiento correcto del sistema y por otro la integridad del nervio antes de realizar la cirugía. Nos sirve por lo tanto como control del nervio sobre sí mismo.
Segundo paso. Estimulación del nervio recurrente al inicio de la cirugía, que denominaremos como recurrente 1 (R1). Disección e identificación del nervio laríngeo recurrente en el surco traqueoesofágico o el cruce con la arteria tiroidea inferior. Es estimulado directamente con la sonda bipolar a 0.5 miliamperios.
Tercer paso. Estimulación del nervio recurrente al final de la cirugía, que denominaremos recurrente 2 (R2). Disección e identificación del nervio laríngeo recurrente en el ligamento de Berry. Es estimulado directamente con la sonda bipolar a 0.5 miliamperios.
Cuarto paso. Estimulación del nervio vago al final de la cirugía, que denominaremos como vago 2 (V2). Finalmente estimulamos de nuevo el nervio vago, después de la cirugía.
Consideramos, por consenso, resultado negativo de la prueba cuando: 1) no obtuvimos respuesta eléctrica de ningún nervio después de examinar a 0.5, 0.8 y 1 miliamperios, sucesivamente, y de comprobar la colocación del electrodo y las conexiones, y 2) cuando habiendo obtenido algún registro, la estimulación de V2 no tuvo transmisión eléctrica.
Comprobamos en el postoperatorio que dicho negativo se correspondiera o no con repercusión clínica en la forma de disfonía o trastornos de deglución. En los casos que hubo clínica compatible con lesión recurrencial, se realizó laringoscopia al cabo de un mes.
Consideramos lesión definitiva cuando se evidenció parálisis de alguna cuerda por laringoscopia, más allá de los 6 meses después de la intervención.
Todos los pacientes fueron revisados a los 30 días y a los 6 meses de la intervención.
Estudio estadísticoPara el análisis estadístico se utilizó el programa SPSS para Windows en su versión 17. Las variables cuantitativas se describieron usando la media, la desviación típica y el rango. Para las variables cualitativas se obtuvieron las frecuencias absolutas y relativas, expresadas en porcentajes.
Para la comparación de la prevalencia de lesiones antes y después de la neuromonitorización, se utilizó la prueba exacta de Fisher. Se midieron las diferencias entre V1 y V2, mediante la prueba t de Student para muestras relacionadas. Para todos los análisis el nivel de significación estadística se fija en el 5%, valor α=0.05.
ResultadosSe realizó la técnica quirúrgica de tiroidectomía total bilateral o unilateral, con identificación sistemática de los nervios laríngeos recurrentes.
Entre los años 2003 y 2010 se intervinieron un total de 411 pacientes. Se realizaron 292 tiroidectomías totales bilaterales (584 nervios en riesgo) y 119 tiroidectomías totales unilaterales (119 nervios en riesgo) en este grupo, con un total de 703 nervios en riesgo incluidos en el estudio.
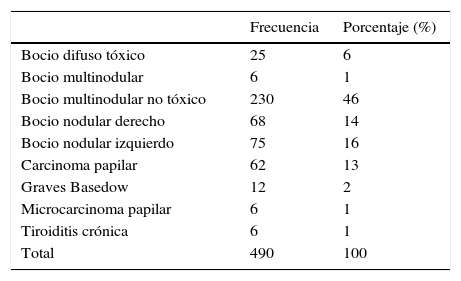
Desde septiembre del año 2010, además de la identificación sistemática de los nervios laríngeos recurrentes, realizamos sistemáticamente la neuromonitorización de los mismos. En este período, entre 2010 y 2011, se intervinieron un total de 79 pacientes. Se realizaron 56 tiroidectomías totales bilaterales (112 nervios en riesgo) y 23 tiroidectomías totales unilaterales (23 nervios en riesgo) en este grupo, con un total de 135 nervios en riesgo incluidos en el estudio. Por lo tanto, el total de nervios incluidos en el estudio fue de 838 (tabla 1).
Total de tiroidectomías / nervios de riesgo incluidos
| Antes/después de introducción neuromonitorización | N.o tiroidectomías totales / nervios | N.o tiroidectomías bilaterales / nervios | N.o tiroidectomías unilaterales / nervios |
|---|---|---|---|
| Antes de neuromonitorización | 411 / 703 | 292 / 584 | 119 / 119 |
| Después de neuromonitorización | 79 / 135 | 56 / 112 | 23 / 23 |
| Total | 490 / 838 | 348 / 696 | 142 / 142 |
De los 490 pacientes incluidos en el estudio, el 88.6% fueron mujeres, mientras que tan solo el 11.4% eran hombres.
Observamos que la proporción de pacientes intervenidos clasificados por patologías antes y después de la introducción de la neuromonitorización conservan similares porcentajes (tabla 2).
Total de patologías tiroideas intervenidas entre 2003-2011
| Frecuencia | Porcentaje (%) | |
|---|---|---|
| Bocio difuso tóxico | 25 | 6 |
| Bocio multinodular | 6 | 1 |
| Bocio multinodular no tóxico | 230 | 46 |
| Bocio nodular derecho | 68 | 14 |
| Bocio nodular izquierdo | 75 | 16 |
| Carcinoma papilar | 62 | 13 |
| Graves Basedow | 12 | 2 |
| Microcarcinoma papilar | 6 | 1 |
| Tiroiditis crónica | 6 | 1 |
| Total | 490 | 100 |
Respecto a la edad, la media de edad es de 44.71 años (IC 95%: 41.77-47.65) y la mediana, de 46 años. La media de la respuesta y latencia de los nervios vagos y recurrentes tras la estimulación se presentan en la tabla 3.
La media de la respuesta y latencia de los nervios vagos y recurrentes tras la neuromonitorización
| Media respuesta / latencia | N. vago derecho V1 (al comienzo) | N. recurrente derecho R1 (al comienzo) | N. recurrente derecho R2 (final) | N. vago derecho V2 (final) | N. vago izquierdo V1 (al comienzo) | N. recurrente izquierdo R1 (al comienzo) | N. recurrente izquierdo R2 (final) | N. vago izquierdo V2 (final) |
|---|---|---|---|---|---|---|---|---|
| Respuesta | 425.57 microvoltios (mediana: 381) | 557.54 microvoltios (mediana: 519) | 525.59 microvoltios (mediana: 448) | 424.6 microvoltios (mediana: 409) | 365 microvoltios (mediana: 350) | 447.28 microvoltios (mediana: 391.5) | 479.94 microvoltios (mediana: 427) | 382.56 microvoltios (mediana: 329.50) |
| Latencia | 8.46±4.7 milisegundos (mediana: 3.8) | 1.9±0.908 milisegundos (mediana: 1.8) | 1.82±0.0849 milisegundos (mediana 1.700) | 3.736±0.1416 milisegundos (mediana: 3.700) | 6.091±0.1490 milisegundos (mediana: 6.000) | 1.99±0.081 milisegundos (mediana: 1.90) | 1.80±0.0569 milisegundos (mediana: 1.800) | 6.144±0.1131 milisegundos (mediana: 6.100) |
Tras comparar las medias del nervio vago al inicio y al final de la intervención quirúrgica respecto a la respuesta y a la latencia, observamos que no existen diferencias estadísticamente significativas en las medias (tabla 4).
Comparación de las medias del nervio vago al inicio y al final de la intervención quirúrgica respecto a la respuesta y a la latencia
| Valor de t-Student | Grado de libertad | Significación (bilateral) | ||
|---|---|---|---|---|
| Par 1 | Respuesta del nervio vago derecho (V1) al inicio de la cirugía vs. Nervio vago derecho final cirugía (V2) | 0.028 | 62 | 0.978 |
| Par 2 | Respuesta del nervio vago izquierdo (V1) al inicio de la cirugía vs. Nervio vago izquierdo final cirugía (V2) | −0.577 | 63 | 0.566 |
| Par 3 | Latencia del nervio vago derecho (V1) al inicio de la cirugía vs. Nervio vago derecho final cirugía (V2) | 0.999 | 62 | 0.322 |
| Par 4 | Latencia del nervio vago izquierdo (V1) al inicio de la cirugía vs. Nervio vago izquierdo final cirugía (V2) | −0.480 | 63 | 0.633 |
Vemos como antes de la neuromonitorización, de 704 nervios en riesgo, hubo 14 lesiones de nervio laríngeo recurrente.
Con el sistema Avalanche®, de 135 nervios en riesgo, no se ha tenido ninguna lesión nerviosa.
En total desde el año 2003, de 839 nervios en riesgo, hay solo 14 lesiones de nervio (1.7%) y todas ocurrieron antes de la neuromonitorización.
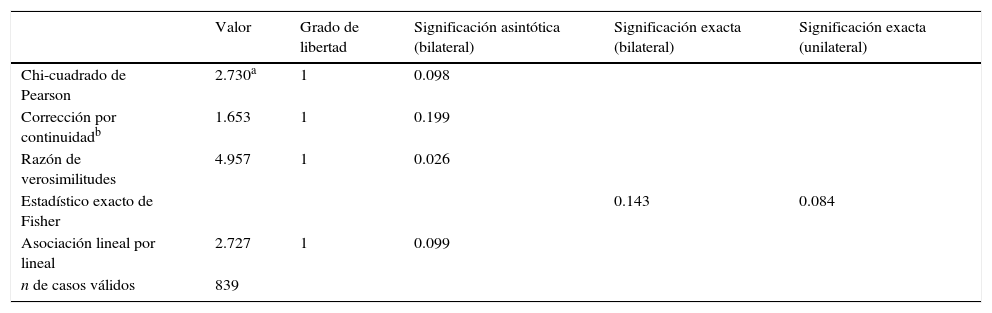
Según el estadístico exacto de Fisher, no hay diferencias significativas entre antes y después de la neuromonitorización, con una p=0.084, aunque seguramente con una muestra mayor se podrían detectar diferencias (tabla 5).
Pruebas de Chi-cuadrado. Comparación antes y después de la introducción de la neuromonitorización
| Valor | Grado de libertad | Significación asintótica (bilateral) | Significación exacta (bilateral) | Significación exacta (unilateral) | |
|---|---|---|---|---|---|
| Chi-cuadrado de Pearson | 2.730a | 1 | 0.098 | ||
| Corrección por continuidadb | 1.653 | 1 | 0.199 | ||
| Razón de verosimilitudes | 4.957 | 1 | 0.026 | ||
| Estadístico exacto de Fisher | 0.143 | 0.084 | |||
| Asociación lineal por lineal | 2.727 | 1 | 0.099 | ||
| n de casos válidos | 839 |
La neuromonitorización de los nervios recurrentes y vagos durante la cirugía tiroidea se ha convertido en un instrumento más de ayuda, para localizar anatómicamente el nervio recurrente. El mayor riesgo de lesión del nervio laríngeo recurrente se produce en: el bocio subesternal, el hipertiroidismo, las reintervenciones, y los tumores malignos14.
La neuromonitorización no se ha universalizado por el costo inicial, pero se convierte en una ayuda técnica imprescindible en centros especializados en cirugía tiroidea. La estimulación indirecta del nervio laríngeo recurrente a través del nervio vago después de la tiroidectomía es más precisa que la estimulación directa. La estimulación indirecta es más sensible en alto riesgo que en los pacientes de bajo riesgo15. En el trabajo de Thomusch et al.16 se concluye que la estimulación indirecta del vago es mejor predictor de la disfunción nerviosa postoperatoria que la estimulación directa del nervio laríngeo recurrente.
Para los cirujanos menos experimentados, la neuromonitorización reduce las parálisis permanentes del nervio laríngeo recurrente. Sin embargo, para los expertos en cirugía tiroidea, alcanzar tasas menores de 1% en cirugía tiroidea benigna de primera intención deja poco margen para que la neuromonitorización sea útil.
La estimulación en las proximidades del nervio puede ayudar a la disección, debido a que algunas variantes anatómicas presentan mayor riesgo de lesión. Un nervio laríngeo recurrente bifurcado es especialmente propenso a las lesiones cerca de la arteria tiroidea inferior o ligamento de Berry. La sensibilidad de la estimulación vagal durante la cirugía fue del 63%, lo que significa que se prevén 2 de cada 3 paresias, durante la cirugía.
La tasa elevada de falsos negativos (no respuesta acústica ni electromiográfica en el sistema sin lesión real) se debe a un mayor número de errores técnicos (como el desplazamiento de los electrodos, errores de conexión o desconocimiento del funcionamiento), y a que la incidencia de parálisis de nervio laríngeo recurrente es baja. También depende de cuando se haga la primera laringoscopia postoperatoria (cuanto antes se haga, más fácil es hallar paresias).
Los cambios de latencia y la amplitud de los potenciales después de la resección tiroidea en comparación con los valores preoperatorios pueden ser más importantes que la señal acústica. Una disminución de la amplitud mayor del 50% o un tiempo de latencia de más del 20% predice disfunción del nervio laríngeo recurrente.
En nuestro estudio, no podemos concluir que la monitorización es útil para conocer la funcionalidad preoperatoria, puesto que ninguno de los 79 pacientes tuvo lesión nerviosa. Sería conveniente, en futuros trabajos, correlacionar las diferencias en estos parámetros en el nervio antes y después de la tiroidectomía, con la funcionalidad (y la repercusión clínica) del nervio. Para esto, obviamente debe haber alguna lesión. Es interesante comentar que, dado que siempre se realizó la localización intraoperatoria del nervio, las diferencias, de existir, deberían ser atribuibles a la introducción del sistema de neuromonitorización.
Respecto a los valores predictivos positivo y negativo, no hemos podido sacar conclusiones debido a que no se han producido lesiones desde que se dispone del sistema de neuromonitorización Avalanche®. En este estudio, dado que no hubo lesión de nervios, la tasa de verdaderos negativos y la tasa de falsos positivos es del 0% en ambas.
La neuromonitorización no prevé de forma fiable la evolución postoperatoria, a pesar de ser útil identificar el nervio laríngeo recurrente, en situaciones anatómicas aberrantes. Un nervio anatómicamente intacto puede mostrar alteración de la función tras la operación, debido al estiramiento neural durante la retracción del bocio.
En un estudio17, el uso de la neuromonitorización no podía disminuir significativamente el riesgo de parálisis del nervio laríngeo y no se halló influencia de la neuromonitorización en otras complicaciones quirúrgicas. La aplicación de la neuromonitorización del nervio es una herramienta útil, pero no sustituye a la identificación intraoperatoria del nervio laríngeo recurrente.
Argumentos a favor de usar la neuromonitorización de forma sistemática: 1) ayuda a localizar el nervio laríngeo recurrente; 2) diferencia la rama anterior y posterior del nervio laríngeo recurrente en caso de bifurcaciones; 3) ayuda a la toma de decisiones en casos difíciles de la cirugía; 4) es útil además en casos de nervio laríngeo inferior no recurrente; 5) facilita la orientación en caso de cirugía compleja: reintervenciones, bocios complejos, y extensión mediastínica, y 6) la neuromonitorización puede detectar que no funcionan los nervios, aunque los nervios visualmente no parezcan lesionados.
Argumentos en contra de la neuromonitorización: 1) el uso de la neuromonitorización puede alargar la intervención quirúrgica; 2) presenta un alto costo; 3) al localizar el nervio vago puede dañarse el simpático cervical; 4) no hay unanimidad en la literatura acerca de una reducción significativa de la parálisis del nervio laríngeo recurrente transitoria o definitiva; 5) parece ser que en cirujanos con mucha experiencia y tasas menores del 1%, no mejoran dichas tasas, y 6) la falta de un protocolo estándar puede conducir a un incremento en la tasa de parálisis recurrencial.
En nuestro estudio, desde septiembre de 2010 se ha aplicado el sistema de la neuromonitorización Avalanche® de forma sistemática a todos los pacientes intervenidos de cirugía tiroidea.
Nosotros planteamos de forma sistemática la combinación de la identificación visual rutinaria del nervio laríngeo recurrente con la neuromonitorización. Algunos resultados coinciden con estudios previos18, en los que se concluye que la neuromonitorización no redujo la tasa de parálisis recurrencial frente a un grupo sin neuromonitorización, señalando la visualización del nervio como el estándar de oro, como en nuestro estudio. Un estudio19 concluye que es necesario normalizar los procedimientos de la neuromonitorización para evitar lesiones, y la tasa de parálisis se redujo significativamente con el uso de la neuromonitorización. Otro estudio17 revela que el uso de la neuromonitorización no podía disminuir significativamente el riesgo de lesión del nervio laríngeo recurrente y que la aplicación de la neuromonitorización es una herramienta útil en la cirugía del tiroides, pero no sustituye a la identificación intraoperatoria del nervio laríngeo recurrente.
ConclusionesEn nuestros resultados, aunque los hallazgos en cuanto a lesión nerviosa se refieren, antes y después de la introducción de la neuromonitorización, no hayan sido estadísticamente significativos, podemos concluir que desde la implantación de la neuromonitorización no se ha registrado ninguna lesión nerviosa recurrencial. Se necesitaría un estudio prospectivo aleatorizado, estratificado y con un tamaño muestral mayor que el estudio actual, para que los resultados sean realmente valorables a medio plazo.
En este estudio, los resultados no se han podido correlacionar con la clínica, pues desde la introducción de la neuromonitorización en 2010 no se ha producido ninguna lesión, y por tanto, todos los valores que se han obtenido son normales.
De todas formas, consideramos que el «estándar de oro» en la cirugía tiroidea debe ser la identificación sistemática del nervio laríngeo recurrente y la neuromonitorización de los mismos, y que nunca debe sustituirla, sino complementarla.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.