La infección de prótesis articular es la complicación más temida y catastrófica, por causar severos daños físicos en los pacientes, y generar elevados costos económicos.
ObjetivosDescribir las características microbiológicas y determinar los patrones de resistencia que se presentan en infecciones de prótesis articular en un hospital de referencia en México.
Material y métodosSe incluyeron pacientes a los que se les retiró la prótesis articular por sospecha de aflojamiento aséptico y séptico. Se hizo búsqueda microbiológica y análisis de susceptibilidad.
ResultadosSe incluyeron 111 pacientes, el 55% se diagnosticaron con infección de prótesis articular, siendo la más frecuente la prótesis de cadera (43%). En el 97% de los casos infectados se tuvieron cultivos positivos, el 75% fueron infecciones monomicrobianas. Las especies bacterianas aisladas con mayor frecuencia fueron: Staphylococcus epidermidis (31%), Enterococcus faecalis (16%), Staphylococcus aureus (13%) y Escherichia coli (8%). El patrón de resistencia en las 2 primeras fue: oxacilina (79%), eritromicina (45%) y, ciprofloxacino (37%). Enterococcus faecalis mostró alto porcentaje de resistencia para: eritromicina y clindamicina (86%), y fluoroquinolonas (43%). El 86% de las Escherichia coli tenían betalactamasas de espectro extendido, además de alta resistencia para fluoroquinolonas (86%), trimetoprim/sulfametoxazol (86%) y gentamicina (72%).
ConclusiónLas características microbiológicas encontradas en infecciones de prótesis articular varía de acuerdo a los centros hospitalarios; en esta serie se encontró una proporción alta de Staphylococcus coagulasa negativos y Enterococcus spp., así como una alta resistencia bacteriana.
The prosthetic joint infection is the most feared and catastrophic complication for cause severe physical damage to patients and, generates high economic costs.
ObjectivesTo describe the microbiological characteristics and to determine the resistance pattern in prosthetic joint infections in a reference hospital in Mexico.
Material and methodsPatients whose prosthetic devices were withdrawn due to suspicion of septic and aseptic loosening were included. Cultures were performed to identify microorganisms and susceptibility analysis.
ResultsOf the 111 patients included, 55% were diagnosed with prosthetic joint infection, with the most frequent prosthesis being of the hip (43%). Positive cultures were obtained in 97% of the infected cases, of which 75% were monomicrobial infections. The most frequent bacterial species isolated were: Staphylococcus epidermidis (31%), Enterococcus faecalis (16%), Staphylococcus aureus (13%), and Escherichia coli (8%). The resistance patterns for the Staphylococcus genus were: oxacillin (79%), erythromycin (45%) and ciprofloxacin (37%). Enterococcus faecalis showed a high percentage of resistance to erythromycin and clindamycin (86%), and fluoroquinolones (43%). The large majority (86%) of Escherichia coli were extended spectrum beta-lactamases positive, in addition to having high resistance to fluoroquinolones (86%), trimethoprim/sulfamethoxazole (86%) and gentamicin (72%).
ConclusionThe microbiological characteristics found in prosthetic joint infections vary according to the hospitals. In this series, a high proportion of coagulase-negative Staphylococci and Enterococcus spp. were found, as well as a high bacterial resistance.
La colocación de prótesis articulares es una opción terapéutica para mejorar la movilidad y calidad de vida de los pacientes que sufren desgaste articular1; sin embargo, en un número reducido de casos la implantación del material protésico puede ocasionar complicaciones que afectan al paciente y el éxito de la cirugía. Las complicaciones más comunes asociadas a las artroplastias son el aflojamiento aséptico y la infección de prótesis articular (IPA), siendo esta última la más seria y catastrófica, ya que suele generar secuelas físicas irreversibles con elevados costos económicos, por la administración prolongada de tratamientos antimicrobianos y constantes estancias hospitalarias2,3.
En general los agentes etiológicos más comunes en infecciones de prótesis articular pertenecen al género Staphylococcus, de los cuales la especie más frecuente es Staphylococcus aureus (S. aureus)4; sin embargo, se ha observado que dependiendo de la zona geográfica o del centro hospitalario, la distribución de estas cambia. Por ejemplo Bejon et al.5 describen que en un centro ortopédico de Oxford en Reino Unido las especies más frecuentes pertenecen a los Staphylococci coagulasa negativa. Así como hay diferencia entre la distribución de los microorganismos, también existe diferencia en los patrones de resistencia antimicrobiana6,7.
En México, los estudios publicados hasta el momento sobre infecciones de prótesis articular no describen con detalle las características microbiológicas y los patrones de resistencia antimicrobiana8–10 por lo que conocer la epidemiología microbiana y la susceptibilidad antimicrobiana de este tipo de infecciones es de suma importancia para generar pautas preventivas y optimizar los tratamientos antimicrobianos empíricos que se usan para prevenir infecciones relacionadas con prótesis articulares.
El objetivo de este estudio fue describir las características microbiológicas y, determinar los patrones de resistencia antimicrobiana que se presentan en las infecciones de prótesis articular que se atienden o refieren al Instituto Nacional de Rehabilitación, el cual es el hospital de referencia más grande en México de la Secretaría de Salud y que se especializa en atender patologías musculoesqueléticas y en realizar artroplastias primarias y de revisión.
Materiales y métodosSe realizó un estudio transversal, descriptivo, observacional; del 20 noviembre de 2011 al 23 de noviembre de 2013. Fueron incluidos todos aquellos pacientes a los que se les retiró la prótesis articular por aflojamiento aséptico o séptico; además de que se les hayan tomado por lo menos 3 biopsias de tejido periprotésico, para diagnóstico microbiológico.
Definición de infección de prótesis articularSe definió como IPA cuando los pacientes cumplieron con los siguientes criterios:
- 1.
Dos cultivos positivos de tejido periprotésico o cultivo positivo de prótesis articular, con microorganismos fenotípicamente idénticos.
- 2.
Formación de fístula en la prótesis articular.
- 3.
Tener 3 de los siguientes criterios menores: a. Elevación de proteína C reactiva sérica y velocidad de sedimentación globular. b. Conteo elevado de células blancas en líquido sinovial. c. Porcentaje elevado de neutrófilos polimorfonucleares en líquido sinovial. d. Análisis histológico positivo del tejido periprotésico. e. Un cultivo positivo.
Los tejidos periprotésicos fueron colocados en medios de transporte e inmediatamente llevados al laboratorio. Posteriormente fueron macerados y homogenizados en 2ml de solución salina (0.85%) estéril. Del macerado se tomaron alícuotas de 0.1ml que fueron sembradas en los siguientes medios de cultivo: agar sangre de carnero 5%, agar MacConkey, agar feniletilalcohol, agar Sabouraud con antibiótico y caldo tioglicolato. Las condiciones y tiempos de cultivo que se utilizaron fueron: para microorganismos aerobios 37°C; 7días, hongos temperatura ambiente; 30días, microorganismos anaerobios 37°C; 2días.
Cultivo de prótesis articularEl cultivo de prótesis articular se realizó mediante la técnica de sonicación descrita por Trampuz et al.4 brevemente. La prótesis articular fue colocada en un recipiente estéril de polipropileno. Posteriormente se adicionaron 400ml de solución salina (0.85%) al recipiente. En seguida este fue colocado en un baño ultrasónico (BRANSON 3510, EE. UU.) a 40kHz durante 5min. Una vez transcurrido el tiempo se tomaron alícuotas de 0.1ml del líquido de sonicación, las cuales fueron sembradas y cultivadas en las mismas condiciones que los tejidos periprotésicos.
Identificación y ensayos de susceptibilidad de los microorganismosA los cultivos que presentaron desarrollo se les realizó identificación y ensayos de susceptibilidad con el equipo semiautomatizado Vitek 2 (BioMériux, Francia), de acuerdo a las recomendaciones del fabricante.
El análisis de los resultados se hizo con estadística descriptiva (promedio, mediana y frecuencias), utilizando el software Stata 12.0.
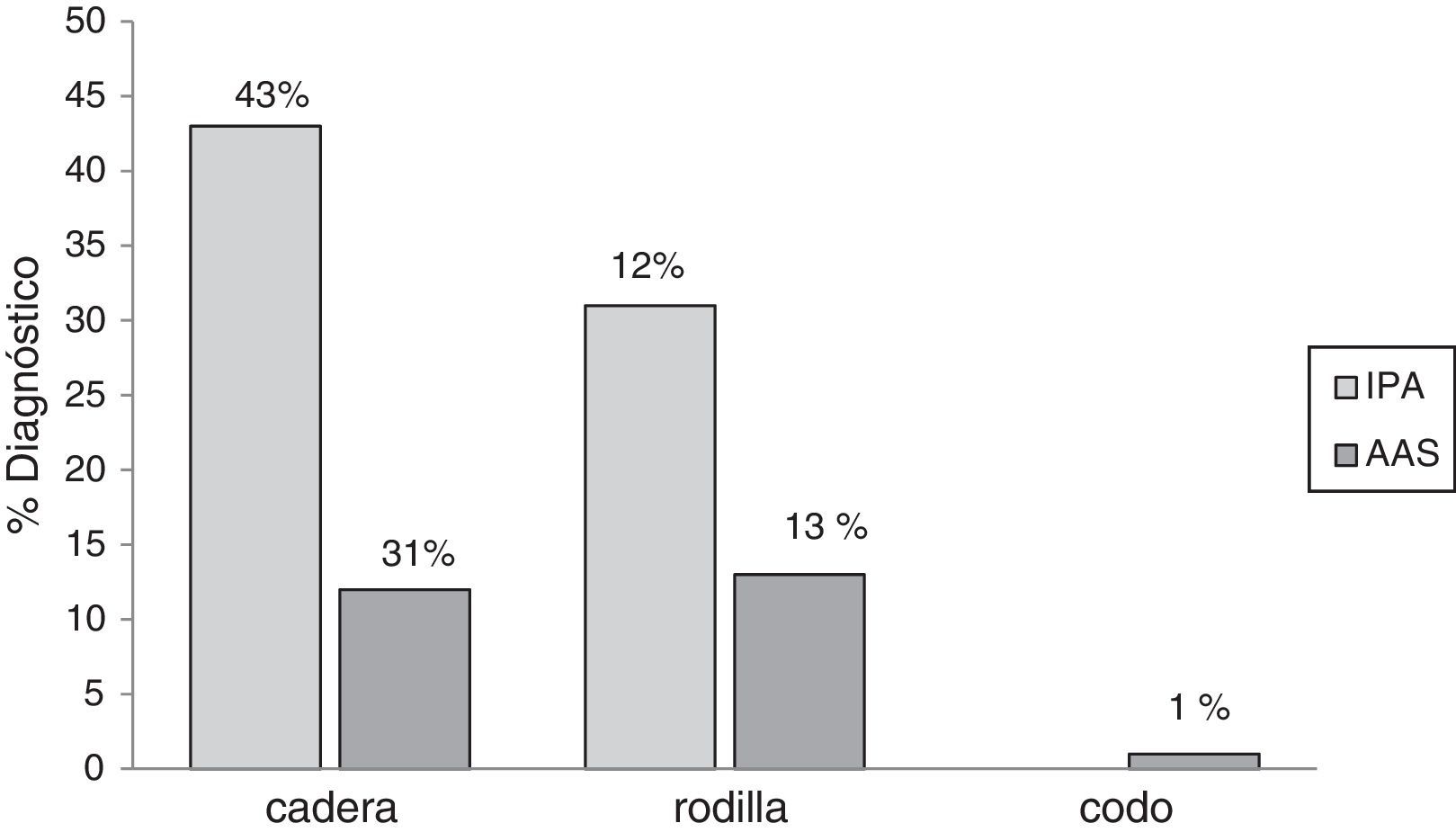
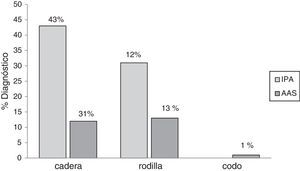
ResultadosSe incluyeron 111 pacientes a los que se les retiró la prótesis articular. Setenta y cinco (68%) pacientes eran del género femenino y la mediana de edad fue 64 años (19-91). Los tipos de prótesis articulares retiradas fueron: cadera, 83 (75%); rodilla, 27 (24%); y codo, una (1%). En promedio, por cada paciente se cultivaron 3 muestras de tejido periprotésico (rango, 3-6 muestras). De los pacientes incluidos 62 (55%) se diagnosticaron como IPA; siendo las prótesis de cadera las que más se infectaron (fig. 1).
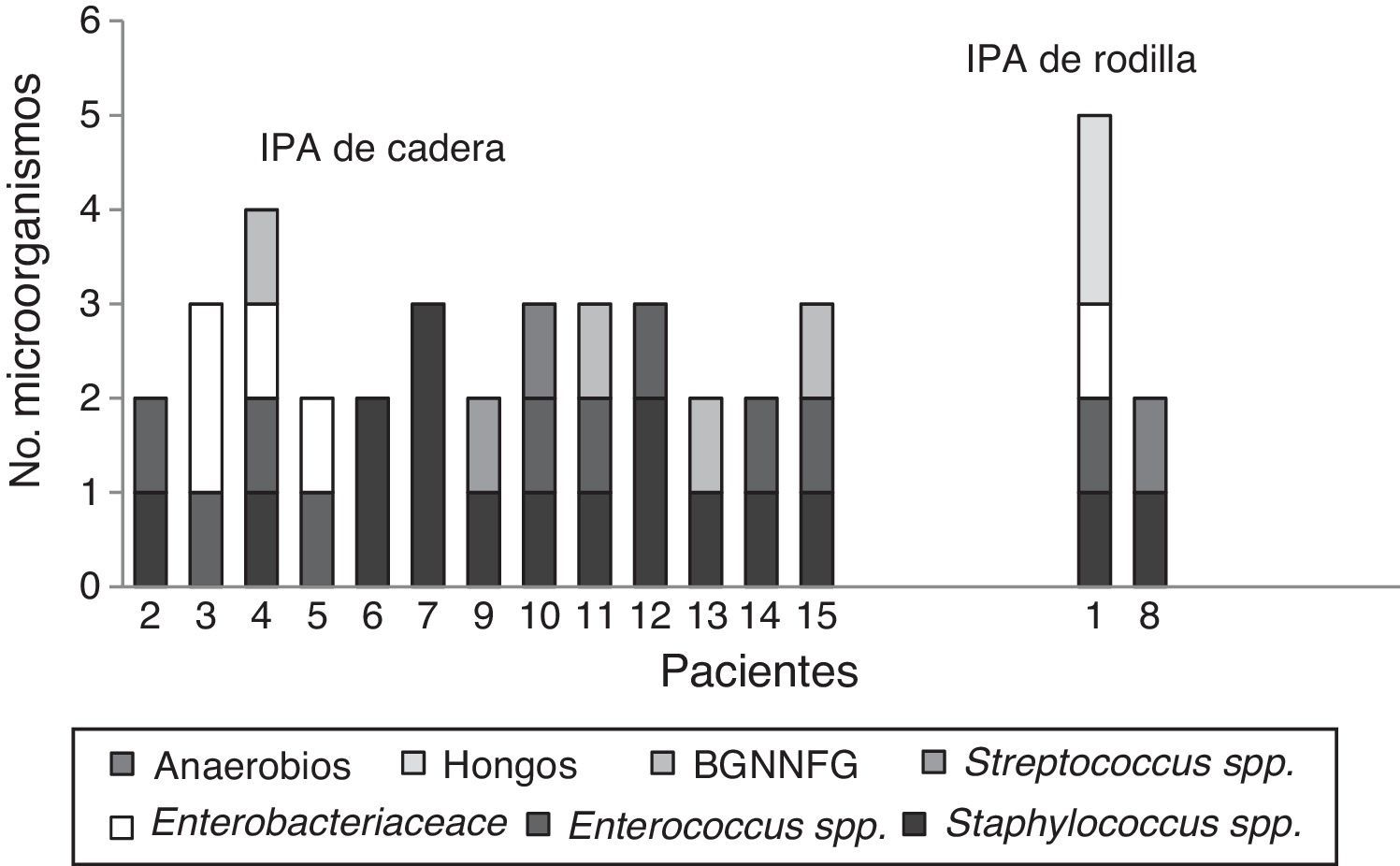
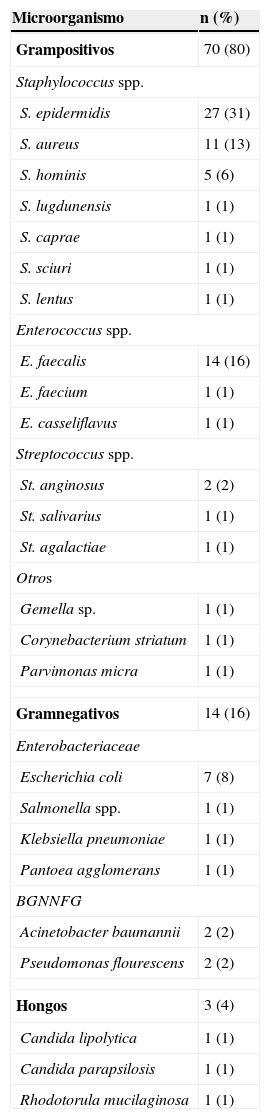
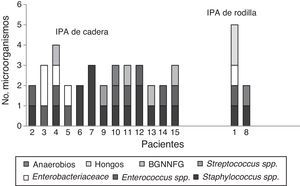
En 59 (97%) pacientes con IPA se obtuvieron cultivos positivos, los 3 restantes se diagnosticaron clínicamente, por la presencia de fístula. Cuarenta y cuatro (75%) fueron infecciones monomicrobianas y 15 (25%) polimicrobianas. De los microorganismos aislados, 70 (80%) eran grampositivos, 14 (16%) gramnegativos y 3 (4%) hongos (tabla 1). Las especies bacterianas aisladas con mayor frecuencia fueron en primer lugar Staphylococcus epidermidis (S. epidermidis), seguido por Enterococcus faecalis (E. faecalis), S. aureus y Escherichia coli (E. coli), 27 (31%), 14 (16%), 11 (13%) y 7 (8%), respectivamente. En las IPA polimicrobianas, el promedio de microorganismos aislados fue de 3 especies (rango, 2-4 especies). La figura 2 describe las características microbiológicas de este tipo de infecciones.
Distribución de los microorganismos aislados en los cultivos positivos
| Microorganismo | n (%) |
|---|---|
| Grampositivos | 70 (80) |
| Staphylococcus spp. | |
| S. epidermidis | 27 (31) |
| S. aureus | 11 (13) |
| S. hominis | 5 (6) |
| S. lugdunensis | 1 (1) |
| S. caprae | 1 (1) |
| S. sciuri | 1 (1) |
| S. lentus | 1 (1) |
| Enterococcus spp. | |
| E. faecalis | 14 (16) |
| E. faecium | 1 (1) |
| E. casseliflavus | 1 (1) |
| Streptococcus spp. | |
| St. anginosus | 2 (2) |
| St. salivarius | 1 (1) |
| St. agalactiae | 1 (1) |
| Otros | |
| Gemella sp. | 1 (1) |
| Corynebacterium striatum | 1 (1) |
| Parvimonas micra | 1 (1) |
| Gramnegativos | 14 (16) |
| Enterobacteriaceae | |
| Escherichia coli | 7 (8) |
| Salmonella spp. | 1 (1) |
| Klebsiella pneumoniae | 1 (1) |
| Pantoea agglomerans | 1 (1) |
| BGNNFG | |
| Acinetobacter baumannii | 2 (2) |
| Pseudomonas flourescens | 2 (2) |
| Hongos | 3 (4) |
| Candida lipolytica | 1 (1) |
| Candida parapsilosis | 1 (1) |
| Rhodotorula mucilaginosa | 1 (1) |
BGNNFG: bacilos gramnegativos no fermentadores de glucosa.
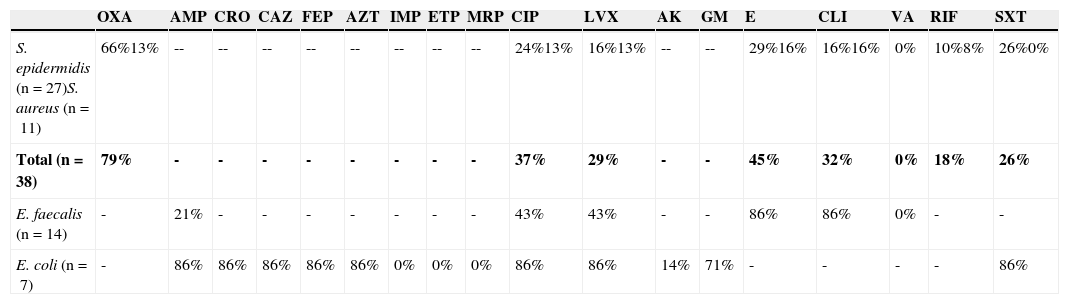
En la tabla 2 se muestra el porcentaje de resistencia a diversos antibióticos, en las 4 especies de microorganismos que se aislaron con mayor frecuencia. Se encontró una elevada resistencia antimicrobiana a oxacilina (79%), eritromicina (45%), ciprofloxacino (37%) y clindamicina (32%) en S. epidermidis y S. aureus. E. faecalis mostró resistencia para eritromicina (86%), clindamicina (86%), ciprofloxacino (43%) y levofloxacino (43%). Ninguno de los cocos grampositivos fue resistente a vancomicina. El 86% de las cepas de E. coli aisladas fueron betalactamasas de espectro extendido positivo; además presentaron resistencia para ciprofloxacino (86%), levofloxacino (86%), trimetoprim/sulfametoxazol (86%) y gentamicina (71%).
Patrón de resistencia a distintos antibióticos de las 4 especies de microorganismos aislados con mayor frecuencia
| OXA | AMP | CRO | CAZ | FEP | AZT | IMP | ETP | MRP | CIP | LVX | AK | GM | E | CLI | VA | RIF | SXT | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S. epidermidis (n=27)S. aureus (n=11) | 66%13% | -- | -- | -- | -- | -- | -- | -- | -- | 24%13% | 16%13% | -- | -- | 29%16% | 16%16% | 0% | 10%8% | 26%0% |
| Total (n=38) | 79% | - | - | - | - | - | - | - | - | 37% | 29% | - | - | 45% | 32% | 0% | 18% | 26% |
| E. faecalis (n=14) | - | 21% | - | - | - | - | - | - | - | 43% | 43% | - | - | 86% | 86% | 0% | - | - |
| E. coli (n=7) | - | 86% | 86% | 86% | 86% | 86% | 0% | 0% | 0% | 86% | 86% | 14% | 71% | - | - | - | - | 86% |
AK: amikacina; AMP: ampicilina; AZT: aztreonam; CAZ: ceftazidima; CIP: ciprofloxacino; CLI: clindamicina; CRO: ceftriaxona; E: eritromicina; ETP: ertapenem; FEP: cefepime; GM: gentamicina; IMP: imipenem; LVX: levofloxacino; MRP: meropenem; OXA: oxacilina; RIF: rifampicina; SXT: trimetoprim/sulfametoxazol; VA: vancomicina.
En negrita los resultados globales de sensibilidad de los Staphylococcus (S. epidermidis y S. aureus).
El remplazo articular en las últimas décadas se ha convertido en uno de los procedimientos quirúrgicos más frecuentes en países industrializados11. Esta cirugía mejorara la movilidad y calidad de vida de los pacientes que sufren desgaste en las articulaciones; sin embargo, en algunos casos pueden presentarse complicaciones; que afectan al paciente y el éxito de la cirugía. Entre las complicaciones más comunes que suelen presentarse después de un procedimiento de remplazo articular están el aflojamiento aséptico y la infección12. En un estudio publicado por Zhang et al.13 se describe que de 10,000 artroplastias de cadera y rodilla practicadas en Australia durante el 2013, el 13% fueron artroplastias de revisión por problemas con la prótesis articular, de estas, el 29% fueron aflojamientos asépticos y el 20% IPA. Allepuz et al.1 calcularon que de 6,027 artroplastias de revisión practicadas en 2 hospitales de referencia en España durante un año, el 13% fueron por aflojamiento aséptico y el 17% IPA. El número de aflojamientos asépticos e IPA que nosotros encontramos fue mucho más alto con respecto a las cifras antes mencionadas, siendo la segunda la más frecuente, ya que un poco más de la mitad de los pacientes a los que se les retiró la prótesis articular fue por presentar infección. La IPA es de las complicaciones más serias y catastróficas, debido a que la mayoría de los casos suelen sufrir secuelas físicas irreversibles; además de que su tratamiento genera elevados costos económicos a los sistemas de salud14.
Las causas más comunes por las que se puede desarrollar IPA son la contaminación directa del material protésico durante la cirugía con: bacterias de piel, provenientes del personal médico o del mismo paciente; por vía hematógena: cuando se cursa con bacteriemias en otro sitio del cuerpo, y por pérdida de la continuidad de la piel o cuando hay procesos infecciosos en los tejidos blandos que circundan a la misma prótesis articular15,16.
En la literatura se describe que los principales microorganismos causantes de este tipo de infecciones son: en primer lugar los cocos grampositivos (70%), seguidos de bacilos gramnegativos (20%) y hongos en menos del 1%17,18. De los primeros, las especies más frecuentes son: S. aureus (45%), S. epidermidis (36%) y Enterococcus spp. (10%)19,20. En este estudio se aislaron porcentajes similares de cocos grampositivos, pero por especie observamos que S. epidermidis y Enterococcus spp. fueron los más frecuentes; estos últimos incluso en mayor número con respecto a S. aureus, el cual es de los microorganismos más importantes en IPA21. Las especies de Enterococcus spp. causan varios tipos de infecciones, principalmente infecciones nosocomiales, endocarditis, infección del tracto urinario así como infecciones intraabdominales y pélvicas22. Aunque no es un patógeno común para las infecciones ortopédicas, hay un número importante de informes que demuestran un incremento de las infecciones ortopédicas por Enterococcus spp.23 Tornero E et al.24 realizaron un estudio multicéntrico para describir las características clínicas y microbiológicas de IPA por Enterococcus spp. en el estudio se muestra que aproximadamente el 9.3% de las IPA son causadas por estos microorganismos, siendo E. faecalis y Enterococcus faecium las especies que más se aíslan, principalmente en IPA polimicrobianas. Como se ha mencionado anteriormente, nosotros encontramos un número importante de IPA por Enterococcus spp. y las especies que más aislamos fueron las mismas que reportaron Tornero et al. además de que también se aislaron de infecciones polimicrobianas (69%). En las IPA polimicrobianas por Enterococcus spp, nosotros observamos que estas estaban de manera conjunta con: Staphylococcus spp, Enterobacteriacea y Pseudomonas aeruginosa (P. aeruginosa). Otra característica observada es que los Enterococcus spp. fueron aislados principalmente en prótesis de cadera (81%), esto podría asociarse con malas técnicas de aseo prequirúrgico o por la cercanía de la zona genital.
Con respecto a los bacilos Gram negativos en IPA, estudios epidemiológicos como el de Rodríguez Pardo y su grupo de trabajo25 describen que las especies más frecuentes causantes de este tipo de infecciones son: Enterobacteriaceae (78%), P. aeruginosa (20%) y otros bacilos gramnegativos (2%). De las primeras, E. coli y Enterobacter spp. son las más comunes. Zmistowski et al.26 publicaron un estudio similar y describen que la mayoría de los pacientes que presentaron IPA por bacilos gramnegativos se asociaron con infecciones primarias de vías urinarias. En nuestro estudio aislamos este mismo tipo de bacterias gramnegativas; sin embargo, cabe mencionar que en un caso se aisló Salmonella spp. Las IPA por Salmonella spp. son raras y generalmente se asocian por contaminación vía hematógena, cuando los pacientes presentan infección del tracto gastrointestinal27. Nosotros no pudimos descifrar el origen de la IPA por Salmonella spp. ya que no contamos con suficientes datos clínicos del paciente.
Las IPA normalmente son causadas por bacterias y en muy pocos casos por hongos; sin embargo, en pacientes con IPA crónicas y que llevan mucho tiempo con terapia antimicrobiana, se incrementa el riesgo de que la prótesis se infecte con hongos28. De acuerdo con la frecuencia de hongos en IPA se ha reportado su aislamiento en menos del 1%, siendo Candida spp. el género más común, y por especie, es C. albicans29,30. El porcentaje de hongos que nosotros aislamos fue alto con respecto a lo publicado anteriormente; de todas las especies que cultivamos, la mayoría eran distintas a C. albicans.
Otros de los microorganismos que en los últimos años han adquirido relevancia en IPA son las bacterias anaerobias, las cuales son difíciles de aislar e identificar porque requieren de medios de cultivo especializados y largos tiempos de incubación31. Para solucionar este problema se ha sugerido el uso de sistemas automatizados. Minassian et al.32 usaron el sistema BD BACTECTM como herramienta para diagnosticar IPA; en su estudio los autores recuperaron con este sistema una cantidad importante de bacterias anaerobias, principalmente Propionibacterium spp, que es una bacteria que se aísla en bajo porcentaje y que se reconoce como causante de IPA33. Nosotros aislamos un número muy reducido de bacterias anaerobias, a pesar de que tenemos optimizadas las condiciones de cultivo para aislar este tipo de microorganismos y usamos medios de cultivo altamente especializados (caldo tioglicolato y agar feniletilalcohol). Para incrementar la recuperación de este tipo de microorganismos se sugiere implementar técnicas de biología molecular, como por ejemplo: la amplificación del gen 16s ARN, el cual ha demostrado ser efectivo en el diagnóstico de IPA34.
El uso indiscriminado de los antibióticos ha ocasionado que muchas de las bacterias presenten altos porcentajes de resistencia antimicrobiana35. Esta alta resistencia es la principal causa de que de las terapias antimicrobianas profilácticas fallen en la prevención de IPA36. En un estudio multicéntrico publicado por Tornero et al.37 donde se describe la resistencia en S. aureus y S. epidermidis aislados de IPA entre 1999 y 2009, se encontró que aproximadamente el 9% de los S. aureus eran resistentes a meticilina, mientras que la resistencia para este mismo antibiótico en S. epidermidis fue del 60%; la resistencia para fluoroquinolonas en estas bacterias fue del 16% y del 35%, respectivamente. En nuestro estudio observamos porcentajes de resistencia mucho más altos para fluoroquinolonas en S. aureus y S. epidermidis. Martínez Pastor et al.38 en un estudio similar describen la resistencia en bacilos gramnegativos, principalmente de E. coli, las cuales fueron aisladas de IPA entre 2000 y 2007, en un hospital ortopédico de España; estos autores en sus resultados mencionan que el 85% de las E. coli que aislaron de IPA fueron productoras de betalactamasas de espectro extendido y el 50% mostraban resistencia a fluoroquinolonas. El porcentaje de cepas de E. coli productoras de betalactamasas de espectro extendido que nosotros encontramos fue similar al que reportan Martínez Pastor et al.38 sin embargo, la resistencia a fluoroquinolonas fue mucho más alta. La resistencia a ampicilina en los E. faecalis que nosotros aislamos no fue tan alta (21%), lo cual llama la atención ya que en los últimos años se ha observado que las cepas clínicas de E. faecalis aisladas en distintos tipos de infecciones muestran susceptibilidad disminuida para este antibiótico, por lo que se ha tenido que utilizar fármacos de mayor espectro39. En general las diferencias en los patrones de resistencia entre las distintos microorganismos aislados en IPA se deben a la selección clonal por presión selectiva, la cual es producto del uso indiscriminado de los antibióticos, y al tipo de terapias antimicrobianas que se utilizan en las distintas zonas geográficas y los diversos hospitales40.
Por último, el mayor aporte que tiene este estudio es el análisis detallado de las características microbiológicas y patrones de resistencia antimicrobiana que se presentan en IPA. Los resultados que aquí se muestran son trascendentes, ya que el Instituto Nacional de Rehabilitación es uno de los centros de referencia más importantes en México, por lo que estas mismas características podrían estarse presentando en centros muchos más pequeños. Ahora sería importante analizar si las terapias antimicrobianas profilácticas que se usan en el país para prevenir IPA son efectivas, ya que encontramos mucha mayor resistencia antimicrobiana en los microorganismos que causan este tipo de infecciones.
ConclusiónLas características microbiológicas encontradas en IPA varía de acuerdo a los centros hospitalarios; en esta serie se encontró una proporción alta de Staphylococci coagulasa negativos y Enterococcus spp, así como una alta resistencia antimicrobiana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.