El melanoma es una neoplasia cutánea común que ha alcanzado gran importancia en las últimas décadas debido al aumento en su incidencia y a su comportamiento agresivo, con metástasis ganglionares y a distancia frecuente. La biopsia, en caso de sospecharse melanoma, debe ser escisional, con el objetivo de obtener información histológica completa y analizar factores de mal pronóstico, como ulceración, número de mitosis y el Breslow, que influyen en la estadificación preoperatoria del paciente y en la decisión de realizar biopsia de ganglio centinela o no. La escisión local amplia es el manejo indicado para el melanoma con márgenes periféricos de piel normal ya establecidos de acuerdo al Breslow y a la localización del tumor. La linfadenectomía terapéutica es el tratamiento recomendado de los pacientes con melanoma que tienen ganglios linfáticos clínica o radiológicamente positivos.
En este artículo se realiza una revisión del tratamiento quirúrgico del melanoma, la toma adecuada de biopsia de lesiones sospechosas, los factores histológicos adversos, las indicaciones de biopsia del ganglio centinela y de linfadenectomía radical. Además se revisan situaciones especiales en las cuales el manejo del melanoma difiere por su localización (acral plantar, subungueal, lentigo maligno) o diagnóstico durante el embarazo.
Melanoma is a common cutaneous tumour. It is of great importance due to its increasing incidence and aggressive behaviour, with metastasis to lymph nodes and internal organs. When suspecting melanoma, excisional biopsy should be performed to obtain complete histological information in order to determine the adverse factors such as ulceration, mitosis rate, and Breslow depth, which influence preoperative staging and provide data for sentinel lymph biopsy decision making. The indicated management for melanoma is wide local excision, observing recommended and well-established excision margins, depending on Breslow depth and anatomical location of the tumour. Therapeutic lymphadenectomy is recommended for patients with clinically or radiologically positive lymph nodes.
This article reviews surgical treatment of melanoma, adverse histological factors, sentinel lymph node biopsy, and radical lymphadenectomy.
Details are presented on special situations in which management of melanoma is different due to the anatomical location (plantar, subungual, lentigo maligna), or pregnancy.
El melanoma cutáneo primario es una de las neoplasias cutáneas más comunes. Es la quinta neoplasia maligna más común en hombres y la sexta en frecuencia en mujeres; se asocia con una alta morbimortalidad debido a su comportamiento agresivo, por su alto riesgo de metástasis nodal regional y a distancia1. Se estima que en Estados Unidos en 2014 se diagnosticará un melanoma aproximadamente a 76,000 personas, y 9,710 muertes serán atribuidas a este cáncer2. De todas las muertes relacionadas con el cáncer cutáneo, el melanoma explica el 75% de ellas. Sin embargo, se cree que estas cifras son una subestimación de la realidad, ya que una cantidad considerable de melanomas in situ o superficiales no son reportadas. El riesgo durante la vida de adquirir un melanoma in situ o invasivo se ha incrementado de forma notable, de 1 en 30 en comparación con 1 en 1,500 en 19353.
EpidemiologíaSi bien el melanoma tiene un pico de presentación entre la quinta y la sexta décadas de la vida4, su incidencia en personas de entre 25 y 29años se ha incrementado como el cáncer más común en este grupo de edad. El 95% de los casos se originan en la piel, el resto tienen origen en ojos y mucosas (oral, vagina o ano)5, y del 3 al 10% de las personas se presentan con enfermedad metastásica sin lesión primaria clínicamente evidente6.
Enfoque diagnósticoAnte la sospecha de melanoma se debe realizar un examen físico completo de toda la piel, que incluya las mucosas oral y anogenital, las palmas de las manos y, las plantas de los pies. La dermatoscopia7 es una técnica diagnóstica de interés creciente en el estudio de tumores cutáneos, especialmente los pigmentados; también se usan técnicas de imagenología digital computada avanzada.
Una vez detectadas las lesiones pigmentadas sospechosas de melanoma, se debe realizar biopsia escisional (1-3mm de margen)8, idealmente con márgenes negativos. En las extremidades, esta debe ser dirigida de forma longitudinal con el objetivo de no alterar posteriormente el resultado del ganglio centinela9.
La biopsia apropiada debe permitir valorar el Breslow, ya que de esto dependerán los exámenes de extensión que se requieran, el margen quirúrgico definitivo y el pronóstico del paciente. El Breslow es la profundidad que alcanza el melanoma medido en milímetros desde la capa más superficial de la epidermis hasta el mayor punto de penetración. A mayor Breslow peor pronóstico del paciente y menores tasas de curación.
La biopsia escisional, no es apropiada en: palmas de manos, plantas de pies, cara, dedos, región subungueal, pabellón auricular o en lesiones muy grandes; y en estos casos esta indicada una biopsia incisional es aceptada, tomando la porción que clínicamente demuestra ser más profunda. En caso de que la biopsia incisional no permita una microestadificación certera del paciente —lo que es frecuente debido a una subestimación del grosor de la lesión—, es apropiado repetir el procedimiento, y de preferencia se debe proceder a la biopsia escisional10.
Estadificación preoperatoriaCuando se confirma el diagnóstico de melanoma, es necesaria la estadificación del paciente. Esta es determinada por el grosor, las características histológicas del melanoma y la extensión locorregional de la enfermedad. La estadificación permite evaluar el riesgo de metástasis ganglionar y sistémica del melanoma, que aumenta de acuerdo al grosor de la lesión. La recomendación, según las guías del NCCN (National Comprehensive Cancer Network, por sus siglas en inglés), 2014 10, es que en paciente con estadiosi y ii no se realicen exámenes de extensión de rutina, solo en el caso de que el paciente presente síntomas o signos de enfermedad distante al tumor primario. Por el contrario, sí se hace énfasis en la realización de un examen físico cutáneo completo, de las vías linfáticas regionales y de la cuenca ganglionar. En caso de dudas en el examen físico ganglionar, se sugiere una ecografía de la cuenca ganglionar antes de biopsia del ganglio centinela. Si en la ecografía se encuentra una lesión sospechosa, esta debe confirmarse histológicamente. Para pacientes en estadioiii con ganglio centinela positivo (clínicamente negativos) los panelistas dejan a decisión del médico tratante la realización de tomografía computada (TC) o tomografía por emisión de positrones (PET)/TC. Consideran apropiada la confirmación histológica de la invasión ganglionar a través de la aspiración con aguja fina, biopsia del núcleo o biopsia abierta, así como estudios de imagen para propósitos de estadificación y evaluación de síntomas y signos específicos en pacientes con melanoma estadioiii con ganglios clínicamente positivos. Para pacientes con melanoma estadioiv con metástasis a distancia, el consenso recomienda confirmar histológicamente la metástasis e idealmente realizar estudio genético (mutación de BRAF o c-Kit) para inicio de terapia dirigida, deshidrogenasa láctica (marcador pronóstico) adicional a estudios de imagen (TC con o sin PET/TC), donde se incluya resonancia magnética (RMI) o TC contrastada de sistema nervioso central debido a la alta incidencia de metástasis cerebrales en pacientes en estadioiv.
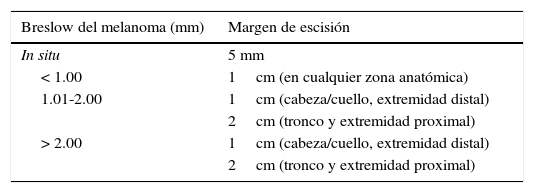
Manejo quirúrgicoLa cirugía indicada para la erradicación de este tumor, también conocida como escisión radical amplia, es el manejo adecuado del melanoma cutáneo primario, en estadiosi-iii, e incluyendo los casos con metástasis regional nodal. El objetivo fundamental es la extirpación tanto del tumor visible como microscópico, y de satélites microscópicos y macroscópicos. Este tipo de cirugía requiere el cumplimiento de 2 aspectos: que la resección del tumor primario incluya un margen periférico de piel normal medido a partir del borde visible de cualquier pigmentación residual, tejido lesional o cicatriz de la biopsia, y que el margen profundo de la escisión se extienda hasta la fascia muscular11. Sin embargo, no se ha demostrado que incluir la fascia muscular dentro de la resección, sea suficiente para que el procedimiento sea exitoso12. En cuanto a los márgenes de escisión adecuados, se han investigado ampliamente en estudios clínicos aleatorizados13,14, encontrándose la necesidad de ampliar los márgenes a medida que aumenta el Breslow del melanoma10 (tabla 1). Se considera poco probable que márgenes mayores de 2cm impacten significativamente en la recurrencia local (12%) y la pobre sobrevida a 5años (55%) que tienen los pacientes con melanomas con Breslow mayor de 4mm, ofreciendo un manejo adecuado que, funcional y estéticamente, es más aceptable para el paciente15. La evidencia demuestra que la falla en los procedimientos más radicales, como márgenes de 3-5cm y amputación de extremidades, se debe al comportamiento agresivo intrínseco del melanoma y no a un inadecuado manejo quirúrgico primario. La persistencia de márgenes quirúrgicos positivos para melanoma, en el examen histológico de la extirpación, demanda la realización de una segunda escisión. En los casos en que no es posible lograr márgenes negativos libres de tumor se ha sugerido la radioterapia complementaria, que ha demostrado la disminución de las tasas de recidiva local de algunos tipos histológicos de melanoma16,17.
Márgenes de escisión según el Breslow
| Breslow del melanoma (mm) | Margen de escisión |
|---|---|
| In situ | 5 mm |
| < 1.00 | 1cm (en cualquier zona anatómica) |
| 1.01-2.00 | 1cm (cabeza/cuello, extremidad distal) |
| 2cm (tronco y extremidad proximal) | |
| > 2.00 | 1cm (cabeza/cuello, extremidad distal) |
| 2cm (tronco y extremidad proximal) |
Adaptada de las Guías del NCCN 2014.4.
Los melanomas con localización en palmas manos, plantas de pies, cabeza, cuello y aquellos que histológicamente están asociados a ulceración, invasión angiolinfática, satelitosis o Breslow alto tienen mayor riesgo de recurrencia local después de la escisión radical amplia. En el estudio de Balch et al. de 200118 se demostró que para los melanomas de 1 a 4mm de grosor la recurrencia local se asocia con mortalidad elevada, y que demostrar la ulceración en el melanoma primario es el factor pronóstico más importante que nos debe alertar del riesgo de una elevada recurrencia local y de metástasis.
Se recomienda la reconstrucción del defecto residual con cierre primario o injerto de espesor total o parcial en la mayoría de los casos. La realización de colgajos solo está indicada en los casos en los cuales los defectos primarios sean muy grandes para realizar los procedimientos previamente mencionados. Si el injerto es la mejor opción para la reconstrucción de un defecto localizado en extremidades, no debe ser recolectado de la extremidad proximal, ya que esto podría potencialmente reintroducir células tumorales a la herida reconstruida.
La mayoría de las guías recomiendan manejar con márgenes de 0.5cm los melanomas in situ10. No obstante, la aplicación de estos márgenes ha demostrado ser insuficiente para el manejo del lentigo maligno localizado en cabeza y cuello debido al crecimiento principalmente radial de este subtipo de melanoma. Por esta razón es mejor abordado si se utiliza un método con control de márgenes, difiriendo la reconstrucción del defecto una vez se confirme la extirpación completa del tumor19. Para el melanoma in situ en otras áreas anatómicas que no sean cabeza y cuello es útil realizar escisión radical amplia con márgenes de 0.5-1cm, informándose mayores tasas de curación con márgenes de 1cm, sin diferencias considerables en la morbilidad11.
Enfoque del paciente con metástasis ganglionar clínicamente negativa-biopsia de ganglio centinelaDespués de realizar el manejo quirúrgico del melanoma, el siguiente paso es la estadificación de los ganglios linfáticos regionales. El melanoma in situ tiene un potencial metastásico que no es significativo, al igual que los melanomas con Breslow menor de 1mm no asociados a otros factores histológicos de mal pronóstico (<5%)20. Para los melanomas con Breslow entre 1-4mm el riesgo de micrometástasis a ganglios linfáticos regionales es del 20-25%, y del 3-5% para metástasis a distancia21,22, considerándose como el principal factor pronóstico de sobrevida a largo plazo en pacientes con melanoma con estadiosi y iii. Estas no son fácilmente detectables con técnicas de imagenología como la ecografía23, o inclusive con PET/TC24, que es una de las herramientas diagnósticas sugeridas para definir la presencia o no de metástasis de los pacientes con melanoma. La biopsia del ganglio centinela es un procedimiento mínimamente invasivo y con una alta exactitud para la detección de micrometástasis ganglionares y que ha reemplazado la linfadenectomía electiva en la estadificación de pacientes con ganglios linfáticos clínicamente negativos. Un estudio aleatorizado reveló que la biopsia del ganglio centinela provee información pronóstica importante, al identificar a pacientes con melanomas primarios con Breslow intermedio o grueso, con metástasis nodales que se beneficiarían de linfadenectomía de finalización inmediata; con lo que se prolonga la sobrevida libre de enfermedad y de la diseminación a distancia de la enfermedad, en pacientes con melanomas de grosor intermedio25. El candidato ideal para la biopsia del ganglio centinela es el paciente con melanoma con Breslow de al menos 1mm y sin metástasis ganglionares regionales clínicas ni radiológicas. Recientemente las indicaciones para la biopsia del ganglio centinela fueron ampliadas, y se recomienda en los pacientes con Breslow de 1-4mm en cualquier localización anatómica, en la estadificación de enfermedad regional en pacientes con Breslow >4mm, y en pacientes con Breslow 0.75-1mm asociado con factores histológicos adversos como ulceración, tasa mitósica >1, invasión angiolinfática o satelitosis26. También se recomienda realizar de rutina la biopsia de ganglio centinela en pacientes pediátricos con melanoma con Breslow de 1mm o mayor, debido a que estos pacientes tienen mayor riesgo de metástasis ganglionar que los adultos, a pesar de tener un mejor pronóstico. Los nevos melanocíticos atípicos en niños y adolescentes tienen una alta tasa de ganglios centinela positivos. Por esta razón, la biopsia del ganglio centinela podría estar indicada en pacientes pediátricos en los cuales el melanoma se incluya como diagnóstico diferencial27.
El uso de la biopsia de ganglio centinela en algunos subtipos de melanoma es controversial; por ejemplo, para el melanoma desmoplásico puro se ha demostrado una baja incidencia de metástasis nodal (0-4%)28,29; sin embargo, en otros se han encontrado tasas de metástasis regionales hasta del 14%, y para el melanoma desmoplásico mixto es más alta (25%) que para el melanoma desmoplásico puro, semejante a la del melanoma no desmoplásico30,31. Algunos autores, sin embargo, consideran que el riesgo de metástasis ganglionar del melanoma desmoplásico es suficiente justificación para realizar la biopsia del ganglio centinela si se encuentra en estos tumores un Breslow de 1mm o mayor10.
A pesar de la alta precisión de la biopsia del ganglio centinela para la detección de micrometástasis ganglionares, hay algunos casos en los que la utilización de esta técnica es subóptima, como por ejemplo en pacientes a quienes ya se les realizó la escisión radical amplia y cierre del defecto, cuando la linfogammagrafía demuestra más de 2 cuencas ganglionares de drenaje, en melanomas cercanos o sobre la cuenca de drenaje ganglionar, melanomas de cabeza y cuello en donde la linfogammagrafía mapea un ganglio centinela intraparotídeo, cuando hay metástasis ganglionar a distancia confirmada, cuando la linfogammagrafía es negativa y en quienes la expectativa de vida es limitada, debido a un melanoma avanzado, o a otras comorbilidades9.
Aunque la biopsia del ganglio centinela es un procedimiento poco invasivo, no está exento de complicaciones, y dentro de estas se encuentran las de la herida quirúrgica (infecciones, dehiscencia, etc.) linfedema (<5%), formación de seroma, reacciones al medio de contraste (<1%) y resultados falsamente negativos (5-15%)32.
Enfoque del paciente con metástasis ganglionar clínicamente positivaCuando los pacientes se presentan con un melanoma primario y con ganglios clínicamente palpables, la estadificación y la confirmación de metástasis ganglionar del melanoma se deben hacer con una biopsia por aspiración con aguja fina (BACAF)33. La BACAF es una técnica rápida, precisa y útil clínicamente para la valoración de pacientes con sospecha de melanoma metastásico. En caso de que el tejido obtenido por BACAF no sea suficiente para el diagnóstico o no se cuente con este recurso, se sugiere una biopsia escisional del ganglio.
Las tasas de sobrevida de los pacientes que se presentan con metástasis ganglionar clínicamente palpables se reduce de forma significativa (10-50%), dependiendo del número de ganglios afectados, la extensión del compromiso ganglionar y el Breslow del melanoma primario34.
Tratamiento quirúrgico de las metástasis ganglionaresPosterior a la confirmación de metástasis ganglionar regional del melanoma, el tratamiento estándar es la linfadenectomía radical. Esta a su vez es conocida con 3 diferentes términos de acuerdo al método que se utilizó para el diagnóstico y si se cuenta o no con confirmación histológica. Siendo así, la linfadenectomía de finalización se refiere a la realizada después de la biopsia del ganglio centinela positivo: linfadenectomía electiva cuando se ejecuta a cuencas ganglionares clínicamente negativas y que no se tenga confirmación histológica del compromiso nodal, y por último el procedimiento efectuado a cuencas ganglionares clínicamente positivas después de confirmarse histológicamente, que se conoce como linfadenectomía terapéutica11.
La linfadenectomía terapéutica está indicada en todos los pacientes que tengan metástasis ganglionar clínicamente evidente y no debería reemplazarse por radioterapia o terapia sistémica adyuvante, aunque sí podrían usarse como tratamientos coadyuvantes35. En los pacientes en quienes se confirme metástasis extensa a distancia y/o metástasis ganglionares grandes, fijas a estructuras adyacentes, no está indicada la linfadenectomía terapéutica. Estos pacientes tienen un pobre pronóstico y podrían beneficiarse de otros tratamientos, como radioterapia paliativa o terapia sistémica. La linfadenectomía electiva no se realiza de rutina, y como se mencionó anteriormente, fue sustituida por la biopsia de ganglio centinela. En cuanto a la linfadenectomía de finalización, hay controversia en la función y en las indicaciones después de la biopsia de ganglio centinela positivo. Hasta el momento no se ha comprobado que la linfadenectomía de finalización mejore la sobrevida de los pacientes en comparación con la observación después de biopsia de ganglio centinela positivo, ni que todos los pacientes con biopsia de ganglio centinela positivo se beneficien de la linfadenectomía de finalización, ya que no todos desarrollan una metástasis ganglionar clínicamente evidente y la biopsia del ganglio centinela pudo haber resecado el único foco de metástasis nodal. Por otro lado, no hay por el momento evidencia de pacientes con biopsia de ganglio centinela positivo que no tengan al menos 5% de probabilidad de tener comprometido otros ganglios no centinela26.
De momento, la conclusión de las guías de los jurados de la American Society of Clinical Oncology-Society of Surgical Oncology (ASCO-SSO), en lo que se refiere a linfadenectomía de finalización, es efectuarla a todos los pacientes con biopsia de ganglio centinela positivo, y si el paciente renuncia a la linfadenectomía, lo recomendado es un seguimiento estricto que permita la detección y tratamiento temprano de recurrencia ganglionar26.
Tratamiento de la recurrencia localEl melanoma recurrente localmente está asociado en la mayoría de los casos a metástasis sistémicas, lo cual disminuye dramáticamente la sobrevida a 10años (<5%) de estos pacientes. El mayor indicador pronóstico de recurrencia local y muerte en pacientes con melanoma es el Breslow inicial, asociado a otros factores adversos histológicos como la ulceración y la mitosis9. Clínicamente se presenta como un nódulo azul subcutáneo, de tamaño variable pero usualmente de 2 a 5cm de diámetro, que comúnmente se presenta en la vecindad de la escisión del melanoma primario (metástasis satélite) o en ruta a la cuenca de drenaje linfático regional (metástasis en tránsito)9. En estos casos el diagnóstico se debe realizar con un BACAF o con biopsia escisional bajo anestesia local. Al confirmar el diagnóstico de melanoma recurrente el paso siguiente es realizar estudios de extensión de imagenología (TC, RMN o PET/TC) y biopsia de ganglio centinela, si es candidato, para re-estadificación, evaluación de síntomas y definir manejo10.
Idealmente, en los pacientes con melanoma recurrente (local, satélite y/o en tránsito) se debe obtener tejido para el análisis genético del tumor, lo que es especialmente importante para valorar el uso de terapias blanco o se planea su inclusión en un estudio clínico. Si se confirma la ausencia de enfermedad regional nodal, se recomienda escisión quirúrgica con márgenes negativos y cierre primario del defecto en lo posible. Los pacientes con recurrencia en tránsito resecable pueden beneficiarse de la biopsia de ganglio centinela, adicional a la escisión radical amplia, y reconstrucción del defecto con injerto o colgajo. Aunque no es claro todavía si los márgenes de resección deben ser amplios en la recurrencias, sí es claro que se debe dejar margen de piel normal10.
Situaciones clínicas especialesAún hay interrogantes en cuanto a cuál debería ser el manejo correcto de pacientes con melanoma primario en algunas situaciones clínicas, como por ejemplo su localización subungueal, el melanoma acral o el manejo adecuado de las pacientes embarazadas con diagnóstico de melanoma. No obstante, las recomendaciones de expertos son una herramienta en la cual se puede basar el manejo de estos casos.
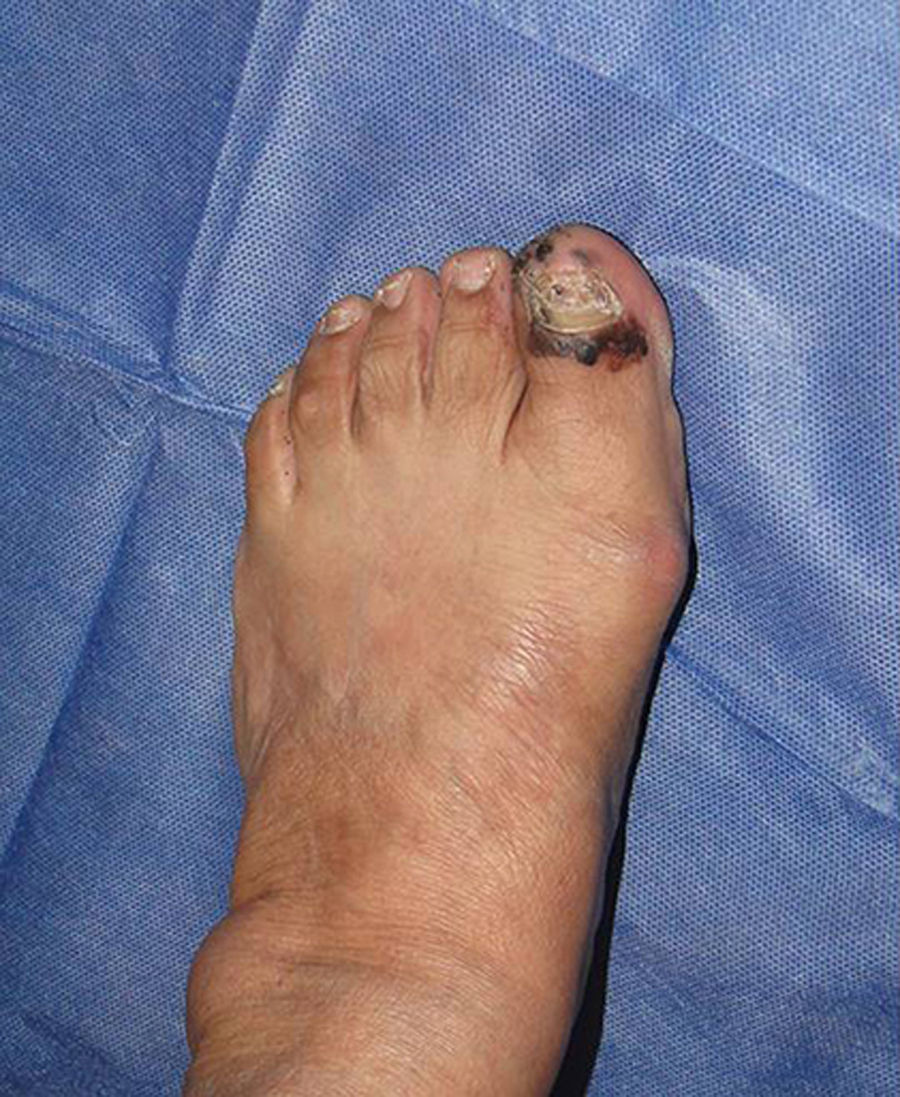
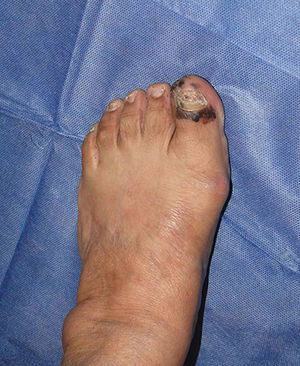
Melanoma subunguealEs una variante poco común del melanoma en personas de raza blanca, en quienes la prevalencia es del 3%, contrario a la prevalencia del melanoma subungueal en pacientes de raza negra, en quienes es del 15-35%36. La localización más frecuente de esta entidad es en el primer dedo tanto de manos como de pies (75%). Clínicamente se presenta como una melanoniquia longitudinal de novo o previa con cambios en los últimos meses. El signo de Hutchinson —pigmentación de la piel periungueal— es altamente sugestivo de melanoma (fig. 1). El melanoma amelánico se presenta de forma atípica al melanoma convencional, como un nódulo eritematoso frecuentemente ulcerado en la región subungueal asociado a onicólisis y distrofia de la lámina ungueal con ausencia de pigmento. Ante cualquiera de estos signos el paso a seguir es la toma de biopsia para confirmación histológica. La biopsia longitudinal que incluya en lo posible toda la pigmentación (escisional), como en otros subtipos de melanomas, es la técnica ideal para el estudio de una lesión en que el melanoma se encuentra como diagnóstico diferencial. Esta debe incluir tejido del lecho ungueal y en profundidad llegar hasta periostio37.
Los márgenes para la escisión radical amplia se basan en la guías de acuerdo al Breslow y factores histológicos adversos. Si el melanoma es in situ, los márgenes recomendados son de 5mm, incluyendo lecho y matriz proximal y reconstrucción con injerto de espesor parcial. Si se trata de un melanoma subungueal invasivo en extremidad inferior, la amputación a nivel de la articulación metatarsofalángica es el manejo más adecuado. Sin embargo, cuando se trata de un melanoma subungueal invasivo que compromete una extremidad superior, se prefiere amputación a nivel de la articulación distal a la lesión, utilizando márgenes de 1cm, con el objetivo de dar al paciente un manejo más conservador y que permita una mejor funcionalidad de la mano38.
Las indicaciones de biopsia de ganglio centinela en el melanoma subungueal se apoyan en las guías de manejo del melanoma convencional basadas en el grosor del melanoma y en la presencia o no de ganglios palpables26.
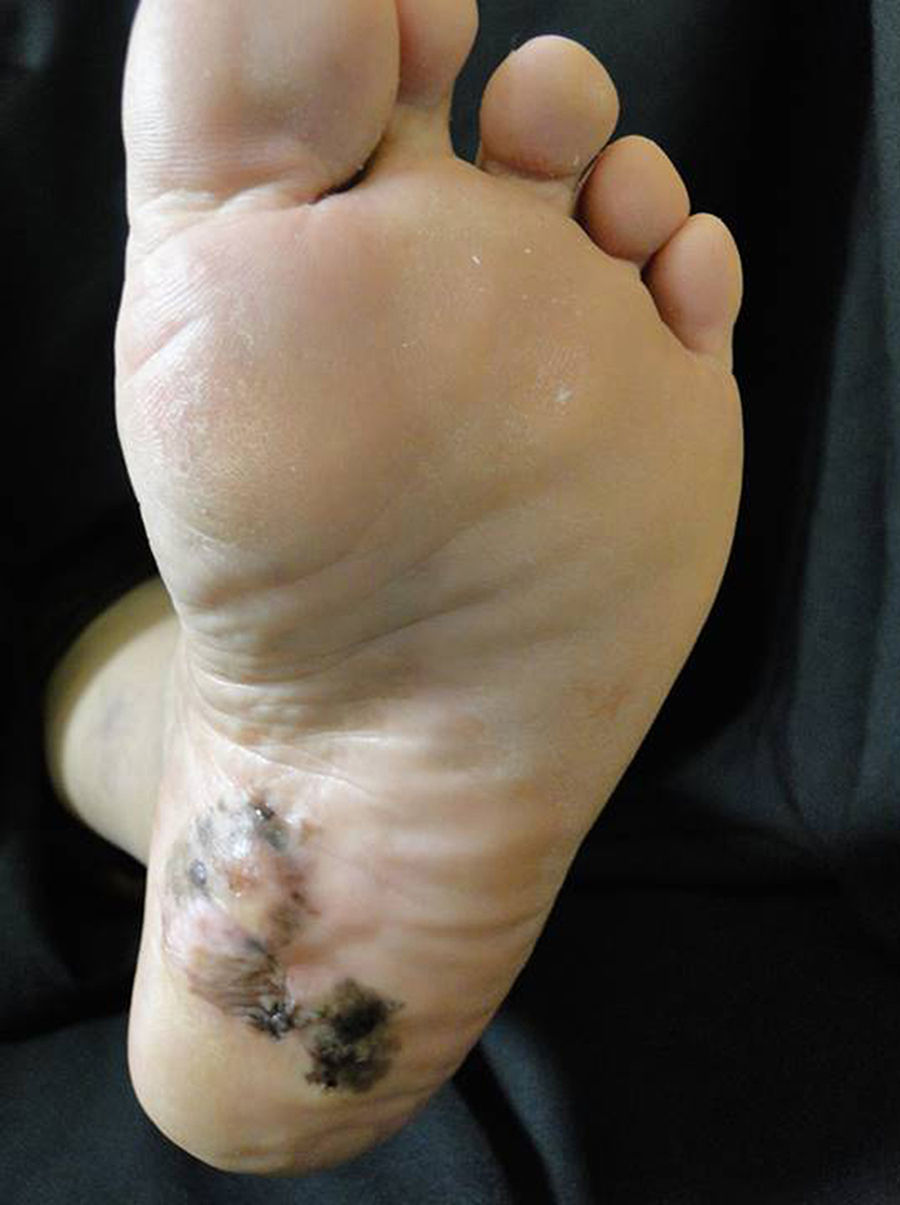
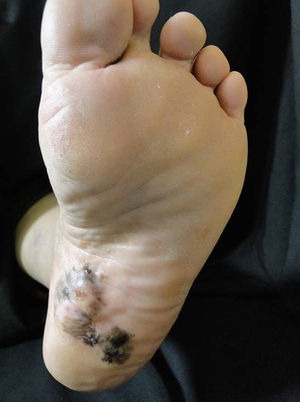
Melanoma acral plantarLa importancia de este subtipo clínico de melanoma es el pobre pronóstico al que se encuentra asociado debido al diagnóstico tardío39. Es fundamental una alta sospecha clínica del médico tratante adicional a un entrenamiento en dermatoscopia, ya que esta herramienta es de gran utilidad para decidir la toma de biopsia de una lesión melanocítica plantar (fig. 2)9.
La biopsia en estos pacientes debe ser escisional. Sin embargo, cuando las lesiones son muy grandes se podría recurrir a la biopsia incisional. El manejo definitivo se basa en el estadio de la enfermedad y el manejo recomendado por las guías de melanoma ya establecidas para sus equivalentes en grosor e histología en otras localizaciones cutáneas10.
La decisión de realizar biopsia de ganglio centinela está fundamentada en las indicaciones de la ASCO-SSO previamente descritas en este artículo, de acuerdo al estadio del melanoma26. Se recomienda la linfadenectomía terapéutica para el caso del melanoma primario con ganglios clínicamente positivos.
La reconstrucción de los defectos en plantas se fundamenta en la localización en la superficie plantar, el estadio de la enfermedad, comorbilidades y estilo de vida del paciente. En pacientes con defectos localizados en sitios de no apoyo, sedentarios, comorbilidades y/o enfermedad metastásica asociada se prefiere realizar un cierre primario del defecto o con injerto de piel parcial o total. Para defectos en puntos de apoyo de la superficie plantar las opciones de reconstrucción son colgajos de rotación, avance o colgajos musculocutáneos libres, preferiblemente realizados por cirujano plástico reconstructivo9.
Lentigo malignoAnte la lesión en la cara sugerente de lentigo en quien se sospechan cambios malignos, el proceso a seguir es la toma de biopsia para confirmar el diagnóstico. No obstante, el método adecuado para la biopsia es un reto, ya que usualmente se trata de lesiones que tienen bordes mal definidos y que son grandes para una zona estéticamente muy sensible como la cara. Según las guías de manejo del melanoma, el método más acertado para la toma de biopsia es la muestra escisional, siendo la biopsia incisional o por rasurado frecuentemente subóptima. Sin embargo, una opción aceptable es realizar la biopsia incisional profunda o por sacabocado de la zona que clínicamente se vea más profunda10. La biopsia por rasurado puede comprometer la evaluación histopatológica completa del tumor y la medida adecuada del Breslow, por lo que no usamos esta técnica para el diagnóstico de melanoma en nuestros pacientes.
Ya confirmado el diagnóstico de lentigo maligno, se procede a la resección del tumor con márgenes de 5mm para el lentigo maligno de cabeza y cuello son usualmente subóptimos, por lo cual se recomienda utilizar una técnica de resección por estadios que permita la evaluación exhaustiva de los márgenes19. De confirmarse la presencia de un lentigo maligno invasivo, se procede a la estadificación de acuerdo con el Breslow40. Para la estadificación de lentigo maligno melanoma se utiliza la linfogammagrafía con coloide de tecnecio de sulfuro. Esta sustancia reemplaza las tinciones azules que son utilizadas de rutina, ya que en esta localización son innecesarias y se asocian a un riesgo remoto de discromía permanente de la piel, necrosis y anafilaxis41. Si se confirma micrometástasis, se debe proceder a la linfadenectomía de finalización más parotidectomía superficial si las micrometástasis afectan ganglios periparotídeos9.
Melanoma y embarazoEl melanoma durante el embarazo tiene unaprevalencia de hasta el 31% de todos los cánceres que se presentan en este estado42, y es una neoplasia con una alta morbimortalidad y con un riesgo no despreciable de metástasis a la placenta y al feto. Es conocido que el embarazo no afecta de forma significativa la agresividad del melanoma en cuanto a metástasis y a sobrevida se refiere; sin embargo, es conveniente concienciarse de que pueden ocurrir en el embarazo, y en caso de enfrentarnos a esta situación, dar un manejo correcto y rápido42,43. La biopsia de pacientes embarazadas con sospecha de melanoma debe ser como en todos los casos escisional, y se recomienda realizarla bajo anestesia local con lidocaína sin epinefrina. Después de confirmar el diagnóstico, la estadificación puede hacerse de forma segura con una radiografía de tórax y deshidrogenasa láctica o con RMN o ecografía abdominal si es un melanoma con Breslow grueso o adenopatías palpables. Los márgenes de escisión son los mismos que si se tratara de una mujer no embarazada44. La biopsia de ganglio centinela es segura con tecnecio de sulfuro coloide.
ConclusionesLas lesiones sospechosas de melanoma deben ser biopsiadas en lo posible escisionalmente para permitir al patólogo reportar de la forma más completa las características histológicas del tumor, que deben incluir la presencia de ulceración o no, el número de mitosis, el Breslow y otros factores histológicos adversos como el Clark, la presencia de invasión linfovascular, satelitosis y regresión del melanoma. De estos factores histológicos adversos, el que más se asocia con micrometástasis es la ulceración, seguido de la presencia de una o más mitosis. Los pacientes con melanomas en estadiosi y ii no requieren exámenes de rutina. En pacientes con compromiso ganglionar regional o en estadioiii de la enfermedad la recomendación es confirmación histológica con aspirado por aguja fina o biopsia abierta, y se deja a criterio médico la realización de estudios de imagen en busca de metástasis a distancia. Estudios de imagen como TC y/o PET, más RMN cerebral, están indicados en pacientes con melanoma en estadioiv. Adicionalmente realizar LDH, la cual tiene significado pronóstico en los melanomas estadioiv. El tratamiento del melanoma localizado y regionalmente metastásico es fundamentalmente quirúrgico. El término escisión local amplia implica la utilización de márgenes periféricos de 1 a 2cm a partir de cualquier pigmentación residual o cicatriz, esto según el Breslow y la localización anatómica del melanoma. La biopsia de ganglio centinela es un procedimiento mínimamente invasivo que provee información sobre pronóstico del paciente y que, además, identifica los pacientes en quienes es más útil la realización de linfadenectomía de finalización, por lo que ha desplazado la utilización de la linfadenectomía programada y actualmente no se recomienda realizar de rutina. Los pacientes que más se benefician de la biopsia de ganglio centinela son pacientes con melanomas de 1-4mm sin evidencia clínica o radiológica de compromiso ganglionar regional, aunque las indicaciones se han extendido a más escenarios clínicos.
Finalmente, el melanoma debe ser considerado una de las malignidades cutáneas más agresivas debido a altas tasas de metástasis regional y a distancia; requiere un diagnóstico temprano para ofrecer un tratamiento oportuno y disminuir así la morbimortalidad con la cual está asociada esta neoplasia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.