La perforación cardiaca posterior al implante de un marcapasos con electrodos de fijación activa o pasiva es una patología de presentación poco frecuente y con altas tasas de mortalidad si no es detectada a tiempo. En una serie de 2.200 pacientes que recibieron un marcapasos transvenoso se encontró una incidencia del 0,8% de perforación cardiaca, sin embargo, existen reportes con cifras que superan considerablemente dicho valor cuando se utilizan marcapasos con electrodos de fijación activa. La presentación clínica es muy variable, siendo el dolor precordial el síntoma más frecuente, y hasta un 15% de los pacientes pueden cursar asintomáticos, identificándose solo en la tomografía axial computarizada (TAC) de control, haciendo de esta complicación un reto para el diagnóstico oportuno en algunos casos.
En este artículo, realizamos un aporte a la literatura mundial de una perforación cardiaca secundaria al uso de un cardiodesfibrilador implantable (CDI) y una revisión sistemática de la literatura actual sobre esta eventualidad, junto con sus aspectos más relevantes, con la finalidad de retroalimentar a las personas inmersas en este medio.
Cardiac perforation after implanting a pacemaker with active or passive fixation is an uncommon presentation pathology and with high mortality rates. In a series of 2,200 patients who received a transvenous pacemaker, the incidence of cardiac perforation was 0.8%, however, there are reports with statistics that exceed considerably when using pacemakers with active fixation leads. The clinical presentation is highly variable, precordial pain is the most frequent symptom and up to 15% of the patients can be asymptomatic, identifying the perforation only the computed tomography of control, making this complication a timely diagnostic challenge in some cases.
In this article, we make a contribution to the world literature of a cardiac perforation secondary to the use of an Implantable Cardioverter Defibrillator (ICD) and systematic review of the current literature on this topic along with its most important aspects in order to give a feedback to people involved in this subject.
Paciente femenina de 79 años de edad quien ingresa a nuestra institución por 2 meses de malestar torácico. Se realiza electrocardiograma (EKG) evidenciando taquicardia supraventricular con complejo ancho dado por bloqueo de rama izquierda como ritmo de base, ecocardiograma con fracción de eyección del ventrículo izquierdo (FEVI) deprimida, trastornos de contractilidad y enzimas cardiacas elevadas, por lo que se lleva a coronariografía la cual reporta arterias coronarias sanas. Se realiza mapeo electroanatómico y ablación por radiofrecuencia de taquicardia con origen ventricular. En el postoperatorio se realiza ecocardiograma obteniendo FEVI del 30%, por lo cual se implanta cardiorresincronizador bajo anestesia general con electrodos de fijación activa a nivel de aurícula y ventrículo derechos, sin aparentes complicaciones inmediatas, evaluadas en radiografía de tórax portátil realizada en la unidad de cuidados intensivos (UCI).
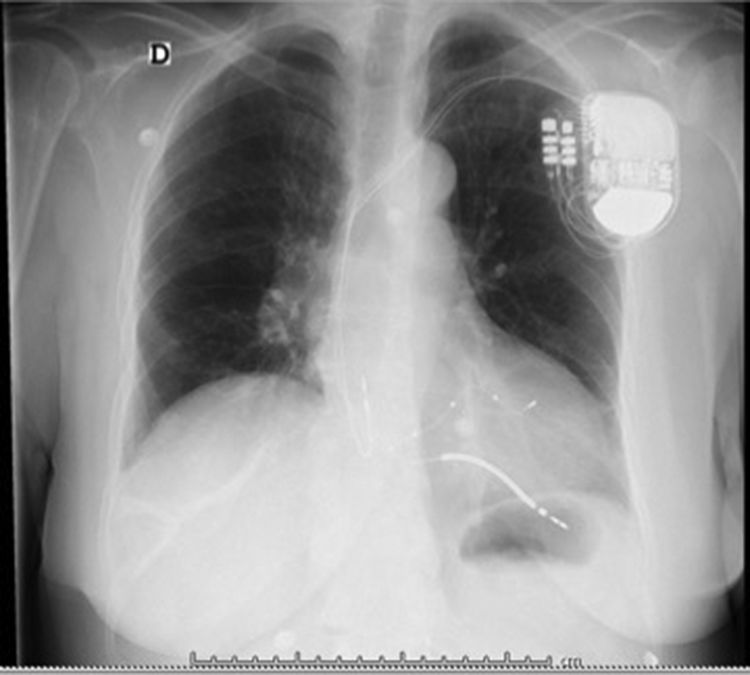
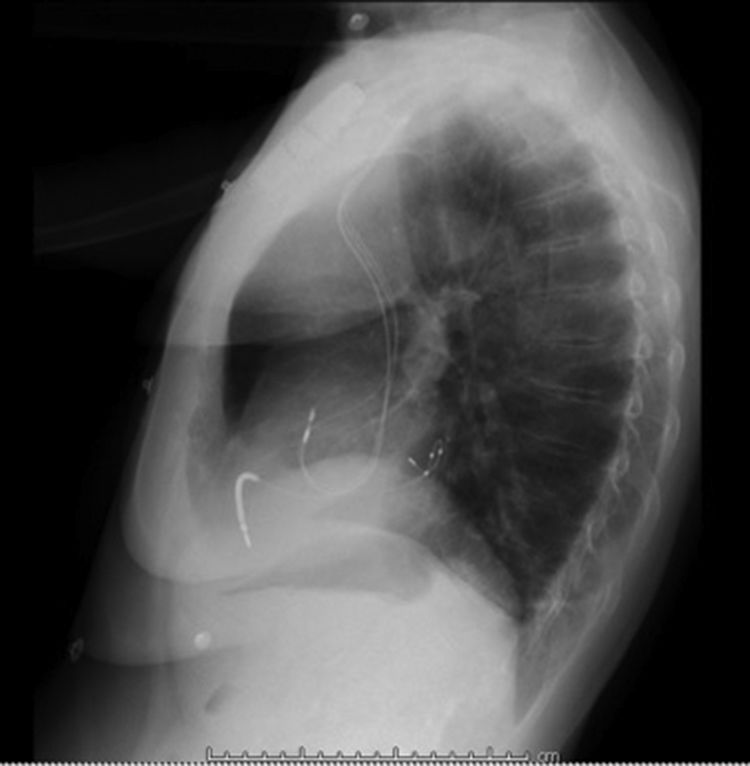
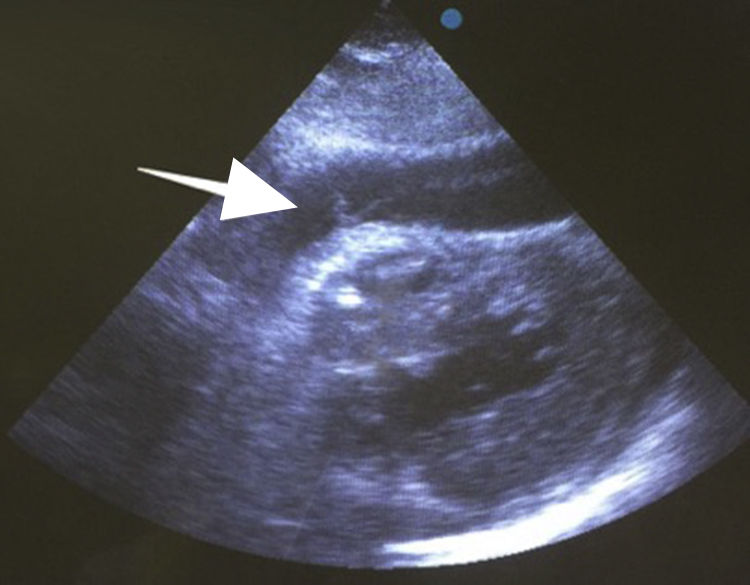
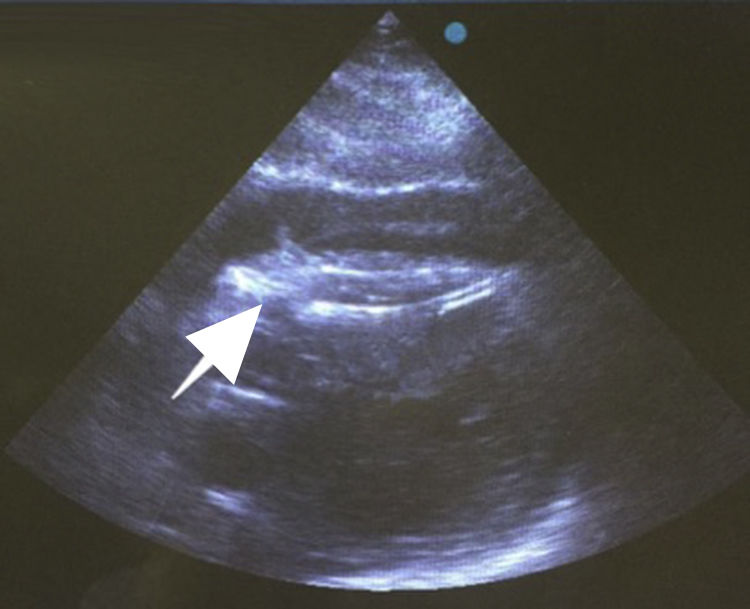
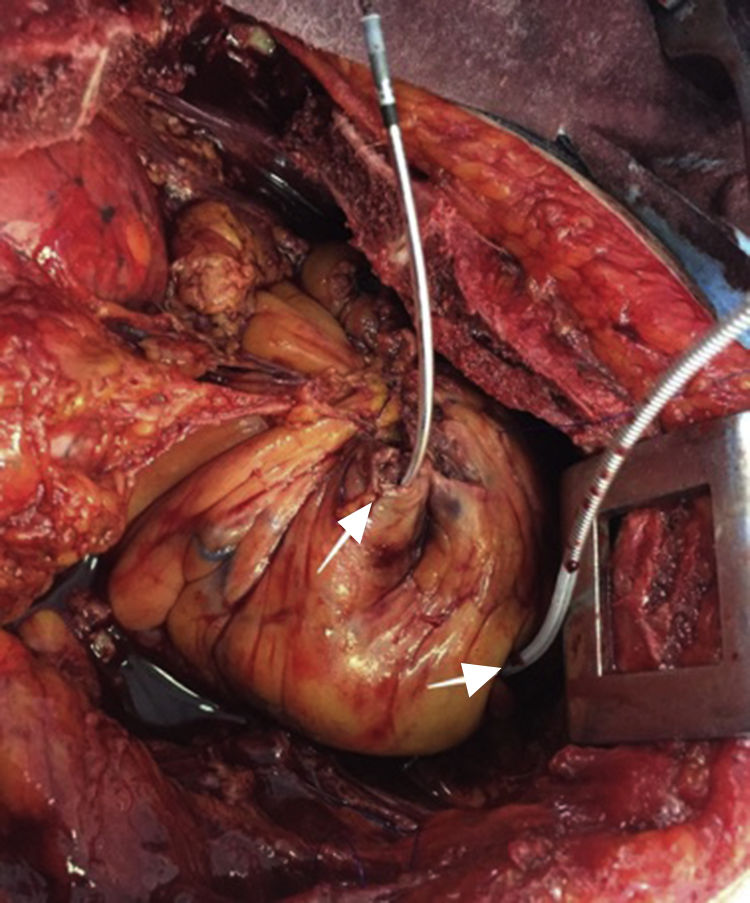
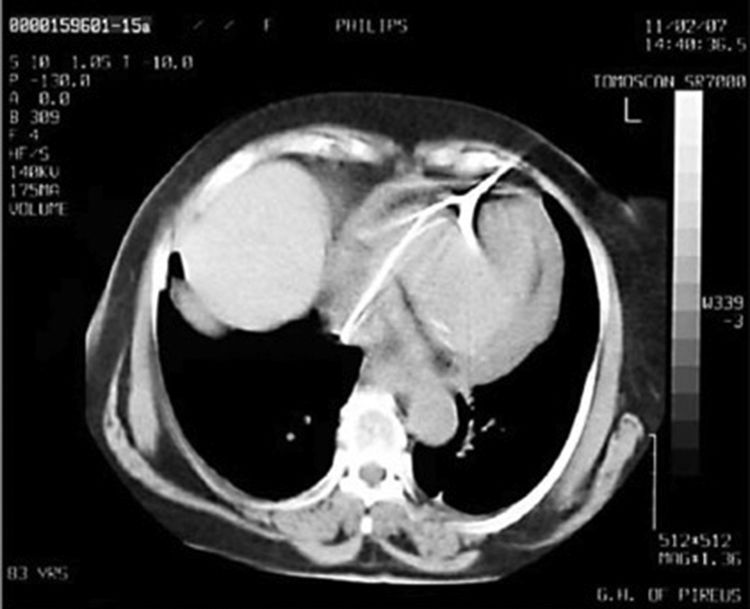
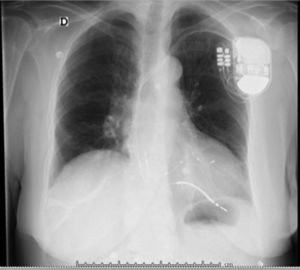
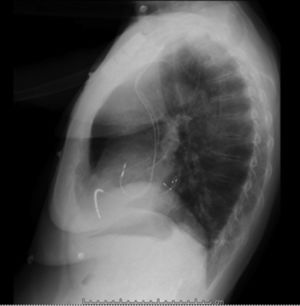
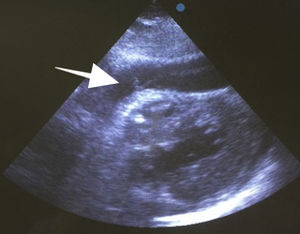
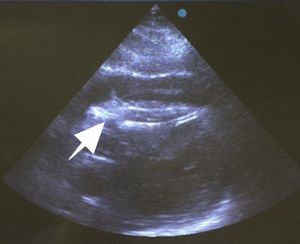
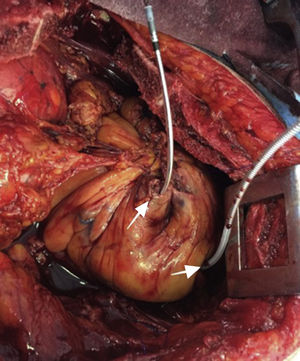
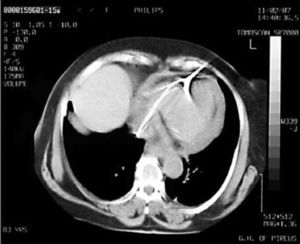
Después de 36h de la intervención la paciente presenta diaforesis; se realiza radiografía de tórax sugiriendo que el electrodo ventricular del cardiodesfibrilador implantable (CDI) se encontraba fuera del corazón (figs. 1 y 2); minutos después la paciente presenta palidez, frialdad generalizada con taquicardia e hipotensión severa; al examen físico se obtiene TA: 64/30mmHg; FC: 120lpm; FR: 30rpm, SatO2: 91%, ruidos cardiacos velados y ecocardiograma el cual muestra colapso ventricular derecho, derrame pericárdico y el electrodo (figs. 3 y 4), por lo que es trasladada inmediatamente a salas de cirugía con la sospecha de taponamiento cardiaco; se realiza esternotomía media evidenciando: hemopericardio aproximadamente 2.000cc, soluciones de continuidad en número de 2 en el ventrículo derecho, la primera puntiforme de 4mm, correspondiendo al electrodo de fijación auricular el cual se movilizó muy probablemente durante el preoperatorio, dado que en la radiografía prequirúrgica se encontraba normoinserto, y otra de 3cm en la pared anterior del ventrículo derecho a través de las cuales emergen los electrodos de fijación activa del dispositivo (fig. 5), con sangrado activo masivo, aurículas, ventrículos y grandes vasos colapsados; se introduce sonda Foley sobre defecto de mayor tamaño con posterior insuflación de la misma controlando parcialmente el sangrado, cardiorrafia y paso de hemoderivados directo al corazón por la sonda; presenta asistolia requiriendo maniobras de reanimación cardiocerebropulmonar avanzadas durante 20min sin obtener respuesta, por lo que la paciente fallece.
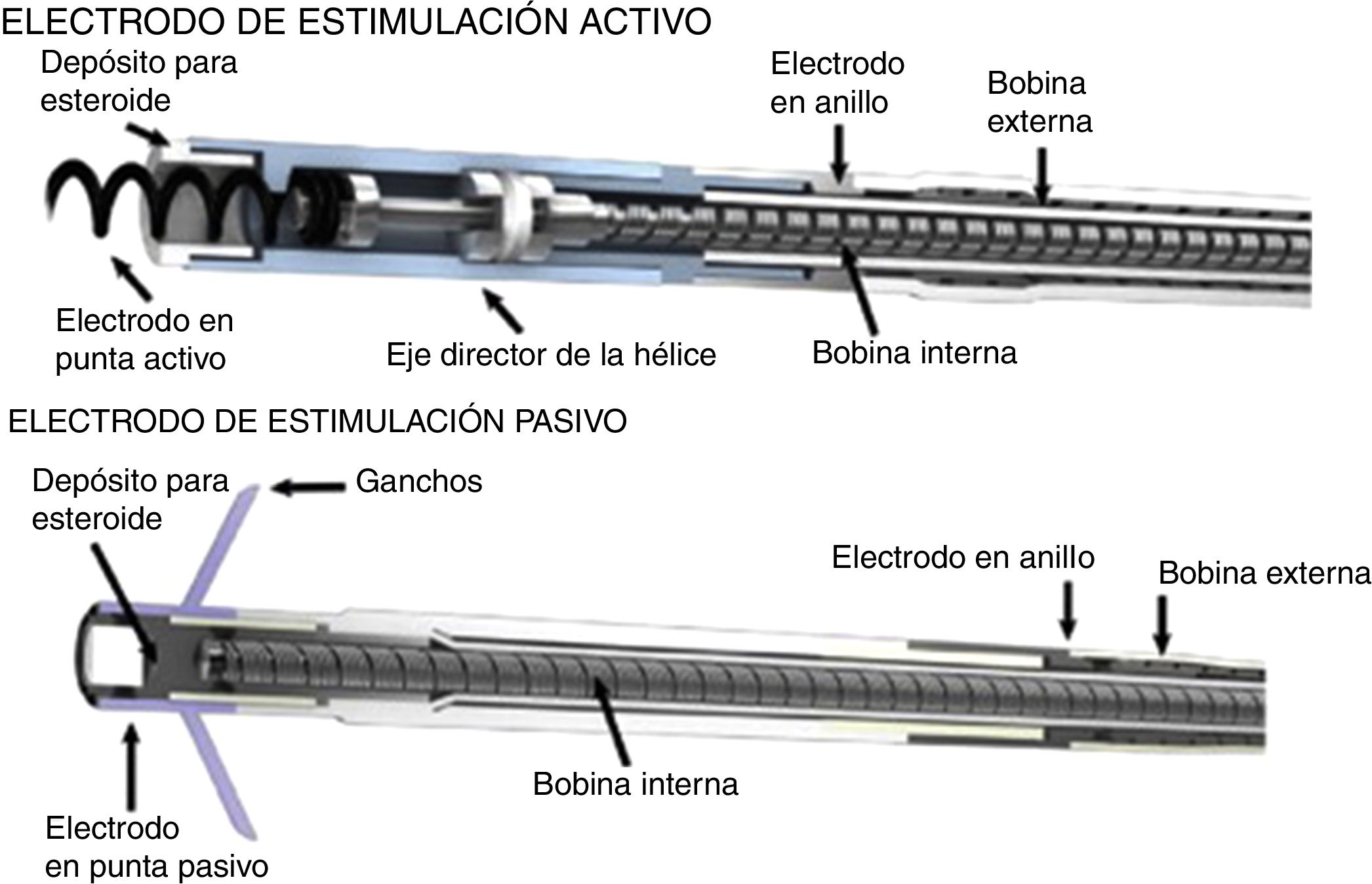
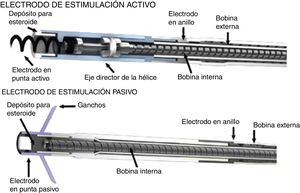
En 1899, cuando J. A. McWilliam informó en el British Medical Journal de sus experimentos con energía directa al corazón en asistolia logrando contracción del miocardio, se abrieron las puertas a la investigación y a los primeros estudios en electrofisiología del corazón1. Posteriormente, en 1959, Furman y Schwedel demostraron la estimulación cardiaca por vía transvenosa por primera vez2. Luego en 1959 Elema Schonander, el cual fue pionero del marcapasos actual, implantó exitosamente un marcapasos recargable en Stockholm, sin embargo, no fue hasta el inicio de la década de los 60 que se introdujo en la práctica clínica el uso de estos dispositivos de estimulación transvenosa permanente, dando inicio a los prototipos actuales3,4. Luego, en 1962, Kantrowitz introdujo la técnica con electrodo bipolar transvenoso, el cual evitaba la intervención por toracotomía para la colocación de electrodos epicárdicos, los cuales conllevaban una mayor morbilidad. Hacia los años 70 se diseñaron los dispositivos con electrodos que tenían sistema de fijación pasiva y fijación activa (fig. 6), estos últimos con la finalidad de mejorar la conducción miocárdica al ubicarse de manera firme al corazón.
Electrodo de fijación activa (imagen superior) con extremo helicoidal que permite la conexión directa al corazón, electrodo de fijación pasiva (imagen inferior)4.
La utilización e implementación de estos dispositivos tales como marcapasos, cardiodesfibriladores y resincronizadores cardiacos ha venido en aumento en las últimas 2 décadas; en Inglaterra en 2014 fueron implantados cerca de 10.000 marcapasos4-6.
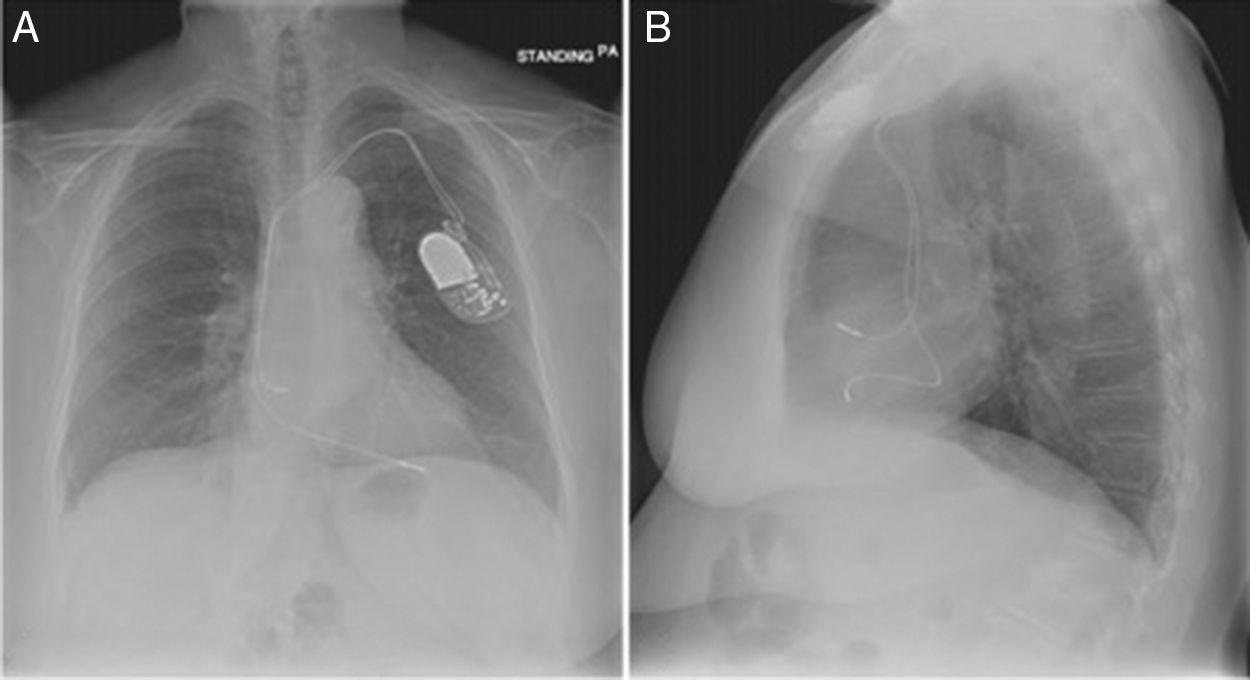
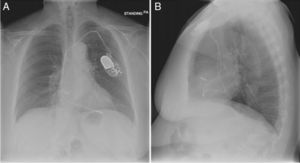
El implante de estos dispositivos se rige por protocolos estrictos y técnicas que buscan disminuir complicaciones y optimizar su funcionalidad, teniendo como principio el de alojar a nivel auricular y/o ventricular electrodos según sea la patología. En la figura 7 observamos una radiografía de tórax con posicionamiento adecuado de los electrodos a nivel de la aurícula y ventrículo derechos, sin embargo, si correlacionamos esta imagen con la de nuestro caso la diferencia en cuanto al electrodo ventricular derecho no es muy significativa, lo cual le confiere la complejidad a este tipo de complicaciones y nos conduce a la realización de otro estudio imagenológico en el paciente que se encuentra estable7.
Radiografía de tórax anteroposterior (A)-lateral (B). Adecuado posicionamiento de los electrodos en la aurícula y ventrículo derechos7.
La incidencia de las complicaciones puede variar según el dispositivo utilizado y según la época de su implementación. Antes del año 2000 se reportó perforación miocárdica en un 0,1-0,8% hasta un 0,6-5,2% en marcapasos y desfibriladores automáticos implantables (DAI), respectivamente, y datos después del año 2000 muestran una incidencia del 0,5 y 0,33% para marcapasos y DAI, respectivamente8. La perforación se ha presentado con mayor frecuencia a nivel auricular, encontrando reportes de hasta el 15% en aurícula y del 6% en ventrículo. Otras complicaciones asociadas a estos dispositivos pueden ser: neumotórax (1,5%), desplazamiento del dispositivo (2,4%), pericarditis (5%), taponamiento cardiaco (0,2%) y hemotórax (0,08%), e incluso se ha reportado rotura de músculos papilares con disfunción valvular. En el caso de la pericarditis con perforación el riesgo de taponamiento cardiaco hemorrágico y muerte puede aumentar, por lo que el manejo debe ser más estricto o el seguimiento debe ser más estrecho en pacientes sin descompensación de su estado hemodinámico9-12.
Hao et al. demuestran en un análisis retrospectivo de 1.217 pacientes la efectividad de la implantación de los electrodos pasivos vs. activos auriculares en cuanto a su conducción, sin evidenciar diferencias significativas funcionales, y además sin reportar casos de perforación alguna, teniendo en cuenta que se trata de electrodos en la aurícula, la cual reporta en la mayoría de series de casos una tasa significativamente mayor de perforaciones comparada con los ventrículos, teniendo en cuenta como factor de riesgo el grosor de la pared auricular que puede ser de 2mm13. Liu et al. demostraron en su estudio con 199 pacientes que la fijación activa vs. la pasiva no tienen diferencia significativa en un periodo de 5 años de seguimiento en el rendimiento de la energía respecto a electrodos de fijación pasiva y activa14. En cuanto a la perforación, se ha demostrado un aumento de la misma con el uso de electrodos de fijación activa; sin embargo, en un análisis de los tipos de fijación activa no hubo diferencias significativas entre ellos15.
Un estudio estadounidense con 3.451 pacientes a quienes se colocaron marcapasos con electrodos de fijación activa mostró que están asociados con un aumento del derrame pericárdico (81 [2,9%] vs. 6 [1,0%]; p=0,005) y pericardiocentesis (46 [1,6%] vs. 2 [0,3%]; p=0,01) a un año en comparación con los cables de fijación pasiva, lo cual sugiere un mayor potencial de microperforaciones miocárdicas posiblemente como base de su fisiopatología. A nivel macroscópico no se observó una diferencia significativa de perforación, sin embargo, los hallazgos anteriores hacen pensar lo contrario16; por esto, en casos de pacientes con patologías de base como pericarditis se debe tener mayor prudencia para suponer el derrame como causa de perforación, haciendo más difícil el diagnóstico por presentar alteraciones anatómicas secundarias a una patología concomitante17.
El derrame pericárdico es un signo que puede o no estar presente al momento de la perforación; teniendo en cuenta la fisiopatología de la lesión pensaríamos que debe ser muy frecuente, sin embargo, en un estudio con 1.026 pacientes a los cuales se les implantó un marcapasos, se encontró perforación sin derrame pericárdico en el 0,2%18.
Las complicaciones se pueden clasificar según el tiempo de presentación, denominándose «agudas» en las primeras 24h, «subagudas» de 24h a 30 días y «crónicas» cuando aparecen después de 30 días de la colocación del marcapasos19,20.
Existen múltiples signos y síntomas que nos orientan en el diagnóstico de la perforación cardiaca posterior al implante de un dispositivo tipo marcapasos y CDI como, por ejemplo:
- 1.
Dolor en el pecho.
- 2.
Disnea.
- 3.
Hipotensión.
- 4.
Síncope.
- 5.
Error de captura o ganancia.
- 6.
Choques inapropiados del dispositivo.
- 7.
Estimulación del músculo o del diafragma.
- 8.
Dolor abdominal.
- 9.
Derrame pericárdico.
- 10.
Taponamiento cardiaco.
- 11.
También se ha informado de que el hipo es consecuencia de la estimulación del nervio frénico debida a perforación21.
Los factores de riesgo asociados a la perforación cardiaca posterior al implante de marcapasos se han descrito en estudios con resultados estadísticamente significativos, permitiéndonos aumentar la sutileza en la técnica de colocación en los siguientes casos o la sospecha diagnóstica en paciente con evolución tórpida dada por signos o síntomas descritos anteriormente en su postoperatorio temprano o tardío. Estos pueden ser: uso de marcapasos temporal (HR: 2,7; IC del 95%: 1,4-3,9; p=0,01), electrodos con punta helicoidal (HR: 2,5; IC del 95%: 1,4-3,8; p=0,04) y esteroides (HR: 3,2; IC del 95%: 1,1-5,4; p=0,04)22. En 2013, un estudio realizado en Valencia, España, de carácter retrospectivo, en 2.200 pacientes en los cuales se implantaron 3.822 dispositivos (3.035 marcapasos de fijación activa y 787 DAI) demostró en su análisis multivariado que los siguientes fueron factores independientes de perforación cardiaca: edad >80 años (OR: 3,84; IC del 95%: 1,14-12,87; p=0,029), sexo femenino (OR: 3,14; IC del 95%: 1,07-9,22; p=0,037) y posición apical del electrodo ventricular derecho (OR: 3,37; IC del 95%: 1,17-9,67; p=0,024)20.
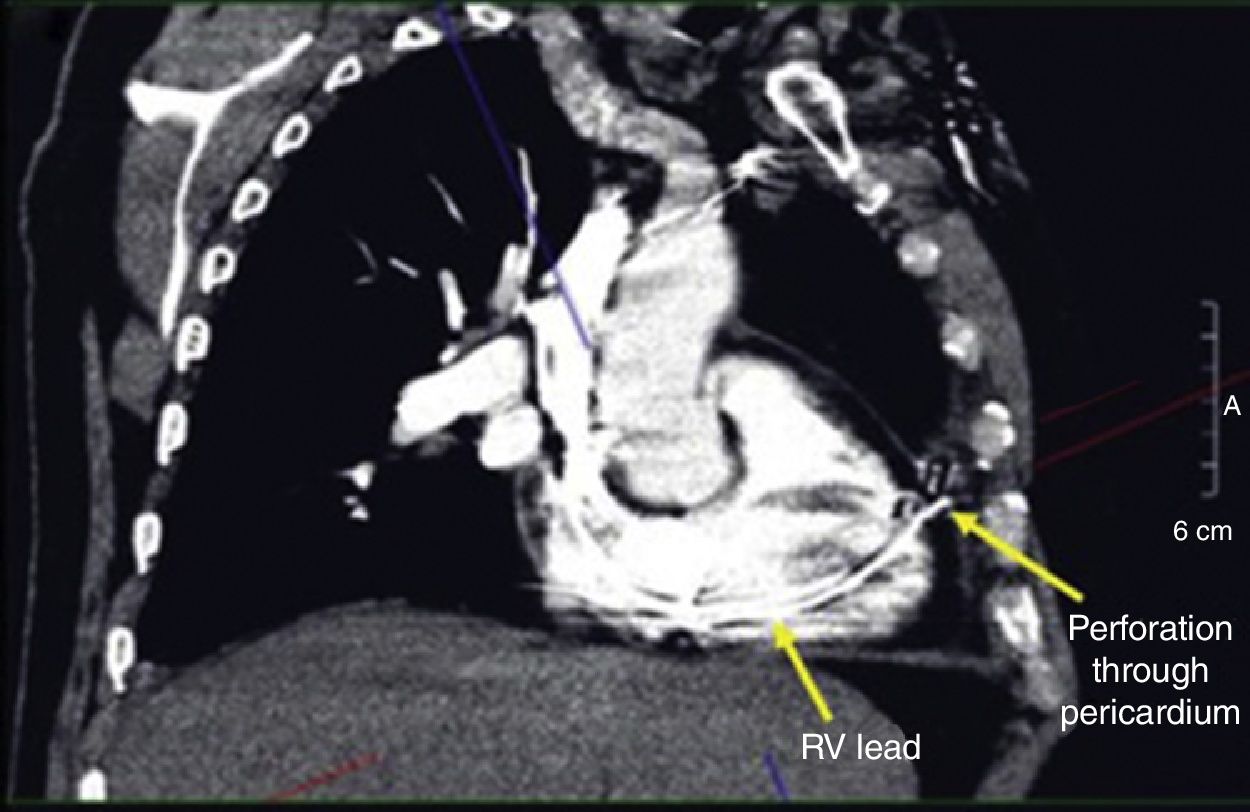
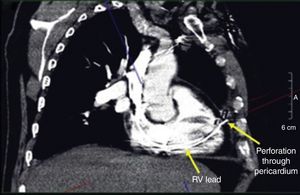
El diagnóstico de la perforación ventricular secundaria a electrodos de marcapasos la podemos identificar y confirmar con radiografía de tórax como lo observamos en nuestro caso, en el cual se encontraba el electrodo ventricular fuera de la cámara cardiaca. Otros métodos diagnósticos pueden ser el fluoroscopio, la ecocardiografía o TAC de tórax, encontrándose en esta última alteraciones de hasta el 15% de pacientes asintomáticos durante los controles postimplante del dispositivo10,23,24. En el ecocardiograma tridimensional podemos obtener una mayor precisión que en la TAC de tórax en la identificación de la perforación ventricular por electrodos, debido principalmente al efecto tomográfico conocido como «estrella» causado por los materiales del electrodo (figs. 8 y 9), haciendo difícil el diagnóstico. No existe consenso sobre criterios radiográficos diagnósticos universalmente aceptados entre los grupos de radiólogos, por esto la correlación clínica nos orienta. Todos estos estudios orientan al diagnóstico, pero la no evidencia del electrodo fuera del corazón no nos descarta la complicación, como sucedió en nuestro caso donde hubo una migración del electrodo de fijación activa auricular derecho con posterior perforación del ventrículo ipsilateral, lo cual nos muestra una complicación aún más infrecuente debido a la perforación ventricular por el electrodo ubicado en la aurícula17,25,26.
Tomografía computarizada de tórax, en la que observamos el electrodo de fijación activa a través del corazón, indicando su trayectoria con las flechas amarillas en el ventrículo derecho y pericardio25.
Tomografía computarizada de tórax en corte axial con el signo de la «estrella» generado por el electrodo17.
El tratamiento dependerá de la dinámica de los signos y síntomas, por lo cual en algunos casos el manejo podría ser conservador tratándose de un paciente estable hemodinámicamente, con derrame pericárdico el cual puede ser tratado en primera instancia con pericardiocentesis y colocación de drenaje pericárdico para posteriormente hacer reposicionamiento del electrodo bajo guía fluoroscópica una vez se encuentre el paciente en mejores condiciones en la misma hospitalización; sin embargo, no hay estudios que nos permitan adoptar esto como una conducta universal. En caso de estar frente a un paciente con inestabilidad hemodinámica o taponamiento cardiaco, el manejo puede ser por toracotomía anterolateral o esternotomía media según el especialista se sienta más entrenado para realizar el retiro del electrodo con posterior cierre primario del defecto con sutura no absorbible tipo polipropileno vascular con o sin Pledget, parche de pericardio e incluso con el advenimiento de los nuevos hemostáticos tipo matriz consistente en gránulos de gelatina con trombina humana como método de puente en el intraoperatorio para posterior cierre de la lesión con sutura y alojando un electrodo epicárdico o reposicionando los nuevos electrodos intracardiacos; a pesar de estas apreciaciones, el manejo definitivo sigue siendo tema de debate en la actualidad27-30, no hay estudios que nos permitan concluir fuertemente cuáles son los criterios para definir el manejo conservador o quirúrgico inicial, por lo que debe individualizarse cada caso clínico31.
ConclusionesPresentamos el caso clínico de una paciente con perforación cardiaca posterior a la colocación de un marcapasos con electrodos de fijación activa, la cual a pesar de ser una complicación poco frecuente puede llegar a ser letal incluso en las manos más expertas.
La perforación es más frecuente en la aurícula que en el ventrículo, debido al grosor de su pared; además, factores como el uso de marcapasos temporales, electrodos de fijación activa, uso de esteroides, edad mayor de 80 años, género femenino y electrodo en ápex del ventrículo derecho se asocian con mayor riesgo de perforación. Clínicamente se presenta con dolor retroesternal de moderada a severa intensidad, sin embargo, debemos recordar que la ausencia de inestabilidad hemodinámica y derrame pericárdico no descarta el diagnóstico de perforación cardiaca en este tipo de pacientes, por lo cual los síntomas clínicos y los estudios imagenológicos son la base del abordaje inicial ante la sospecha de esta complicación. El manejo debe ser igualmente analizado para cada paciente; si está estable hemodinámicamente puede ser manejado de forma conservadora, y si presenta inestabilidad debe ser llevado inmediatamente a la sala de cirugía como se hizo en nuestro caso, en el cual desafortunadamente las perforaciones eran tan grandes que condicionaron una pérdida sanguínea masiva con un estado de shock hipovolémico irreversible. El tratamiento se basa en el retiro y la reacomodación del electrodo, que puede ser bajo fluoroscopio o en cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.