Determinar los beneficios transoperatorios de la colocación de un separador retráctil de pulmón durante la disección esqueletizada de la arteria mamaria, en la cirugía de revascularización miocárdica.
MétodosEstudio transversal descriptivo. Se analizaron variables transoperatorias de 62 pacientes que necesitaron colocación del separador de pulmón durante la disección de la arteria mamaria izquierda.
ResultadosLa disponibilidad del separador permitió su uso en 57 pacientes. La duración de la disección mamaria fue significativamente más prolongada cuando no se empleó el separador (55,5±4,5 vs. 50,4±4,67min). También hubo más sangrado durante el procedimiento en ese grupo (69±20,74 vs. 57,2±12,17ml). Se conservó la integridad de la cavidad pleural en el 87,7% de los pacientes en que se empleó el separador.
ConclusionesSe demostraron beneficios evidentes con el uso del separador de pulmón en cuanto a disminución del tiempo de disección mamaria y conservación de la integridad de la cavidad pleural y de la vena mamaria.
To determine the trans-operative benefits of a malleable lung retractor placement during skeletonised internal mammary artery harvesting in coronary artery bypass graft surgery.
MethodsA descriptive cross-sectional study was conducted by analysing the trans-operative variables of 62 patients who required a lung retractor placement during left internal mammary artery harvesting.
ResultsThe separator was used in 57 patients. The duration of mammary dissection was significantly longer when the retractor was not used (55.5±4.5 vs. 50.4±4.67min). There was also more bleeding during the procedure in that group (69±20.74 vs. 57.2±12.17ml). Pleural cavity integrity was preserved in 87.7% of the patients in whom the retractor was used.
ConclusionsClear benefits of the use of lung retractor were demonstrated in terms of decreased mammary artery dissection time, and preservation of pleural cavity, as well as mammary vein integrity.
Aproximadamente la mitad de todas las muertes por enfermedades cardiovasculares ocurren a causa de la oclusión de arterias coronarias1. La Organización Mundial de la Salud estima la cantidad de estas defunciones en 7 millones por año, así como un total de 800.000 cirugías de revascularización miocárdica, realizadas en el mundo2, para restaurar el flujo sanguíneo distal a una obstrucción arterial1.
Un elemento fundamental de estas operaciones es seleccionar un injerto que se ajuste a las especificidades del paciente, para proveerle de favorables resultados a largo plazo y evitarle reintervenciones y complicaciones3. En este escenario, el factor que más influye en la supervivencia de los pacientes es la selección del hemoducto, y sus características morfológicas son los criterios más importantes a la hora de elegirlo4.
La arteria mamaria interna es el vaso con condiciones más ideales para revascularizar coronarias enfermas5. En 1992, Cunningham et al.6 describieron ampliamente las particularidades técnicas del procedimiento para su disección esqueletizada y delinearon las ventajas reconocidas en aquel momento. Puntualizaron, entre otras, la posibilidad de evitar la entrada pleural, con lo que se evitarían derrames de importante cuantía en dicha cavidad. Señalaron que en el abordaje al segmento proximal de la arteria, puede estar obstaculizada la visualización del cirujano, por la expansión de los pulmones, lo que podría evitarse con la colocación estratégica de un separador flexible; además, mencionaron que en ese mismo lugar puede ser necesario dividir la vena torácica interna con el objetivo de obtener una exposición más satisfactoria.
En los 25 años que mediaron desde entonces, presuntamente se ha escrito muy poco acerca del mencionado separador. En una extensa revisión de publicaciones relacionadas con la disección de la arteria mamaria en cualquiera de sus variantes, solo se encontró el artículo de Efthymiou y Weir7, en el que proponen el empleo de pinzas hemostáticas convenientemente colocadas, para optimizar la disección extrapleural del hemoducto, y teorizan sobre la fabricación futura de un separador más sofisticado. La literatura analizada parece apuntar al hecho de que, excepto estos autores, nadie más considera necesario separar el pulmón del lecho de la mamaria, o quienes lo hacen no lo comentan en sus informes.
En lo concerniente a la conservación de la integridad tanto de la pleura como del plexo venoso mamario, predomina la inconsistencia en lo señalado por los autores. Al no existir guías o consensos en relación con la mejor forma de diseccionar los hemoductos, cada grupo quirúrgico se ajusta a la norma que considere más conveniente, con base en su mayor o menor experiencia.
El objetivo de este estudio fue determinar, en una serie de pacientes, los beneficios transoperatorios de la implementación de un separador retráctil confeccionado a partir de aditamentos en desuso, propios de la cirugía coronaria, para facilitar la disección esqueletizada de la arteria mamaria, que permitiera optimizar el empleo del personal, agilizar el procedimiento e intentar conservar la vena mamaria y la cavidad pleural intactas.
MétodoSe realizó un estudio transversal descriptivo. Se analizaron los datos concernientes a la disección de la arteria mamaria izquierda en una serie de 62 pacientes operados de revascularización miocárdica, aislada o en combinación con otro procedimiento, entre febrero de 2016 y diciembre de 2017. Los criterios de inclusión en el estudio fueron que la disección de la mamaria se realizara mediante esqueletización solo con clips y tijera; y que el cirujano considerara necesaria la colocación de un separador de pulmón, estuviera o no disponible, para facilitar la preparación del hemoducto en cualquiera de sus segmentos.
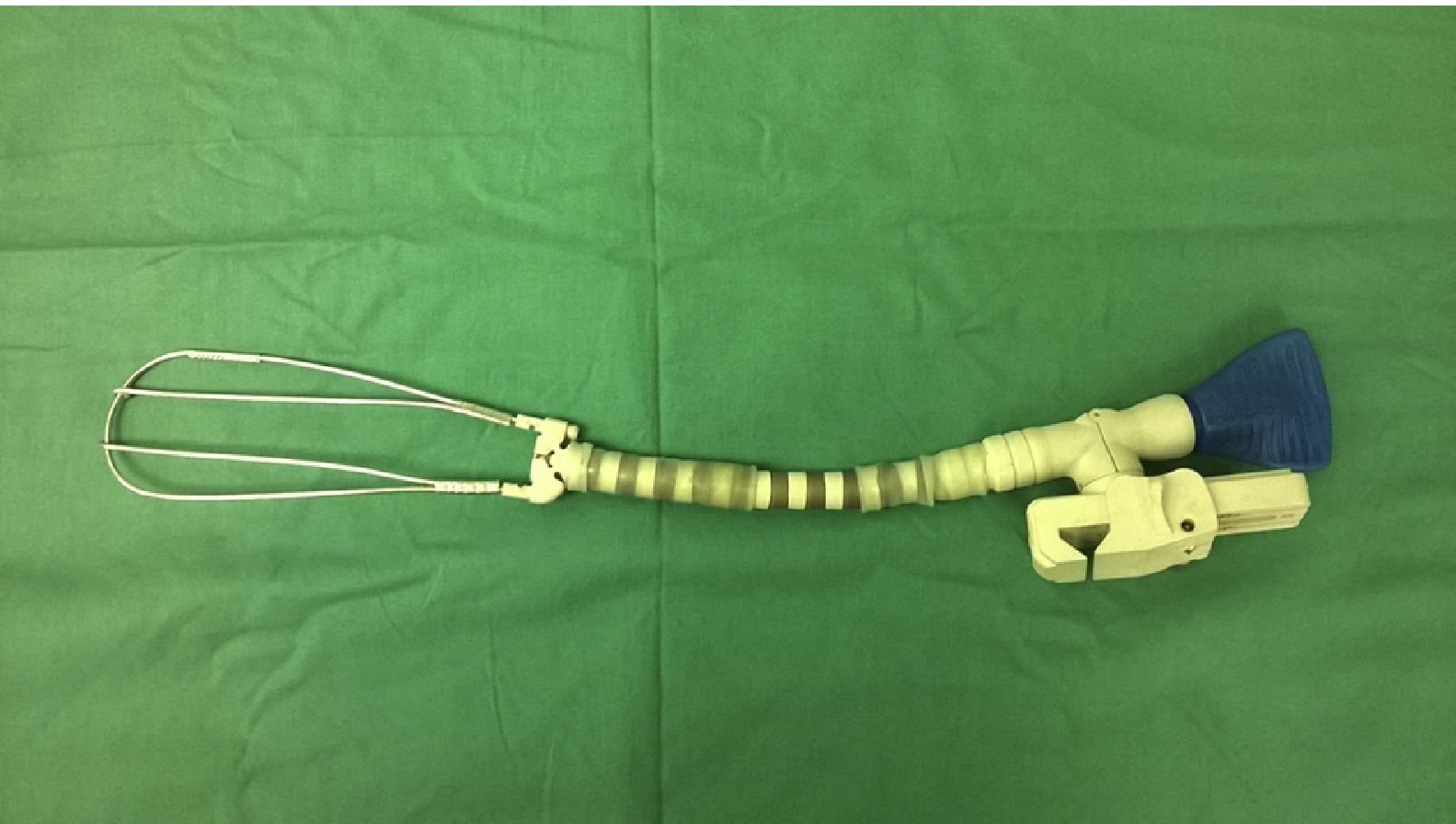
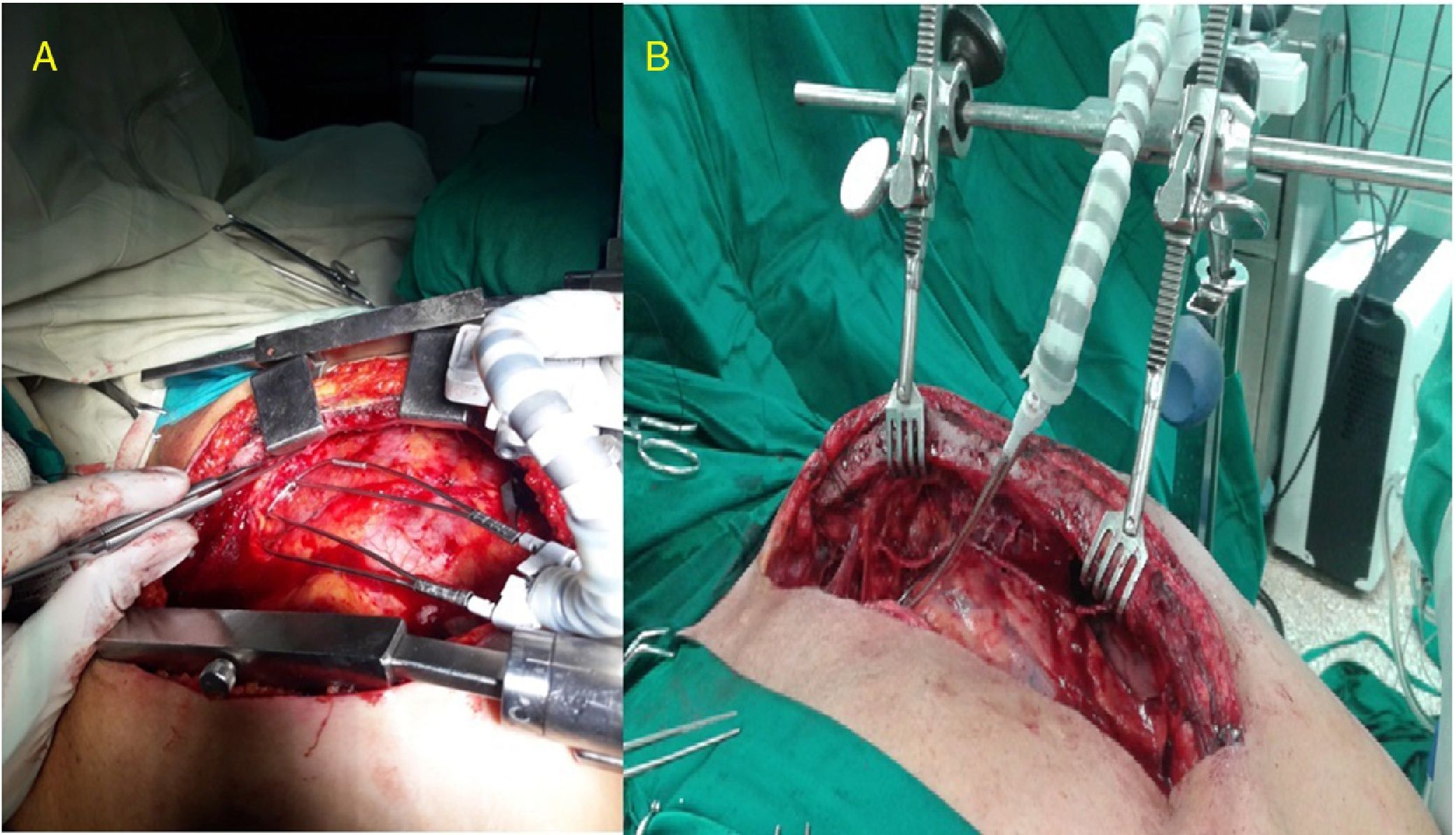
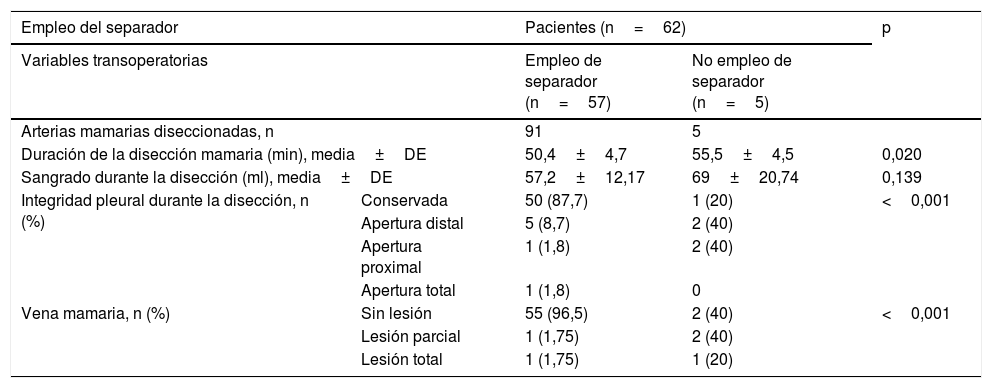
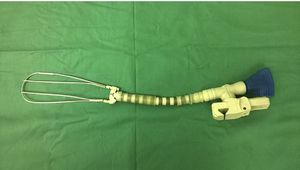
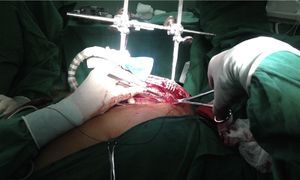
Características del separadorSe confeccionó un dispositivo ajustable (fig. 1) que puede fijarse de varias formas a prácticamente cualquier separador esternal (figs. 2 y 3). Convenientemente colocado, permite la depresión de segmentos superomediales del pulmón, alejándolos del recorrido de la mamaria, lo que agiliza y facilita su disección sin afectar el desempeño del cirujano, sin necesidad de disminuir el volumen corriente pulmonar o la presión positiva al final de la espiración, y sin requerir la asistencia de otro miembro del personal quirúrgico para esta maniobra.
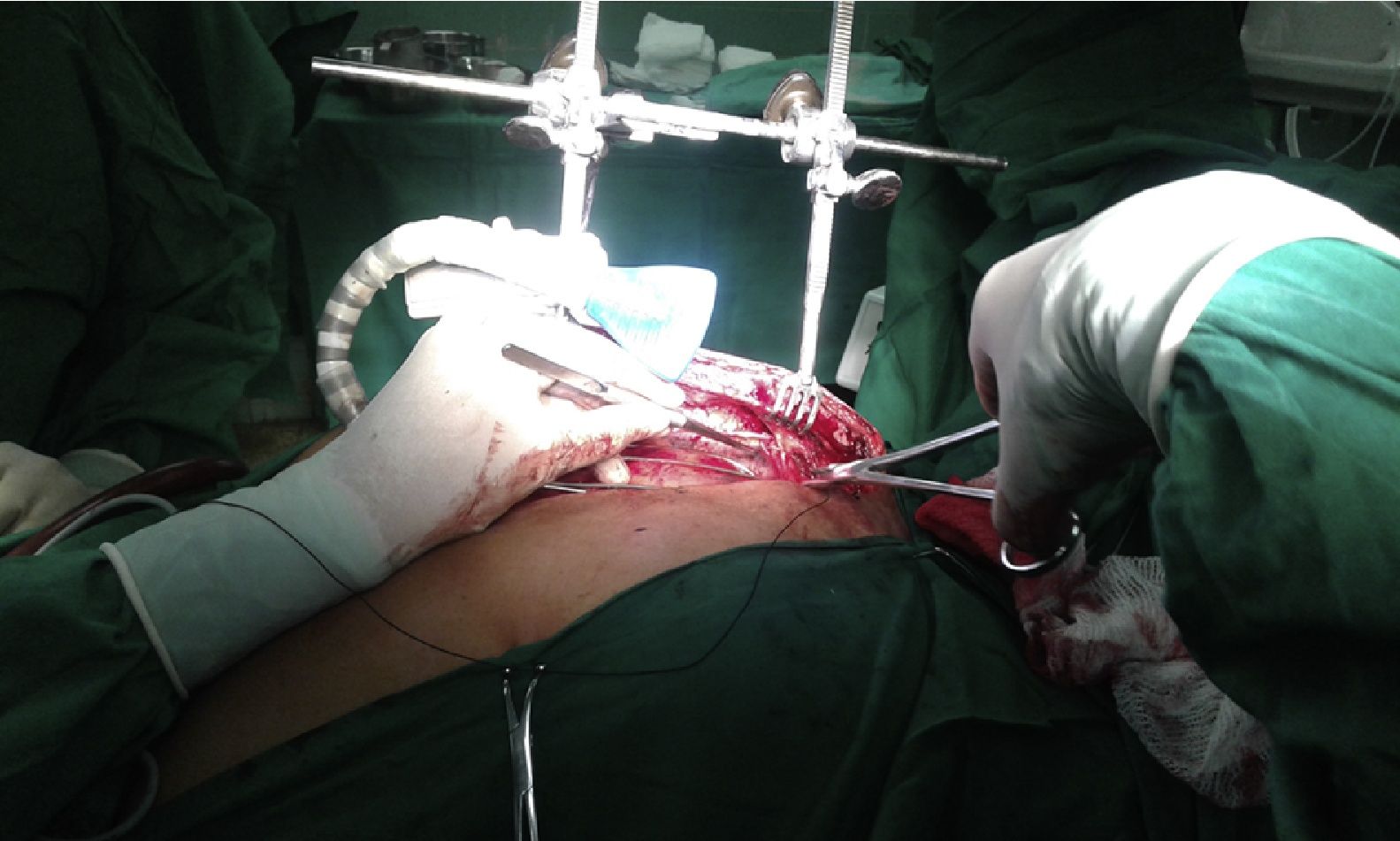
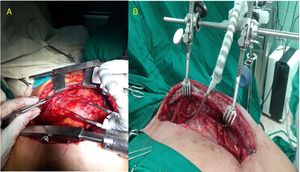
Disección de mamaria derecha. Detalle de la maniobra para separar, mediante lazo de seda, el segmento proximal de la vena mamaria del recorrido de la arteria. En la figura 2 B (mamaria izquierda) ya ha sido anclado el punto al borde de la herida y se observa la vena separada.
Todos los componentes del separador provienen de accesorios inutilizables por desperfectos (guías y cánulas de cardioplejia retrógrada y ostial), o confeccionados para un solo uso (brazos articulados desechables de estabilizadores) en cirugía coronaria.
Disección mamaria y colocación del separadorSe realizó disección esqueletizada de la arteria mamaria izquierda solo con clips y tijeras. Se intentó conservar intactas la cavidad pleural y el plexo venoso retroesternal. Según su disponibilidad y la necesidad a juicio del cirujano, se empleó el separador de pulmón que se presenta, para optimizar la exposición de la mamaria y facilitar su disección extrapleural.
Definición de las variablesSe identificaron factores de riesgo preoperatorios para complicaciones respiratorias y de la herida esternal en concordancia con los internacionalmente aceptados en la literatura8,9. En el factor «historia de nicotinismo» fueron incluidos pacientes con antecedentes de haber fumado al menos durante una década hasta menos de 2 años antes de la cirugía.
Se cuantificó la duración de la disección mamaria (en minutos) desde la visualización de la arteria hasta su división distal final, se empleara o no el separador.
El sangrado se cuantificó mediante la medición del volumen aspirado (ml) y la estimación del contenido de sangre en las compresas utilizadas durante el procedimiento de disección mamaria, según los protocolos del hospital.
La apertura accidental de la pleura se situó en 2 localizaciones: proximal (por encima del tercer espacio intercostal [EIC]) y distal (por debajo del cuarto EIC).
Se definió como lesión total de la vena mamaria la división transversal de su tronco por encima del tercer EIC; lesiones parciales fueron consideradas los desgarros o secciones accidentales de algunas de sus ramas por debajo del cuarto EIC.
Procesamiento estadísticoEl análisis estadístico se realizó con la herramienta Excel del paquete Microsoft Office, versión 2016. Las variables continuas se expresaron mediante el promedio±la desviación estándar, con un intervalo de confianza del 95%de la media. Las variables categóricas se expresaron mediante recuento y porcentajes. Para las comparaciones de variables continuas se empleó el test de t de Student. Para las comparaciones de variables categóricas se usó el test de Chi cuadrado.
Se consideraron no significativos valores de p>0,05, significativos, p≤0,05, muy significativos, p≤0,01, y altamente significativos, p≤0,001.
ÉticaEl estudio fue aprobado por el Comité de Ética de la Investigación de nuestro hospital como parte de un proyecto institucional que analiza los resultados de la implementación de modificaciones a la técnica clásica de disección esqueletizada de la arteria mamaria. Todos los pacientes firmaron un modelo de consentimiento informado para formar parte de dicho proyecto y autorizar la publicación de datos relacionados con su cirugía.
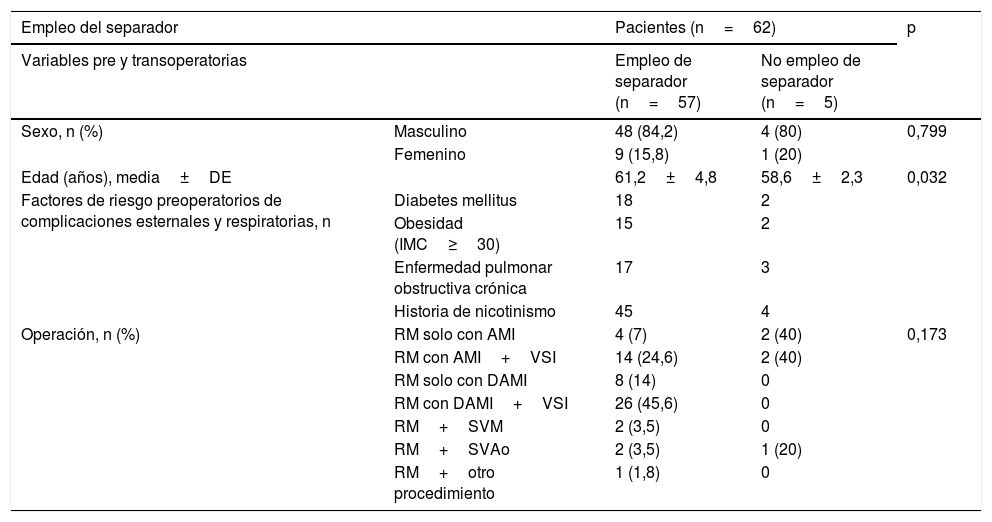
ResultadosEl separador de pulmón que se presenta fue empleado en 57 de los 62 pacientes sometidos a disección de la arteria mamaria para cirugía de revascularización coronaria, que cumplieron con los criterios de inclusión en el estudio en el período que se analiza. En 5 casos el cirujano consideró necesaria la utilización del separador, pero este no estuvo disponible, al no estar esterilizado; puede asumirse, por tanto, que su uso respondió a una distribución aleatoria, en la población de pacientes en que se consideró pertinente su empleo. Como muestra la tabla 1, la mayoría de los pacientes (83,9%) involucrados en el estudio fueron del sexo masculino. Los individuos del grupo donde se empleó el separador de pulmón tenían más edad (61,2±4,8 vs. 58,6±2,3 años; p=0,032; IC 95%). Cuarenta y nueve pacientes (79%) tenían historia de nicotinismo; 20 padecían de diabetes mellitus y enfermedad pulmonar obstructiva crónica. La cirugía que más se realizó fue la revascularización miocárdica con 2 arterias mamarias, complementada con injertos venosos (41,9%).
Variables pre y transoperatorias generales
| Empleo del separador | Pacientes (n=62) | p | ||
|---|---|---|---|---|
| Variables pre y transoperatorias | Empleo de separador (n=57) | No empleo de separador (n=5) | ||
| Sexo, n (%) | Masculino | 48 (84,2) | 4 (80) | 0,799 |
| Femenino | 9 (15,8) | 1 (20) | ||
| Edad (años), media±DE | 61,2±4,8 | 58,6±2,3 | 0,032 | |
| Factores de riesgo preoperatorios de complicaciones esternales y respiratorias, n | Diabetes mellitus | 18 | 2 | |
| Obesidad (IMC≥30) | 15 | 2 | ||
| Enfermedad pulmonar obstructiva crónica | 17 | 3 | ||
| Historia de nicotinismo | 45 | 4 | ||
| Operación, n (%) | RM solo con AMI | 4 (7) | 2 (40) | 0,173 |
| RM con AMI+VSI | 14 (24,6) | 2 (40) | ||
| RM solo con DAMI | 8 (14) | 0 | ||
| RM con DAMI+VSI | 26 (45,6) | 0 | ||
| RM+SVM | 2 (3,5) | 0 | ||
| RM+SVAo | 2 (3,5) | 1 (20) | ||
| RM+otro procedimiento | 1 (1,8) | 0 | ||
AMI: arteria mamaria interna (en referencia a la cirugía); DAMI: dos arterias mamarias internas; DE: desviación estándar; IMC: índice de masa corporal; RM: revascularización miocárdica; SVAo: sustitución valvular aórtica; SVM: sustitución valvular mitral; VSI: vena safena interna.
La tabla 2 muestra que la duración de la disección mamaria fue significativamente más prolongada en el grupo donde no se empleó el separador de pulmón (55,5±4,5 vs. 50,4±4,67min; p=0,020; IC 95%). No hubo diferencia significativa en la cuantía del sangrado durante la disección entre ambos grupos (69±20,74 vs. 57,2±12,17ml; p=0,139). Se pudo conservar la integridad de la cavidad pleural en el 87,7% de los pacientes en que se empleó el separador, pero solo en el 20% del otro grupo (p<0,001). En solo 4 pacientes la vena mamaria sufrió algún tipo de lesión accidental; en 3 de esos casos no se usó el separador.
Variables transoperatorias relacionadas con la disección mamaria
| Empleo del separador | Pacientes (n=62) | p | ||
|---|---|---|---|---|
| Variables transoperatorias | Empleo de separador (n=57) | No empleo de separador (n=5) | ||
| Arterias mamarias diseccionadas, n | 91 | 5 | ||
| Duración de la disección mamaria (min), media±DE | 50,4±4,7 | 55,5±4,5 | 0,020 | |
| Sangrado durante la disección (ml), media±DE | 57,2±12,17 | 69±20,74 | 0,139 | |
| Integridad pleural durante la disección, n (%) | Conservada | 50 (87,7) | 1 (20) | <0,001 |
| Apertura distal | 5 (8,7) | 2 (40) | ||
| Apertura proximal | 1 (1,8) | 2 (40) | ||
| Apertura total | 1 (1,8) | 0 | ||
| Vena mamaria, n (%) | Sin lesión | 55 (96,5) | 2 (40) | <0,001 |
| Lesión parcial | 1 (1,75) | 2 (40) | ||
| Lesión total | 1 (1,75) | 1 (20) | ||
DE: desviación estándar.
Los métodos de obtención y preparación de la arteria mamaria para cirugía coronaria han recibido tanta atención como el procedimiento mismo de construcción de injertos.
Hacia 1985 la mayoría de estos vasos eran diseccionados de forma pediculada. En 1986 un trascendental artículo del grupo de la Clínica Cleveland de Ohio10 estableció los beneficios, en materia de permeabilidad a largo plazo y disminución de reintervenciones, de la revascularización de la arteria descendente anterior con la mamaria en lugar de la safena. Comienza entonces a modificarse la técnica de disección con el objetivo de obtener un hemoducto de mayor longitud que permitiera la realización de más puentes arteriales (secuenciales) y en posiciones más distales. Presuntamente por esos años se acuña el término «esqueletización» en cirugía cardíaca11 y se reportan los primeros beneficios de la preparación de una arteria mamaria desprovista de tejidos perivasculares que le disminuyen el largo y el diámetro12.
Es en ese contexto en el que se publica el artículo de Cunningham et al., quizás la más completa descripción de la técnica de disección esqueletizada de la mamaria, tal como se continúa practicando hoy. Por primera vez, no solo se le da importancia a la calidad del hemoducto obtenido, sino además, a preservar en la medida de lo posible la integridad anatómica y funcional de las estructuras alrededor de su lecho. Señalan sus autores que la esqueletización in situ (diferente a la técnica propuesta por Keeley en 1987, que separaba inicialmente el vaso de forma pediculada12) minimizaría la posibilidad de lesiones de estructuras adyacentes (nervio frénico, venas, conductos linfáticos), preservaría la irrigación sanguínea esternal y daría alguna protección contra la entrada inadvertida en la cavidad pleural. Contradictoriamente a estos postulados, subrayaban la necesidad de dividir la vena mamaria interna en cualquier momento en que su localización interfiriera con la satisfactoria disección de su arteria homónima6.
A la luz de los conocimientos actuales, los principales inconvenientes relacionados con daños a estructuras periarteriales durante la disección esqueletizada de la mamaria están en relación con la afectación de la irrigación sanguínea (colateral) al esternón, si no se respeta la integridad de las bifurcaciones de sus ramas, y la lesión de estructuras vasculares (venas, conductos linfáticos) y nerviosas (frénico), así como de órganos vecinos (pulmones y pleuras).
En este contexto, aún no existe un consenso definitivo en cuanto al mejor destino de la pleura mediastínica y la vena mamaria interna. En relación con la apertura o no de la cavidad pleural, es muy difícil precisar la tendencia predominante13. Cada grupo quirúrgico defiende los pros y contras de una u otra estrategia; por tal motivo pueden encontrarse reportes de series en las cuales siempre se abre14 o en las que se intenta conservar cerrada15. En relación con la vena mamaria, aparentemente la mayoría de los autores acepta con indiferencia la posibilidad de desecharla y solo escasos reportes avalan las ventajas de no lesionar el plexo retroesternal, al interpretar la congestión venosa a ese nivel como un posible factor predisponente para complicaciones infecciosas del sitio quirúrgico16.
El riesgo de lesión del nervio frénico y su repercusión sobre el funcionamiento del diafragma ha sido también motivo de estudio en relación con la disección mamaria. Los cirujanos no solo deben estar atentos ante la posibilidad de este accidente cuando se abre la brecha pericárdica para el puente17, sino sobre todo durante el abordaje a los segmentos proximales del mencionado hemoducto, pues son conocidas las estrechas relaciones anatómicas entre ambas estructuras a ese nivel18,19.
Es precisamente el segmento más proximal de la arteria mamaria el que representa una mayor complejidad anatómica durante su disección. La observación directa del hemoducto se ve comprometida por la poca movilidad que ofrecen esas porciones del esternón, y por la interposición de los segmentos superomediales del pulmón en el campo visual del cirujano. Además, a ese nivel las ramas arteriales son mucho más gruesas y en ocasiones más cortas; también aumenta la cuantía de tejido graso que envuelve las estructuras vasculares y nerviosas, el que a su vez es más laxo, lo que dificulta su manipulación. En muchas ocasiones la vena mamaria discurre en el aspecto medial de su arteria, lo cual entorpece su visualización, enlentece el procedimiento de disección y aumenta el riesgo de lesionar uno u otro conducto.
Nuestra experiencia nos indica que cuando la vena mamaria interfiere con la disección proximal de la arteria, las opciones que puede considerar el cirujano son cortarla entre clips y apartar los extremos del campo visual o, mediante maniobras delicadas y en ocasiones demoradas, intentar distanciar ambos vasos y separar la arteria de su lecho sin lesionar ninguno. En nuestro estudio, se logró conservar la integridad total del plexo venoso retroesternal en la mayoría de los pacientes en que se empleó el separador de pulmón; solamente se lesionaron accidentalmente 2 venas en 57 pacientes (3,5%). La colocación cuidadosa del aditamento, al alejar el pulmón y el tejido graso de la zona del pedículo venoarterial y mejorar la visión y la maniobrabilidad del cirujano, pudo haber tenido un efecto coadyuvante en el 96,5% de las venas que fueron totalmente conservadas, favorecido en algunos casos por una sencilla maniobra consistente en la separación transitoria de la vena del recorrido de su arteria, traccionándola con un lazo anclado a la piel (fig. 3). Existió una diferencia altamente significativa en cuanto a la conservación de la vena mamaria entre ambos grupos (p<0,001; IC 95%).
Cuando es la insuflación pulmonar la que interfiere, se precisa generalmente la asistencia de otro miembro del equipo para la depresión del órgano mediante un separador manual clásico u otro accesorio (cánula de aspirador, etc.). Otras opciones a considerar incluyen la modificación de la ventilación (disminución de la presión positiva al final de la espiración o del volumen corriente) y la colocación de compresas húmedas sobre el pulmón para lograr su hundimiento parcial, técnica que pierde su eficacia si la pleura no ha sido ampliamente abierta7. Cirujanos que intenten diseccionar la mamaria sin modificar momentáneamente la anatomía de pulmones enfisematosos y/o hiperinsuflados enfrentarán mayores dificultades, consumo de más tiempo y una elevada probabilidad de lesionar tanto la pleura mediastínica como estructuras vasculares o nerviosas de su vecindad. En nuestro estudio se acortó 5min, como promedio, la duración de la disección cuando se usó el separador de pulmón. No obstante, es aún dilatada la duración de la disección mamaria. Debe considerarse que no se empleó electrocauterizador, y que para los jóvenes cirujanos que realizaron la preparación del hemoducto, estos casos aún constituyen lo que habitualmente se conoce como curva de aprendizaje, en la práctica quirúrgica.
Existen pocos estudios que relacionen los efectos de la preservación de la integridad pleural con la disfunción respiratoria postoperatoria20. Según lo mejor de nuestro conocimiento, este es el primer reporte acerca de los beneficios inmediatos de la utilización, en una serie de pacientes, de un separador de pulmón específicamente confeccionado para facilitar la disección de la arteria mamaria interna durante la cirugía de revascularización miocárdica, en escenarios donde complicadas relaciones anatómicas ponen en riesgo la calidad del procedimiento, la salud de importantes estructuras que se encuentran a ese nivel y el mantenimiento de la integridad pleural.
Se asume erróneamente que la preparación de la arteria mamaria de forma esqueletizada está consecuente y estrechamente relacionada con la conservación de la pleura intacta21. Es cierto que la manipulación cuidadosa de la reflexión de su porción mediastinal permitirá en muchas ocasiones descubrir completamente el recorrido de la mamaria sin entrar en la cavidad torácica, pero no siempre es así. En uno de nuestros pacientes, la arteria mamaria discurría por un lecho completamente intrapleural, lo que obligó a la apertura total de la cavidad para su disección. Por otra parte, con cada inspiración los pulmones se insuflarán, y casi inevitablemente intentarán ocupar su espacio habitual, por lo que deberán tomarse medidas para mantenerlos alejados del sitio de trabajo del cirujano. Las adherencias normales de la pleura mediastínica a la pared torácica son lo suficientemente débiles como para ser rotas incluso por la presión ejercida por un neumomediastino22. Esto justifica el hecho de que la simple depresión de cualquier segmento pulmonar con instrumentos que no han sido diseñados para ese objetivo o tipo de cirugía pueda abrir inadvertidamente la cavidad, incluso de forma desapercibida, mientras se intenta descubrir el trayecto de la arteria. Este riesgo parece ser mayor durante la disección de la mamaria derecha, donde la inserción de la pleura a la pared costal ocurre en un plano más medial, lo que provoca además una mayor incursión del pulmón derecho en el espacio anterior del mediastino, principal causa de la apertura pleural accidental inicial cuando no se logra que la sierra corte simétricamente el esternón.
Debe recordarse además que la mayoría de los grupos que practican la disección esqueletizada de la mamaria se auxilian de electrocauterizador o bisturí armónico23–25. La acción de estos implementos, incluso a baja intensidad, puede lesionar una pleura extremadamente delgada, el pulmón26 u otras estructuras27 si se aproximan demasiado al hemoducto en cualquiera de sus segmentos. Independientemente de la causa que la provoque, la violación de la cavidad pleural podrá ocasionar neumotórax28 o derrames pleurales29, con algún grado de alteración funcional.
Se ha demostrado que el procedimiento de disección mamaria induce cambios en la mecánica pulmonar, al deteriorar su funcionamiento en el postoperatorio inmediato, lo que incrementa el riesgo de complicaciones respiratorias. Estos perjuicios son significativamente atribuidos, entre otras causas, al trauma sobre la pared torácica30 y el parénquima pulmonar7, pero en especial a la apertura de la cavidad pleural. En este sentido, un cuantioso cuerpo de evidencia muestra que la preservación de la integridad pleural durante la preparación del hemoducto está asociada a grados inferiores de disfunción pulmonar30.
En nuestro estudio, se logró conservar la integridad pleural en el 82,3% del total de los pacientes, y en el 87,7% del grupo donde se empleó el separador de pulmón. Este implemento pudo haber tenido un efecto coadyuvante en el 98% del total de los casos con pleura intacta. En solamente un paciente (1,8%) ocurrió apertura pleural durante la disección proximal de la mamaria, a pesar de emplearse el separador.
Algunos autores han reportado una mayor incidencia postoperatoria de atelectasias en el lado izquierdo en comparación con el derecho, pero no se ha podido precisar satisfactoriamente la causa de este fenómeno. Si la preservación pleural no se ha relacionado etiológicamente en algunos estudios31, una posible explicación podría estar vinculada con la acción de desinflar los pulmones, mecánica (depresión manual exagerada) o ventilatoriamente (disminución de la presión positiva al final de la espiración y/o el volumen corriente) durante la disección del segmento proximal de la mamaria, maniobra, esta última, muchas veces solicitada al anestesiólogo, cuando la labor del cirujano se ve limitada por la expansión de aquellos32. La colocación de un separador flexible facilitará una depresión menos profunda del pulmón, de una forma estable y estrictamente necesaria para descubrir el trayecto de la mamaria, con evidentes ventajas sobre la dinámica ventilatoria durante ese tiempo.
Otro de los beneficios del empleo del separador de pulmón está en relación con lograr una disminución o un mejor control del sangrado. Esto puede observarse desde 2 perspectivas: inmediata (en el transoperatorio) y a corto plazo (postoperatorio). La mejor visualización de los vasos mamarios y sus ramas facilitará su control, disminuirá las posibilidades de desgarro y permitirá una mejor hemostasia de otras fuentes de hemorragia en un lecho que puede explorarse sin dificultad. A su vez, la conservación de la integridad pleural evitará la acumulación imperceptible de sangre en este espacio durante la cirugía: un campo quirúrgico cubierto de sangre obligará al cirujano a buscar sitios de hemorragia oculta, que de otra forma no se diagnosticarán hasta el final de la operación. A esto debe agregarse prescindir de la necesidad de drenar un espacio pleural que ha logrado mantenerse cerrado33 y otras ventajas en relación con la evitación de la colocación de drenajes34, lo que muchas veces permite la rápida salida del paciente de la sala de cuidados intensivos35.
Otro de los posibles riesgos que entraña la violación de la pleura es la formación secundaria de fístulas entre arterias sistémicas y vasos pulmonares. Adherencias pleurales provocadas por procesos inflamatorios36 o traumas a la pleura o el parénquima pulmonar26 están entre las causas fundamentales; la cercana relación anatómica que se puede establecer entre la mamaria y el pulmón37, cuando la pleura es violada, la convierten en uno de los vasos fundamentales en desarrollar estas comunicaciones26. Por este y otros motivos, algunos autores38 abogan por dejar intacta la mayor parte de la pleura aunque haya ocurrido su apertura accidental.
ConclusionesLa disección de la arteria mamaria interna, en especial su segmento proximal, puede verse demorada y accidentada por complejas relaciones anatómicas que se establecen en ese reducido espacio. La confección de un dispositivo separador, de fácil funcionamiento y colocación, permitirá la depresión del pulmón minimizando traumas mecánicos, evitando desgarros y lesiones por una inadecuada visualización. En nuestro estudio, se demostraron beneficios evidentes con el uso del separador de pulmón en cuanto a disminución del tiempo de disección mamaria y conservación de la integridad pleural y del plexo venoso retroesternal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.