El trasplante cardíaco pediátrico constituye un reto multidisciplinar y son escasas las series amplias a nivel mundial. Presentamos evolución, tendencias y resultados de nuestra serie y perspectivas futuras.
Material y métodosDesde inicio del programa (1990) hasta 2015, se han realizado 163 trasplantes (158 pacientes): 50,3% (n=82) cardiopatías congénitas (80,5% [n=66] univentriculares); 33,7% (n=55) miocardiopatía dilatada; 4,3% (n=7) miocardiopatía hipertrófica; 3,6% (n=5) retrasplante, y 7,9% (n=14) otras causas. La edad media fue 5,1±3,2 años (rango 11 días-17 años) y peso medio 17,2±3kg (rango 2,8-70). Se realizaron análisis descriptivo, comparativo (períodos históricos) y análisis multivariante y de seguimiento (Software-R-Core-Team-2013).
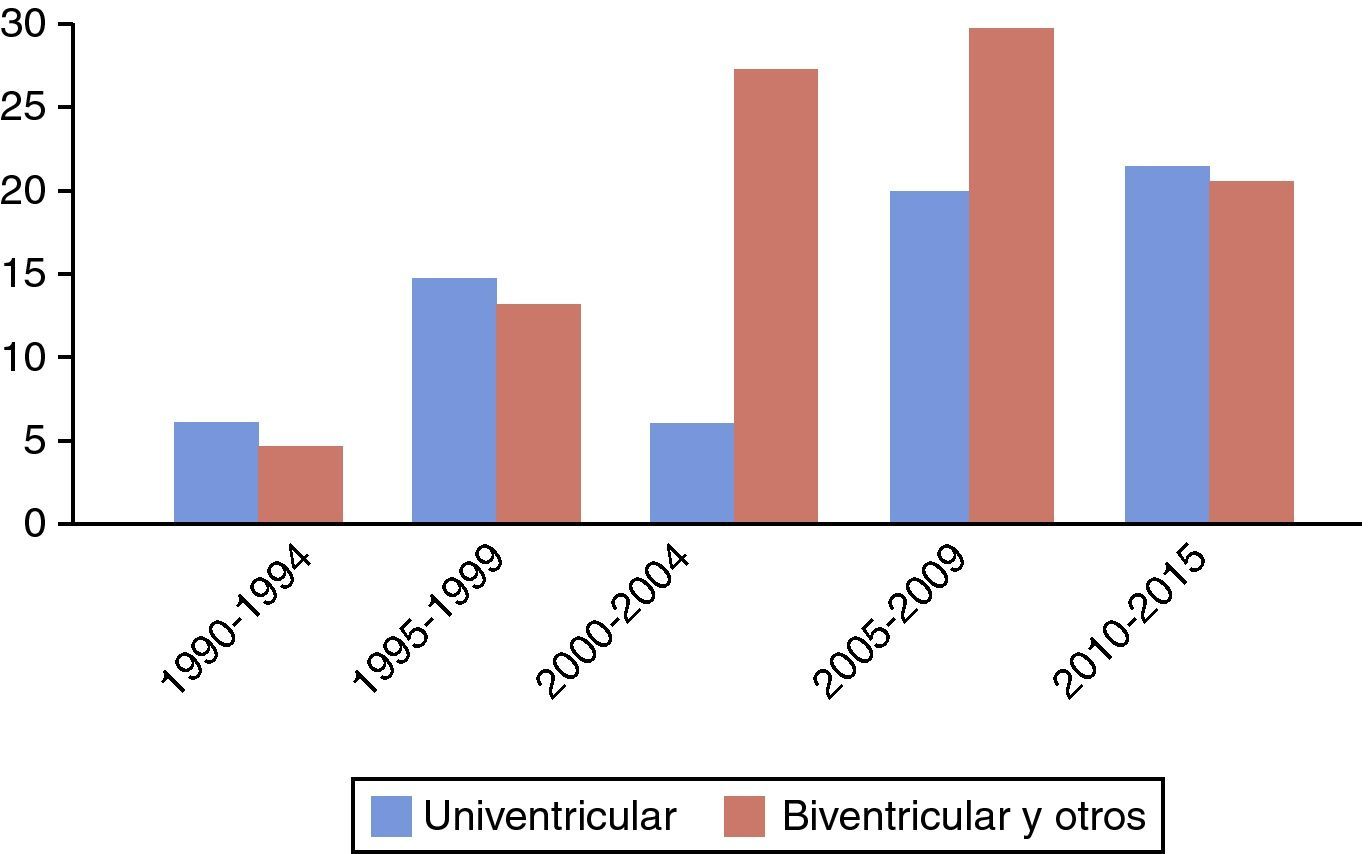
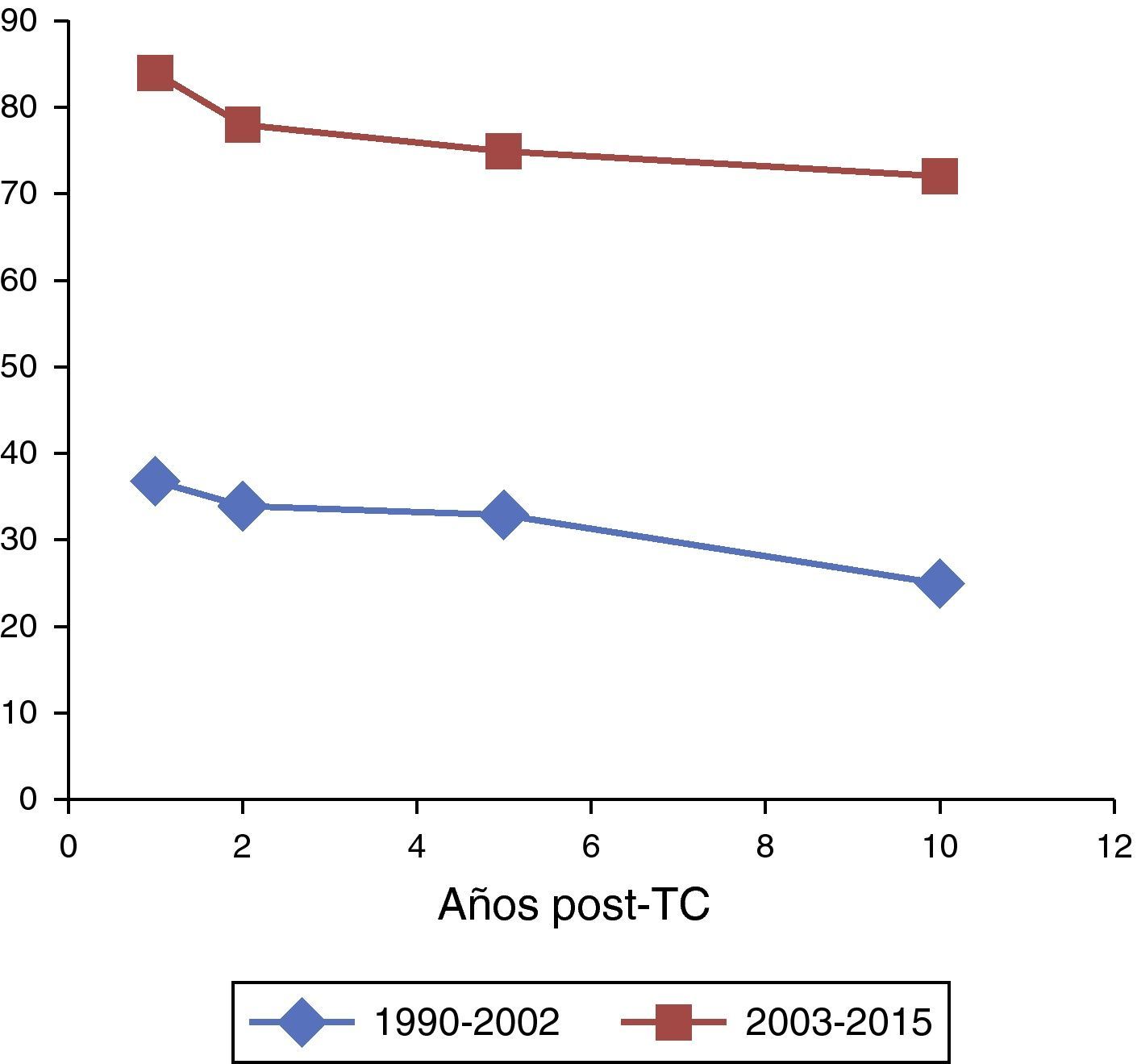
ResultadosA partir del 2003, se incrementa el número global de trasplantes cardíacos, convirtiéndose la fisiología univentricular en estadio Glenn (n=14) y Fontan (n=10) la cardiopatía congénita más prevalente, precisando reconstrucciones complejas preimplante. La mortalidad global a 30 días fue del 20,2% (n=33), descendiendo en el segundo período (14,4% vs. 30,5%, p<0,0011). El período de seguimiento medio global fue 10,4±3,6 años (rango 3,2 meses-21,1 años). La supervivencia a 10 años se incrementó en aquellos trasplantados a partir del 2003 (80,8% vs. 60,9%, p<0,034). La fisiología univentricular previa (OR 2.7, rango 1.9-3.6, IC del 95%, p<0,039) y la era histórica (OR 5,8, rango 3,4-6,9, IC del 95%, p<0,011) se asociaron a mayor riesgo de eventos adversos en el análisis multivariante.
ConclusiónEl trasplante cardíaco pediátrico presenta óptimos resultados en nuestro medio, superponibles a series mundiales. Aunque el perfil de riesgo está incrementándose, los resultados actuales reflejan los avances en el manejo de estos pacientes.
Single-center data on pediatric heart transplantation over long time frames remains scarce. We analyze our experience and how risk profile between early and current eras has evolved as well as the future implications.
Material and methodsWe divided 163 pediatric heart transplants (158 patients) between 1990-2015 into two groups: the first 13 years (59 transplants) and the most recent 13 years (104 transplants). Congenital heart disease was present in 50.3% (n=82) (of them, 80.5% (n=66) univentricular heart); dilated cardiomyopathy 33.7% (n=55); hypertrophic cardiomyopathy 4.3% (n=7); re-transplant 3.6% (n=5) and others 7.9% (n=14). Mean age was 5.1±3.2 years (range 11 days-17 years); mean weight 17.2±3kg (range 2.8-70). Descriptive and comparative analysis along with multivariate and survival analysis were included (Software-R-Core-Team-2013).
ResultsSince 2003, the overall number of transplants increased and Glenn (n=14) and Fontan (n=10) stages were the most prevalent types of congenital heart disease. Early mortality was 20.2% (n=33) and a significative decrease was detected for the second era (14.4% vs 30.5%, p<0.0011). Mean follow-up was 10.4±3.6 years (range 3.2 months-21.1 years). Actuarial 10-year survival improved significantly after 2003 (80.8% vs 60.9%, P<.034). Prior univentricular palliation (OR 2.7, range 1.9-3.6, CI 95%, P<.039) and era (OR 5.8, range 3.4-6.9, CI 95%, P<.011) were associated to a higher risk for adverse events (multivariate analysis).
ConclusionThe risk profile of pediatric transplant patients has significantly increased over time. Transplantation following single-ventricle palliation has increased dramatically and remains a surgical challenge. Despite this, long-term survival has consistently improved over the years.
Desde aquel histórico primer trasplante cardíaco (TC) pediátrico realizado en Loma Linda en 1984 por el Dr. Bailey, el cual implantó un corazón de babuino a un neonato1, han sido muchos los cambios y progresos acontecidos en este ámbito, modificándose tanto las estrategias como el perfil de estos pacientes a lo largo de los años.
Sobre la base de los datos de la International Society of Heart and Lung Transplantation (ISHLT)2,3, los receptores pediátricos tan solo constituyen un 12,5% del total de los trasplantes cardíacos mundiales anuales y, en la actualidad, el TC pediátrico sigue siendo un reto multidisciplinar para cualquier equipo.
Hasta la fecha, son escasos los centros que han publicado los resultados de su actividad trasplantadora en esta población, siendo limitados los programas con más de 20 años de historia que cuenten con un amplio número de pacientes, en los que se incluyen los centros de Toronto (Canadá), Londres (Reino Unido), Berlín (Alemania), Melbourne (Australia), así como varios en Estados Unidos (Loma Linda, Atlanta, Missouri, Houston y Stanford)4-6. De manera superponible, nuestro centro en España mantiene una elevada actividad trasplantadora en pacientes pediátricos desde el año 1990, englobando cerca del 50% de los TC pediátricos anuales realizados en el país.
Debido al reto que supone para el conjunto de profesionales implicados y a la escasez de datos a nivel mundial, presentamos la evolución, las tendencias y los resultados de nuestra serie, así como las perspectivas futuras, con atención particular a las modificaciones en el perfil de estos pacientes a lo largo del tiempo.
Material y métodosPacientes. Desde el inicio del programa en 1990, se han realizado 163 trasplantes en 158 pacientes pediátricos (menores de 18 años de edad) durante un período de tiempo de 26 años (1990-2015), siendo la totalidad incluidos en el estudio. El seguimiento fue completado en el 100%. Los pacientes fueron divididos en dos grupos según el período de tiempo: primer (1990-2002) y segundo período (2003-2015).
Manejo intra/postoperatorio. Respecto a la técnica quirúrgica del TC, la técnica bicava se introdujo en 2001 en esta serie. La asociación de una reconstrucción anatómica preimplante de ramas pulmonares, arco aórtico o retorno venoso sistémico se asoció en casos de cardiopatías congénitas complejas. La inmunosupresión (inducción) mediante ciclosporina fue reemplazada gradualmente por basiliximab a partir del 2004. El seguimiento del rechazo se realizó por datos ecocardiográficos en aquellos menores de 2 años de vida y mediante biopsias miocárdicas seriadas a partir de dicha edad.
Datos y análisis estadístico. Los datos fueron extraídos del Registro Nacional de Trasplante Cardíaco (pacientes pediátricos) de la Sección de Insuficiencia Cardíaca de la Sociedad Española de Cardiología (SEC). Dichos datos son aportados y actualizados por nuestro Centro de forma continua. El análisis de datos se realizó mediante Software R Core Team 2013 (R Foundation for Statistical Computing, Vienna, Austria). Se incluyeron análisis descriptivo y comparativo (chi cuadrado, test exacto de Fisher y t de Student según variables categóricas o continuas, respectivamente) por períodos históricos, uni y multivariante (regresión logística, intervalo de confianza [IC] 95%). En el análisis de supervivencia se emplearon curvas de Kaplan-Meier. Se definió evento adverso como muerte o necesidad de retrasplante. Se consideró p<0,05 como significación estadística.
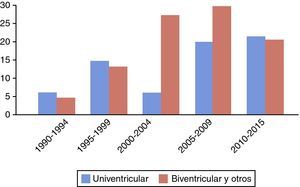
ResultadosAnálisis descriptivo. En 1990 se realiza el primer TC pediátrico, siendo el receptor un paciente con miocardiopatía (MCP) dilatada. Posteriormente, en 1991 se trasplanta el primer caso tras cirugía de Norwood en paciente con síndrome de ventrículo izquierdo hipoplásico (SVIH). Desde entonces y hasta la fecha, se han ido sumando los progresivos estadios de paliación univentricular así como un amplio rango de otras cardiopatías congénitas, incluyendo también fisiología biventricular (primer caso trasplantado en 1995 debido a origen anómalo de coronaria izquierda). En la figura 1 se muestra el volumen de TC pediátricos por períodos desde el comienzo del programa, junto con proporción de fisiología univentricular previa.
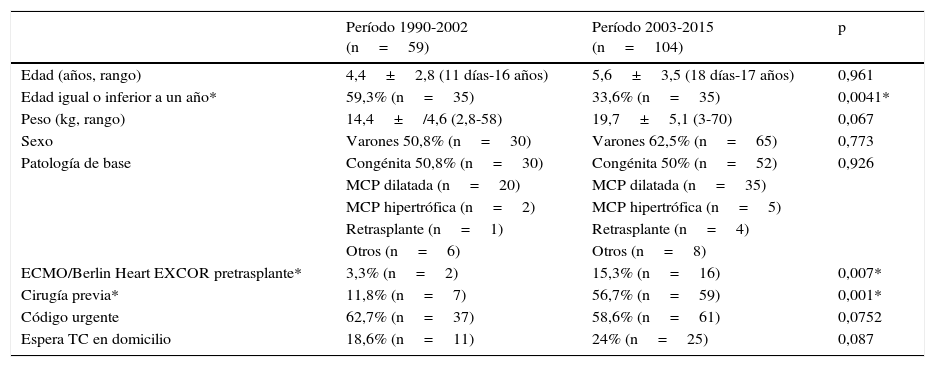
La edad media fue 5,1±3,2 años (rango 11-17 años), siendo un 44,3% (n=70) igual o menores de un año de vida en el momento del TC. El peso medio fue 17,2±3kg (rango 2,8-70). Un 50,3% (n=82) presentaba algún tipo de cardiopatía congénita (de ellos, un 80,5% [n=66] tenían fisiología univentricular); un 33,7% (n=55) MCP dilatada; un 4,3% (n=7) MCP hipertrófica; un 3,6% (n=5) retrasplante y otras causas en un 7,9% (n=14). Los diagnósticos en pacientes con cardiopatías congénitas se muestran en la tabla 1. De los pacientes con fisiología univentricular previa (n=66), 12 de ellos habían alcanzado el estadio Fontan, perteneciendo 5 a los últimos 3 años de la serie.
Diagnósticos específicos en cardiopatías congénitas
| Diagnóstico | Número (n=82) |
|---|---|
| Univentricular 66 (80,5%) | |
| Norwood/híbrido/fístula | 37 |
| Glenn | 15 |
| Fontan | 12 |
| Fontan take-down | 2 |
| Biventricular 16 (19,5%) | |
| ccTGA | 2 |
| TGA | 3 |
| Complejo de Shone | 1 |
| Estenosis aórtica crítica | 1 |
| Anomalía de Ebstein | 2 |
| VDDS | 1 |
| Truncus | 2 |
| Canal AV completo | 1 |
| ALCAPA | 1 |
| Patología mitral | 2 |
ALCAPA: origen anómalo de arteria coronaria izquierda; AV: aurículo-ventricular; ccTGA: transposición de grandes arterias congénitamente corregida; TGA: transposición de grandes arterias; VDDS: ventrículo derecho de doble salida.
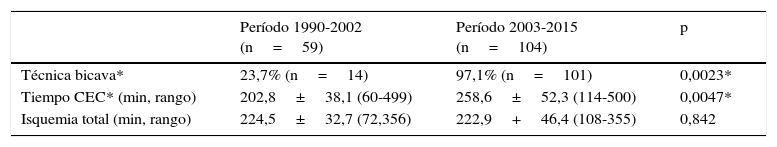
La técnica biauricular (Shumway) se realizó en un 76,3% de los trasplantados con anterioridad al año 2001, a partir del cual se introduce de forma predominante la técnica bicava.
Análisis comparativo por períodos históricos. Los resultados de las variables antropométricas y clínico-diagnósticas se muestran en la tabla 2: la edad igual o inferior a un año de vida, antecedentes de cirugía previa o implantación de asistencia circulatoria o ventricular pre-TC fueron las diferencias notables entre ambas eras. Los resultados de los datos quirúrgicos se muestran en la tabla 3: la técnica bicava junto con el incremento en los tiempos de circulación extracorpórea (CEC) fueron las variables significativas entre ambos períodos.
- –
«Pasado»: era 1990-2002 (n=59). La cardiopatía congénita más prevalente con necesidad de TC fue el SVIH en estadio Norwood (n=19). El rango de edad de TC más frecuente fue por debajo del primer año de vida (n=35).
La mortalidad a 30 días fue significativamente superior en fisiología univentricular respecto al resto de cardiopatías (40,7% vs. 21,8%, p<0,0024).
- –
«Presente»: era 2003-2015 (n=104). Se incrementa el número global de TC, siendo la fisiología univentricular en estadio Glenn (n=14) y Fontan (n=10) la cardiopatía congénita más prevalente. La mortalidad a 30 días se mantuvo significativamente superior en aquellos con paliación univentricular previa (20,5% vs. 10,8%, p<0,046), aunque dichas diferencias experimentaron un notable acercamiento respecto al período previo al 2003.
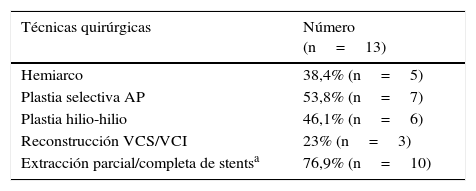
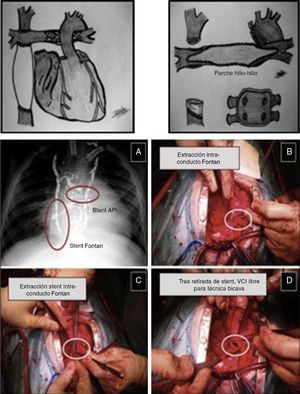
En la tabla 4 se presentan las técnicas de reconstrucción anatómica preimplante empleadas durante el período más reciente (2013-2015) (figs. 2 y 3, vídeo 1), bien con tejidos del donante o heterólogos. Del total de 23 pacientes de ese período, 13 de ellos (54.2%) precisaron dichas técnicas (todos ellos con fisiología univentricular), siendo necesario en 7 el empleo de parada circulatoria bajo hipotermia profunda.
Tabla 4.Técnicas actuales de reconstrucción anatómica preimplante (2013-2015)
Técnicas quirúrgicas Número
(n=13)Hemiarco 38,4% (n=5) Plastia selectiva AP 53,8% (n=7) Plastia hilio-hilio 46,1% (n=6) Reconstrucción VCS/VCI 23% (n=3) Extracción parcial/completa de stentsa 76,9% (n=10) AP: arteria pulmonar; VCI: vena cava inferior; VCS: vena cava superior.
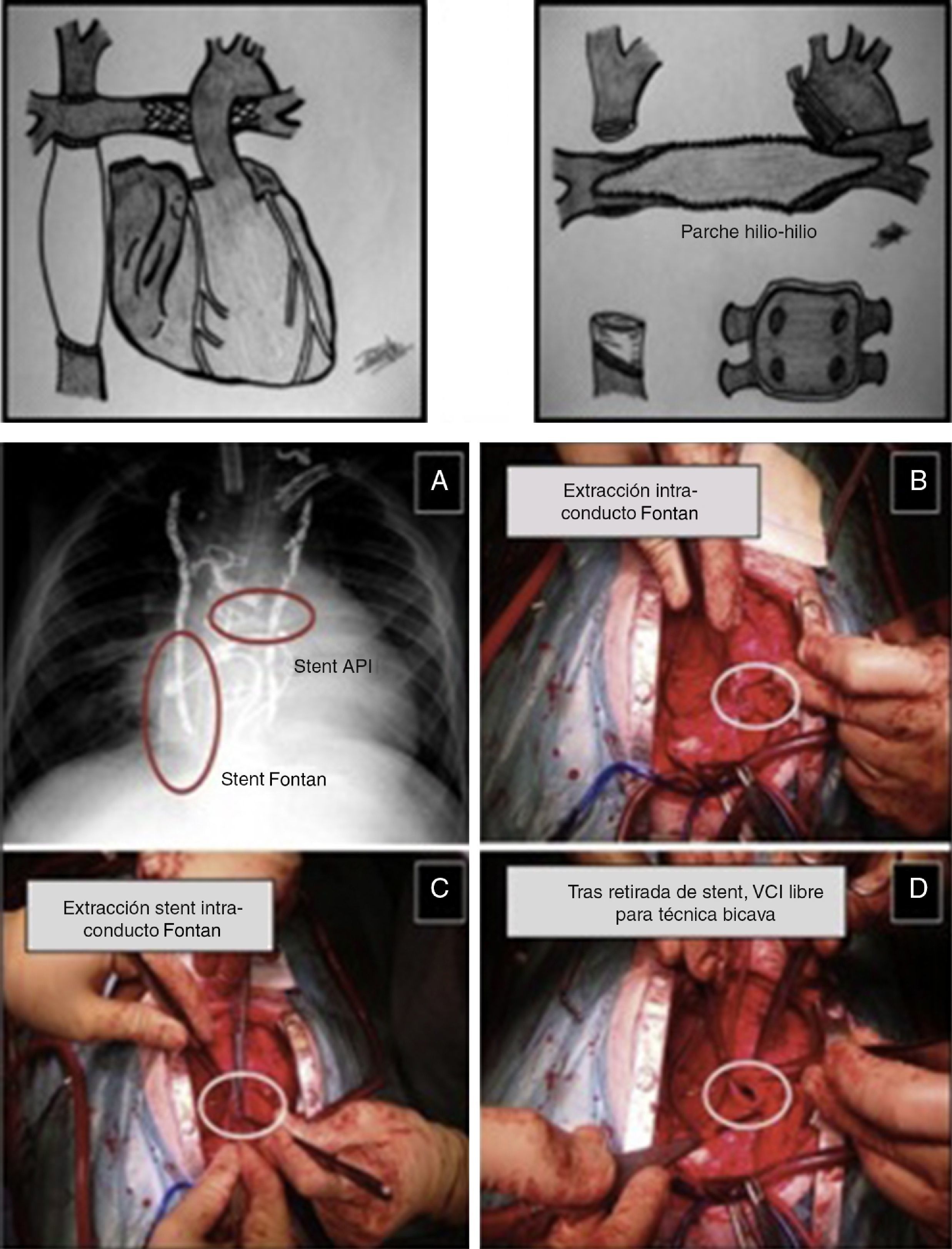
Figura 2.Trasplante tras cirugía de Fontan extracardíaco. Esquema: aspecto externo pre-trasplante del recetor (stent en ramas pulmonares) y campo quirúrgico poscardiectomía (plastia pulmonar hilio-hilio previa a implantación del corazón donante). Imagen intraoperatoria (A-D): extracción de stent en conducto extracardíaco de Fontan previo al TC.
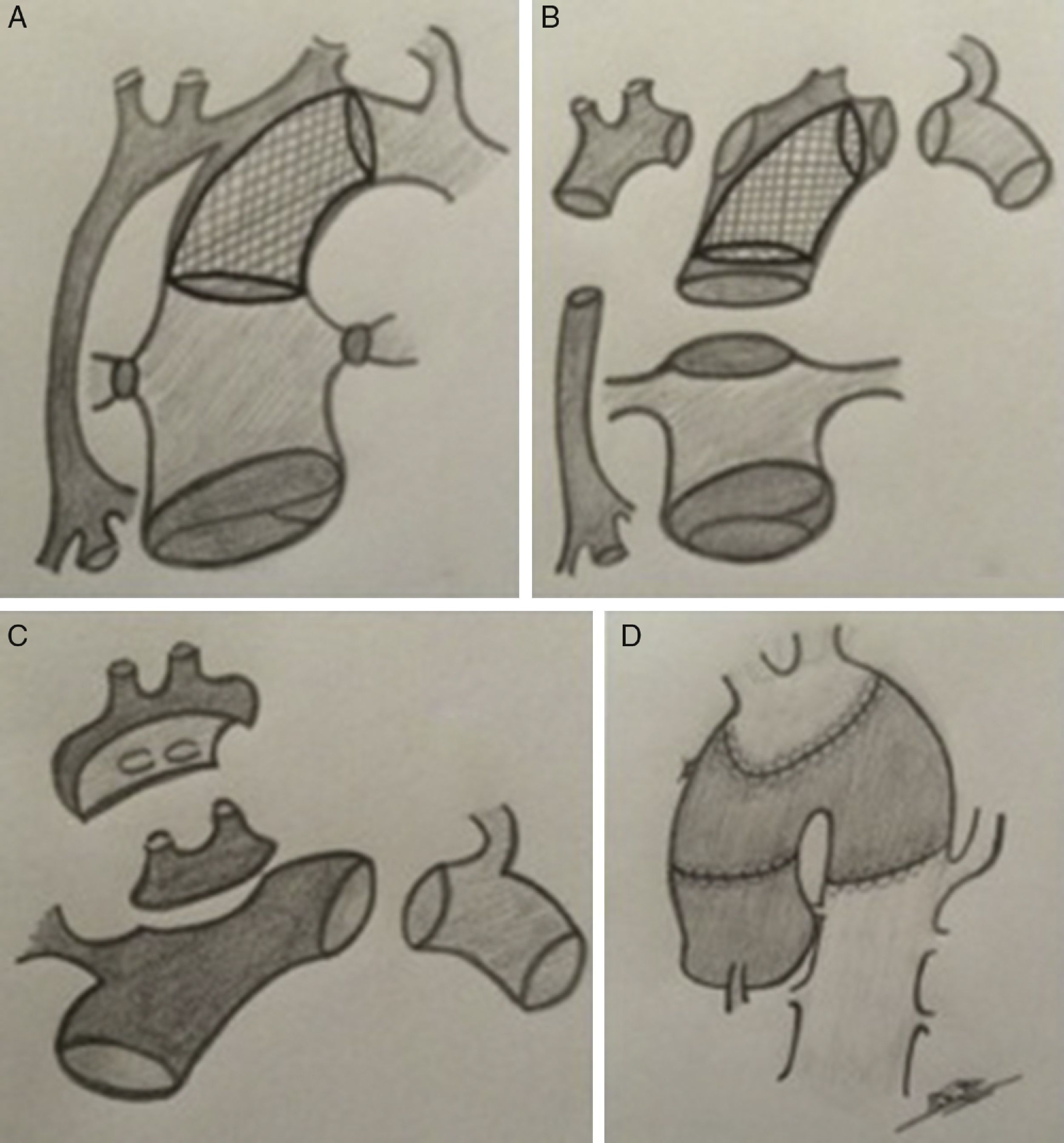
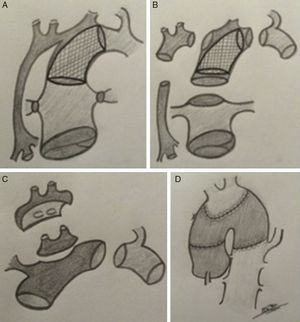
(0,55MB).Figura 3.Esquema de estrategia quirúrgica de TC neonatal en receptor con atresia aórtica e hipoplasia de arco. A) Anatomía pre-TC. Abordaje híbrido (bibanding y stent ductal). B) Se muestran las estructuras por separado: aorta (2mm), arco, tronco pulmonar, stent ductal y aorta torácica descendente. C) Implantación de injerto libre de arco donante tras aislar el casquete de troncos supra-aórticos del receptor (parche de Carrell). D) Resultado final (anastomosis arco donante con aorta donante).
(0,29MB).
Análisis comparativo por períodos históricos: datos antropométricos y clínico-diagnósticos
| Período 1990-2002 (n=59) | Período 2003-2015 (n=104) | p | |
|---|---|---|---|
| Edad (años, rango) | 4,4±2,8 (11 días-16 años) | 5,6±3,5 (18 días-17 años) | 0,961 |
| Edad igual o inferior a un año* | 59,3% (n=35) | 33,6% (n=35) | 0,0041* |
| Peso (kg, rango) | 14,4±/4,6 (2,8-58) | 19,7±5,1 (3-70) | 0,067 |
| Sexo | Varones 50,8% (n=30) | Varones 62,5% (n=65) | 0,773 |
| Patología de base | Congénita 50,8% (n=30) | Congénita 50% (n=52) | 0,926 |
| MCP dilatada (n=20) | MCP dilatada (n=35) | ||
| MCP hipertrófica (n=2) | MCP hipertrófica (n=5) | ||
| Retrasplante (n=1) | Retrasplante (n=4) | ||
| Otros (n=6) | Otros (n=8) | ||
| ECMO/Berlin Heart EXCOR pretrasplante* | 3,3% (n=2) | 15,3% (n=16) | 0,007* |
| Cirugía previa* | 11,8% (n=7) | 56,7% (n=59) | 0,001* |
| Código urgente | 62,7% (n=37) | 58,6% (n=61) | 0,0752 |
| Espera TC en domicilio | 18,6% (n=11) | 24% (n=25) | 0,087 |
ECMO: asistencia circulatoria mediante oxigenación de membrana (extracorporeal membrane oxygenation); TC: trasplante cardíaco.
* Significación estadística.
Análisis comparativo por períodos históricos: datos quirúrgicos
| Período 1990-2002 (n=59) | Período 2003-2015 (n=104) | p | |
|---|---|---|---|
| Técnica bicava* | 23,7% (n=14) | 97,1% (n=101) | 0,0023* |
| Tiempo CEC* (min, rango) | 202,8±38,1 (60-499) | 258,6±52,3 (114-500) | 0,0047* |
| Isquemia total (min, rango) | 224,5±32,7 (72,356) | 222,9+46,4 (108-355) | 0,842 |
CEC: circulación extracorpórea.
* Significación estadística.
Respecto a los resultados inmediatos globales, la mortalidad a 30 días de la serie fue del 20,2% (n=33), descendiendo drásticamente en el segundo período respecto al primero (30,5% vs. 14,4%, p<0,0011) y siendo el rechazo agudo o fracaso primario del injerto la causa más frecuente de mortalidad precoz (27,1% vs. 6,7%, p<0,0056) (tabla 5).
Análisis comparativo por períodos históricos: datos de seguimiento
| Período 1990-2002 (n=59) | Período 2003-2015 (n=104) | p | |
|---|---|---|---|
| Mortalidad a 30 días | 30,5% (n=18) | 14,4% (n=15) | 0,0011* |
| Fracaso primario del injerto | 27,1% (n=16) | 6,7% (n=7) | 0,0056* |
| Supervivencia a medio plazoa | A un año: 90,2% (n=37) | A un año: 94,3% (n=84) | 0,165 |
| A 2 años: 82,9% (n=34) | A 2 años: 87,6% (n=78) | ||
| Supervivencia a largo plazoa | A 5 años: 80,4% (n=33) | A 5 años: 84,2% (n=75) | 0,034* |
| A 10 años: 60,9% (n=25) | A 10 años: 80,8% (n=72) |
Análisis global de seguimiento. El período de seguimiento global fue de 10,4±3,6 años (rango 3,2-21,1 años). De los supervivientes iniciales al alta (n=125), la mortalidad acumulada fue al 1.er año del 7,1% (n=9), al 2.° año del 14,3% (n=18), al 5.° año del 17,4% (n=22), al 10.° año del 26,1% (n=33) y al 15.° año del 28,5% (n=36).
La causa más frecuente de mortalidad tardía fue el rechazo crónico por enfermedad vascular del injerto (n=13), seguida de infecciones (n=4) y tumores malignos (n=2). El desarrollo global de patología tumoral de la serie fue del 3% (n=5), todos a partir del 10.° año post-TC: sarcoma de Kaposi (n=2), linfoma de células B (n=2) y linfoma no Hodking (n=1).
La tasa actual de mortalidad global del total de la serie durante el seguimiento es del 40,4% (n=66), permaneciendo todos los supervivientes actuales con una óptima clase funcional.
Supervivencia superior a 10 años post-TC. Actualmente, 38 pacientes presentan ya una supervivencia superior a 10 años post-TC (rango 10,2-21,1). De ellos, un 52,6% (n=20) presentaba MCP dilatada, seguida de cardiopatías congénitas (34,2%, n=13) (7 de ellas con fisiología univentricular), MCP hipertrófica (5,2%, n=2), MCP restrictiva (2,6%, n=1) y otras causas (5,2%, n=2). El TC en el primer año de vida se había realizado en un 36,8% (n=14) de ellos. Un 34,2% (n=13) presentaba algún tipo de cirugía previa, realizándose técnica bicava en un 57,9% (n=22). En un 26,3% (n=10) la supervivencia actual alcanza incluso más de 15 años (siendo 5 de ellos trasplantados con edad inferior a 6 meses).
El retrasplante ha sido necesario en 4 pacientes a los 12,8±1,4 años del primer TC por enfermedad vascular del injerto (tasa retrasplante 2,3%/año a partir del 10.° año).
La tasa de mortalidad de este grupo es del 2,6%/año a partir del 10.° año (secundaria a vasculopatía crónica), siendo las complicaciones no infecciosas más frecuentes la insuficiencia renal (n=5) y neoplasias (n=5) y las infecciosas más frecuentes la neumonía (n=7).
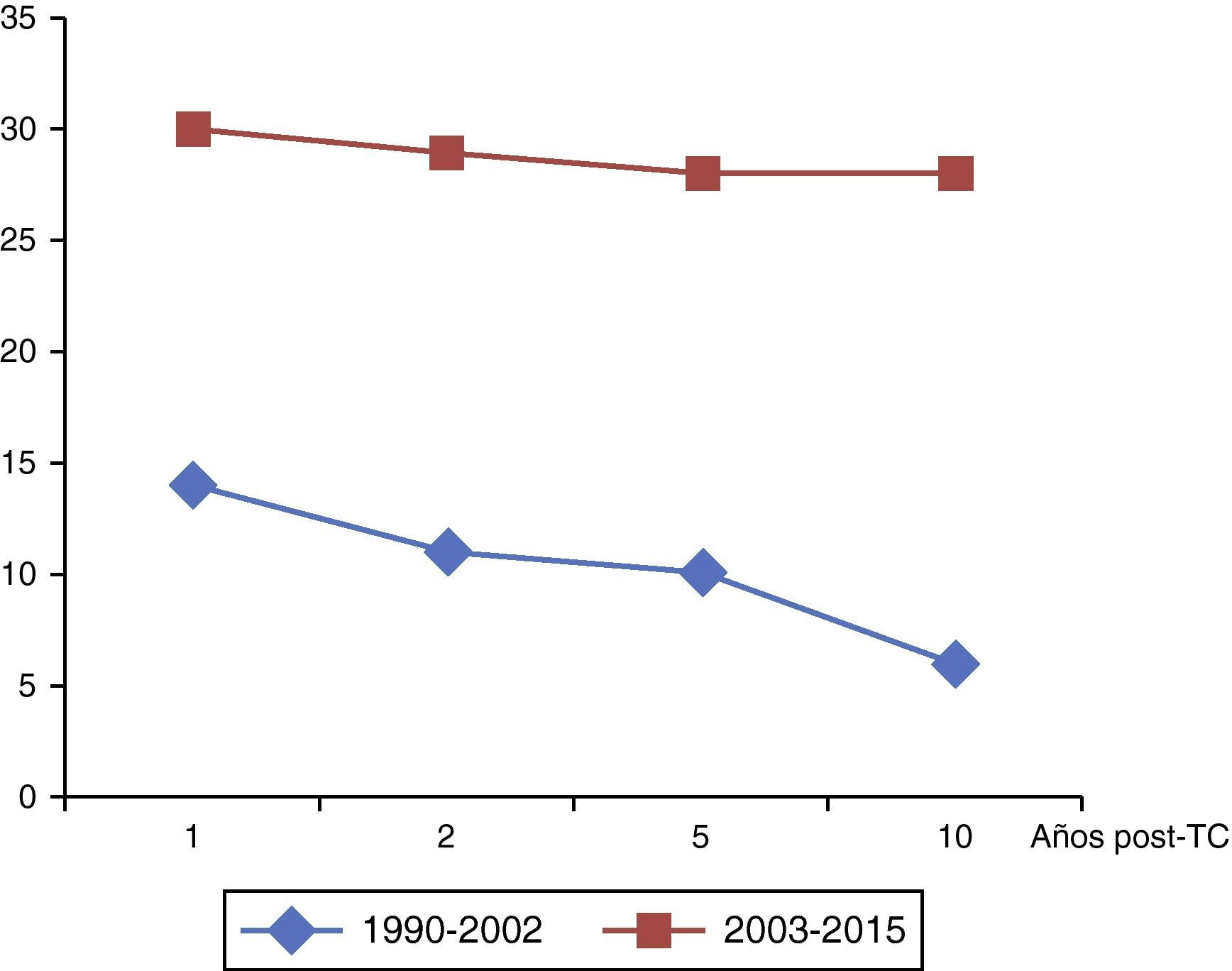
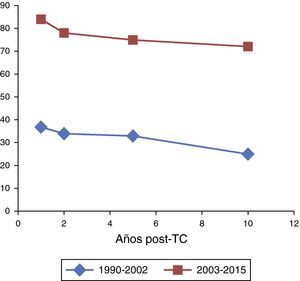
Análisis comparativo de seguimiento por períodos históricos. Los resultados de este análisis se muestran en la tabla 5. Mientras que la supervivencia a 1, 2 y 5 años se mantuvo constante con independencia de la era histórica, la supervivencia a 10 años se vio incrementada de forma significativa en aquellos pacientes trasplantados a partir del 2003 (60,9% vs. 80,8%, p<0,034). En la figura 4 se muestran las respectivas curvas de supervivencia tras el alta hospitalaria (n=125) durante el período de seguimiento según la era histórica.
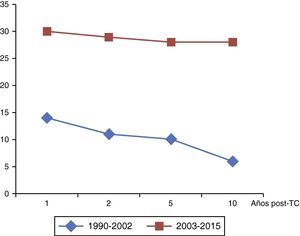
De forma específica, para el grupo de paliación univentricular previa, se objetivó un notable incremento de la supervivencia en aquellos trasplantados a partir del 2003 (fig. 5). A 10 años, existía un 22,2% de supervivientes trasplantados en el período 1990-2002 frente a un 71,7% de los que fueron trasplantados entre 2003 y 2015.
Comparando el grupo univentricular respecto al resto de cardiopatías, se objetivó en el período previo al año 2003 que las diferencias en la supervivencia post-TC eran muy marcadas (40,7% vs. 71,8% a 2 años, 37% vs. 71,8% a 5 años y 22,2% vs. 59,3% a 10 años, p<0,003), mientras que a partir del año 2003 estas diferencias desaparecen (74,3% vs. 75,3% a 2 años, 71,7% vs. 72,3% a 5 años y 71,7% vs. 67,7% a 10 años, p<0,93).
Análisis multivariante. Las siguientes variables se asociaron a mayor riesgo de eventos adversos en el análisis univariante: cardiopatía de base tipo SVIH (odds ratio [OR] 1,5, rango 0,6-1,9, IC del 95%, p<0,043), edad inferior a 3 meses en el momento del TC (OR 0,9, rango 0,3-1.2, IC del 95%, p<0,038), cirugía de paliación univentricular previa (OR 3,2, rango 2,1-4,8, IC del 95%, p<0,02) y período histórico anterior al 2003 (OR 4,1, rango 3,3-5,7, IC del 95%, p<0,029).
En el análisis multivariante, la fisiología univentricular previa (OR 2,7, rango 1,9-3,6, IC del 95%, p<0,039) y la era histórica (OR 5,8, rango 3,4-6,9, IC del 95%, p<0,011) se mantuvieron asociadas a un mayor riesgo de eventos adversos post-TC.
DiscusiónLa alta tasa de donación de nuestro país es ampliamente conocida, situándolo por ello como líder mundial en trasplantes de órganos desde hace décadas. En nuestro terreno, esto ha posibilitado el incremento de los TC también en población pediátrica de forma progresiva, existiendo múltiples consideraciones que deben ser tenidas en cuenta para evaluar el pasado, presente y futuro en este escenario.
¿A qué retos nos enfrentamos los cirujanos? El perfil del paciente candidato a TC ha ido variando con los años, condicionando las estrategias quirúrgicas tanto para la extracción del corazón donante como para su implantación.
Determinadas patologías, como la MCP dilatada, hipertrófica, así como distintas cardiopatías congénitas con fisiología biventricular u otras causas excepcionales (como la enfermedad de Kawasaki, tumores cardíacos o cardiopatía isquémica), han presentado una incidencia similar a lo largo de los años, siendo quizás las más «asequibles» desde el punto de vista quirúrgico, al no implicar grandes variaciones anatómicas en la mayoría de los casos. Sin embargo, aquellos pacientes con fisiología univentricular merecen una especial atención, más aún cuando son una población en aumento, dadas las mejoras en la supervivencia tras los diferentes estadios de paliación previos.
Mientras que el TC tras cirugía de Norwood no era infrecuente al inicio de nuestro programa, ahora nos enfrentamos a casos en estadios posteriores con mayor frecuencia, de forma predominante en los últimos 5 años. El paciente «típico» actualmente presenta una fisiología univentricular con múltiples cirugías previas e implante de dispositivos percutáneos en diversas localizaciones, reflejando el desarrollo paralelo de la cardiología intervencionista en este ámbito.
Los grupos de St. Louis (Missouri) y Toronto7,8, así como el grupo de Melbourne9, describen de igual forma un incremento de este perfil de pacientes a partir del 2000, aumentando por tanto la complejidad quirúrgica tras estadios de Glenn y Fontan.
El análisis secuencial de las anastomosis sobre la base de la patología subyacente es la piedra angular para conseguir una extensa reconstrucción anatómica pre-implante que optimice el pronóstico10-13. Esto conlleva una ardua labor quirúrgica, con tiempos significativamente más prolongados de CEC en los últimos años, precisando en ocasiones hipotermia profunda y parada circulatoria para reconstrucciones pulmonares y de arco complejas. Todo ello obliga a un control más exhaustivo aún si cabe de los tiempos de coordinación con el equipo extractor y a una reconstrucción con tejidos heterólogos en gran parte de los casos previa a la llegada del corazón donante, gracias a lo cual no se han visto afectados los tiempos de isquemia total desde el inicio del programa.
Nuestros datos en relación con el incremento del perfil de riesgo de estos pacientes también coinciden con la serie norteamericana de Stanford14. Sin embargo, es llamativo que en el período reciente, cerca de un 50% de los pacientes precisan asistencia ventricular pre-TC, frente al 15,3% de nuestra serie, pudiendo estar en relación directa con el menor tiempo en lista de espera dada la disponibilidad de órganos dentro de la Organización Nacional de Trasplantes en España.
Los resultados son dependientes del paso del tiempo. En términos generales, los avances no solo en el terreno quirúrgico, sino también en el tratamiento inmunosupresor y manejo postoperatorio, han permitido descender drásticamente la mortalidad precoz por fracaso primario del injerto tanto en nuestra serie como a nivel mundial15,16, a costa quizás de sustituir dicha complicación general por otras ya individuales derivadas de la complejidad de la cardiopatía subyacente, características anatómicas y dificultades técnicas del TC.
En relación con la mortalidad precoz, aunque los datos de la United Network for Organ Sharing (UNOS) han demostrado clásicamente un incremento en la misma en aquellos pacientes con múltiples cirugías previas17, esto ya comienza a estar discutido a la luz de los resultados actuales. Sobre la base de nuestros datos, la mortalidad precoz presenta un espectacular descenso con el paso de los años precisamente en los pacientes con múltiples paliaciones univentriculares previas.
Asimismo, en nuestros datos no se objetiva que el TC por debajo del año de vida condicionase un mejor pronóstico. Estos resultados pueden deberse a que la mayoría de esos pacientes pertenecían al primer período, en el cual existe una mayor mortalidad precoz. Esto, a su vez, viene determinado por el elevado número de pacientes sometidos a TC con diagnóstico de SVIH en estadio de Norwood durante los primeros años del programa, factor asociado con un incremento en la mortalidad precoz post-TC7,18.
Con el paso de los años, la supervivencia post-TC se ha visto incrementada de forma exponencial19,20, encontrándonos con un pool de pacientes que ya alcanzan más de 10-15 años post-TC, constituyendo un reto especialmente para el manejo clínico del balance de la inmunosupresión y sus efectos secundarios.
La supervivencia a largo plazo de nuestra serie en España es excelente, superponible a otras series como la de Stanford o Atlanta14,21, aunque, a diferencia de esta última, presentamos una llamativa mejoría en la supervivencia en aquellas cardiopatías complejas (de predominio univentricular) en el último período analizado respecto al resto de cardiopatías de la serie. El retrasplante, aunque infrecuente, sigue presentando elevada mortalidad20,22 cuando se precisa debido a vasculopatía crónica del injerto.
Aunque el análisis multivariante es dificultoso en este ámbito, es destacable que los años recientes son los que se constituyen para nosotros como el factor clave asociado a una mejor supervivencia, siendo beneficiados de nuevo en mayor medida los pacientes con fisiología univentricular23,24.
Podemos reseñar que los datos presentados son superponibles al resto de grandes series mundiales publicadas hasta la fecha, que aunque siendo escasas, compartimos con todas ellas un mismo denominador común: el progresivo incremento en la supervivencia a pesar del aumento en el perfil de riesgo de estos pacientes.
¿Cuál es el futuro?ThyTech Project. Garantizar una hipotética supervivencia indefinida del corazón trasplantado sería una revolución en estos pacientes, disminuyendo o incluso anulando la necesidad de tratamiento inmunosupresor, evitando con ello los efectos secundarios a largo plazo así como la posibilidad de retrasplante y sus complicaciones. Aunque esto es aún una utopía en la actualidad, nuestro centro es pionero en una reciente línea de investigación a nivel mundial que podría suponer una revolución en el ámbito de la regulación inmunológica, permitiendo una supervivencia indefinida del injerto.
El ThyTech Project es un ensayo clínico que evalúa el potencial terapéutico de las células T reguladoras tímicas tras su infusión en pacientes pediátricos sometidos a trasplante. Todo ello está liderado por el Laboratorio de Inmuno-Regulación y la Unidad de Producción Celular de nuestro Centro. Esto supondría un inmenso avance precisamente en los pacientes pediátricos, que, hipotéticamente, permitiría mantener el injerto normofuncionante a lo largo de toda su vida.
Trasplante AB0 incompatible. Por otra parte, en un futuro no tan lejano, el trasplante AB0 incompatible podrá ser finalmente implantado en España. Con ello conseguiremos incrementar el pool de donantes para menores de un año de vida, gracias a la colaboración del Alberta Transplant Institute (Edmonton, Canadá), liderado por la Dra. Lori West, donde esta práctica está implantada ya desde hace años, con excelentes resultados25. Su experiencia en este ámbito, así como sus múltiples protocolos, han sido adoptados por nuestro centro (destacando la exsanguinotransfusión para aclaramiento de isohemaglutininas durante la CEC para evitar el rechazo hiperagudo), permitiendo así sentar las bases para el inicio de este tipo de trasplante en el país.
Por último, y aunque no haya sido el objeto de este estudio, no podemos olvidar que el niño se convierte en adulto. El TC en adultos con cardiopatías congénitas entraña de igual forma una elevada complejidad, requiriendo un exhaustivo manejo tanto quirúrgico como multidisciplinar que garantice una óptima calidad de vida.
Limitaciones. Debe tenerse en cuenta la naturaleza retrospectiva del estudio junto con la falta de disponibilidad de determinadas variables para su inclusión de aquellos TC realizados durante los primeros años de la serie.
ConclusionesEl TC pediátrico presenta óptimos resultados en nuestro medio, superponibles a series mundiales. Aunque su complejidad es máxima en fisiología univentricular, los resultados actuales reflejan los progresivos avances en el manejo tanto quirúrgico como peri y postoperatorio, así como en las estrategias de inmunosupresión. Se nos avecina un futuro en el que seguirá incrementándose la complejidad, lo que supone nuevos retos para todos, que sin duda asumiremos para seguir innovando y creciendo.
Agradecemos a todo el equipo multidisciplinar que ha hecho y sigue haciendo posible este programa de TC pediátrico: Cardiología Pediátrica y Unidad de Trasplante, Cirugía Cardíaca Pediátrica, Anestesiología, UCI pediátrica, Hemodinámica, Neonatología, planta de hospitalización, Inmunología y personal de enfermería y perfusión.
Vídeo 1. Se muestra la estrategia quirúrgica («split-graft technique») de TC neonatal en receptor con atresia aórtica, hipoplasia severa de arco y comunicación interventricular con ventrículos balanceados con paliación híbrida previa y disfunción ventricular severa. Se emplea injerto libre del arco donante para la reconstrucción anatómica extensa requerida pre-TC.