La oxigenación de membrana extracorpórea (ECMO) es un sistema de asistencia mecánica circulatoria y respiratoria extracorpórea de corta duración. Está indicado en el shock cardiogénico e insuficiencia respiratoria con compromiso vital de cualquier causa, cuando las medidas terapéuticas médicas o quirúrgicas convencionales, incluyendo el empleo del balón intraaórtico de contrapulsación, han fracasado. Sus ventajas respecto a otros sistemas de asistencia mecánica circulatoria son: 1) inicio rápido de la asistencia mediante canulación periférica; 2) es una técnica poco agresiva, por lo que es mejor tolerada en estos pacientes críticos; 3) al no necesitar toracotomía, permite continuar con las medidas de resucitación cardiopulmonar en los pacientes con parada cardíaca; 4) proporciona soporte pulmonar, univentricular o biventricular; 5) se ha mostrado eficaz como puente a una asistencia ventricular de larga duración o como puente a trasplante cardíaco, y 6) es mucho más económico que otros dispositivos de asistencia ventricular.
Extracorporeal membrane oxygenation (ECMO) is a short-term mechanical circulatory and respiratory assistance. It is indicated in life-threatening cardiogenic shock and respiratory insufficiency of any cause, when conventional medical and surgical therapeutic measures, including intraaortic balloon pump have failed. its advantages regarding other mechanical circulatory assistance are: 1) quick start of assistance trough peripheral cannulation; 2) it is a less aggressive technique, therefore it is better tolerated; 3) there is no need of thoracotomy, allowing cardiopulmonary resuscitation in patients with cardiac arrest; 4) it provides lung, univentricular or biventricular support; 5) it has been shown efficient as bridge to bridge or bridge to transplantation, and 6) it is cheaper than other ventricular assist devices.
La ECMO es un sistema de asistencia mecánica circulatoria y respiratoria capaz de proporcionar soporte cardíaco y pulignar, durante un periodo de días o semanas, en la insuficiencia cardíaca o respiratoria refractaria al tratamiento convencional. Puede emplearse como puente a la recuperación, como puente al trasplante cardíaco, o como puente a un dispositivo de asistencia ventricular de largo plazo. En caso de asistencia respiratoria se ha utilizado como puente a la recuperación pulmonar o al trasplante pulmonar (TP).
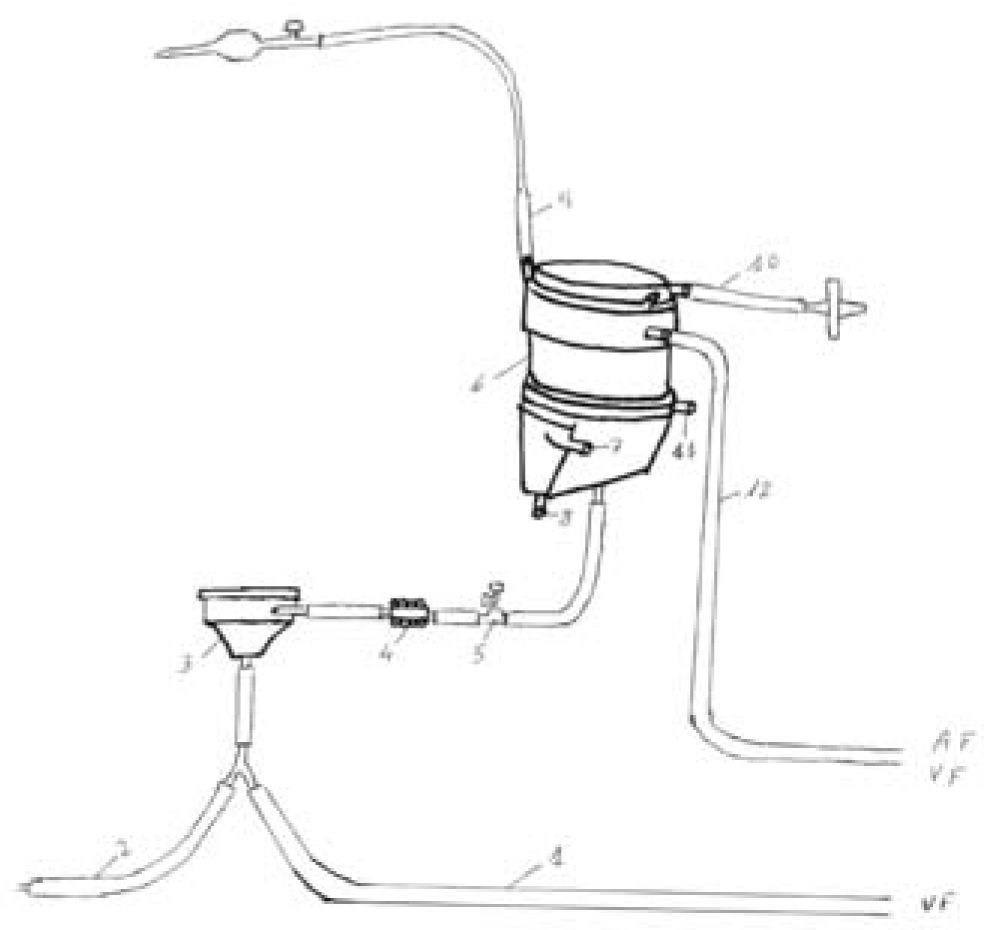
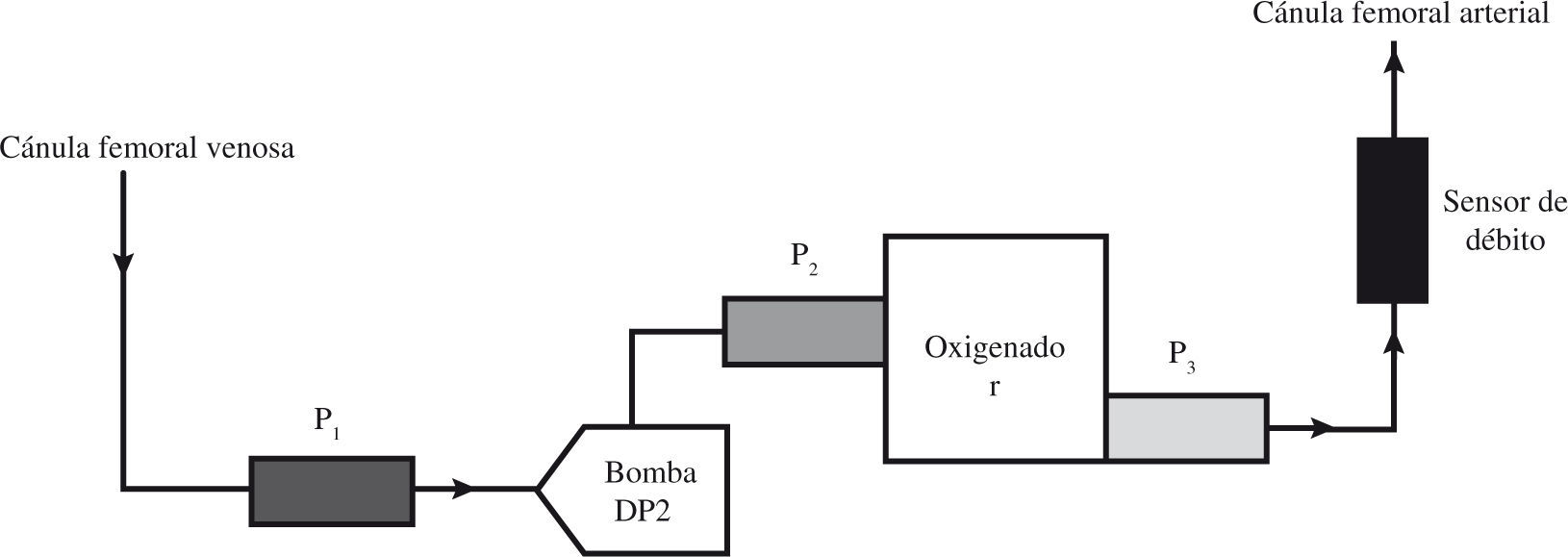
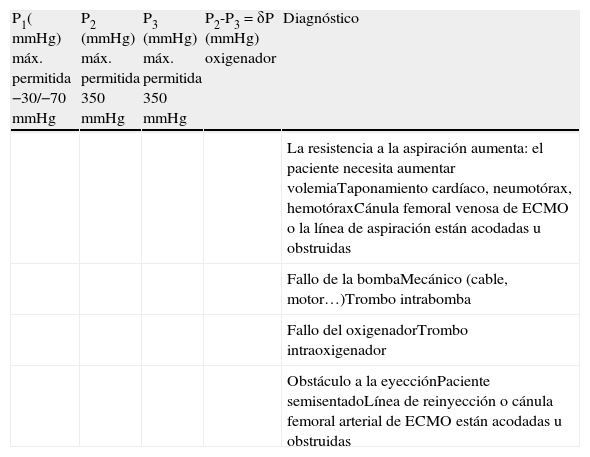
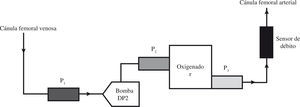
Componentes Del Sistema De Oxigenación De Membrana ExtracorpóreaCircuitoEl circuito se compone de los siguientes elementos ensamblados en serie: cánula de drenaje venoso, línea venosa, bomba centrífuga, oxigenador, línea arterial y una segunda cánula de retorno arterial o venosa (Fig. 1). Las diferentes compañías del sector biomédico proporcionan estos componentes revestidos de heparina o del componente molecular de la membrana celular (fosforilcolina). Estos aditivos reducen los requerimientos de anticoagulación, las complicaciones hemorrágicas y la reacción inflamatoria.
Componentes del circuito ECMO: la ubicación de las cánulas arterial y venosa se corresponde con las siglas AF y VF. 1: línea venosa; 2: línea de priming; 3: bomba centrífuga; 4: medidor de flujo; 5: conexión para determinación de análisis sanguíneos y monitorización de presión; 6: oxigenador; 7 y 8: conexiones para la entrada y salida de agua del inter-cambiador de calor (habitualmente no se utiliza en adultos); 9: línea de purgado de aire; 10: línea de entrada de la mezcla oxígenoaire; 11: línea de salida de dióxido de carbono; 12: línea arterial.
El circuito contiene dos cánulas de material plástico flexible. Una se conecta a la línea venosa del circuito, recoge la sangre desoxigenada desde una vena, y la otra, que se conecta a la línea arterial del circuito, la devuelve oxigenada a través de una arteria o una vena.
Se ha impuesto la canulación periférica (percutánea o quirúrgica), que presenta las ventajas de rapidez y facilidad de instauración de la asistencia cardiopulmonar, menor incidencia de complicaciones hemorrágicas e infecciosas y flujo no inferior al obtenido con canulación central. Sólo describiremos la canulación periférica.
Son cánulas de poliuretano reforzadas con anillos de acero inoxidable (Medtronic Inc, St. Paul MN, USA; Medos Medizintechnik AG, Stolberg, Germany), que presentan flexibilidad y resistencia al acodamiento, son radiopacas y permiten altos flujos. La longitud es de 50cm en las venosas y 18cm en las arteriales. Para canulación percutánea se utiliza una cánula venosa de 20–22 F y una arterial de 14–16 F. Para canulación quirúrgica se utiliza una cánula venosa de 22–26 F y una arterial de 16–20 F.
En la elección del tamaño de las cánulas debe influir el área corporal; en el caso de canulación quirúrgica, el tamaño de los vasos a canular. Sólo si la arteria es de gran calibre elegiremos una cánula 20 F; en caso contrario, para evitar complicaciones graves (rotura o disección arterial), 16 o 18 F. El empleo de una cánula venosa que ocupe por completo la luz de la vena femoral (VF) puede provocar obstrucción grave del retorno venoso y edema a tensión que comprometa la irrigación del miembro.
Líneas venosa y arterialLa línea venosa transporta la sangre desoxigenada desde la cánula venosa hasta la bomba centrífuga, y desde ésta al oxigenador. La línea arterial transporta la sangre oxigenada en el oxigenador hasta la cánula arterial o una segunda cánula venosa. El material del que están construidas suele ser cloruro de polivinilo, que les otorga transparencia, reexpansión tras compresión, flexibilidad, resistencia al acodamiento, dureza y práctica ausencia de liberación de partículas desde su superficie interna.
Bomba centrífugaEs un propulsor provisto de aspas o conos de plástico, en el interior de un habitáculo plástico. Cuando el propulsor rota rápidamente, genera una presión negativa en la conexión de entrada a la bomba, atrayendo sangre, y una presión positiva en la conexión de salida, expulsando sangre. Las bombas centrífugas no son oclusivas; cuando la bomba se detiene o se enlentece lo suficiente de forma que la presión generada sea menor de la necesaria para provocar un flujo anterógra-do, la sangre fluirá retrógradamente, provocando una fístula arteriovenosa masiva con sus efectos deletéreos hemodinámicos, a menos que se ocluya la línea arterial o venosa.
Manteniendo constantes las revoluciones por minuto (rpm), las bombas centrífugas generan un aumento de flujo cuando aumenta la precarga o disminuye la poscarga, y viceversa, lo cual impide el cálculo de flujo teniendo sólo en cuenta las rpm; por lo tanto, deben incorporar un medidor de flujo en la línea arterial.
Las bombas centrífugas empleadas actualmente en ECMO podemos subdividirlas en:
- –
Bombas de larga duración, que permiten un tiempo de empleo continuado de 14 días de los actuales oxigenadores utilizados en ECMO. Las más utilizadas son la bomba Rotaflow (Maquet Cardiovascular, Wayne, NJ, USA), con un volumen de cebado de 32ml, y la bomba Levitronix® (Levitronix, Waltham, Massachusetts, USA), con un volumen de cebado de 31ml.
- –
Bombas de corta duración o de duración indeterminada, que permiten un tiempo de empleo continuado que no suele superar al de los actuales oxigenadores utilizados en ECMO, y precisan ser recambiadas cada 3–4 días de forma preventiva. Las más utilizadas son la bomba centrífuga Bio-Pump Plus (Medtronic Inc, St. Paul, MN, USA), con un volumen de cebado de 80ml, y la bomba Deltas-tream DP2® (Medos Medizintechnik AG, Stolberg, Germany), con un volumen de cebado de 18ml.
Se compone de una fase gaseosa y una fase sanguínea, separadas por una membrana. La ley de Fick describe la velocidad a la que los gases difunden a través de gases, líquidos y sólidos. Esta ley establece que la velocidad de difusión es proporcional al gradiente de presión parcial del gas en la dirección de la difusión, es decir, a la diferencia de presión parcial del gas a uno y otro lado de la membrana por unidad de distancia. La ley de Fick es el principio en que se basa el funcionamiento de los oxigenadores.
Los oxigenadores que se utilizan actualmente en ECMO son de larga duración y están provistos de fibras de polimetilpenteno, impermeables al plasma. Estas fibras permiten una utilización muy prolongada del oxigenador, incluso de varias semanas, manteniendo un intercambio gaseoso de calidad. Los oxigenadores de este tipo más utilizados son: Medos Hilite LT 7000 (volumen de cebado 275ml), Jostra Quadrox PLS (Maquet Cardiopulmonary AG, Hirrlingen, Germany) (volumen de cebado 250ml) y Dideco EOS ECMO (Sorin Group MR, Saluggia, Italia) (volumen de cebado 150ml).
ConsolaEs la encargada del control hemodinámico del sistema ECMO: 1) suministra fuerza electromotriz a la bomba sanguínea y regula su funcionamiento, y 2) traduce la información aportada por los sensores hemodinámicos implantados en el circuito. Cada tipo de bomba centrífuga funciona únicamente con su propia consola.
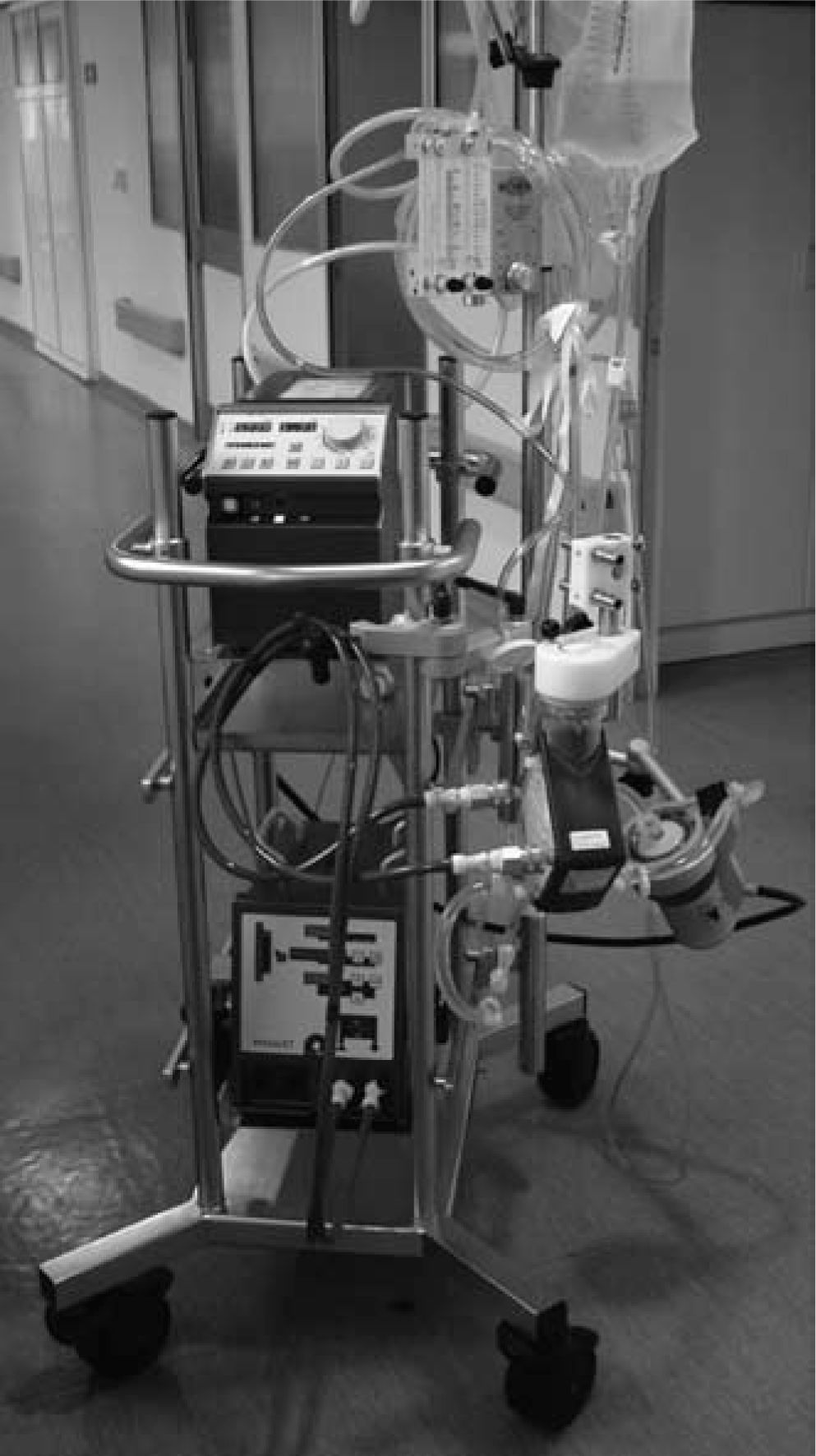
Oxigenación de membrana extracorpórea Maquet (Fig. 2)Combina la bomba Rotaflow y el oxigenador Jostra Quadrox PLS. La ventaja de este sistema es su aprobación para el empleo continuado durante 14 días. La crítica es que la consola sólo da información de las rpm y flujo. El peso de la consola es de 15kg, lo que permite su traslado con cierta facilidad para el transporte interhospitalario.
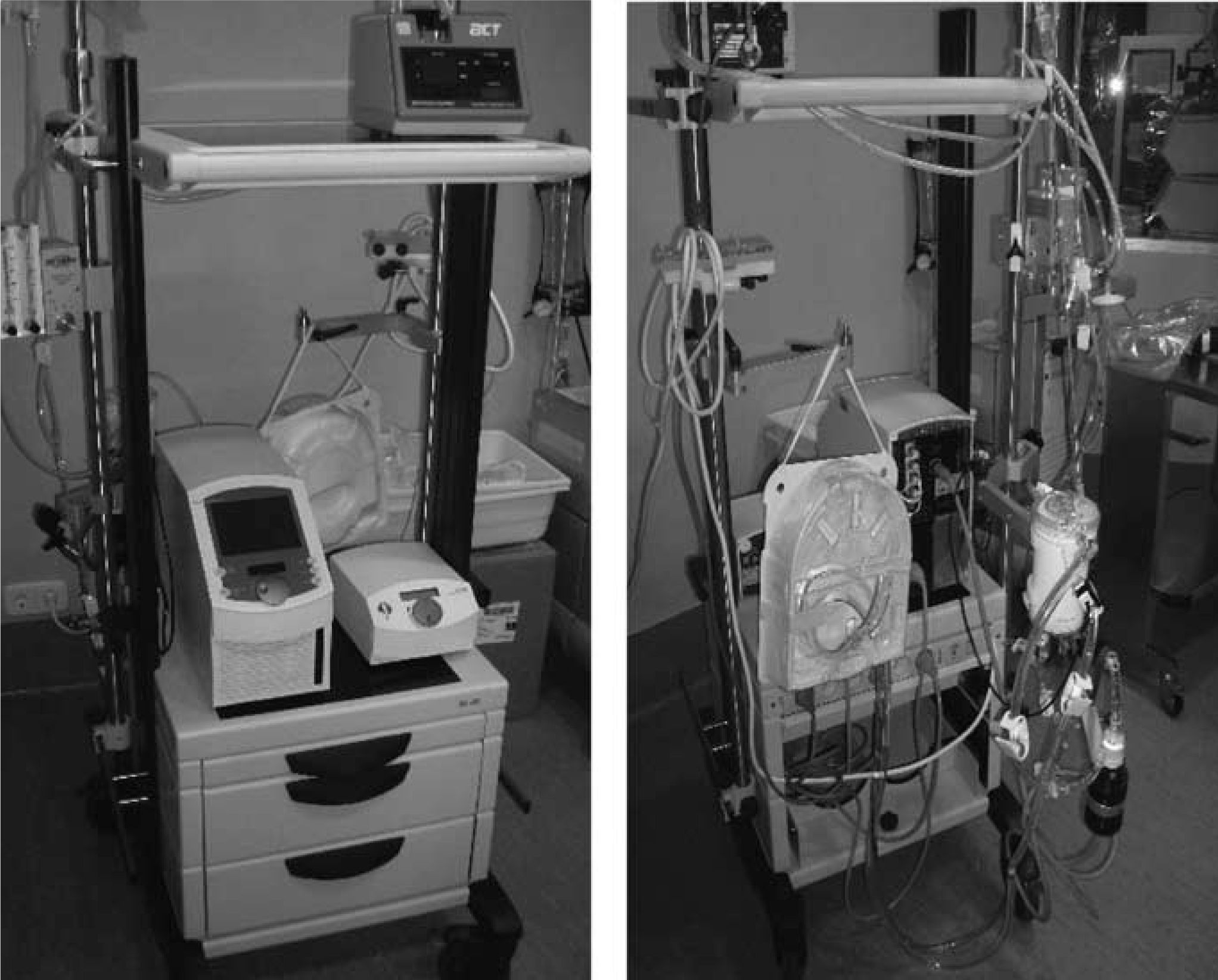
Oxigenación de membrana extracorpórea Medos Deltastream (Fig. 3)Combina la bomba sanguínea Deltastream DP2 y el oxigenador Medos Hilite LT 7000. La ventaja del sistema es la completa información que suministra la consola (Deltastream DC) y los sistemas de seguridad que incorpora. No sólo registra las rpm y flujo, sino también la presencia de aire, mediante un detector acoplado en el sensor de flujo, y las presiones en distintas zonas del circuito (línea venosa, preoxigenador y postoxigenador). Además, la consola está provista de un control inteligente que permite: 1) activación automática del modo de flujo cero cuando detecta aire en el circuito o detecta flujo retrógrado, impidiendo la emisión de flujo, pero manteniendo las rpm suficientes para contrarrestar la poscarga de la línea arterial, y 2) limitar la presión negativa en la línea venosa, reduciendo las rpm de forma programada, para evitar hemólisis y cavitación.
El inconveniente es la bomba sanguínea, que es de corta duración y obliga a su recambio, como mucho, tras 4 días de empleo, pero posee sistemas de detección anticipada del fallo de la bomba y está ensamblada con conexiones rápidas que permiten un cambio fácil y exclusivamente de la bomba. El peso de la consola es de 18kg.
Sistema Levitronix® CentrimagEs un sistema de asistencia ventricular de corto plazo que utiliza una bomba centrífuga con la particularidad de que el cabezal de bomba es de levitación magnética sobre el motor, produciendo una rotación sin fricción ni desgaste, con las ventajas de un soporte circulatorio continuado durante, al menos, 14 días y muy baja hemólisis. Este sistema es capaz de adaptar un oxigenador de los descritos de largo plazo y convertirse en un sistema ECMO, manteniendo las ventajas aportadas por su bomba sanguínea. Las desventajas son su más alto coste y la poca información que suministra la consola, básicamente, rpm y flujo.
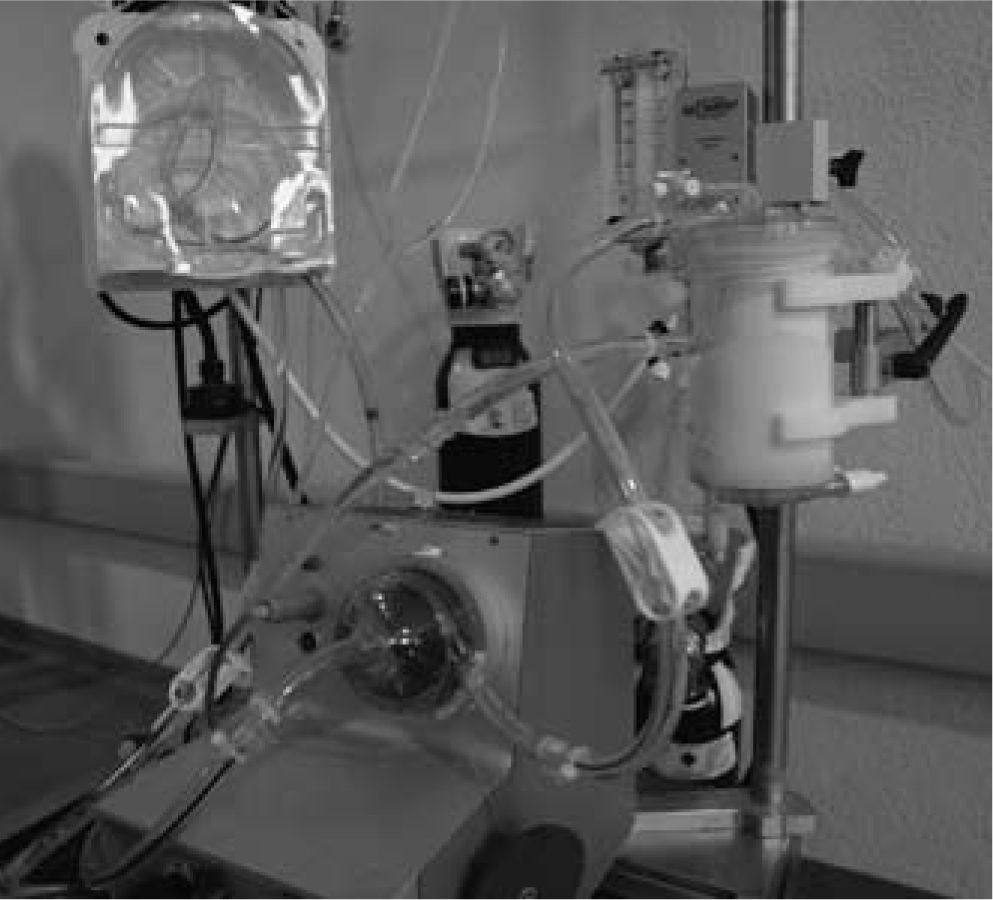
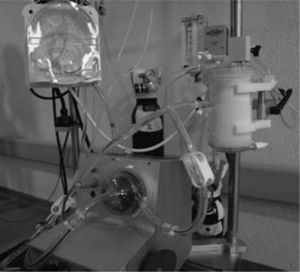
Oxigenación de membrana extracorpórea Biomedicus MedtronicMuchos equipos disponen de una o varias consolas Medtronic, desde la más antigua Bio-Console 540 a la más moderna Bio-Console 560. Combinando una de estas consolas, la bomba sanguínea Bio-Pump Plus y un oxigenador de larga duración, sólo se necesita adquirir un mezclador de oxígeno-aire y adaptar todos estos componentes en un carro para disponer de un sistema ECMO sin prácticamente coste económico. Nosotros hemos adaptado el circuito ECMO Medos para utilizar con la consola Medtronic, intercambiando la bomba sanguínea Deltastream DP2 por la bomba Bio-Pump Plus (Fig. 4). La ventaja de este sistema ECMO híbrido Medtronic-Medos es disponer de un oxigenador de larga duración en el circuito (Hilite LT 7000).
Mezclador oxígeno-airePor medio de este dispositivo se regula la proporción de oxígeno/aire (FiO2) y el flujo de esta mezcla de gases que entra en la fase gaseosa del oxigenador. El aporte de oxígeno y la eliminación de CO2 es relativamente independiente en los oxigenadores de membrana. El control de la eliminación de CO2 se realiza variando el flujo de gas del mezclador; si se aumenta el flujo de gas aumentamos la eliminación de CO2 al disminuir la presión parcial de CO2 en la fase gaseosa, y viceversa. El control del aporte de oxígeno se lleva a cabo aumentando o disminuyendo la FiO2 del gas suministrado por el mezclador.
Carro con sistemas de soportePermite tener el conjunto del sistema integrado y autónomo, tanto para el hardware (consola principal, consola de seguridad, soportes para el motor de la bomba y oxigenador, mezclador de oxígeno-aire, consola medición ACT, botellas de oxígeno y aire) como para el circuito (tubos, cabezal de la bomba sanguínea, oxigenador), gracias a soportes concebidos de manera específica para la asistencia ECMO. Los sistemas ECMO Medos Deltastream y Maquet han desarrollado sendos carros para transporte intrahospitalario (Figs. 2 y 3), y además Maquet ha diseñado también un sistema portátil para transporte interhospitalario.
CanulaciónSe describen las técnicas de canulación periférica y los dos tipos de ECMO: asistencia venoarterial (V-A ECMO) y asistencia venovenosa (V-V ECMO). Mientras se prepara el campo para la canulación, se inicia la purga del circuito ECMO por parte del personal responsable, en nuestro caso facultativos específicamente formados en el empleo de ECMO, de la unidad de cuidados intensivos y reanimación. Los sistemas ECMO actuales aportan circuitos con todos sus componentes ya conectados (Maquet, Medos) y de fácil purgado para poder iniciar rápidamente la asistencia.
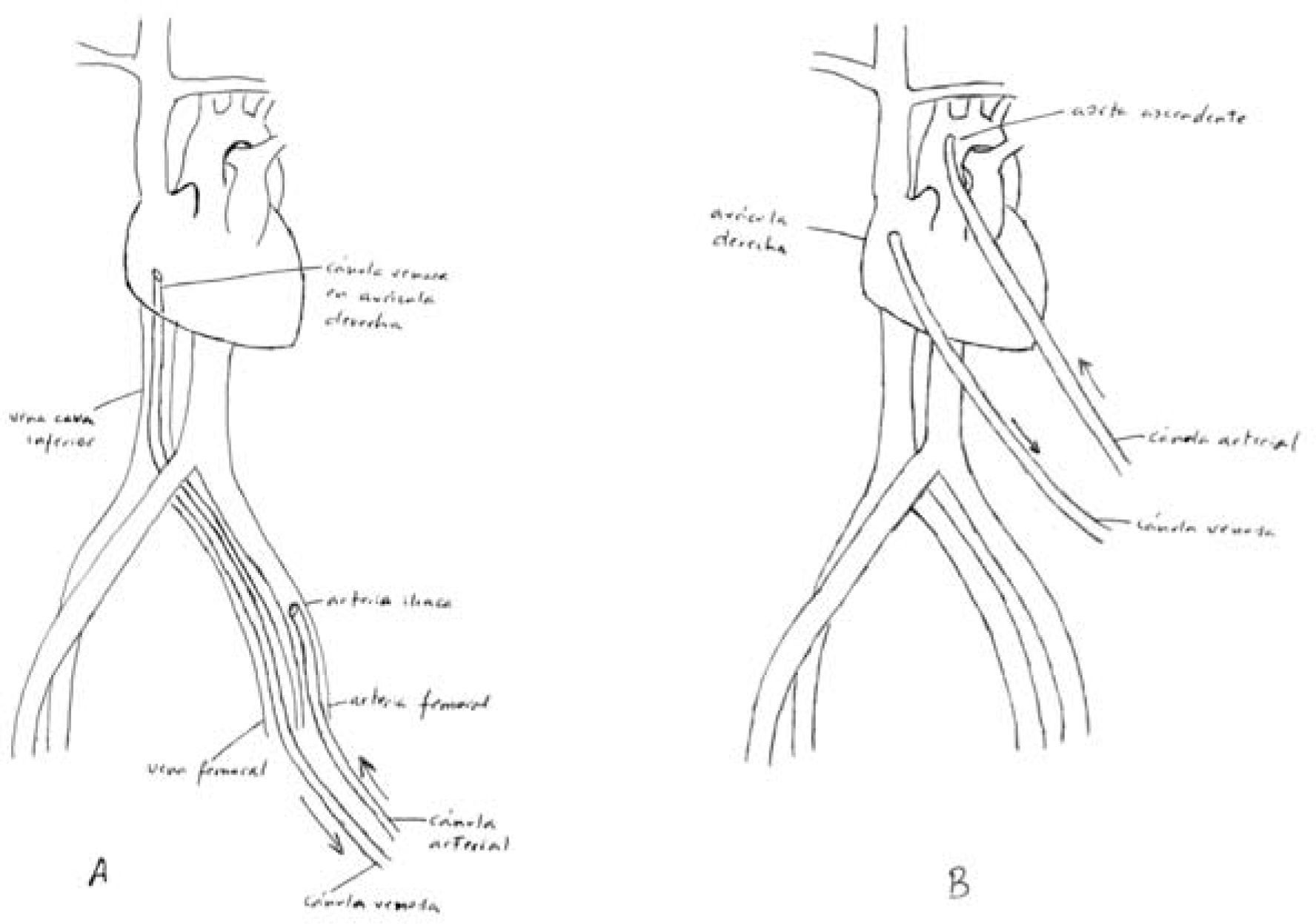
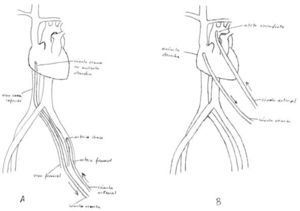
Asistencia venoarterial oxigenación de membrana extracorpóreaEste tipo de asistencia está indicado para soporte cardíaco o cardiorrespiratorio. Se necesitan dos cánulas, una de las cuales se introduce en una arteria periférica, y la otra en una vena periférica (Fig. 5).
Canulación arterialPor la facilidad de su abordaje percutáneo y quirúrgico, la arteria habitualmente escogida es la arteria femoral (AF) común. En caso de enfermedad aortoilíaca, otra arteria con posibilidad de abordaje rápido es la arteria axilar.
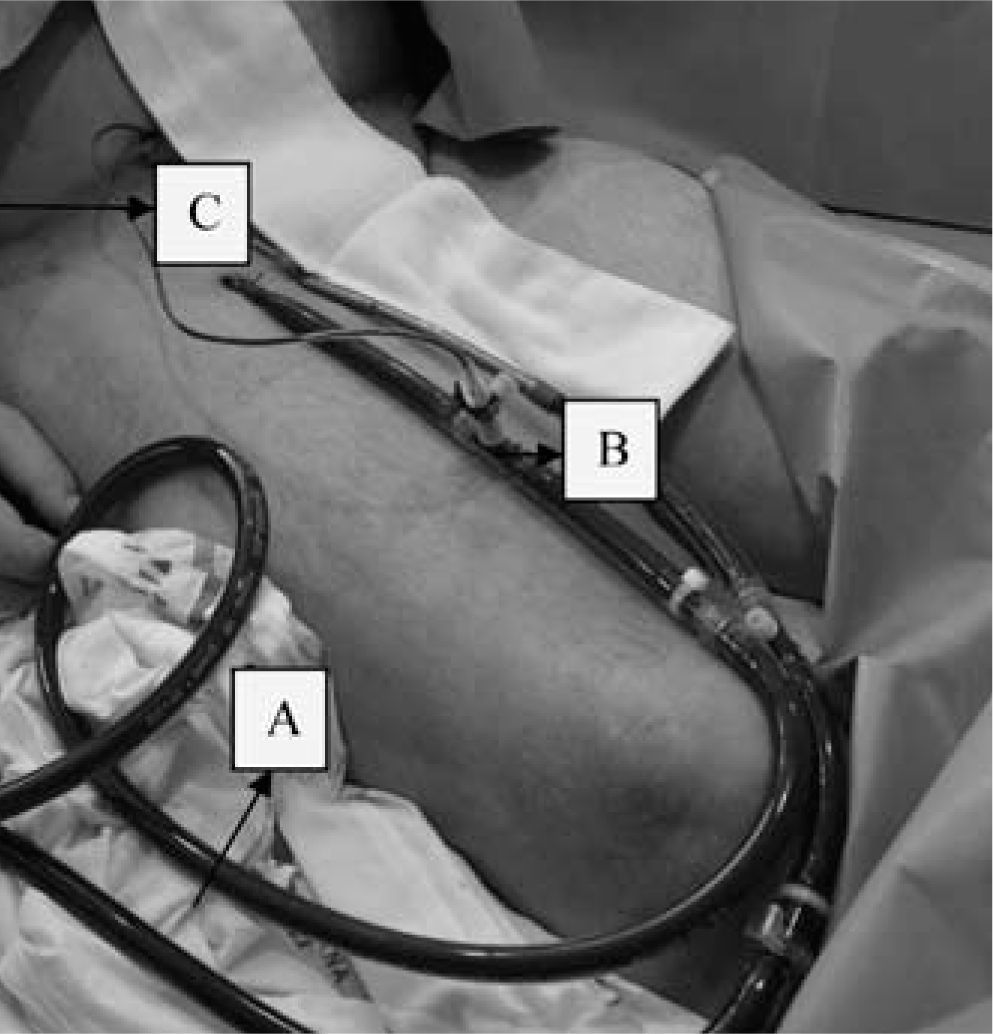
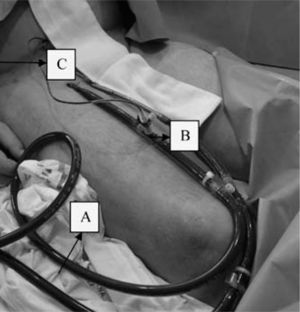
PercutáneaEs una técnica interesante en las complicaciones que surgen en el laboratorio de hemodinámica, ya que la AF suele estar canulada previamente, lo que permite un inicio muy rápido de la asistencia. Se lleva a cabo mediante la técnica de Seldinger. Con objeto de evitar una probable isquemia del miembro inferior debido a la obstrucción de la luz que provoca la cánula arterial del sistema ECMO, se debe colocar distalmente a ella una segunda cánula más pequeña para perfundir el miembro. Nosotros utilizamos una línea de perfusión que viene dentro del fungible para ECMO de Medos, semejante a un segmento de una línea de gotero convencional, pero de consistencia más rígida para facilitar la canulación y evitar posibles acodaduras. Esta línea de perfusión tiene en un extremo una conexión que permite adaptarla a una llave de tres pasos en la cánula arterial del sistema ECMO (Fig. 6).
QuirúrgicaEs nuestra técnica de elección. La canulación a cielo abierto tiene varias ventajas: 1) se realiza siempre en AF común, incluso en arteria ilíaca externa, y en la zona más apropiada (con menos arteriosclerosis); 2) se utilizan cánulas de mayor calibre al estimarse directamente el diámetro de la AF, y 3) en pacientes en shock cardiogénico el pulso femoral está disminuido haciendo difícil, insegura y prolongada la canulación percutánea, siendo, a veces, en esta situación de emergencia, más rápida la técnica a cielo abierto.
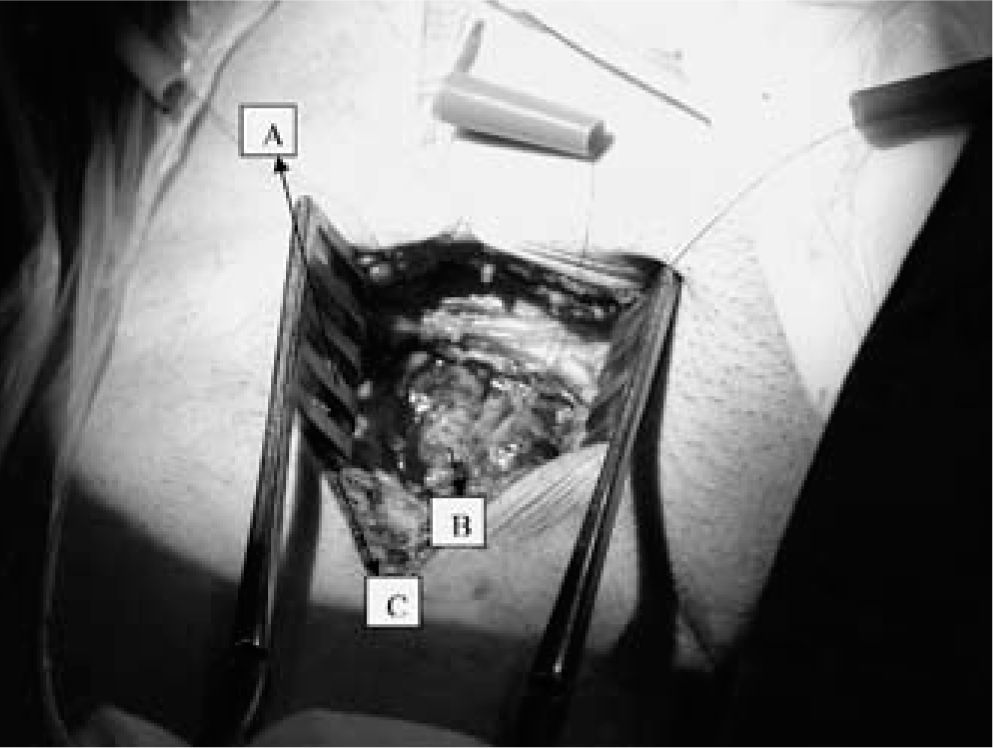
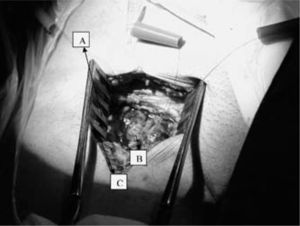
Una vez disecada la AF, se hepariniza y canula al paciente del mismo modo que para la canulación percutánea según técnica de Seldinger. Para evitar la hemorragia pericánula aconsejamos anudar ambas suturas en bolsa de tabaco alrededor de las cánulas. Tras el cierre de la incisión, los torniquetes de fijación quedarán enterrados en la herida quirúrgica (Fig. 8). Antes de colocar la cánula de perfusión del miembro canulamos la VF, como veremos a continuación, e iniciamos la asistencia (Fig. 9).
Canulación venosaLa vena periférica suele ser la VF de uno u otro lado. En caso de trombosis venosa iliofemoral, puede canularse la vena yugular interna.
PercutáneaLa técnica es la misma que la descrita para la canulación arterial percutánea, a excepción de que la cánula venosa se avanza hasta ubicarla en la aurícula derecha o en la unión cavoauricular.
QuirúrgicaLa VF quedará expuesta en el lado interno de la AF. En el cayado de la safena se realiza una sutura circular (Fig. 7). En el interior de esta sutura se introduce la cánula venosa según técnica de Seldinger. El torniquete oclusor no se fija a la cánula venosa, lo que permitirá movilizar la cánula venosa si se comprueba mala ubicación de la misma (Fig. 9).
Asistencia venoarterial oxigenación de membrana extracorpóreaEstá indicada cuando se precisa exclusivamente una asistencia respiratoria. La canulación puede realizarse de tres formas diferentes: 1) colocando una cánula venosa de drenaje en la VF, y una de retorno en aurícula derecha a través de la vena yugular interna; 2) colocando una cánula venosa de drenaje en la vena yugular interna, y una de retorno en la vena cava inferior a través de la VF, y 3) colocando una cánula venosa de drenaje en la VF, y una de retorno en aurícula derecha a través de la VF contralateral. En este tipo de asistencia es más frecuente la canulación percutánea.
Inicio y mantenimiento del paciente en oxigenación de membrana extracorpóreaUna vez purgado el circuito, se conectan las líneas con las cánulas correspondientes, evitando la introducción de aire en el circuito. En este punto se inicia la asistencia. En primer lugar se desocluye la cánula venosa; después se aumentan las revoluciones de la bomba a 1.000–1.500 rpm, y luego se inicia la desoclusión progresiva de la cánula arterial, controlando que no se produzca flujo retrógrado (V-A ECMO). Posteriormente, se aumentan progresivamente las rpm y, por lo tanto, el flujo sanguíneo hasta obtener parámetros hemodinámicos y respiratorios satisfactorios:
- –
Saturación venosa central o mixta de oxihemoglobina del 75–80%.
- –
Saturación arterial de oxihemoglobina del 100% para V-A ECMO, o bien 85–100% para V-V ECMO.
Para conseguir un estado de bienestar e inmovilidad relativa del paciente durante la implantación de ECMO, se recomienda una infusión endovenosa de sedantes, analgésicos y relajantes musculares a dosis individualizadas según las necesidades y circunstancias clínicas de cada paciente. La relajación muscular se retira tras finalizar el acto quirúrgico de canulación, siempre que las condiciones respiratorias lo permitan. Se debe dejar con sedación-analgesia las primeras 12h. Posteriormente, es recomendable realizar ventana de sedación diaria para valorar el estado neurológico del paciente.
La situación ideal es tener al paciente con la mínima dosis de sedación-analgesia con el fin de intentar la extubación y desconexión de la ventilación mecánica. Aunque es posible mantener al paciente sin respiración asistida, resulta muy difícil, en la mayoría de los casos, por la situación de edema pulmonar asociado.
Profilaxis antibióticaEs recomendable realizar doble profilaxis para bacterias grampositivas y gramnegativas. La duración de la terapia antimicrobiana es algo discutido y no consensuado. Algunos centros la mantienen mientras la asistencia esté funcionando, y en otros la limitan a las primeras 48h. Hay que valorar cada día signos de infección sistémicos y en la zona de inserción de las cánulas, por lo que es recomendable la extracción de hemocultivos ante aumento de leucocitosis u otros reactantes de fase aguda (p. ej. procalcitonina o proteína C reactiva).
AnticoagulaciónEn circuitos heparinizados la dosis de inducción es 1–1,5mg/kg de heparina no fraccionada. Posteriormente, se iniciará perfusión de heparina a dosis de 2mg/kg/día y se modificará con el objetivo de mantener el tiempo de coagulación activado (ACT) entre 160–180 s. Se debe realizar un seguimiento individualizado y continuo (cada 2h) y ajustar la anticoagulación a las circunstancias concretas de cada paciente en cada momento (hemorragia, necesidad de cambio de bomba o de sistema…). Así, estos rangos de ACT deben ser algo inferiores en los pacientes poscardiotomía (140–170 s), por el mayor riesgo de hemorragia; incluso, no debe administrarse heparina si el drenado torácico es mayor de 100ml/h.
En el momento del destete de ECMO ha de tenerse especial atención a la anticoagulación, ya que al proporcionar menores flujos se ha de mantener al paciente más anticoagulado. Ante flujos de bomba inferiores a 1,5l/min, el ACT debe ser superior a 200 s.
Particularidades de mantenimiento en asistencia venoarterial oxigenación de membrana extracorpóreaControl hemodinámicoEl flujo sanguíneo extracorpóreo durante V-A ECMO debe ser suficientemente alto para proporcionar una presión de perfusión adecuada (presión arterial media 65–85mmHg), saturación venosa de oxígeno mayor del 70% y ácido láctico en sangre igual o inferior a 1,4mmol/l. Es importante mantener una presión venosa central mayor de 8mmHg, que asegura un flujo pulmonar suficiente para evitar lesión de isquemia-reperfusión pulmonar. En estos pacientes, disponer de un catéter de Swan-Ganz es de gran utilidad, ya que nos permite valorar:
- –
El gasto cardíaco del paciente durante ECMO. El flujo sanguíneo total del paciente resulta de la suma de los flujos registrados por el medidor de flujo en el circuito ECMO y por el catéter de Swan-Ganz, que debería ser superior a 2,2l/min/m2.
- –
La presión en arteria pulmonar y la presión de enclavamiento pulmonar. Cuando la función ventricular izquierda se encuentra gravemente afectada, puede ocurrir que el ventrículo izquierdo (VI) sea incapaz de eyectar en la aorta el disminuido volumen de sangre que llega a través de la circulación pulmonar. Esto puede conducir a: 1) dilatación del VI, que impedirá su posible recuperación; 2) formación de trombos intracardíacos, y 3) aumento de la presión capilar pulmonar, con el riesgo de edema y hemorragia pulmonar.
La monitorización de las presiones sanguíneas en el circuito pulmonar mediante el catéter de Swan-Ganz detecta esta infrecuente complicación. En nuestra casuística de 28 pacientes, sólo la hemos encontrado en un paciente; no obstante, cuando ocurre obliga a tomar medidas progresivas para solucionarla.
- –
En primer lugar, incrementar la dosis de inotrópicos y/o asociar el balón intraaórtico de contrapulsación. Si estas medidas no evitan la dilatación del VI, es necesaria la realización de una septostomía auricular o la inserción de un catéter de drenaje ventricular izquierdo. Medidas alternativas podrían ser: cambiar la canulación ECMO de periférica a central, para aumentar el drenaje venoso y disminuir el flujo sanguíneo al VI, o bien implantar un dispositivo de asistencia ventricular de medio o largo plazo (bridge to bridge).
- –
La retirada o disminución de fármacos vasoactivos, la corrección de la hipovolemia y la indicación y progresión del destete de ECMO.
El registro de las presiones en el circuito ECMO proporciona información del estado del paciente, de las cánulas, de la bomba y del oxigenador de membrana (Tabla I). La consola Medos proporciona la medición de varias presiones y la incorpora a la pantalla principal facilitando su visualización. En otros modelos también pueden medirse presiones intrasistema, pero la consola no nos facilita directamente los datos, por lo que precisa conexión a un monitor adicional.
Presiones Intrasistema. Aproximación Diagnóstica con el Control de las Presiones Ante Disminución del Flujo con Régimen de Revoluciones Constante
| P1( mmHg) máx. permitida −30/−70mmHg | P2 (mmHg) máx. permitida 350mmHg | P3 (mmHg) máx. permitida 350mmHg | P2-P3 = δP (mmHg) oxigenador | Diagnóstico |
| La resistencia a la aspiración aumenta: el paciente necesita aumentar volemiaTaponamiento cardíaco, neumotórax, hemotóraxCánula femoral venosa de ECMO o la línea de aspiración están acodadas u obstruidas | ||||
| Fallo de la bombaMecánico (cable, motor…)Trombo intrabomba | ||||
| Fallo del oxigenadorTrombo intraoxigenador | ||||
| Obstáculo a la eyecciónPaciente semisentadoLínea de reinyección o cánula femoral arterial de ECMO están acodadas u obstruidas |
El modelo Medos denomina P1 a la presión en la línea venosa (prebomba). Es una presión negativa, ya que la bomba realiza una fuerza de succión de la sangre a través de la cánula venosa. Los valores normales oscilan entre −10 a −60mmHg, aunque pueden verse modificados según el tamaño de cánula venosa utilizada. Si la P1 es muy negativa hay que valorar diferentes posibilidades: necesidad de aumentar la volemia, o bien obstrucción en la cánula venosa por trombo o acodamiento, o bien cánula venosa no ubicada en la unión cavoauricular (Tabla I).
La P2 es la presión entre la bomba y el oxigenador, y P3 es la presión postoxigenador. El valor de estas presiones es positivo, y oscila entre 200–300mmHg. La presión P2 es unos 40–60mmHg mayor que P3 debido a la resistencia al flujo que ofrece el oxigenador. La alteración de estas presiones indica disfunción de la bomba, del oxigenador o de la cánula arterial (Tabla I).
EcocardiografíaSe recomienda la realización de ecocardiografía antes de iniciar la asistencia para descartar la existencia de insuficiencia aórtica grave, que contraindicaría su colocación, y para estimar la fracción de eyección del VI y valorar, tras la puesta en marcha de la asistencia, su evolución. La ecocardiografía transtorácica o transesofágica informa de la correcta posición de la cánula venosa en aurícula derecha, la evolución de la recuperación cardíaca y la aparición de dilatación y trombosis ventricular izquierda. Asimismo, es imprescindible para la realización de un correcto destete de ECMO.
Control parámetros sanguíneosExiste un consumo continuo de células sanguíneas debido a:
- –
Hemorragia en las zonas quirúrgicas por la anticoagulación necesaria durante el soporte ECMO. Por ello, es muy importante una exquisita hemostasia durante la implantación del sistema ECMO.
- –
Las altas presiones, tanto negativas como positivas, a que es sometida la sangre en el circuito ECMO.
- –
La exposición a superficies extrañas en el circuito ECMO.
Ello obliga a un control riguroso del hematocrito y las plaquetas, que deben mantenerse por encima del 30% y en número igual o superior a 100.000/mm3, respectivamente. En caso de hemorragia o alteración importante de los tiempos de coagulación se debe administrar plasma fresco o fibrinógeno. Para identificar el déficit de factores de coagulación, de fibrinógeno o de plaquetas resulta útil el tromboelastograma. Hay que descartar diariamente la aparición de hemólisis, mediante la determinación de la bilirrubina sérica total, lactato deshidrogenasa y la valoración de presencia de esquistocitos.
Ventilación mecánicaDurante V-A ECMO, una gran parte del flujo sanguíneo pulmonar se deriva hacia el circuito extracorpóreo, y el mantenimiento de una ventilación normal puede hacer subir el pH pulmonar capilar, al disminuir localmente la presión parcial de CO2, y provocar hemólisis y hemorragia pulmonar. Así pues, durante V-A ECMO, el volumen tidal, la presión de ventilación, la frecuencia ventilatoria y la FiO2 se reducen para evitar el barotrauma, el volutrauma, la toxicidad del oxígeno y la alcalosis local. Debe mantenerse una presión al final de la espiración (PEEP) superior a 8cmH2O para evitar el colapso alveolar, y se modulará según el grado de edema pulmonar.
Se recomienda que la relación flujo de gas emitido por el mezclador de oxígeno-aire/flujo de bomba sea 1/1 al inicio; posteriormente, esta relación se modificará según los resultados de gases obtenidos directamente en la línea arterial postoxigenador del circuito.
DesconexiónCuando durante al menos 24 h de soporte hay evidencia de recuperación ventricular, manifestada por disminución de las presiones de llenado (presión venosa central y presión capilar pulmonar), normalización de la morfología de la onda de presión arterial, disminución de las necesidades de inotrópicos y recuperación de la función cardíaca sistólica en la ecocardiografía, y, además, la oxigenación sanguínea pulmonar no está comprometida, los flujos de ECMO son reducidos progresivamente. En nuestra experiencia, reducimos los flujos progresivamente durante 24 h hasta 1,5 l/min. Mantenemos otras 12–24 h al paciente en ECMO a 1,5 l/min. Si se mantienen los datos de recuperación ventricular, reducimos los flujos a menos de 1 l/min durante 2–4 h. Si con estos bajos flujos la fracción de eyección del VI es superior al 35–40%, el índice cardíaco superior a 2,2 l/min/m2 y el estado hemodinámico permanece estable, se retira la asistencia. Hay que recordar que con flujos de menos de 1 l/min se debe aumentar la dosis de heparina.
Particularidades de mantenimiento en asistencia venoarterial oxigenación de membrana extracorpóreaA diferencia de V-A ECMO, durante V-V ECMO el flujo extracorpóreo debe mantenerse lo más elevado posible para optimizar la liberación de oxígeno. Como no toda la sangre venosa puede ser capturada por la cánula venosa de drenaje, la saturación de oxígeno en aurícula derecha, que será prácticamente la misma que en aorta, rara vez será mayor del 90%, permaneciendo alrededor del 80%; no obstante, si el gasto cardíaco y concentración de hemoglobina son normales, la liberación de oxígeno a los tejidos será adecuada.
Durante V-V ECMO el gasto del ventrículo derecho (VD) es normal, incluso mayor que antes de iniciar ECMO, debido al aumento del gasto cardíaco que se produce tras corregir la hipoxia. Por lo tanto, aquí la reducción de los parámetros de ventilación mecánica están específicamente dirigidos a evitar los efectos lesivos pulmonares debidos al barotrauma, volutrauma y toxicidad del oxígeno. Así pues, reduciremos el volumen tidal a 10ml/kg, utilizaremos presión inspiratoria igual o inferior a 35mmHg, PEEP inferior a 10cmH2O, frecuencia de 4–6 respiraciones/min (relación inspiratoria/ espiratoria de 2–4/1) y FiO2 igual o inferior a 0,5. La mejoría de la radiografía de tórax, de la distensibilidad pulmonar y de la saturación arterial de oxihemoglobina, junto con el aumento de la diferencia de saturación de oxígeno entre la sangre en aorta y aurícula derecha o arteria pulmonar, indicarán que el pulmón se está recuperando.
Para proceder a la desconexión del paciente en V-V ECMO se realizarán varios intentos de ausencia de flujo de oxígeno-aire a través del oxigenador extracorpóreo, mientras que el flujo sanguíneo extracorpóreo permanece constante, pero sin transferencia de gases a nivel del oxigenador extracorpóreo. Los pacientes son observados durante varias horas, durante las cuales se determinan los parámetros ventilatorios necesarios para mantener una oxigenación y ventilación adecuadas sin ECMO. Si el intercambio gaseoso y la hemodinámica se mantienen normales, con parámetros ventilatorios adecuados (FiO2≤0,5, presión inspiratoria ≤ 35mmHg y PEEP ≤ 10cmH2O), podremos retirar la ECMO.
Indicaciones de reemplazamiento del sistema de oxigenación de membrana extracorpórea- –
Fuga plasmática en la fase gaseosa del oxigenador.
- –
Relación PaO2 postoxigenador/FiO2 oxigenador inferior a 150mmHg.
- –
PCO2 postoxigenador igual o superior a 50mmHg o con relación flujo gas/flujo sanguíneo 3/1 o mayor.
- –
Presencia de coágulos en alguno de los componentes del circuito.
- –
Disminución del flujo de bomba con o sin aumento del gradiente de presión transoxigenador.
- –
Aumento del ruido habitual de la bomba.
La ECMO está indicada en la insuficiencia cardíaca o respiratoria que no responde al tratamiento convencional.
Insuficiencia cardíacaLos criterios para iniciar ECMO incluyen: 1) shock cardiogénico refractario: índice cardíaco inferior a 2 l/min/m2, presión arterial sistólica igual o inferior a 75mmHg o presión arterial media inferior a 65mmHg y presión capilar pulmonar superior a 20mmHg, con al menos dos fármacos inotrópicos y balón de contrapulsación; 2) parada cardíaca que no responde a las medidas convencionales de resucitación cardiopulmonar, y 3) riesgo inminente de muerte secundario a arritmia ventricular maligna recurrente.
Shock cardiogénico poscardiotomíaDespués de cirugía cardíaca, la incidencia de shock cardiogénico resistente a inotrópicos y contrapulsación es del 0,5–1%1−3. El daño miocárdico como consecuencia de la lesión de isquemia-reperfusión (stunning miocárdico) es la causa más importante4. Los pacientes sometidos a trasplante cardíaco (TC) pueden desarrollar hipertensión pulmonar postoperatoria resistente a vasodilatadores pulmonares, apareciendo shock cardiogénico secundario a insuficiencia cardíaca derecha5.
Ambas causas de insuficiencia cardíaca postoperatoria pueden ser superadas con el empleo de ECMO, y en la literatura se describe una supervivencia hospitalaria del 16–50%1,3,6–9. En nuestra experiencia, la supervivencia con ECMO en shock poscardiotomía es del 50% (datos no publicados).
Shock cardiogénico agudo y parada cardíaca no quirúrgicosLas ventajas de ECMO en estas situaciones de emergencia son: 1) facilidad y rapidez del establecimiento de la asistencia mediante canulación periférica; 2) no es necesario el traslado a quirófano, pudiéndose realizar la técnica en UCI/reanimación, y 3) posibilidad de continuar con las medidas convencionales de resucitación cardiopulmonar hasta iniciar ECMO.
Los pacientes en shock cardiogénico refractario necesitan cuanto antes la restauración de una perfusión tisular adecuada para evitar que el fracaso multiorgánico alcance la irreversibilidad. Ésta es la clave del éxito en el tratamiento de estos pacientes. El sistema ECMO es el dispositivo de más rápida implantación, ya que no es preciso trasladar al paciente a quirófano; no precisa personal de enfermería especializado para instrumentar, y no precisa toracotomía, habitualmente es suficiente el abordaje de la arteria y VF.
Recientemente, el hospital Pitié-Salpêtrière ha publicado sus resultados en 55 pacientes con shock cardiogénico refractario de origen médico tratados con ECMO entre los años 2003–20069: 18 pacientes con descompensación aguda de miocardiopatía dilatada en fase terminal, con cinco supervivientes (27,7%); 16 pacientes con shock postinfarto agudo de miocardio, con cinco supervivientes (31,2%); 16 pacientes con miocarditis fulminante y 10 supervivientes (62,5%), y cinco pacientes con shock de causas más infrecuentes (intoxicación por fármacos, rechazo agudo del injerto cardíaco, etc.), con un superviviente. La supervivencia total para este grupo de pacientes resultó ser del 38%.
Las variables que en el momento de inicio de ECMO se relacionaron independientemente con mortalidad precoz fueron: inserción de ECMO durante masaje cardíaco (OR: 20,68), diuresis últimas 24 h inferior a 500ml (OR: 6,5), actividad protrombina inferior al 50% (OR: 3,9) y sexo femenino (OR: 3,89). Resultados similares han sido publicados por otros autores con supervivencias entre el 23–35%10,11.
Nuestra experiencia en 16 pacientes tratados con ECMO por shock cardiogénico médico, entre diciembre de 2006 y septiembre de 2008 es la siguiente: miocardiopatía dilatada o isquémica seis pacientes; shock postinfarto agudo de miocardio cuatro pacientes; rechazo agudo tres pacientes; rechazo crónico dos pacientes, y miocarditis un paciente. De ellos, 11 pacientes pudieron ser dados de alta hospitalaria, es decir, un 68,75% (datos no publicados).
Bridge to bridgeLa duración limitada del soporte ECMO ha dificultado su aceptación en adultos con baja o nula probabilidad de recuperación miocárdica. Estos inconvenientes pueden ser superados mediante la transferencia a un dispositivo de asistencia ventricular de larga duración (VAD), después de la resucitación inicial con ECMO, con vistas al tratamiento definitivo mediante TC o terapia definitiva. La supervivencia en estos pacientes sometidos a bridge to bridge es satisfactoria y se sitúa entre el 78–100%12–14.
Parece demostrado que la asistencia previa con ECMO no es un factor de riesgo de mortalidad tras la implantación de un VAD12–14, lo cual debería evitar el rechazo a utilizar ECMO cuando la probabilidad de recuperación miocárdica es pequeña o nula en pacientes candidatos a TC. Por lo tanto, la estrategia de emplear ECMO como puente a un VAD permite soporte circulatorio inmediato y el rescate de pacientes candidatos a TC en los que no habría sido posible implantar de entrada un VA D por la situación de emergencia.
Insuficiencia respiratoriaEl síndrome de distress respiratorio del adulto (SDRA), la enfermedad obstructiva de la vía aérea (obstrucción mecánica de la vía aérea y estatus asmático grave) y la disfunción del injerto postrasplante pulmonar representan las situaciones clínicas en las que, cuando el tratamiento óptimo convencional no resuelve la insuficiencia respiratoria, el empleo de ECMO representa la única posibilidad de solución en estos pacientes15–17.
Se han descrito unos criterios de gases sanguíneos para el empleo de ECMO en SDRA (ECMO blood gas criteria)18,19: 1) PaO2 igual o inferior a 50mmHg durante al menos 2 h a una FiO2 = 1,0, y PEEP igual o superior a 5cm H2O (fast entry criteria), o bien 2) Pa O2 igual o inferior a 50mmHg durante al menos 12 h a una Fi O2 igual o superior a 0,6, y PEEP igual o superior a 5cm H2O después de 48 h en la unidad de cuidados intensivos (slow entry criteria).
Otros autores15,16 emplean el siguiente criterio para sentar la indicación de ECMO: shunt transpulmonar superior al 30% con FiO2 igual o superior a 0,6 (que corresponde a una relación PaO2/FiO2 inferior a 100 o gradiente alveoloarterial de oxígeno superior a 500) y distensibilidad inferior a 0,5ml/cm H2O/kg. Aunque más propio de la enfermedad obstructiva de la vía aérea, una insuficiencia respiratoria con hipercapnia y pH arterial inferior a 7,2 sería indicación de ECMO16.
Entre 1990–1996, Kolla, et al.16 trataron a 94 pacientes con insuficiencia respiratoria hipoxémica refractaria al tratamiento convencional, mediante ECMO. Presentaban los siguientes valores medios: PaO2/FiO2 55,7; shunt transpulmonar 0,52, y días de ventilación pre-ECMO 3,5. Neumonía con ARDS fue la causa de la insuficiencia respiratoria en 49 pacientes, y la supervivencia en este grupo fue del 53%. En los restantes 45 pacientes las causas de ARDS fueron: traumatismo (18 pacientes), sepsis extratorácica (siete pacientes) y una variedad de otras causas (20 pacientes), siendo la supervivencia en ellos del 51%. La supervivencia global fue del 52% y la mayoría de supervivientes llevan una vida normal y ninguno presenta enfermedad pulmonar crónica. Otros centros presentan experiencias similares a las de Kolla, con supervivencias entre el 50–66% en pacientes con parámetros de afectación pulmonar igualmente graves20–23.
La probabilidad de mortalidad es mayor si los siguientes factores existen previamente al empleo de ECMO20: acidosis grave con pH inferior a 7,1 (OR: 8,4) y ventilación mecánica prolongada durante más de 8 días (OR: 5,5).
El estudio CESAR (soporte ventilatorio convencional vs ECMO en insuficiencia respiratoria aguda grave) está siendo llevado a cabo para determinar en la actualidad el impacto de ECMO sobre los resultados clínicos24. El ensayo CESAR asigna de forma aleatorizada pacientes con insuficiencia respiratoria aguda grave, potencialmente reversible, a recibir ventilación mecánica convencional o ECMO. El objetivo principal del estudio es la supervivencia a 6 meses. Objetivos secundarios incluyen morbilidad y calidad de vida a 6 meses.
Seis pacientes con insuficiencia respiratoria hipercárbica debido a estatus asmático (cuatro pacientes) y obstrucción traqueal aguda (dos pacientes) fueron tratados con ECMO por Kolla, et al.16. En ellos el promedio de PaCO2 era 84mmHg, con pH 7,19 y presión inspiratoria 51,3mmHg. La supervivencia fue del 83%.
También ECMO se ha utilizado en pacientes en lista de espera de TP, bien como puente al trasplante hasta disponer de donante, o bien para estabilizar, durante un breve periodo de tiempo, una descompensación aguda en un paciente en lista de espera de TP25–27. No obstante, la situación más frecuente en el TP que requiere ECMO es la disfunción del injerto postrasplante28–32. En este sentido, puede utilizarse ECMO como soporte temporal, bien hasta que la función del injerto se recupere, o bien como puente al retrasplante.
Entre el 2,7–7,4% de pacientes intervenidos de TP o trasplante cardiopulmonar desarrollan en el postoperatorio una disfunción del injerto pulmonar grave en los que la aplicación del tratamiento convencional es insuficiente. En estos casos, el empleo de la asistencia ECMO consigue supervivencias entre el 35,5–75%28–32.
ContraindicacionesContraindicaciones absolutas- –
Insuficiencia aórtica grave (en caso de V-A ECMO).
- –
Parada cardíaca no presenciada.
- –
Enfermedad terminal (cirrosis hepática, cáncer, insuficiencia renal o diabetes).
- –
Fracaso multiorgánico establecido e irreversible.
- –
Daño neurológico irreversible.
- –
Disección de aorta.
- –
Sepsis.
- –
Mayores de 70 años.
- –
Obesidad mórbida.
Las complicaciones durante el empleo de ECMO son frecuentes, y el éxito de este tratamiento depende del reconocimiento y tratamiento precoz de las mismas.
HemorragiaEs frecuente y puede comprometer la vida del paciente. Se debe al trastorno de coagulación provocado por la administración continua de heparina y disfunción plaquetar, o bien a un defecto de la técnica quirúrgica de implantación de las cánulas arterial o venosa, que provoque hemorragia en el lugar de canulación. Es muy frecuente que la hemorragia sea a nivel local en el lugar de la implantación de las cánulas, que se resuelva con revisión quirúrgica y aplicación local de productos hemostáticos.
La canulación femoral ha reducido notablemente la incidencia de hemorragia. Así, Muehrcke, et al.33 encuentran una incidencia de reintervención por hemorragia poscardiotomía en pacientes con canulación central del 100%, frente al 35% en pacientes con canulación periférica.
TromboemboliaLos fenómenos tromboembólicos debidos a la formación de coágulos en el circuito extracorpóreo son infrecuentes, pero pueden ser muy graves. Es preciso inspeccionar periódicamente el circuito en busca de coágulos. Asimismo, un aumento del gradiente de presión a través del oxigenador sugiere la formación de trombos en esta parte del circuito extracorpóreo. Ante signos de formación de coágulos en el circuito se debe proceder a sustituirlo.
Complicaciones relacionadas con la canulación- –
Perforación de la arteria o VF.
- –
Disección de la AF.
- –
Isquemia de la extremidad inferior: su frecuencia ha disminuido notablemente desde que se ha generalizado el empleo de una cánula de perfusión arterial distal a la cánula arterial femoral (Figs. 6–9). Nosotros empleamos esta cánula de perfusión de la extremidad inferior de rutina, y en 28 casos de V-A ECMO mediante canulación femoral sólo hemos tenido un caso de isquemia distal (3,5%).
- –
Trombosis venosa profunda (flegmasía) o edema a tensión de la extremidad inferior secundaria a obstrucción del retorno venoso por la cánula venosa femoral. Si ocurre esta complicación, se puede resolver asociando una cánula distal en VF conectada en Y con la cánula o línea venosa, o bien cambiando la cánula venosa femoral por otra de menor diámetro, o bien cambiando a canulación central. En nuestra experiencia de 28 casos de V-A ECMO, hemos encontrado esta complicación en un paciente (3,5%).
Cuando existe insuficiencia respiratoria grave, la asistencia V-A ECMO a través de canulación periférica por AF puede verse complicada con el hecho siguiente: las extremidades inferiores y vísceras abdominales serán preferentemente perfundidas con sangre completamente oxigenada proveniente del circuito ECMO, mientras que el corazón, cerebro y extremidades superiores serán preferentemente perfundidas por la sangre eyectada desde el corazón, pobremente oxigenada en los pulmones del paciente34.
Para evitar esta complicación, la saturación arterial de oxihemoglobina debería ser monitorizada, tanto en la extremidad superior como en la inferior. Una baja saturación arterial de oxihemoglobina en la extremidad superior precisa ajustar de forma adecuada los parámetros ventilatorios de la asistencia mecánica respiratoria, o bien aumentar los flujos del sistema ECMO. Si, a pesar de ello, este fenómeno ocurre y tiene trascendencia clínica, deberemos cambiar el sitio de canulación periférica a la arteria axilar, o bien utilizar la canulación central en aorta torácica.
InfecciónEs una de las complicaciones más frecuentes, de ahí la importancia de la profilaxis y de la vigilancia de signos de infección para poder introducir lo más precozmente la antibioterapia adecuada. Un inadecuado y tardío manejo de la sepsis puede llevarnos a una situación de fallo multiorgánico que complica enormemente el manejo del paciente en ECMO. Smedira, et al.35, en 202 pacientes asistidos con ECMO por insuficiencia cardíaca, encontraron una incidencia de infección en el 49%.
ConclusionesLos resultados con ECMO demuestran que es un medio eficaz de soporte cardiopulmonar cuando el tratamiento convencional fracasa. Las ventajas de este tipo de asistencia pueden resumirse en:
- –
Inicio rápido mediante canulación periférica: se consigue abortar con celeridad el desarrollo del fracaso multiorgánico que presentan estos pacientes, evitando que progrese a una fase de irreversibilidad. Además, es una técnica poco agresiva, por lo que es mejor tolerada en estos pacientes críticos. Por otra parte, al no necesitar toracotomía, permite continuar con las medidas de resucitación cardiopulmonar en los pacientes con parada cardíaca.
- –
Proporciona soporte pulmonar, univentricular o biventricular.
- –
En pacientes que no pueden ser desconectados de una asistencia V-A ECMO, debido a que la lesión miocárdica no es recuperable en un corto plazo de tiempo, se ha mostrado eficaz como puente a VA D 12–14 o como puente a TC9.
- –
Representa la única posibilidad de tratamiento en pacientes en lista de espera de TP como puente al TP.
- –
Es mucho más económico que otros dispositivos de asistencia ventricular.