La hipertensión pulmonar tromboembólica crónica se considera el único tipo de hipertensión pulmonar con un tratamiento quirúrgico potencialmente curativo. Aun hoy está infradiagnosticada o con frecuencia diagnosticada tardíamente, comportando un empeoramiento del pronóstico. La hipertensión pulmonar tromboembólica crónica se presenta con síntomas poco específicos y los médicos de atención primaria pueden no ser conscientes de su presencia o del potencial tratamiento. El tratamiento médico actual es, en el mejor de los casos, paliativo. La endarterectomía pulmonar ofrece la única posibilidad de mejora sintomática y pronóstica, siendo curativa en la mayoría de los casos a corto y a largo plazo. Por lo tanto, no solo la identificación de la enfermedad puede ser difícil y tardía sino que incluso después de que el diagnóstico se haya establecido, la evaluación de la operabilidad puede ser un reto. La operabilidad se basa en la estimación preoperatoria de la clasificación quirúrgica y de la probable resistencia vascular pulmonar postoperatoria, las cuales determinan el riesgo de la intervención y el posible resultado. Este complejo procedimiento que va desde la caracterización de la enfermedad a la intervención quirúrgica pasando por todo el proceso decisional, requiere una colaboración multidisciplinar de expertos en hipertensión pulmonar, con un equipo quirúrgico dedicado a este campo y con protocolos bien precisos. En nuestro centro, hemos construido un equipo especializado que incluye radiólogos, cardiólogos, cirujanos cardiacos, anestesistas/intensivistas y fisioterapeutas, que no solo ha permitido obtener resultados quirúrgicos comparables a centros europeos de más alto volumen, sino que también ha permitido desarrollar e implementar otras opciones terapéuticas como la angioplastia pulmonar con balón, dedicadas a los pacientes de alto riesgo descartados para la cirugía.
En el siguiente artículo presentamos una revisión sobre la actualidad en este campo y al mismo tiempo ponemos de ejemplo nuestra experiencia como centro en la gestión de la hipertensión pulmonar tromboembólica crónica a través de un equipo multidisciplinar especializado.
Chronic thromboembolic pulmonary hypertension is considered the only type of pulmonary hypertension with a potentially curative surgical treatment. Even today it is under-diagnosed or often diagnosed late with a worsening of the prognosis. Chronic thromboembolic pulmonary hypertension presents with nonspecific symptoms and general practitioners may not be aware of the condition or potential for treatment. Current medical treatment is, at best, palliative. Pulmonary endarterectomy offers the only possibility of symptomatic and prognostic improvement, being curative in most cases in the short and long term. Not only the identification of the pathology can be difficult and delayed, moreover after the diagnosis has been established, the estimation of operability can be challenging. The operability is based on the preoperative estimation of postoperative surgical classification and probable pulmonary vascular resistance, which determine the risk of intervention and the probable outcome. This complex procedure that includes, characterization of the pathology, the surgical intervention going through the whole decision process requires a multidisciplinary collaboration of experts in pulmonary hypertension, with a dedicated surgical team, and with very precise protocols. At our center, we have built a team of dedicated specialists including radiologists, cardiologists, cardiac surgeons, anesthesiologists and physiotherapists. Together, not only we have been able to obtain surgical results comparable to higher European centers, but also, to develop and implement other therapeutic options such as pulmonary angioplasty with balloon, dedicated to patients at high risk and discarded for surgery.
In the present paper, we present a review of the pathology and, as an example, our single center experience with a multidisciplinary and dedicated management of chronic thromboembolic pulmonary hypertension patients, specifically diagnosis, pulmonary endarterectomy indication, protocols and results.
La hipertensión pulmonar tromboembólica crónica (HPTEC) es una complicación infrecuente de la tromboembolia pulmonar aguda y se asocia a una severa morbimortalidad1. En Estados Unidos, se ha estimado una incidencia del 0,1-0,5%, basándose en el número de casos diagnosticados como HPTEC y relacionados a un índice anual de pacientes supervivientes al evento agudo de embolia pulmonar (EP)2,3. La aparente baja incidencia de desarrollo de HPTEC, posterior a uno o más episodios de EP, ha sido un tema siempre muy discutido y aun hoy muy controvertido. Pengo et al.4informaron de una incidencia acumulativa del 1; 3,1 y 3,8% a 6, 12 y 24 meses del evento agudo, en ausencia de una progresión sucesiva.
Múltiples estudios prospectivos, publicados entre el 2006 y el 2010, hacen referencia a una incidencia de HPTEC que varia del 0,6 al 1,3%, reflejando probablemente la incidencia real de esta enfermedad5–8.
Además, en un reciente trabajo, Delcroix et al. determinan algunos datos epidemiológicos que dan una idea de la dimensión del problema. La HPTEC representa al menos el 19% de los pacientes actualmente derivados a los centros especializados en hipertensión pulmonar (HP). La incidencia de HPTEC se aproxima a 5 casos por millón de habitantes por año y su prevalencia podría alcanzar casi los 40 casos por millón de habitantes9.
La HPTEC no es solamente un fenómeno infrecuente posterior a una EP diagnosticada y tratada, al contrario, son pocos los pacientes afectados de HPTEC que refieren un episodio precedente de EP. Se estima que menos del 40% de los pacientes presentan en su historia clínica un episodio de EP aguda6 y esto hace más difícil el diagnóstico diferencial. Este fenómeno se justifica por la paucisintomatología o en ocasiones ausencia total de síntomas durante el proceso agudo, en aquellos casos en los que los fragmentos tromboembólicos son de pequeño calibre, en número limitado y que tienden a obstruir ramos arteriales distales. Otro motivo que explicaría la ausencia en anamnesis del antecedente del episodio agudo es la trombosis recurrente «in situ», de vasos distales, en aquellos pacientes con cuadros trombofílicos, paraneoplásicos o en general predispuestos por condiciones patológicas.
Fisiopatología y patogénesisLa HPTEC está caracterizada por la organización fibrótica intravascular del coágulo residual. Este coágulo teóricamente proviene del sistema venoso, después de uno o repetidos eventos embólicos agudos. También la trombosis intraluminal «in situ» y no la embolia, como ya se ha mencionado previamente, puede ser el evento agudo. A su vez, un primer evento embólico, y la sucesiva transformación fibrótica, comporta un estado protrombótico endovascular, dada la pérdida de las características protectoras del endotelio, promoviendo así la trombosis local repetida. En términos anatómicos el resultado inicial es una reducción del diámetro de la luz de los vasos debido a la presencia de bridas fibróticas intraluminales, y/o la obstrucción completa, dando lugar a un aumento de la presión pulmonar. La intensidad de los síntomas es, en primer lugar, directamente proporcional al número de arterias involucradas en el proceso y al grado de obstrucción, que conlleva un aumento de la poscarga del ventrículo derecho. En aquellos casos en los que el proceso agudo no provoque un fracaso del ventrículo derecho y el «espacio muerto» no sea tal para dar síntomas respiratorios, el paciente puede incluso no referir ningún tipo de malestar. De todos modos, también en los casos de pacientes que presentan síntomas típicos de la EP, superado el primer episodio refieren bienestar y ausencia de síntomas. Se trata de un lapso de tiempo no claramente definido, que puede variar de meses a años. Durante este intervalo de tiempo se asiste a la recanalización de las arterias con transformación fibrótica del trombo, que se adhiere firmemente a la pared vascular. Simultáneamente, sobreviene una remodelación inicialmente funcional (vasoconstricción) y sucesivamente estructural (hipertrofia) de las pequeñas arterias sanas no involucradas en el proceso inicial. La vasoconstricción de las «arterias sanas» es un mecanismo de compensación, que permite regular el hiperaflujo de sangre a los territorios pulmonares sanos. La vasoconstricción prolongada da lugar a un fenómeno similar a lo que ocurre en el árbol venular y arteriolar poscapilar en la HP secundaria a insuficiencia ventricular izquierda. Se dan lugar cambios en la arquitectura histológica de la pared de las arterias, con hipertrofia muscular de la túnica media e hiperplasia intimal. Todos estos cambios implican también alteraciones en la liberación de sustancias autorreguladoras como el óxido nítrico o la endotelina contribuyendo a su vez al proceso. La arteriopatía secundaria de la microcirculación pulmonar es por lo tanto muy similar a las más clásicas formas de HP y que pueden alcanzar un estado de irreversibilidad10,11. Este comportamiento doble, es decir, el aumento de presión secundaria al remodelado del trombo fibrótico y a la reducción del calibre (componente anatómico) y el remodelado compensatorio de los pequeños vasos sanos (componente funcional o «cambios vasculares secundarios»), es el motivo por el cual esta enfermedad se considera «de doble compartimento»: dual vascular disorder. Se ha teorizado que este fenómeno ocurre en un 10-30% de los paciente y probablemente aumenta con el tiempo si no se realiza la cirugía. Aunque la enfermedad vascular pulmonar concomitante predice un resultado adverso12,13, no se han identificado mecanismos biológicos ni indicadores que puedan predecir el grado de compromiso vascular y de reversibilidad. La desproporción entre la gravedad y el nivel de oclusión de los vasos respecto al grado de HP pueden ser indicadores, pero aun hoy, no se ha demostrado. La mayor incidencia de HP residual o recurrente en pacientes con condiciones médicas asociadas a la HPTEC indica que en estos la arteriopatía pulmonar es más grave14. La nueva visión y los conocimientos fisiopatológicos de la HPTEC han condicionado la rutina de la práctica clínica. El tratamiento principal sigue siendo la endarterectomía pulmonar (EAP), aunque algunos casos podrían no ser idóneos, por un predominio de la enfermedad vascular secundaria en el cuadro de hipertensión y por una irreversibilidad de la misma, dos aspectos aun hoy difíciles de identificar.
La patogénesis de la HPTEC es todavía en gran parte desconocida. La prevalencia de trombofilia hereditaria (deficiencias de antitrombina, proteína C o proteína S, o mutaciones de los factores ii y v) no es significativamente mayor comparado con otros tipos de HP, como la HP idiopática, o incluso en individuos sanos15,16. Anticuerpos antifosfolípidos se detectan en el 21% de los pacientes y se han observado niveles elevados de factor viii en el 41% de los pacientes con HPTEC.
Múltiples investigaciones17-19 han documentado que los pacientes afectados por HPTEC presentan de manera constante una resistencia a la fibrinólisis mediada por plasmina. Esta anormalidad también se ha encontrado en la HP idiopática y en algunas formas de HP adquirida. La molécula de fibrina o la misma arquitectura en general del coágulo de fibrina presenta, probablemente, un anomalía estructural que la hace resistente a la lisis. La exposición prolongada a fibrina o fragmentos de la misma estimula la adhesión de plaquetas y la proliferación de células endoteliales, fibroblastos y células del músculo liso arterial pulmonar, indicando de este modo un papel potencial en el remodelado vascular y la angiogénesis. Por lo tanto, la visión tradicional de la trombosis como un problema plasmático de formación de coágulos es reemplazada por la idea de que el núcleo de la trombosis es el proceso de reparación vascular que conlleva. Los trombos venosos se resuelven por organización y recanalización, posiblemente de manera similar y se asemejan a la formación de tejido de granulación durante la cicatrización de heridas.
La identificación de los factores de riesgo clínicos para HPTEC ha arrojado nueva luz sobre los mecanismos moleculares subyacentes a la persistencia del trombo y su transformación fibrosa. Ciertas observaciones clínicas como la frecuente presentación de HPTEC en los paciente con derivaciones arteriovenosas, esplenectomizados17 o portadores de accesos venosos permanentes, y marcapasos ha estimulado la investigación experimental. Las infecciones en estos pacientes son frecuentes. Staphylococcus aureus o epidermidis son responsables de hasta la mitad de estas infecciones de los dispositivos. Se ha observado que la mayoría de los pacientes con HPTEC con estos tipos de dispositivos tenían antecedentes de infección. El ADN estafilocócico se ha encontrado en especímenes de EAP de este tipo de paciente.
Otros datos interesantes son que la HPTEC es más común en pacientes con grupos sanguíneos A, B y AB. En un estudio, el 77% de los pacientes con HPTEC tenían grupo sanguíneo no-O comparado con el 58% de los pacientes con HAP (p=0,003)17.
Los pacientes oncológicos tienen un mayor riesgo de eventos tromboembólicos, como resultado de distintos mecanismos, que incluyen la activación de los sistemas fibrinolítico y de coagulación, inflamación y producción de citocinas.
Presentación clínica, diagnóstico y selección del paciente candidato a endarterectomía pulmonarLa presentación clínica de HPTEC es poco específica, con disnea de esfuerzo progresiva, palpitaciones, hemoptisis, síncope y, cuando sobreviene la insuficiencia cardiaca derecha, dilatación de las venas del cuello y edemas en miembros inferiores. La HPTEC se define la como la combinación de estos 3 factores:≥3 meses de anticoagulación efectiva y una presión arterial pulmonar media (PAPm)>25mmHg con una presión capilar pulmonar≤15mmHg, y al menos un defecto de perfusión (segmentario). Algunos pacientes sufren de enfermedad pulmonar tromboembólica crónica sintomática sin HP en reposo, y también pueden beneficiarse deEAP20,21 siendo esto aun un argumento muy controvertido.
La evaluación de la operabilidad en pacientes con HPTEC es crucial ya que la cirugía puede ser potencialmente curativa. Este tipo de valoración debe ser realizada por un equipo de expertos multidisciplinar, incluyendo neumólogos, cardiólogos, radiólogos y cirujanos. Tal vez el factor más importante en la determinación de un candidato adecuado se basa en la correlación de gravedad de HP frente al grado y la extensión de la obstrucción. Al igual que cualquier otro procedimiento quirúrgico, los factores individuales del paciente, incluidas la comorbilidad y el nivel de expectativas de los beneficios a largo plazo, son cruciales en el proceso de toma de decisiones.
Como regla general, a los pacientes sintomáticos se les debe ofrecer la cirugía independientemente del grado de hipertensión o de disfunción del ventrículo derecho, a pesar de que estos parámetros se relacionan directamente con un grado correspondiente de enfermedad obstructiva y de gravedad de la enfermedad. Aunque ni el valor de la resistencia vascular pulmonar (RVP) ni el grado de disfunción del ventrículo derecho excluirían al paciente de la consideración quirúrgica, la EAP y la atención postoperatoria se hacen más difíciles. Generalmente, si la enfermedad envuelve las ramas principales, lobares o incluso proximal de las arterias pulmonares segmentarias, el desmonte quirúrgico por endarterectomía es factible. La enfermedad segmentaria y subsegmentaria distal es mucho más difícil de eliminar y, en algunos centros, puede suponer la inoperabilidad del paciente, de ahí la necesidad de predecir en el preoperatorio el nivel de obstrucción y la clase de espécimen postoperatorio (Clasificacion di Jamieson e UCSD)22,23. Esta previsión teórica requiere un análisis atento y profundo de la angiografía pulmonar y de la tomografía axial computarizada con contraste. Estas imágenes deberían ser analizadas comparando unas con otras, en todas la proyecciones y en todos los planos (axial, coronal y sagital). Aun así, la decisión final sobre la factibilidad y la accesibilidad quirúrgica no deja de ser extremadamente subjetiva y requiere gran experiencia.
Obviamente, es estrictamente necesario conocer el grado de HP, razonando en términos de resistencias pulmonares (datos obtenidos con el cateterismo derecho) y también de compromiso de la función ventricular derecha, con el ecocardiograma.
Otros factores que harán de la EAP un desafío, debido al riesgo potencialmente aumentado de enfermedad «distal» y de recurrencia, son los pacientes con factores de riesgo como lo catéteres de acceso venoso, o marcapasos y pacientes que se han sometido a esplenectomía. Sin embargo, ninguna de estas son contraindicaciones absolutas para la cirugía. Tampoco la edad por sí sola es una contraindicación, ya que los estudios han indicado beneficios sostenidos en pacientes mayores de 70 y 80 años de edad24,25.
Como ocurre en la praxis general del cirujano y colaboradores, es fundamental sopesar, no solo el riesgo quirúrgico, el riesgo de recurrencia o la persistencia de HP, sino también la probabilidad de mejoría de los síntomas y de la calidad de vida después de la EAP. Así pues, hay que plantearse la idoneidad de la cirugía en aquellos pacientes con graves enfermedades asociadas, como la enfermedad pulmonar terminal o una neoplasia maligna limitante de la vida, que no solo presentan un riesgo perioperatorio considerable, sino que también es poco probable que puedan disfrutar de los beneficios que se lograrían con la EAP.
Aun así, gracias al aumento progresivo de la experiencia y a la reducción de las tasas de mortalidad perioperatoria, los equipos quirúrgicos de HPTEC se han mostrado dispuestos a operar casos cada vez más complejos26–28.
Por otro lado, casi opuesto, se ha observado que algunos pacientes con oclusiones vasculares crónicas significativas pero hemodinámica pulmonar casi normal en reposo son encuadrables en la HPTEC, y por lo tanto, son elegibles para EAP. Algunos de estos individuos tienen una PAPm que es superior a la observada en la población sana, pero por debajo del umbral de definición de HPTEC29. Actualmente, falta una terminología adecuada para esta fracción de pacientes y el termino «HPTEC» es inapropiado. El grupo de Cambridge ha utilizado el término enfermedad tromboembólica crónica (CTED); otros pueden utilizar el término «enfermedad vascular pulmonar tromboembólica crónica»20. La CTED completamente unilateral es rara, aunque puede ocurrir; sin embargo, la mayoría de los pacientes tienen enfermedad bilateral, que puede ser mayor (operable) en un lado y menor (inoperable) en el otro. Se ha publicado una serie de 42 pacientes con CTED sometidos a EAP29 en la que no hubo mortalidad intrahospitalaria y los pacientes experimentaron una clara mejoría de los síntomas, así como de la clase funcional y de la calidad de vida. Esto indica que los pacientes seleccionados con CTED pueden beneficiarse del tratamiento quirúrgico. Es obviamente muy importante que los riesgos de la cirugía se sopesen previamente y que el paciente esté informado de los mismos. Incluso si un paciente no tiene síntomas, la restauración de la perfusión a un pulmón completamente ocluido puede ser beneficiosa (por ejemplo, eliminando los riesgos para el paciente de la pérdida repentina de la función del pulmón restante). Además la restitución de perfusión en estos pulmones permite prevenir cambios parenquimales crónicos, cicatrices y vasculopatía secundaria. Sin embargo, como expresa el mismo grupo de Cambridge, no se sabe si esta estrategia impide el desarrollo de HPTEC o si son 2 entidades separadas.
Intervención de endarterectomía pulmonarClasificación quirúrgica de la hipertensión pulmonar tromboembólica crónicaUno de los aspectos más complejos de la HPTEC es la toma de decisiones terapéuticas. Para proponer la intervención de EAP es absolutamente necesario hacer una previsión, con la angiografía y la tomografía axial computarizada, de a qué nivel del árbol arterial pulmonar se origina el trombo fibrótico. Cuanto más distal se presenta, más difícil es la extracción del trombo. El grupo de expertos de la Universidad de California ha propuesto recientemente una clasificación quirúrgica (UCSD Clasification)22. Proponen 4 niveles de enfermedad pulmonar oclusiva relacionada con el trombo organizado. El nivel 0 (cero) corresponde con ausencia de CTED. El nivel i indica que el material obstructivo y el plano de disección afectan a una de las principales arterias pulmonares. En caso de obstrucción completa de una de las arterias principales se añade la letra «C» (es decir, nivel IC); esta distinción es importante dadas las diferencias técnicas en la endarterectomía requerida en este contexto. En el nivel ii el tejido fibroso comienza en las ramas lobares o más allá del despegue de la arteria del lóbulo superior. El nivel iii presenta una situación quirúrgica más difícil en la que la enfermedad es distal y comienza en la ramas segmentarias, donde la enfermedad oclusiva puede no ser evidente. El plano de endarterectomía debe ser cuidadosamente analizado en cada rama segmentaria. El nivel iv es el cuadro anatómico más desafiante ya que la endarterectomía puede ser bastante difícil a este nivel (ramas segmentarias distales o incluso subsegmentarias) y se requiere una amplia experiencia quirúrgica para lograr resultados óptimos.
Técnica quirúrgicaLa intervención de EAP requiere un equipo de profesionales especializados y entrenados no solo en la gestión intraoperatoria sino también en los cuidados intensivos en el postoperatorio.
Por regla general, la EAP sigue 4 principios básicos: (1) La endarterectomía debe ser bilateral y, por lo tanto, realizarse mediante un abordaje en esternotomía media; (2) la visualización perfecta es esencial y se realiza a través del bypass cardiopulmonar con periodos de parada circulatoria en hipotermia profunda (acrónimo inglés DHCA: Deep Hypothermic Circulatory Arrest) a aproximadamente 20°C; (3) la identificación del plano de disección correcto es crucial; y (4) una endarterectomía completa es esencial20.
Después de la esternotomía media y la pericardiotomía, se inicia el bypass cardiopulmonar completo con una cánula en aorta ascendente y 2 cánulas venosas en sendas cavas. Se aconseja introducir la cánula de la cava superior a través de la orejuela derecha. Posicionar la cánula directamente en la cava superior no es aconsejable ya que puede impedir la correcta exposición del ramo pulmonar derecho. Se introducen también, 2 cánulas de drenaje del ventrículo izquierdo y del árbol pulmonar, a través de la vena superior derecha y del tronco principal de la arteria pulmonar respectivamente. Una vez iniciada la circulación extracorpórea, se procede al enfriamiento sistémico del paciente, de manera progresiva, manteniendo un mínimo gradiente térmico entre la región superior y la inferior del cuerpo. Las temperaturas nasofaríngea y vesical/rectal tienen que estar constantemente monitorizadas. El objetivo de temperatura antes de proceder con la parada circulatoria son los 20 grados de temperatura nasofaríngea. En general, es fácil que entre la 2 temperaturas haya un gradiente de unos 2 grados, por lo cual, para obtener una temperatura de cerca 20 grados en la región inferior del cuerpo, hay que reducir ulteriormente la temperatura nasofaríngea a unos 19 grados. A medida que se reduce la temperatura corporal el ventrículo entrará en fibrilación. En estas condiciones, si los ventrículos están completamente vaciados y distendidos, el miocardio está protegido. Aun así preferimos completar la protección con la cardioplejía: poco antes de alcanzar la temperatura de hipotermia procedemos con el pinzamiento de la aorta y la cardioplejía en la aorta ascendente. En nuestro centro utilizamos la cardioplejía cristaloide Custodiol o Brechtneider modificada. Se trata de un cardioplejía intracelular, con bajas dosis de sodio y de potasio, enriquecida con ketoglutarato, histidina y triptofano como características principales30. La dosis de esta cardioplejía suele ser muy abundante considerando que se calculan unos 25ml/kg del paciente. De este modo, un paciente de unos 75kg necesita una dosis teórica de 1.875ml de cardioplejía. Esto supone una importante dilución del paciente, con lo cual se puede proceder a la extracción del líquido en exceso con el hemofiltro y/o como lo realiza nuestro equipo la aspiración retrógrada a través de la aurícula derecha, previa atriotomía derecha. Una vez concluida la dosis de cardioplejía se puede controlar el estado del tabique interauricular. En el caso de foramen permeable, tendemos a suturarlo, salvo en aquellos raros casos en los que consideramos que la completa oclusión de este pueda ser contraproducente para la función de un ventrículo derecho extremamente comprometido. Inicialmente, es más conveniente para el cirujano estar de pie en el lado izquierdo del paciente y realizar la endarterectomía en el lado derecho. Durante la fase de enfriamiento se puede también continuar con la exposición del ramo derecho de la arteria pulmonar, con un separador Ritcharson con las puntas protegidas. La cava superior tiene que estar perfectamente controlada y movilizada. Con la punta del bisturí se realiza la arteriotomía longitudinal que se puede extender a «Y» a nivel de la bifurcación, hacia el ramo lobar superior y el inferior. Con 2 puntos de suspensión se mantiene la abertura de la arteria. Se procede entonces con la identificación del plano de clivaje. No siempre es suficientemente espeso como idealmente el cirujano desearía, así que hay que despegar la túnica intima, circularmente y con extrema delicadeza. Sucesivamente con un disector y con un aspirador específico que permite succionar y disecar, se continúa despegando este plano hacia los distintos ramos donde progresivamente la íntima aumenta de espesor, volviéndose francamente fibrótica. Ya en esta fase, cuando se empieza a extender la disección hacia los ramos segmentarlos de los distintos lóbulos es absolutamente necesario proceder con la parada circulatoria, hiperoxigenando el paciente previamente. Interrumpida la circulación sistémica, los pulmones se vacían completamente mediante hiperventilación manual. Una vez asegurados de que el flujo retrógrado bronquial está completamente ausente o es insignificante se continúa con la endarterectomía, traccionando delicadamente del espécimen fibrótico y despegándolo, manteniendo siempre el correcto plano de clivaje, hasta los diferentes ramos incluso subsegmentarios.
Las fases de parada, cuando superan los 20min de duración, deben ser intercaladas con fases de perfusión sistémica hipotérmica. De todos modos cuando la fase inicial de la endarterectomía (es decir la arteriotomía, la identificación del plano etc.) se realizan aun en perfusión, raramente se necesitan más de 20min de parada por cada lado para finalizar la endarterectomía. Una vez concluido el procedimiento en el pulmón derecho, se reconstruye la arteriotomía del ramo pulmonar. Sucesivamente, y del mismo modo descrito para el lado derecho, se procede con la endarterectomía izquierda.
Previamente hemos descrito nuestra técnica de protección miocárdica. Por lo que respecta a la protección cerebral y sistémica, la hipotermia profunda es ya de por sí un optimo método de protección. De todos modos, se ha demostrado en múltiples y consistentes trabajos, sobre todo de la cirugía del arco aórtico, que la probabilidad de daño orgánico (especialmente cerebral) es directamente proporcional a la duración de periodo de parada. De ahí la necesidad de intercalar periodos de parada con periodos de reperfusión durante la EAP. En nuestro centro tenemos una fuerte tradición con el uso de la hipotermia moderada (25-26 grados) asociada a perfusión cerebral anterógrada selectiva para la cirugía aórtica, habiendo demostrado los beneficios de evitar la hipotermia profunda a 20 grados31. Por esta razón, al principio de nuestra experiencia en EAP hemos intentado evitar la hipotermia profunda y la parada, manteniendo la temperatura a 25 grados y los parámetros de perfusión sistémica normales, en particular la saturación de oxigeno venosa mixta (>65%). En hipotermia moderada y siguiendo estos parámetros, el flujo de la circulación extracorpórea se puede reducir a tal nivel (incluso a menos de un litro al minuto) que para el operador, en términos de flujo retrógrado, es como trabajar en parada con el territorio quirúrgico prácticamente exangüe32,33. La desventaja de esta técnica es que en algunos casos, sobre todo aquellos pacientes que presentan una marcada hipertrofia de las arterias bronquiales, el campo quirúrgico no es suficientemente exangüe impidiendo de este modo una correcta endarterectomía. En estos casos, cuando ya se ha demostrado que a 25 grados es imposible continuar correctamente con el procedimiento, para alcanzar la hipotermia profunda era necesario aumentar de nuevo el flujo de bomba a flujo nominal. Durante es fase, era imposible ejecutar alguna maniobra quirúrgica, aumentando de manera significativa los tiempos de bomba y de parada cardiopléjica. Por este motivo y para mantenernos en línea con los mayores expertos en EAP, hemos decidido recurrir directamente a la hipotermia profunda con parada, como previamente se ha descrito.
Esta decisión fue también reforzada por los resultados obtenidos en un ensayo clínico, el PEACOG (PEA and COGnition)34 que investigó los beneficios en la perfusión cerebral comparando la perfusión cerebral selectiva y la hipotermia profunda durante EAP en términos de función cognitiva a 3 y 12 meses. El estudio no mostró diferencias entre las 2 técnicas, lo que indica que la EAP en parada en hipotermia profunda a 20°C proporciona resultados excelentes y reproducibles. No obstante los resultado del registro indican que un mayor tiempo de paro circulatorio puede estar asociado con complicaciones neurológicas35.
El manejo postoperatorio es tan importante, si no más, como el procedimiento de por sí. La gestión del equilibrio hídrico, control de electrólitos, del gasto cardiaco como de las resistencias sistémicas periféricas, y la anticoagulación son algunos de los aspectos fundamentales que requieren ajustes muy delicados. Una descripción detallada de los protocolos postoperatorios requeriría otro complejo e interesantísimo capitulo.
Resultados de endarterectomía pulmonarResultados hemodinámicos y funcionalesLa hemodinámica postoperatoria se vuelve normal o casi normal en la mayoría de los pacientes después de la EAP. Desde las bases de datos de la Universidad de California, San Diego (UCSD, CA, EE.UU.) y registros HPTEC internacionales, se han experimentado mejoras de RVP 700-800din/s/cm-5 a 250din/s/cm-5 después de la cirugía26,32, o sea una caída del ∼65%. Otros parámetros que mejoran notablemente después de EAP incluyen PAPm (de 46 a 26mmHg) y la mediana del test del camino de 6min (de 362 a 459m). La mayor parte de los pacientes experimentan un cambio significativo de la capacidad funcional (NYHA Class), así como mejoras en otras medidas de la capacidad de ejercicio, como el protocolo de Bruce, y la calidad de vida en general. Son constantes la remodelación inversa del ventrículo derecho, con mejoría estructural y funcional. Las mejoras hemodinámicas son prácticamente inmediatas, mientras que, dependiendo de sus mecanismos, las mejoras estructurales y funcionales pueden tardar más22,24,34-36.
En el inmediato periodo posquirúrgico los problemas que se pueden evidenciar son: 1) persistencia de HP, 2) hemorragia parenquimal, 3) el fracaso del ventrículo derecho, y 4) y la insuficiencia respiratoria. La principal causa de HP residual es seguramente la presencia de vasculopatía secundaria e irreversible asociada al edema de reperfusión. Otros motivos podrían ser la extracción incompleta del trombo o la extracción del trombo con un plano de clivaje demasiado superficial. Estas 2 causas son bastante infrecuentes, ya que se sabe que aunque una EAP no sea perfectamente completa, la liberación de al menos un 70% de los vasos permite obtener una respuesta hemodinámica. Además, en manos expertas, el plano de clivaje es evidente. Aun así y en manos expertas, la lesión de la pared de los vasos, sobre todo distales, cuando se extraen las «colas» del trombo, puede favorecer la hemorragia parenquimal que si es severa puede ser letal. El fracaso grave del ventrículo derecho es un fenómeno relativamente raro pero que hay que tenerlo siempre en mente cuando se afronta la intervención de EAP ya que en algunos casos conlleva la implantación de ECMO. En general el ventrículo derecho de los pacientes con HPTEC es hipertrófico y está acostumbrado. La cinética normalmente está deprimida en grado variable, pero una vez reducida la poscarga, la contractilidad del ventrículo derecho mejora rápida y visiblemente. En algunos casos de enfermedad muy avanzada, el miocardio ventricular puede presentar lesiones irreversibles con sustitución fibrótica, como resultado del desequilibrio de perfusión coronaria en un ventrículo derecho severamente hipertrófico y con una tensión parietal desproporcionada. Este fenómeno, si ocurre, lo hace en casos gravísimos de HP, con probable enfermedad vascular secundaria y enfermedad de larga duración. Si a eso sumamos el largo periodo de parada cardiopléjica, es comprensible que en algunos casos el ventrículo derecho no esté en grado de proporcionar una precarga suficiente al ventrículo izquierdo. En estos casos el bajo gasto es evidente y la interrupción de la circulación extracorpórea se hace imposible. En estas situaciones es necesario implantar la asistencia con ECMO, veno-arterial con acceso femoro-femoral. La insuficiencia respiratoria en términos gas-analíticos raramente supone por si sola una indicación a ECMO. En general, acompaña a los fenómenos previamente descritos. En los raros casos de hipoxemia aislada una ECMO veno-venosa puede ser suficiente. Las ventajas y desventajas así como las particularidades técnicas de una u otra modalidad son argumentos de otro capítulo más específico.
Mortalidad aguda y sus predictoresLos resultados de la EAP pueden variar dependiendo de varios factores, incluyendo la cronicidad de la enfermedad, la experiencia del equipo HPTEC, la RVP preoperatoria, la capacidad de ejercicio, la clase funcional de la NYHA del paciente, las comorbilidades y la distribución de la enfermedad. En los centros de alto volumen, la mortalidad intrahospitalaria es ahora<5%, habiendo mejorado con el tiempo35. Se han reportado tasas de mortalidad más altas, aunque se han identificado algunos factores contribuyentes; por ejemplo, una RVP preoperatoria más alta puede aumentar la mortalidad. En el centro de UCSD, el 4,1% de los pacientes con RVP preoperatoria>1.000din/s/cm-5 (unas 12,5 unidades Wood, WU) falleció, mientras que solo el 1,6% que tenía una RVP<1.000din/s/cm-5 falleció22. Los datos del registro internacional de la HPTEC mostraron una mortalidad intrahospitalaria aproximadamente 3 veces mayor en aquellos con RVP>1.200din/s/cm-5 al diagnóstico en comparación con RVP 400-800din/s/cm-5. Sin embargo, es importante enfatizar que aquellos con RVP alta también tienen más que ganar de la cirugía EAP, ya que tienen la mayor mejoría hemodinámica y el mejor beneficio pronóstico. Tienen un riesgo particularmente elevado los pacientes con RVP>1.200din/s/cm-5 (15WU) con una mala función ventricular derecha y una enfermedad más distal en la imagen preoperatoria. Estos pacientes deben ser intervenidos en centros experimentados20. De hecho, este aspecto, o sea la experiencia del centro, es un factor relevante que condiciona evidentemente los resultados. El consenso internacional entre expertos es que la cirugía de EAP se debe realizar en un centro con experiencia, con la sugerencia de que debe haber un centro por cada 40-50 millones de personas realizando un número consistente de casos al año y con≥5 años de experiencia27.
En un reciente registro internacional europeo prospectivo y multicéntrico (27 centros), que ha incluido 679 pacientes afectados de HPTEC, se han comparado los resultados entre pacientes operados y no operados. En el grupo de paciente sometidos a EAP (total 404 pacientes), las características preoperatorias que aumentaron la mortalidad fueron insuficiencia renal dependiente de diálisis, tratamiento farmacológico con vasodilatadores pulmonares como terapia puente y la necesidad de procedimientos cardiacos adicionales. Las complicaciones operatorias y la HP postoperatoria residual influyeron negativamente en la mortalidad. En contraste, una mayor PAPm preoperatoria y un historial de TEV aguda se asociaron con menor mortalidad35.
Según el análisis multivariable, la terapia puente con fármacos dirigidos a la HP, en casi un tercio de los pacientes operados, aumentó el riesgo de muerte. Las posibles explicaciones son: (1) retraso de la EAP debido al inicio de la terapia médica, (2) los posibles efectos de las terapias dirigidas a la HP sobre las propiedades del material tromboembólico crónico que hacen que la cirugía sea más difícil37, (3) lo más importante, la naturaleza estrictamente observacional del registro con terapia médica comenzó con más frecuencia en pacientes con hemodinámica más severa. En cualquier caso, los datos registrados tienden a desalentar el uso de la terapia puente en pacientes operables.
Los supervivientes eran 8 años más jóvenes, menos frecuentemente en clase NYHA IV, y consiguieron caminar una distancia más larga en el 6MWT (350 frente a 290m), menor presión auricular derecha (8 frente a 12mmHg) y RVP (710 versus 844 dinas/cm-5), y un índice cardiaco más alto (2,2 frente a 2L/min-1/m-2). En el postoperatorio la última medida de RVP fue inferior (241 versus 289din/cm-5) y solo el 14% y el 8% de los pacientes presentaron HP postoperatoria y edema de reperfusión respecto al 37% y al 20% respectivamente de los paciente no supervivientes. El tratamiento médico con vasodilatadores dirigido contra la HP en cualquier momento se inició con menor frecuencia (34% frente a 51%).
La supervivencia estimada a uno, 2 y 3 años fue mayor en el grupo operado, respectivamente, 93, 91 y 89% respectivamente.
Experiencia de centroNuestro centro de cirugía cardiovascular del Hospital Sant’Orsola nace en el 1974, siendo un referente italiano y europeo en la cirugía de la aorta y también en el trasplante cardiaco. Gracias a la estrecha colaboración con el Prof. N. Galié, máximo experto mundial de HP, nace la necesidad de ofrecer la EAP a los paciente con HPTEC. En el 2003, una vez establecido un protocolo local gracias a experiencias en centros de referencia como el centro de San Diego, se inicia el programa de EAP. Desde el 2003 hasta el momento actual, se han realizado 145 procedimientos de EAP. En 49 casos la operación se realizó sin parada circulatoria y con el manejo de la circulación extracorpórea en hipotermia moderada como previamente he descrito en la técnica quirúrgica. En el resto de los casos se procedió con la parada a 20 grados de temperatura. El tiempo medio de parada para la EAP bilateral fue de 26,1+18min. El número de periodos de parada fueron uno o 2 en el 43,5 y el 24,8% respectivamente. Solo en el 10% de los casos fue necesario un número superior a 3 periodos.
En un 80% de los casos se observó una inmediata reducción del 36% de los valores de HP preoperatorios que superó el 50% en las 24h sucesivas. En un 32% de los casos se evidenció incluso una completa normalización de los valores de presión pulmonar, antes de la suspensión de la monitorización invasiva.
En un 12% de los casos fue necesario implantar un sistema de asistencia (ECMO periférica femoro-femoral) en el postoperatorio inmediato por persistencia de HP y/o fracaso del ventrículo derecho. En el análisis retrospectivo, hemos documentado cómo precisamente la mayor parte de estos pacientes experimentaban una reducción netamente inferior de los valores de presión pulmonar y resistencias vasculares en el postoperatorio (0,5% respecto al 36% del resto de la población). En el análisis de este grupo se evidenció cómo la mayor parte de estos pacientes presentaban un cuadro de HP más grave a pesar de ser tratados con doble terapia de vasodilatadores pulmonar (inhibidor de la fosfodiesterasa-5 y el antagonista de la endotelina-1), lo que ya de por sí podría ser un indicador de la gravedad de la enfermedad y de la severidad de la vasculopatía.
A este respecto, es decir, el uso de vasodilatadores preoperatorios, (tema muy discutido por algunos expertos), nosotros no hemos observado diferencias en términos de calidad del espécimen quirúrgico o dificultad técnica en la extirpación del trombo fibrótico. Al contrario, el tratamiento preparatorio nos permite apreciar qué grado de reversibilidad tiene la vasculopatía concomitante, tipo test de Reversibilidad Farmacológica. Por otro lado, la reducción del grado de HP permite llevar al paciente a la intervención con un menor grado de disfunción del ventrículo derecho y probablemente reducir el grado de edema de reperfusión. De ahí que los pacientes que necesitaron de ECMO postoperatoria fuesen pacientes con una menor respuesta al tratamiento médico preoperatorio y como consecuencia presentaran una menor respuesta también a la intervención. Obviamente, los pacientes que necesitaron asistencia postoperatoria presentaron una mortalidad mayor del 33%.
Los resultados en términos de mortalidad, una vez superada la curva de aprendizaje, son estacionarios a menos del 5% en los últimos años, aunque la mortalidad global es del 9,7%. Las causa principal de exitus fueron fallo cardiaco, insuficiencia pulmonar y complicaciones infecciosas. En nuestra población, los factores predictivos de mortalidad en el análisis multivariante resultaron ser el bajo gasto cardiaco preoperatorio, la COPD de tipo restrictivo y la duración de tiempo de parada hipotérmica.
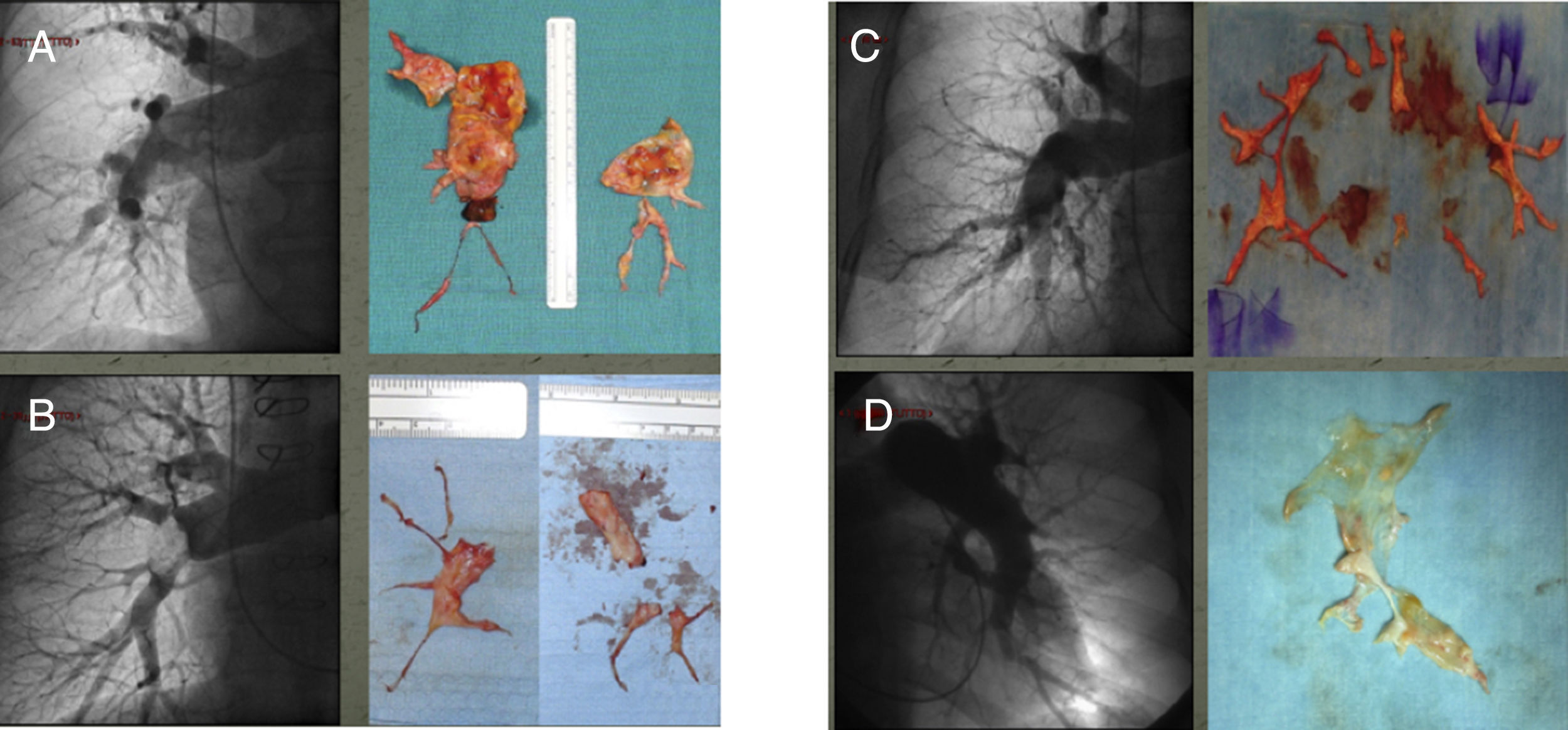
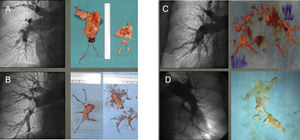
Hemos observado que nuestra población de EAP presentó cuadros extremamente heterogéneos en término de datos hemodinámicos y anatómicos. De hecho hemos distinguido 4 tipo de pacientes: por un lado, aquellos con anatomía favorable (lesiones proximales: ramos principales o lobares y segmentarios proximales o clasificación de Jamieson I y II) con HP menos grave (dando como valor limite las 12 unidades Wood de RVP) (grupo i) y con HP grave (grupo ii), y por otro lado, pacientes con anatomía distal (Jamieson III y IV), y con HP<12 RVP (grupo iii) e HP>12 (grupo iv) (fig. 1).
En esta imagen presentamos la comparación que hemos llevado a cabo, simultáneamente a la EAP entre muestra quirúrgica e imagen de la angiografía pulmonar preoperatoria. En la imagen A, es evidente la casi obstrucción completa del ramo pulmonar principal. En la imagen B, es evidente la presencia de material al origen del ramo del lóbulo inferior derecho. En ambos casos, A y B, la anatomía se considera absolutamente favorable a la cirugía y la correspondencia entre la imagen angiográfica y el espécimen anatómico es evidente. En los casos C y D la imagen angiográfica pone en evidencia una clara reducción del calibre de los vasos distales con una marcada pobreza de vasos subpleurales, signo indirecto de vasculopatía de la microcirculación. También en estos casos existe correspondencia entre la angiografia, el resultado quirúrgico, como en le caso D, y la escasa probabilidad de respuesta hemodinámica.
A pesar de ser todos los casos encuadrables en HPTEC, esta subdivisión en clases, relacionando anatomía y grado de HP, podría facilitar el proceso de toma de decisiones, proporcionando una estimación del riesgo y del grado de respuesta a la intervención. A pesar de que en nuestro análisis no hemos podido demostrar diferencias significativas entre los 4 grupos, sea por la dimensión de la muestra, sea por el carácter retrospectivo del análisis, hemos documentado algunos datos interesantes y de algún modo intuitivos. Por ejemplo, los pacientes del grupo i son los pacientes que han tenido una mejor respuesta no solo en el postoperatorio, sino también a largo plazo. Los pacientes del grupo ii, a pesar de tener una anatomía favorable han tenido una peor respuesta, con una menor reducción de la HP y necesitando de manera más significativa la ECMO postoperatoria. Cosa sorprendente pero que podría interpretarse como que la asociación entre la severa e irreversible vasculopatía periférica junto a la inexorable edema de reperfusión postoperatoria, comporta la persistencia de HP, el fracaso del ventrículo derecho y en consecuencia la necesidad de ECMO.
En el resto de los grupos hemos observado un impacto hemodinámico menos evidente o ausente en los grupos iii y iv respectivamente. En el grupo iv no se ha observado una mayor incidencia de complicaciones, reflejando que la extracción de menor material fibrótico no solo tiene poco impacto a nivel hemodinámico, sino también provoca menor edema de reperfusión, dejando prácticamente al paciente en las mismas condiciones preoperatorias. Lo que hemos aprendido de nuestra experiencia es que estos pacientes (el grupo iv) no deben ser propuestos para la cirugía sino más bien para angioplastia pulmonar con balón (PBA), tratamiento recientemente introducido en nuestro centro. Por lo que respecta el grupo ii, el tratamiento EAP debe ser y sigue siendo el tratamiento primario. Es necesario prever en estos pacientes una gestión postoperatoria más compleja. Es además fundamental poseer de experiencia en la gestión de ECMO. Seguramente, el paciente ideal es el que pertenece al grupo i, y donde probablemente se podrían encuadrar aquellos pacientes afectados de enfermedad tromboembólica crónica (CTEVD), aunque este es un argumento aun extremadamente controvertido.
Los resultados a distancia han demostrado estabilidad de los resultados con un 65,7% de pacientes con valores normalizados. Todos los pacientes operados de EAP continúan con tratamiento anticoagulante a largo plazo. Menos del 7% de los pacientes necesitan tratamiento vasodilatador. En 2 casos ha sido necesario someter a los pacientes a una segunda EAP a distancia de 6 y 5 años por recurrencia de la HPTEC. Ambos casos presentaban una síndrome lupus anticoagulante.
Estamos de acuerdo con los máximos expertos en que los centros especializados tienen que ejecutar un número consistente de procedimientos anuales. Aun así, en nuestro centro hemos asistido a una reducción anual de casos, como consecuencia de una superselección de paciente, reduciendo el número de procedimiento EAP en casos extremos en términos anatómicos y hemodinámicos. Este fenómeno se ha acentuado en los últimos años como consecuencia del desarrollo de una óptima alternativa terapéutica que es la PBA. A pesar de la reducción numérica, los años de experiencia del equipo y los conocimientos adquiridos, permiten tratar estos pacientes con la intervención EAP con resultados en términos hemodinámicos y de mortalidad comparables a centros de mayor volumen.
Nuevas alternativas terapéuticas en la hipertensión pulmonar tromboembólica crónicaCon la aparición de la PBA, la clasificación de los pacientes como «operables» o «inoperables» puede ser menos relevante. Quizás es más apropiado considerar los pacientes candidatos para la cirugía (EAP), la terapia intervencionista /percutánea (PBA) o la no invasiva (médica), pudiendo recibir en el curso de su enfermedad 2 de estas estrategias o las 3.
La experiencia inicial con tratamiento combinado EAP y PBA en casos altamente seleccionados ha sido descrita ya en literatura38,39. Esto se puede aplicar como PBA planificada intraoperatoria durante EAP, PBA de rescate agudo después de fracaso de EAP o PBA para la HP residual o recurrente meses o años después de EAP. La PBA como puente a EAP es una estrategia que no ha sido hasta el momento reportada por ningún centro, ya que se teoriza que la PBA puede cambiar la consistencia del trombo fibrótico y la calidad de la pared vascular, aumentando no solo la complejidad de una sucesiva EAP, sino también la probabilidad de lesión parietal y riesgo de hemorragia parenquimal.
En nuestro centro se están llevando varios casos de PBA de manera rutinaria desde el año 2015. La mayoría de los paciente tratados son pacientes descartados para EAP, aunque en algunos casos son pacientes previamente sometidos a EAP con HP residual y vasos distales patológicos. En general los pacientes presentan mejorías clínicas y hemodinámicas perceptibles ya en la primera sesión de PBA, pero habitualmente es un tratamiento que requiere varias sesiones, ya que tratar demasiadas ramas simultáneamente predispone excesivamente al edema de reperfusión observado en estos paciente. Los resultados de este tipo de tratamiento serán publicados en poco tiempo cuando alcancen un número consistente.
ConclusionesLa HPTEC es una enfermedad considerada rara, a pesar de que no hay datos claros sobre la incidencia y prevalencia real de esta enfermedad. Son múltiples los factores de riesgo conocidos así como las enfermedades predisponentes, pero aun así, en la mayoría de los casos estos no están presentes, haciendo más difícil el diagnóstico.
En cuanto al tratamiento, hay varias líneas del abordaje de la HPTEC que están aún en evolución, ya que hay 3 opciones terapéuticas disponibles y algunas áreas necesitan ser refinadas y aclaradas. Sin embargo, para los pacientes con HPTEC que se consideran operables, el mensaje es claro: no hay mejor tratamiento que una EAP bilateral completa llevada a cabo por un equipo experimentado de HPTEC y por eso sigue siendo el tratamiento de elección para pacientes operables con HPTEC.
De todos modos, para que un paciente afectado de HPTEC pueda ser candidato a EAP, debe tener suficiente material tromboembólico y ser accesible quirúrgicamente, con una RVP proporcional que indica la ausencia o mínima presencia de vasculopatía secundaria.
Siendo una enfermedad quirúrgica rara, es necesario que los centros especializados sean numéricamente limitados para poder así adquirir una experiencia que garantice buenos resultados. La colaboración entre los distintos expertos es absolutamente fundamental durante todo el proceso, desde el diagnóstico, a la valoración de operabilidad, el tratamiento quirúrgico de por sí, la gestión de la circulación extracorpórea, al manejo anestesiológico y de cuidado intensivos. Nuestra experiencia de centro y nuestro resultados reflejan claramente este fenómeno.
La HPTEC, así como sus distintas modalidades terapéuticas requieren investigación continua para poder proporcionar así respuestas a tantos aspectos aun por conocer.
Conflicto de interesesLos autores certifican la completa ausencia de conflicto de intereses o de cualquier tipo de financiación.
La autora (SMS) agradece con afecto la colaboración del Dr. Luís López Almodóvar.