El tratamiento transcatéter de la estenosis aórtica severa se encuentra en continua evolución desde que se describió por Cribier por primera vez en 2002. Se han estandarizado la vía transfemoral retrógrada y la vía transapical, y con la mejora de los dispositivos, se está empleando cada vez con más frecuencia la vía transaórtica. Esta vía puede suponer muchas ventajas para el tratamiento de los pacientes con un alto riesgo quirúrgico y rechazados para los otros abordajes. Nuestro grupo comenzó a emplearla a finales del 2013 y se ha convertido en la vía preferida por delante de la transapical. En este artículo describimos nuestra técnica transaórtica paso a paso, sus ventajas e inconvenientes.
Transcatheter treatment of severe aortic stenosis has progressively evolved from since the first implant in humans performed by Cribier in 2002. The use of retrograde transfemoral and transapical accesses have been well standardised. With the technical improvements introduced into the devices, the trans-aortic route has increasingly been used. This new approach may have many advantages for the treatment of inoperable or high-risk patients. Our group started to use this technique in 2013, and it has become the preferred procedure for us, instead of the transapical approach. In this article, a step by step description is presented of our trans-aortic technique and its main advantages and disadvantages.
La era del TAVI comienza a despegar en 2002 cuando Cribier et al.1 implantan la primera prótesis transcatéter en un paciente rechazado para la cirugía convencional. La vía elegida fue la transeptal venosa, técnica complicada y muy poco reproducible. Posteriormente, se describió la vía transfemoral arterial retrógrada2,3 tanto para las prótesis expandibles con balón, como para las autoexpandibles, siendo la vía que más se emplea actualmente a nivel mundial. En esa misma fecha se describió la vía transapical4 que, aunque sea discutida y no compartida como procedimiento de primera elección por los principales grupos que realizan TAVI, es a día de hoy la alternativa a la vía transfemoral en casos de mal acceso arterial fémoro-ilíaco.
La vía transaórtica (Tao) fue descrita posteriormente en pacientes aislados5,6, que tenían difícil acceso periférico y contraindicación para la vía apical (aneurisma de ápex o disfunción ventricular severa). Se describió tanto para las válvulas autoexpandibles como para las expandibles con balón. Se usó el introductor Ascendra-2 (Edwards Lifesciences, Irvine-California, EE. UU.) para tal fin, aunque dicho sistema de liberación estaba diseñado para la vía transapical y no para la vía Tao. Posteriormente, Bapat y Attia describieron la técnica7 y se populariza en 2013, sobre todo a partir de la introducción del sistema de liberación Ascendra+. Dicho sistema presentaba una nariz aguda que permitía cruzar retrógradamente la válvula aórtica sin dificultad y estaba indicado tanto para la vía apical como aórtica. Nosotros comenzamos el empleo de esta técnica a finales del 2013 tras la introducción del sistema Ascendra+ y con el nuevo sistema Certitude de la Sapiens 3. Este procedimiento ha pasado a ser nuestra técnica de primera elección por delante de la vía apical.
Estudio de imagen preoperatorioUna vez elegido el paciente para TAVI no femoral, tras la discusión por el equipo multidisciplinar («Heart Team»), comienza el proceso de la planificación previa, que es tan importante como la ejecución del propio procedimiento el día de la cirugía. El análisis de la TC previa nos permite establecer varios objetivos. Pensamos que es importante que el cirujano se familiarice con su interpretación y no delegue en otros especialistas, ya que nadie como el que lleva a cabo el procedimiento es capaz de buscar y estudiar lo que realmente es relevante.
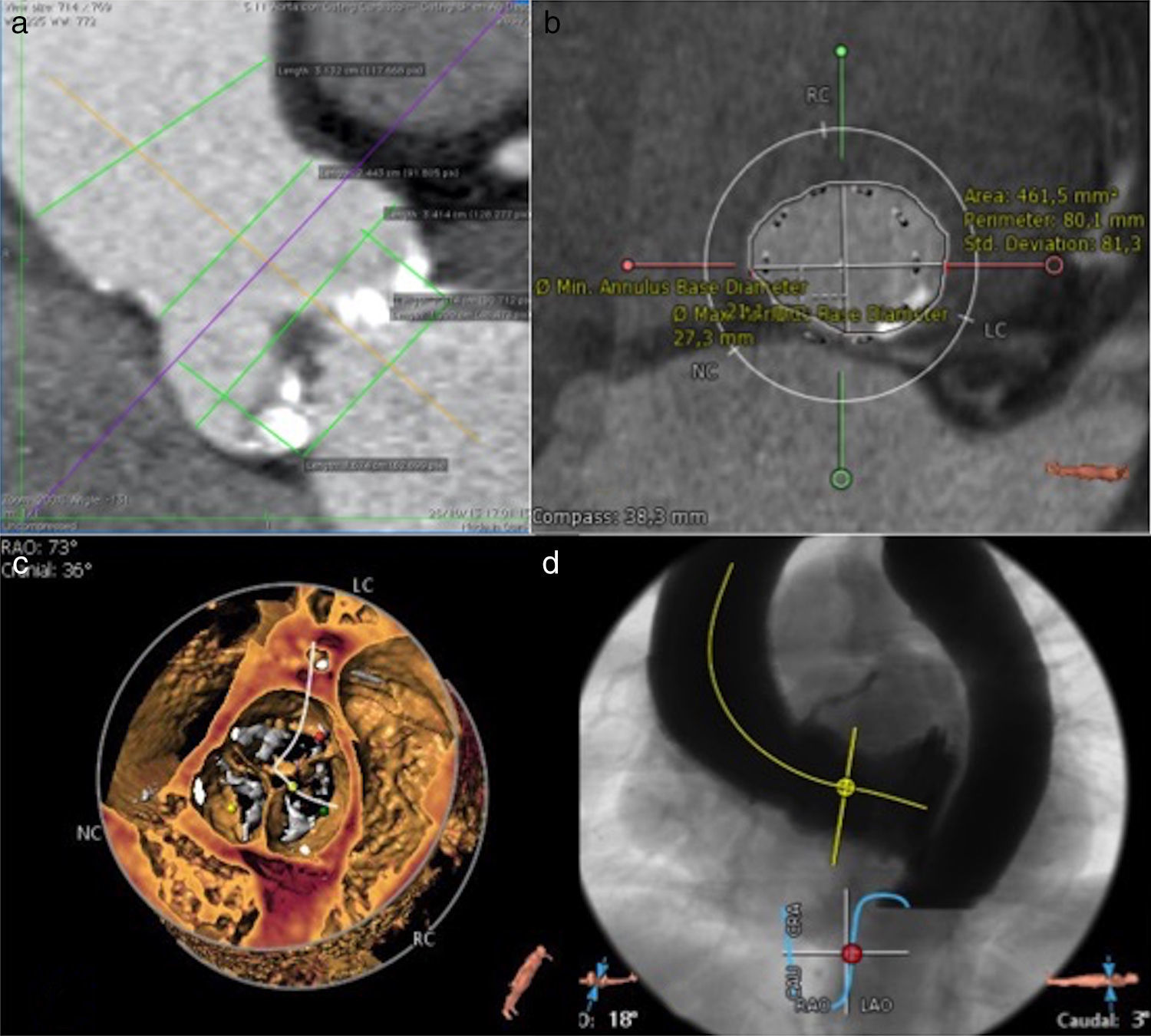
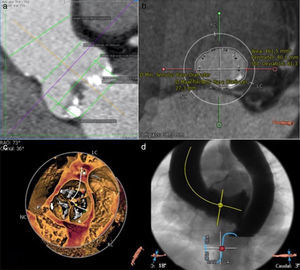
En primer lugar, se analizan la raíz aórtica, el diámetro mínimo y máximo a nivel de los senos de Valsalva, la unión sinotubular y la aorta ascendente, el área del anillo y la altura de los ostia coronarios. La elección de la prótesis a implantar se realiza fundamentalmente con las medidas que se obtienen del área del anillo aórtico. Uno de los programas empleados nos permite implantar virtualmente una prótesis, observar las relaciones de la misma con el anillo, los senos y los ostia coronarios, y así saber de antemano el tamaño y tipo de prótesis a seleccionar y sus potenciales complicaciones. Realizamos un estudio del volumen de la raíz aórtica para evaluar los velos aórticos, su grado de calcificación y el orificio valvular aórtico. Además valoramos el ángulo más adecuado que debe tener el equipo radiológico en el quirófano para la implantación de la prótesis (fig. 1).
Imágenes radiológicas preoperatorias. a) Imagen del análisis de la raíz aórtica con todas las medidas que se obtienen. b) Imagen de reconstrucción del anillo aórtico, donde se obtiene su área y además se observa una prótesis virtual implantada, algo que nos ayuda a mostrar la idoneidad de la prótesis elegida y sus relaciones con las estructuras vecinas. c) Imagen de renderizado de volumen a nivel de velos que nos muestra las calcificaciones y nos orienta para cruzar la válvula de manera más segura durante el implante. d) El ángulo que debe tener el aparato de rayos durante el implante calculado con la TC.
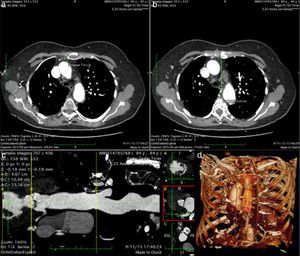
Por otro lado, estudiamos la viabilidad del implante transaórtico. Para ello se precisa una porción de la aorta ascendente próxima al arco aórtico libre de calcificaciones y de una longitud mínima de 5,5cm para las prótesis Sapiens 3 de 23 y 26mm, y 6cm para la prótesis de 29mm. Además, estudiamos la profundidad y las relaciones de la aorta respecto a la línea media del tórax. Según Bapat, si la aorta está muy a la derecha y a menos de 6cm de profundidad, se prefiere la toracotomía a la miniesternotomía. Nosotros hemos usado la miniesternotomía en todos los casos, incluso en pacientes con una aorta muy alejada de la línea media y prácticamente horizontal, con unos buenos resultados (fig. 2).
Otras imágenes del estudio preoperatorio. a) Corte sagital que muestra el sitio teórico de punción, su profundidad y su relación con el esternón. b) La aorta se encuentra completamente a la derecha en este caso, a pesar de eso se ha realizado el implante mediante esternotomía sin problemas. c) Estudio de aorta ascendente para medir la distancia entre anillo aórtico y el sitio de punción. d) Renderizado de volumen que nos ayuda a planificar la cirugía ya que nos muestra las relaciones del sitio de punción con las estructuras vecinas.
En nuestra experiencia, el procedimiento se realiza en el quirófano de cirugía cardíaca por 2 cirujanos cardiovasculares. El equipo radiológico usado es un arco móvil válido para uso vascular y cardíaco. Se emplea anestesia general, se canalizan las vías venosas central y periférica, y se procede a la monitorización arterial invasiva. Se utiliza catéter epidural cervical para controlar el dolor postoperatorio. El empleo de la ecocardiografía transesofágica es fundamental para la monitorización del procedimiento y la valoración de los resultados y las posibles complicaciones. Se dispone el campo quirúrgico dejando preparadas las 2 regiones inguinales y el tórax de forma completa por si se necesita reconvertir el procedimiento a una cirugía convencional. Igualmente el perfusionista debe estar alerta y la bomba de extracorpórea preparada por si se precisa su empleo en caso de alguna eventualidad. Se organiza la disposición del quirófano de tal modo que toda la zona derecha quede libre para la cirugía, así como la cabecera del paciente.
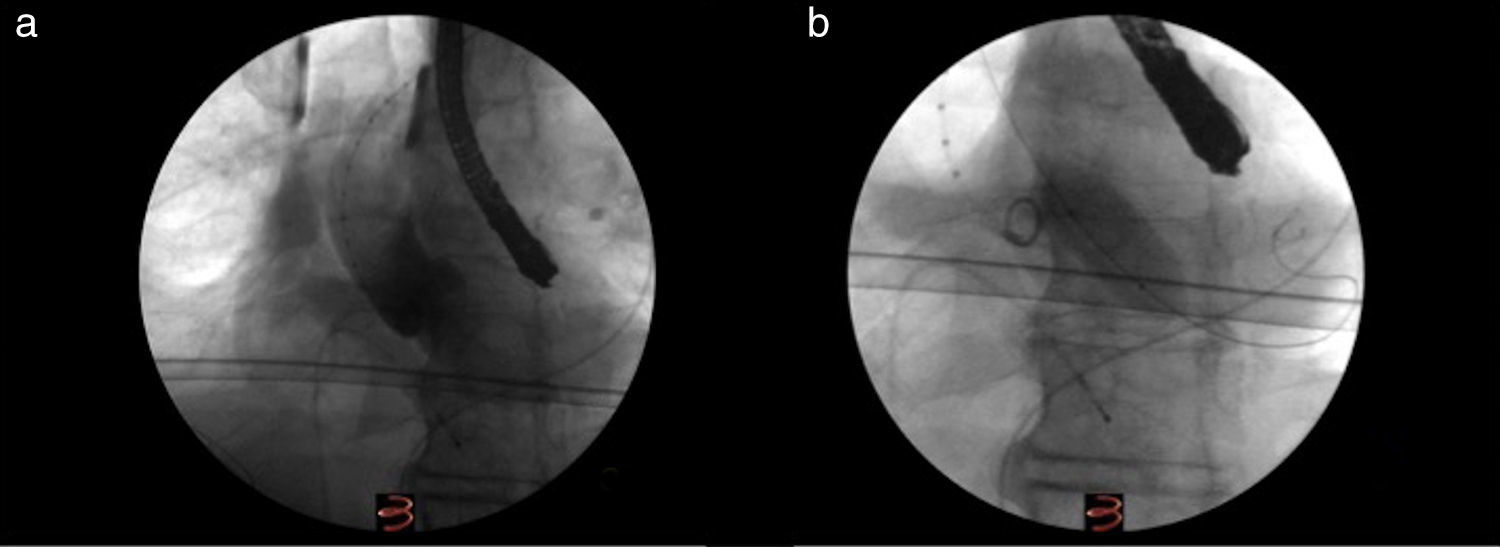
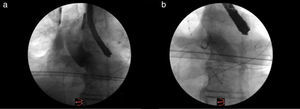
Técnica quirúrgicaHemos tratado de estandarizar nuestra técnica y ejecutar los pasos de manera programada para así facilitar el trabajo de todo el grupo que trabaja en el procedimiento. Se administra heparina sódica a dosis de 5.000 UI. La cirugía comienza con la introducción de un electrodo de marcapasos por la vena femoral derecha, usando un electrodo de fijación pasiva. Se comprueba el buen funcionamiento del mismo. Posteriormente, se canaliza la arteria femoral derecha y se introduce un pigtail centimetrado que ayuda a la localización del plano valvular, la realización de aortografías y a confirmar la distancia desde el punto de punción en la aorta ascendente hasta el anillo aórtico. Colocamos a continuación el sistema de radioscopia según el ángulo prefijado por la TC y comprobamos la correcta alineación de los velos mediante la realización de una aortografía (fig. 3). Generalmente, la TC nos proporciona con precisión dicho ángulo y no suele ser necesario realizar modificaciones.
Procedimiento de valvuloplastia. a) Imagen donde se observa el catéter pigtail centimetrado en la aorta hasta el plano valvular, el catéter de estimulación en el ventrículo derecho y la realización de la aortografía para comprobar el ángulo calculado previamente para el implante. b) Imagen de la realización de la valvuloplastia.
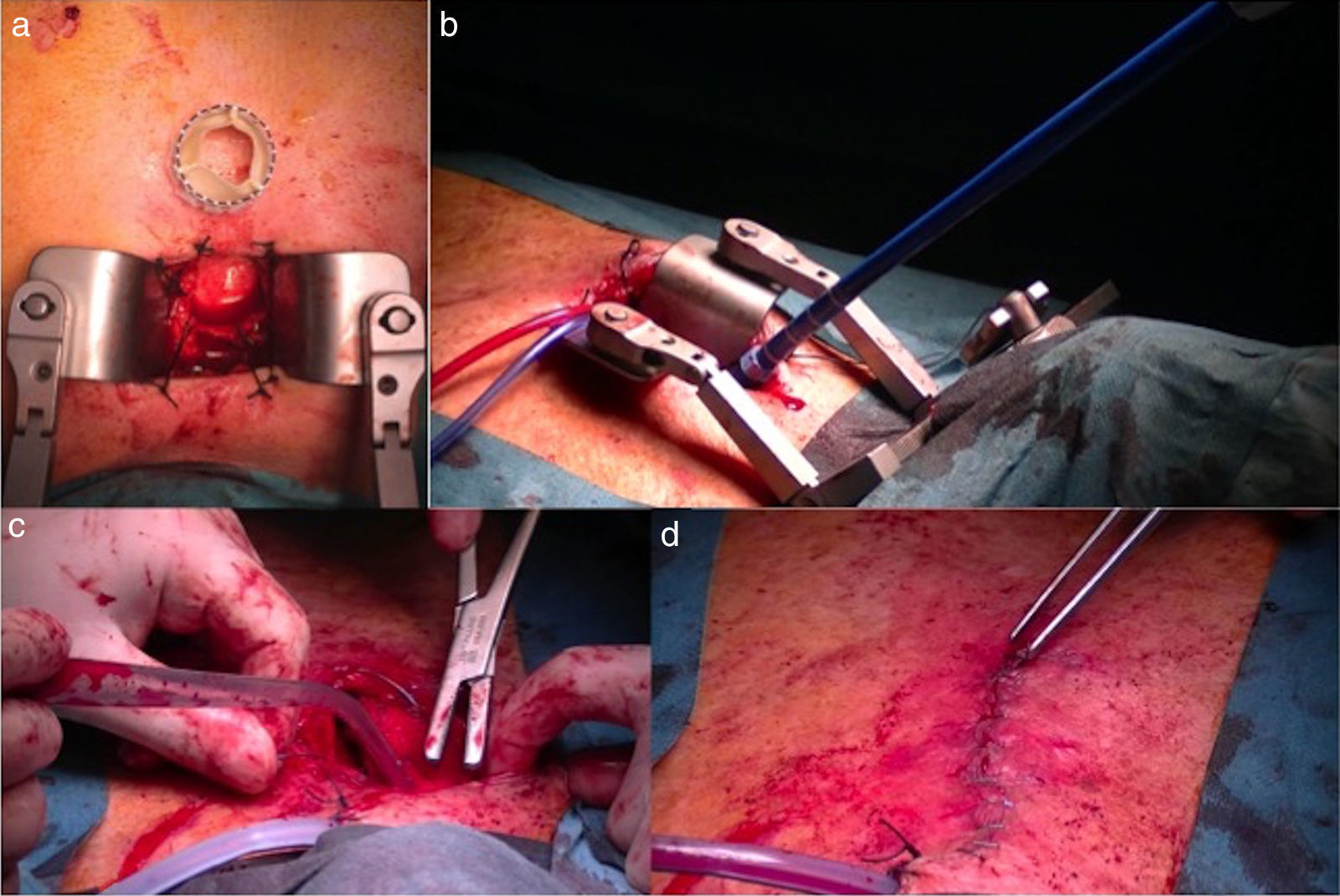
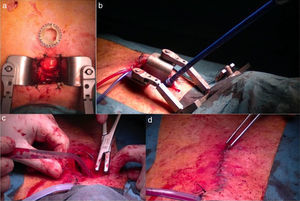
Posteriormente, realizamos una miniincisión en la piel de 4cm y con la ayuda de una sierra oscilante practicamos una miniesternotomía en J hasta el segundo espacio intercostal. Se coloca un miniseparador esternal, se abre el pericardio y se aplican puntos de tracción del mismo hacia arriba que nos faciliten la exposición de la aorta distal. Empleamos 2 suturas en bolsa de tabaco apoyadas en teflón sobre la aorta ascendente tras la palpación y la comprobación radiológica de la distancia del sitio de punción al anillo aórtico (fig. 4). Acto seguido, se practica una punción en el centro de la bolsa de tabaco y se inserta un introductor arterial de 6F. Las maniobras para cruzar retrógradamente la válvula aórtica se realizan con el empleo de una guía teflonada recta de 35’ y de 260cm de largo, siendo a veces necesario el uso de guías hidrofílicas. Se emplea el catéter Amplatz AL1 en raíces aórticas pequeñas y el Amplatz AL2 en pacientes con raíces aórticas grandes. A diferencia de lo que describen Bapat y Attia7, el empleo de los catéteres multipropósito han sido menos efectivos en nuestra experiencia, aunque útiles en algunos casos. Hemos usado en alguna ocasión el catéter Judkins R cuando nuestra intención era dirigir el mismo hacia el velo no coronario. Por este motivo, pensamos que es muy importante disponer de toda una gama de catéteres, en previsión de dificultades técnicas a la hora de cruzar la válvula aórtica. Una vez que el catéter ha cruzado la válvula aórtica, se intercambia dicha guía por una guía extrastiff. Al principio de nuestra experiencia hemos usado la guía Amplatz extrastiff, que preformábamos en el acto quirúrgico, pero ahora preferimos usar guías preformadas como la Confida, que ofrece buenos resultados. La guía preformada Safari también ha sido empleada con buenos resultados. Es importante que la guía rígida haga una curva suave y se adapte al ventrículo, siendo necesario con frecuencia usar un pigtail para su correcta colocación.
Imágenes quirúrgicas. a) Imagen de la incisión quirúrgica observe el tamaño comparado con la prótesis Sapien 3. b) Colocación del introductor Certitude en la aorta ascendente: observe el anillo colocado a la altura de 2cm que ayuda a la hemostasia e impide la introducción accidental de mayor profundidad en aorta. c) Imagen del cierre de la esternotomía parcial con un alambre doble de acero. d) Imagen de la incisión quirúrgica ya cerrada.
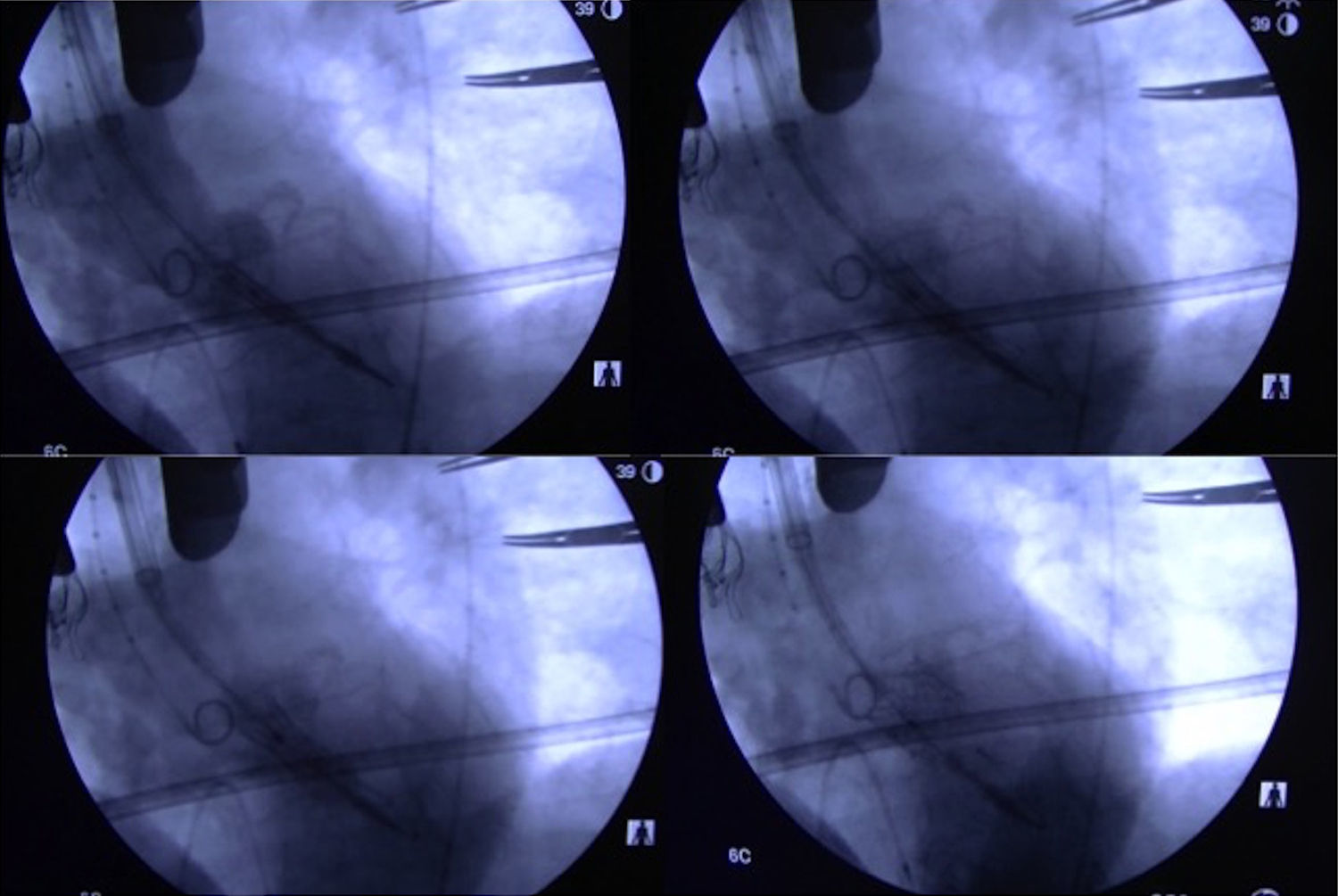
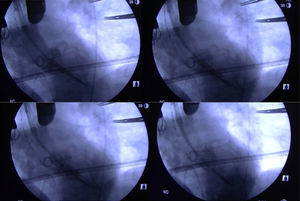
Posteriormente, se debe retirar el introductor de 6F y se coloca el introductor Certitude dentro de la aorta hasta la marca de 2cm. Es interesante emplear un tope visible en la marca de 2cm que nos ayuda a controlar la hemostasia y la cantidad de introductor que se localiza dentro de la aorta (fig. 4). Las maniobras de retirada e introducción de catéteres deben ser muy suaves y controladas, ya que, a diferencia de la vía apical, disponemos de muy poca guía dentro del ventrículo y es muy fácil su dislocación en caso de maniobras intempestivas. Se introduce el catéter balón de valvuloplastia y con previa sobreestimulación se practica la valvuloplastia (fig. 4). La retirada de dicho catéter se debe hacer con sumo cuidado, ya que en esta maniobra es muy fácil la dislocación de la guía e incluso su salida del ventrículo, lo que nos obligaría a repetir todo un repertorio de maniobras para recolocarla en el ventrículo. Posteriormente, se introduce la prótesis hasta el plano anular guiados por el pigtail. El punto del centro debe quedar un poco por encima del plano anular para minimizar el bloqueo aurículo-ventricular. Se practica sobreestimulación y tras la caída de la presión arterial se realiza una aortografía que nos permite confirmar la adecuada colocación de la prótesis. Se expande la prótesis con un inflado muy lento del balón, que nos permite pequeños reajustes en el implante en caso de ser necesario (fig. 5). Posteriormente, se comprueba con ecocardiografía el normofuncionamiento de la prótesis valvular implantada. Se retiran la guía, el catéter balón y el introductor, procediendo al anudado de las bolsas de tabaco y al cierre convencional de la esternotomía y la herida quirúrgica (fig. 4). El paciente suele ser extubado en quirófano y pasa las primeras 24 h del postoperatorio en la UCI. Generalmente, los drenajes se retiran al día siguiente por la mañana y el paciente cursa alta en la UCI pasando a la planta de hospitalización.
Ventajas e inconvenientes de la vía transaórticaLas complicaciones potenciales de la vía Tao son las mismas que las de la vía transfemoral. Se ha descrito la perforación del ventrículo izquierdo y diversas lesiones derivadas del empleo de la guía extrastiff. Estas complicaciones pueden disminuir con el empleo de guías preformadas y con una manipulación cuidadosa de la guía dentro de la cavidad ventricular. También se han descrito la perforación del ventrículo derecho y lesiones debido al catéter de estimulación, sobre todo el de fijación activa (nosotros preferimos el empleo del catéter de fijación pasiva). En nuestra experiencia, no hemos tenido ninguna de esas complicaciones. La disección es una complicación temida que se ha descrito sobre todo cuando se empleaban introductores antiguos no aptos para la vía Tao7.
Las principales ventajas de esta vía son una reducción del dolor postoperatorio, el menor sangrado y el menor derrame pleural. Este procedimiento se puede emplear en pacientes con disfunción ventricular y en caso de aneurisma apical. La esternotomía y la manipulación de la aorta ascendente son procedimientos familiares para cualquier cirujano cardiaco y las posibles complicaciones en el sitio de punción en la aorta ascendente son más fáciles de reparar que las producidas en el ápex ventricular. En caso de complicaciones, podemos convertir el abordaje de mínimo acceso y completar la esternotomía para su resolución. Este procedimiento también puede suponer una posibilidad de entrenamiento para la implantación de prótesis valvulares por otras vías de acceso arterial retrógrado, ya que se fundamentan en una técnica de implante similar.
Nuestra experienciaEste procedimiento se ha realizado en 22 pacientes cuyas características preoperatorias se describen en la tabla 1. En la tabla 2 se describen algunos datos quirúrgicos. Los resultados iniciales han sido satisfactorios con una mortalidad nula en los 30 primeros días y del 9,1% en el primer año. Ningún paciente presentó disfunción valvular, complicaciones vasculares mayores u otras complicaciones, como obstrucción coronaria, ictus o sangrado que precisara cirugía.
Características preoperatorias de los pacientes intervenidos
| Variable | Valor |
|---|---|
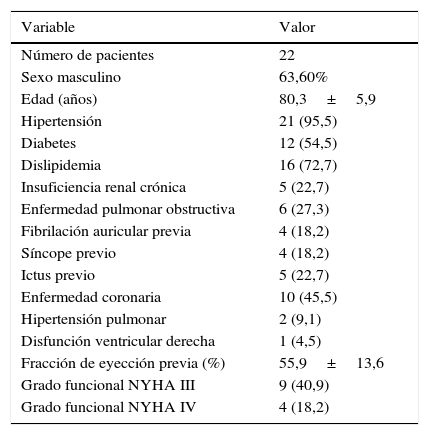
| Número de pacientes | 22 |
| Sexo masculino | 63,60% |
| Edad (años) | 80,3±5,9 |
| Hipertensión | 21 (95,5) |
| Diabetes | 12 (54,5) |
| Dislipidemia | 16 (72,7) |
| Insuficiencia renal crónica | 5 (22,7) |
| Enfermedad pulmonar obstructiva | 6 (27,3) |
| Fibrilación auricular previa | 4 (18,2) |
| Síncope previo | 4 (18,2) |
| Ictus previo | 5 (22,7) |
| Enfermedad coronaria | 10 (45,5) |
| Hipertensión pulmonar | 2 (9,1) |
| Disfunción ventricular derecha | 1 (4,5) |
| Fracción de eyección previa (%) | 55,9±13,6 |
| Grado funcional NYHA III | 9 (40,9) |
| Grado funcional NYHA IV | 4 (18,2) |
Las variables se presentan como n (%) o media±DE.
Datos quirúrgicos de los pacientes intervenidos
| Variable | Valor |
|---|---|
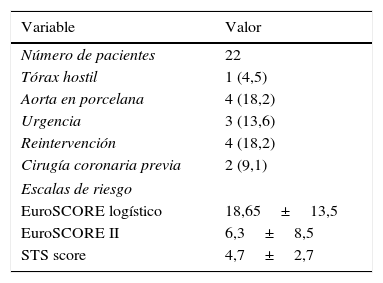
| Número de pacientes | 22 |
| Tórax hostil | 1 (4,5) |
| Aorta en porcelana | 4 (18,2) |
| Urgencia | 3 (13,6) |
| Reintervención | 4 (18,2) |
| Cirugía coronaria previa | 2 (9,1) |
| Escalas de riesgo | |
| EuroSCORE logístico | 18,65±13,5 |
| EuroSCORE II | 6,3±8,5 |
| STS score | 4,7±2,7 |
Las variables se presentan como n (%) o media±DE.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.