La coartación aórtica se define como una disminución de calibre en la aorta que se puede presentar a diferentes niveles y que da lugar a una dificultad en el flujo desde la aorta ascendente hasta la descendente. La edad de presentación en las formas más frecuentes varía desde el período neonatal hasta la edad adulta.
Aunque la forma de presentación más frecuente representa una estenosis aislada, la obstrucción puede llegar hasta la hipoplasia o incluso la interrupción del arco aórtico, asociándose a diferentes enfermedades congénitas más complejas.
Los avances en el tratamiento médico en las formas más severas, así como el desarrollo de las técnicas quirúrgicas y percutáneas, permiten en el momento actual manejar esta afección con excelentes resultados y baja morbimortalidad.
En este artículo pretendemos realizar una revisión de las definiciones actuales de este abanico de afecciones, así como de las opciones terapéuticas de las que disponemos en la actualidad.
Aortic coarctation is defined as a decrease in the caliber of the aorta which can occur at different levels, and which difficult the flow from the ascending aorta to the descending. The age of presentation in the most frequent forms varies from the neonatal period to adulthood.
Although the most frequent presentation form represents an isolated stenosis, obstruction can be reached until the hypoplasia or even interruption of the aortic arch, associating with various more complex cardiac congenital pathologies.
Advances in medical treatment in more severe forms, as well as the development of surgical and percutaneous techniques allow now to manage this condition with excellent results and low morbidity and mortality.
In this article, we intend to conduct a review of the current definitions of this range of pathologies, as well as the therapeutic options which we have today.
La coartación aórtica (CoAo) se refiere a un estrechamiento en la arteria aorta que causa una obstrucción al flujo distal a ella. Normalmente, se considera como una anomalía congénita simple. Sin embargo, aunque cuando nos referimos a coartación solemos pensar en el estrechamiento de la aorta descendente generalmente inmediatamente después de la arteria subclavia izquierda, la realidad es que frecuentemente es una patología que traduce un abanico de alteraciones anatómicas y fisiológicas que se relacionan con un desarrollo anormal del corazón izquierdo.
EmbriologíaLa etiología de la CoAo permanece sin esclarecerse completamente, existiendo diferentes teorías que pretenden explicar el desarrollo de esta malformación. Se han descrito casos familiares, así como la asociación con varias alteraciones genéticas1.
Entre las diferentes teorías que intentarían explicar esta patología, se encuentran:
- –
Una teoría hemodinámica que explicaría esta patología por las alteraciones del flujo sanguíneo a nivel del istmo aórtico durante la vida fetal2, tratando asimismo de explicar las malformaciones del tracto de salida izquierdo que se asocian con frecuencia (hipoplasia de la aorta, del VI y/o su tacto de salida, de la válvula mitral, lesiones estenóticas de la válvula aórtica…).
- –
Una teoría embriogénica que trataría de apoyar el patrón de migración cefálica anormal en el desarrollo del arco aórtico. Al considerar la embriología de la coartación, es importante revisar el desarrollo del arco aórtico y de la aorta descendente. El arco aórtico tiene ramas derivadas desde los arcos embriológicos braquiales (faríngeos) que inicialmente se desarrollan como estructuras simétricas pero que van regresando hasta alcanzar un patrón maduro. La hipoplasia, la interrupción o la coartación del arco distal entre la carótida izquierda y la subclavia izquierda son el resultado de un desarrollo anormal del segmento derivado del cuarto arco faríngeo izquierdo. La falta de migración en sentido cefálico de la arteria subclavia izquierda se originaría en el lugar de la coartación, lo que daría lugar a una retracción cuando el ductus se cierra.
- –
Y, por último, la teoría propuesta por Skoda, que se basa en el crecimiento anormal del tejido ductal dentro de la aorta3, lo que apoyaría el papel de este tejido en la forma más común: la coartación yuxtaductal. Estudios histopatológicos de la aorta a este nivel demuestran la infiltración de células musculares lisas en la zona de la coartación que darían lugar a un anillo circunferencial que determinaría el estrechamiento.
Sin embargo, ninguna de estas teorías explicaría el amplio espectro de malformaciones cardiacas asociadas.
IncidenciaLa CoAo supone entre la 5.ª y 8.ª malformación cardiaca congénita, afectando entre el 6-8% de estas cardiopatías, con una incidencia estimada de 1/2.500 nacidos vivos4. Afecta con mayor frecuencia a los varones (1,27-1,74:1)5, si bien en el caso de coartaciones que afectan a la aorta abdominal se presenta más frecuente en mujeres. En un 4-5% de los casos se asocia a arteria subclavia derecha anómala. Hasta en un 35% de los pacientes con síndrome de Turner se asocia la presencia de coartación aórtica6.
ClasificaciónLa primera clasificación realizada por Bonnet en 19037 dividía esta patología en función de la anatomía y la edad en preductal (infantil) o posductal (del adulto). Sin embargo, se desechó, ya que ambos tipos pueden encontrarse a cualquier edad.
Actualmente, de forma práctica podemos clasificar la coartación según 3 tipos de parámetros:
- –
En función de la edad en: neonatal, infantil y del adulto.
- –
Según el segmento de presentación en: yuxtaductal, ístmica y del arco transverso.
- –
Según la presencia o no de lesiones asociadas en: simple o compleja.
La CoAo simple se define como la que se presenta sin lesiones intracardiacas importantes, con o sin la persistencia del ductus asociada. Las coartaciones complejas incluyen las que presentan patologías cardiacas asociadas importantes. Normalmente, las coartaciones complejas suelen diagnosticarse más precozmente y los niños suelen estar mucho más enfermos.
La lesión más frecuentemente asociada es la válvula aórtica bicúspide que, según los autores, se describe en una proporción que varía entre el 30 y el 80%8. Los defectos septales interventriculares se observan hasta en el 55% de los pacientes. La estenosis subaórtica está presente hasta en un 25% de los casos. Otras lesiones obstructivas izquierdas se describen asociadas a la coartación aórtica, destacando la hipoplasia de cavidades izquierdas y las alteraciones del aparato valvular mitral. La estenosis mitral puede ser causada por un anillo supravalvular mitral, displasia de los velos mitrales, alteraciones del aparato subalvular, variaciones del anillo valvular mitral, válvula en paracaídas o restricciones de los márgenes libres de los velos mitrales9. La asociación de múltiples lesiones obstructivas asociadas a coartación se define como síndrome de Shone10.
Otras lesiones asociadas incluyen el defecto del septo aurículo-ventricular (AV), la D- transposición de grandes arterias (TGA) con o sin atresia tricuspídea, la doble salida de ventrículo derecho tipo Taussig-Bing y la L-TGA. La CoAo es también un importante componente del síndrome de corazón izquierdo hipoplásico.
En muchos pacientes con coartación también se hallan presentes alteraciones extracardiacas vasculares. El 13% de los pacientes diagnosticados de coartación presentan aneurismas intracraneales. Además, un 4-5% de los pacientes llevan asociada la presencia de una arteria subclavia derecha anómala que nace por debajo de la zona de coartación.
Otro tipo de anomalías extracardiacas asociadas incluyen anomalías del sistema musculoesquelético y de los sistemas genitourinario, gastrointestinal y respiratorio. Asimismo, hasta un 30% de los pacientes con síndrome de Turner pueden presentar esta patología11.
FisiopatologíaLa CoAo generalmente consiste en una estenosis de la parte superior de la aorta torácica descendente a nivel del ductus (yuxtaductal). Los cambios hemodinámicos de los pacientes portadores de esta patología van a depender de la severidad de la estenosis, así como de la presencia o no de lesiones cardiacas asociadas y su complejidad.
En el neonato, inmediatamente después del nacimiento, tras el cierre del foramen oval y del ductus arterioso, todo el gasto cardiaco debe atravesar el segmento aórtico estenótico. Por lo tanto, podemos encontrarnos un abanico de síntomas que varían entre la hipertensión sistólica hasta la insuficiencia cardiaca biventricular y shock cardiogénico.
La presencia de coartación aumenta la resistencia al flujo de salida del VI, lo cual elevaría la presión telediastólica del VI, la aorta y sus ramas. Dependiendo de la severidad de la estenosis, el gasto cardiaco y la presencia de colaterales, el gradiente de presión que se genera entre la parte proximal y distal a la obstrucción aórtica alcanza los 50-60mmHg en reposo. Entre los diferentes mecanismos de compensación, quizá el más importante es la presencia de hipertrofia ventricular izquierda, que intenta normalizar el estrés de su pared y la poscarga ventricular, intentando mantener la función sistólica en límites normales12. También puede dar como consecuencia una disfunción diastólica del VI con la consiguiente alteración de la relajación del mismo.
Manifestaciones clínicasLa presentación clínica en los pacientes con CoAo puede variar en función de la edad de presentación:
- –
La presentación en el neonato generalmente se manifiesta como una situación de extrema gravedad. Cuando el ductus se cierra, aparecen signos de insuficiencia cardiaca severa y shock cardiogénico. Un importante porcentaje de estos niños presentan coartaciones complejas. En neonatos con CoAo asociadas a CIV de gran tamaño, generalmente durante los primeros días de vida se desarrolla un fallo cardiaco agudo, con importante acidosis y shock cardiogénico. Todo ello puede derivar en fracaso multiorgánico y muerte si no se comienza rápidamente los tratamientos médico y quirúrgico adecuados. La manifestación clínica característica del paciente con coartación de aorta consiste en una discrepancia de pulsos y presión arterial sistólica entre los miembros superiores e inferiores. Los pulsos están disminuidos por debajo de la coartación, la presión arterial sistólica está aumentada en las extremidades superiores y se observa un gradiente de presión entre miembros superiores e inferiores, generalmente, mayor de 20mmHg. A la auscultación, se puede escuchar un soplo sistólico eyectivo en el borde esternal superior izquierdo y la base con irradiación al área interescapular izquierda. Dependiendo de las lesiones asociadas, pueden aparecer otros ruidos cardiacos.
- –
La sintomatología de los lactantes con CoAo generalmente es más larvada. Los síntomas más frecuentes son taquipnea y alteraciones del crecimiento. Los padres describen irritabilidad, sudoración y dificultad de la alimentación. Dependiendo de la severidad de la estenosis y de la rapidez en el desarrollo de colaterales, el tratamiento quirúrgico puede retrasarse.
- –
No resulta infrecuente diagnosticar coartaciones en niños mayores o adultos. Estas coartaciones son más frecuentemente simples y moderadas. En la historia clínica de estos pacientes, no es infrecuente la presencia de intolerancia al ejercicio e incluso fatiga similar a claudicación en las extremidades inferiores. La exploración clínica depende del desarrollo de colaterales, por lo que estos pacientes pueden estar completamente asintomáticos. El examen físico cuidadoso, sin embargo, revelará una elevación de la presión arterial en las extremidades superiores respecto a las inferiores.
- 1.
Electrocardiograma. El electrocardiograma no es específico en el neonato con coartación aórtica. Generalmente mostrará taquicardia sinusal, eje derecho e hipertrofia ventricular derecha. En niños mayores y adolescentes, se pueden observar signos de hipertrofia ventricular izquierda.
- 2.
Radiografía de tórax. Los hallazgos radiológicos en un neonato que se presenta en insuficiencia cardiaca son inespecíficos. Se observa cardiomegalia moderada o severa, con signos de hiperaflujo pulmonar y de congestión pulmonar. En niños mayores y en adultos, la radiografía de tórax suele ser normal. En otras ocasiones, se pueden observar muescas costales en el margen inferior de las costillas en su tercio medio, secundarias a la erosión producida por las arterias intercostales dilatadas.
- 3.
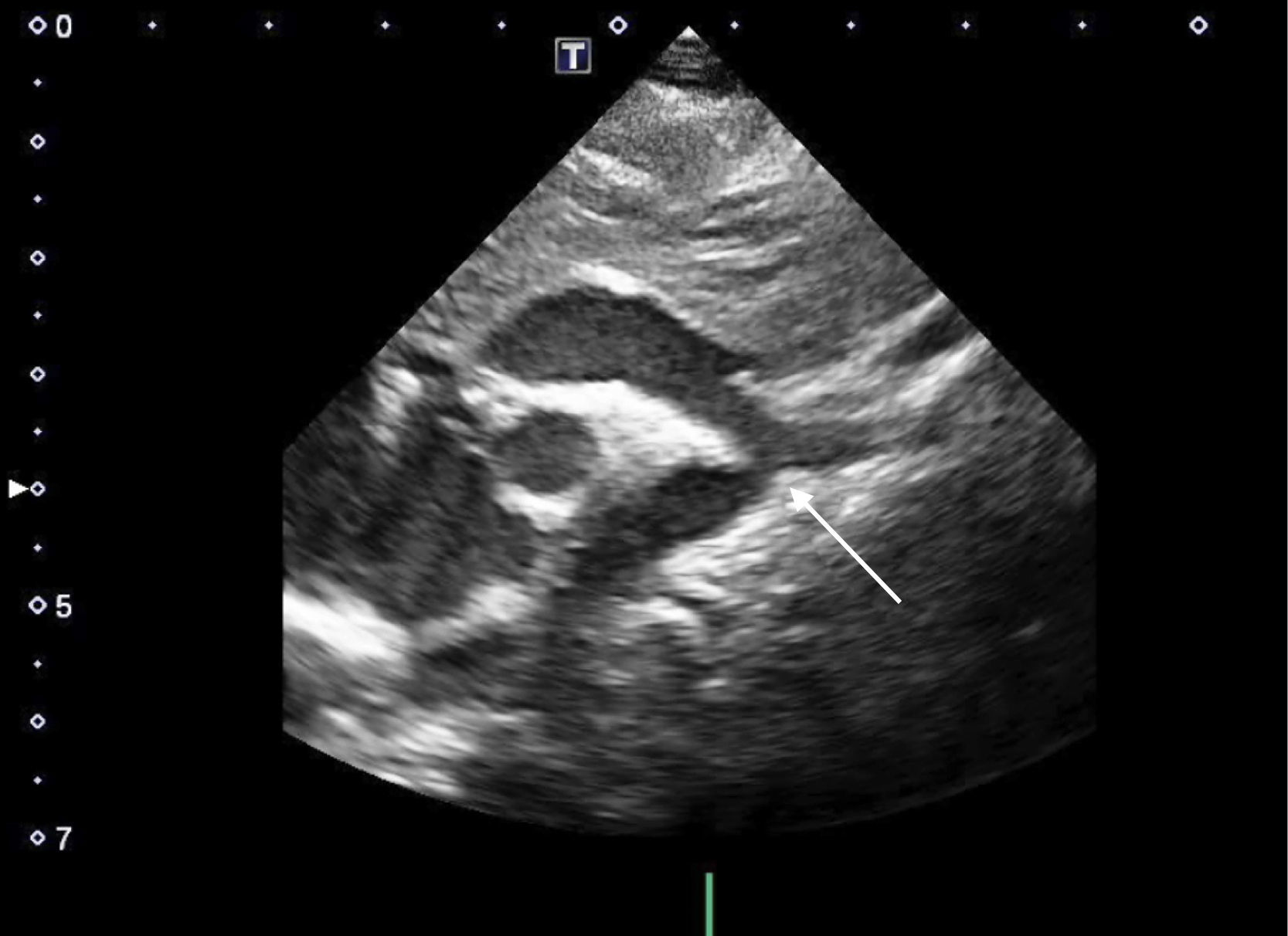
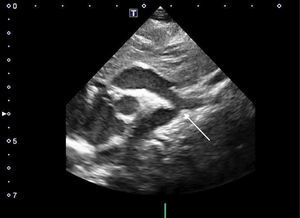
Ecocardiograma. La ecocardiografía Doppler es el método diagnóstico fundamental para la detección de la CoAo (fig. 1). En el lactante y el niño pequeño, resulta más fácil definir la severidad y los gradientes de presión en la zona afectada. Desde el plano supraesternal, la zona de la CoAo aparece como un estrechamiento localizado generalmente después del origen de la arteria subclavia izquierda. Asimismo, pueden diagnosticarse mediante este método otros hallazgos asociados, tales como hipoplasia del istmo, dilatación postestenótica y disminución del flujo tras la zona de la coartación.
Gracias al Doppler y el Doppler color, se puede ver una aceleración de flujo en la zona de la coartación que permite evaluar la severidad de la obstrucción mediante la diferencia de presiones entre la aorta proximal y distal a la coartación. Dependiendo de la severidad, puede aparecer una prolongación diastólica de la onda de flujo en aorta abdominal.
- 4.
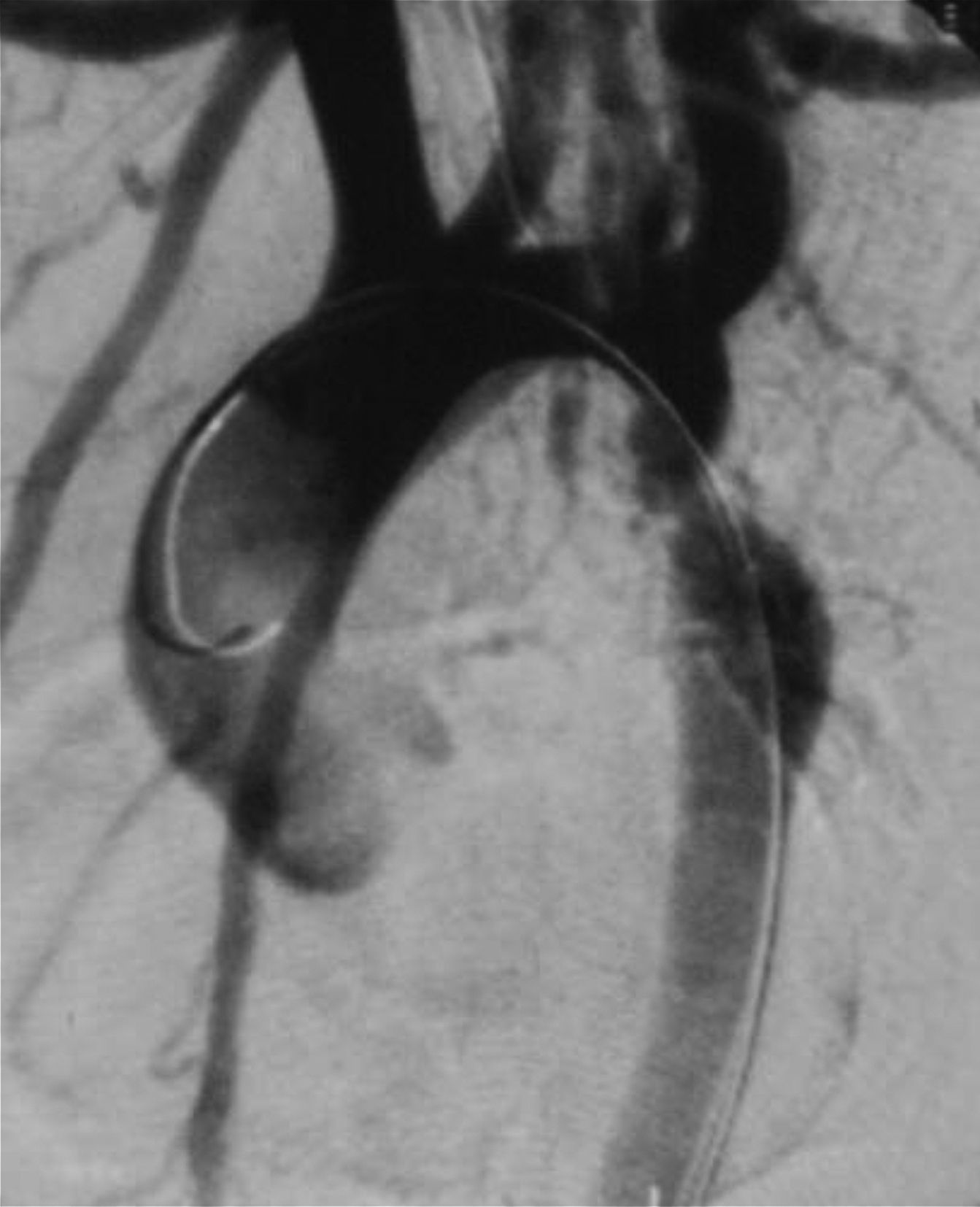
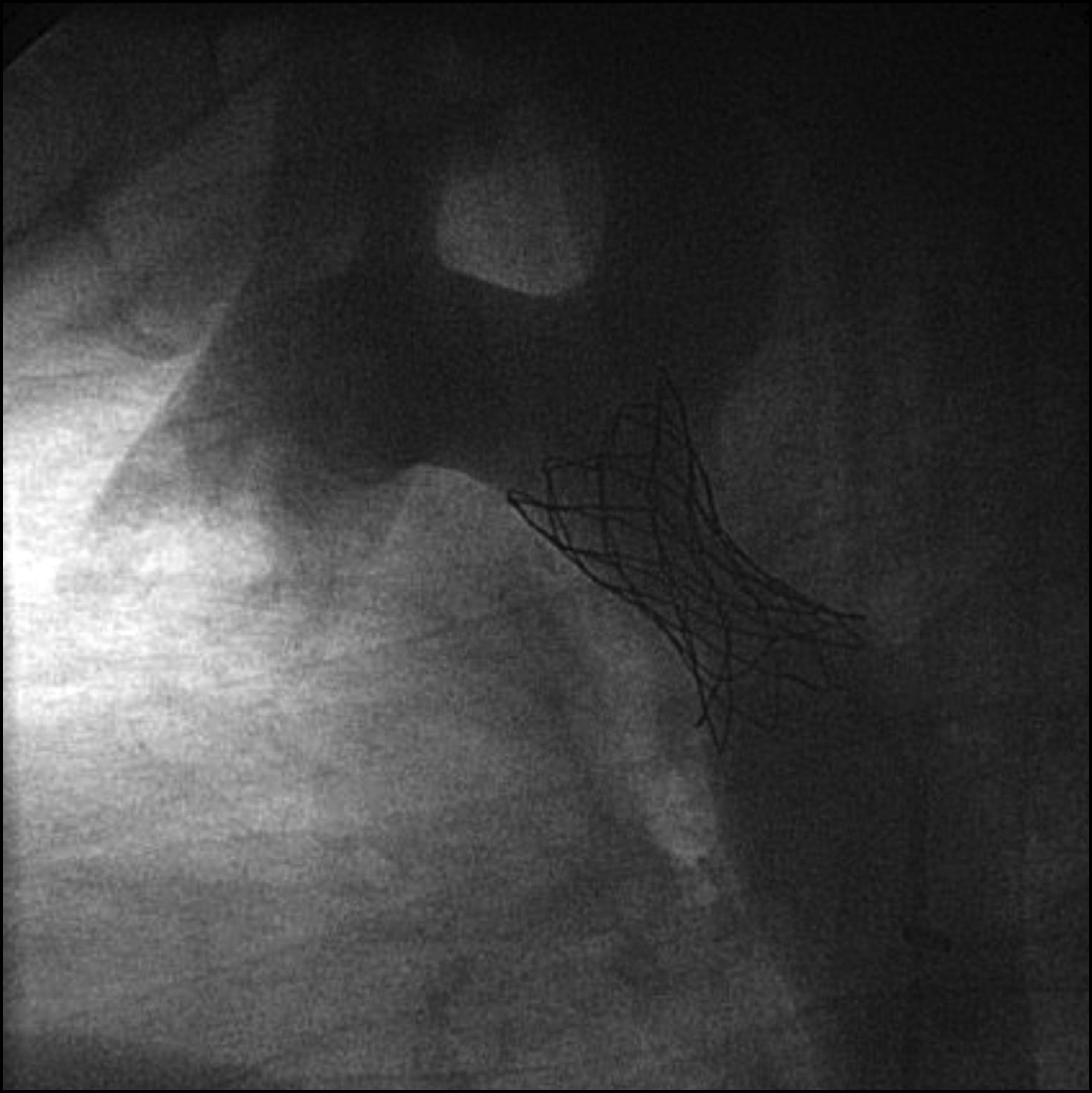
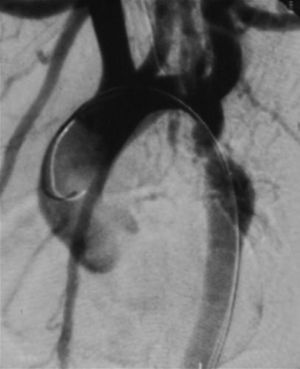
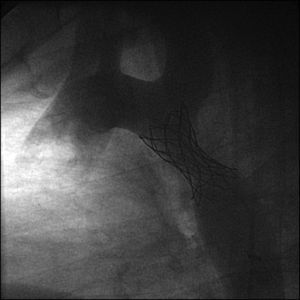
Cateterismo cardiaco y angiografía. El cateterismo y la angiografía permiten demostrar la anatomía de la zona coartada, su severidad y extensión (fig. 2). Se consideran significativos los gradientes superiores a 20mmHg. Sin embargo, en los neonatos y niños pequeños raramente se utiliza, ya que la ecografía suele ser suficiente como método diagnóstico para indicar el tratamiento quirúrgico.
También puede utilizarse como opción terapéutica en los casos indicados13.
- 5.
Angiorresonancia magnética. En los últimos años, se han desarrollado otros métodos para definir la localización y la severidad de la coartación, la anatomía del arco aórtico, el istmo y el área de dilatación postestenótica. También se utiliza en el seguimiento a los pacientes operados o a los que se les realizó angioplastia con balón.
- 6.
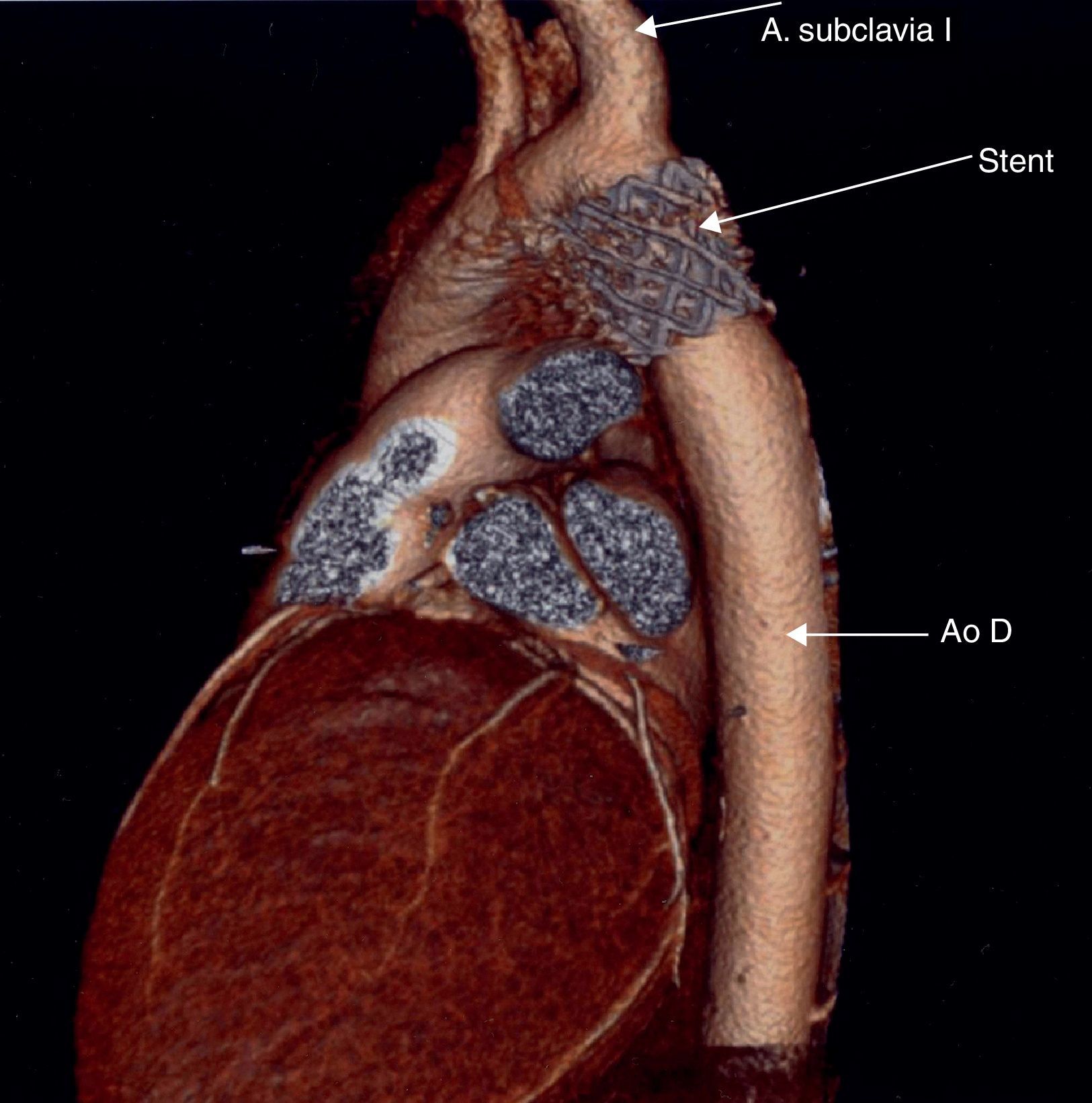
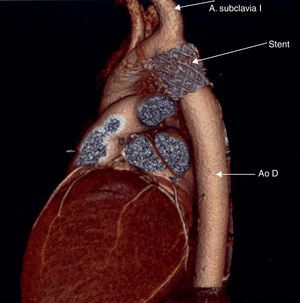
Tomografía computarizada. En las coartaciones tratadas mediante angioplastia con stent, la presencia de este ocasiona artefactos en la resonancia magnética que impiden evaluar la evolución de estos pacientes, por lo que la tomografía computarizada resulta la técnica de elección en estos casos14 (fig. 3).
La coartación de aorta sin tratamiento tiene una historia natural desfavorable: excluyendo la coartación crítica del neonato, los pacientes sobreviven como media hasta los 34 años de edad15. Las causas de mortalidad más frecuente son shock cardiogénico, rotura aórtica, endocarditis bacteriana y hemorragia intracraneal. El momento y el tipo de tratamiento dependen de la forma y la edad de presentación.
Tratamiento médicoEl tratamiento médico inicial es fundamental en el caso del recién nacido que se presenta en estado crítico. Resulta imprescindible intentar mantener el flujo en la aorta distal a la coartación mediante la persistencia del ductos, para lo cual se utiliza la infusión de prostaglandinas (PGE), el apoyo de la función ventricular con inotrópicos y diuréticos, y asistencia respiratoria mecánica en caso necesario.
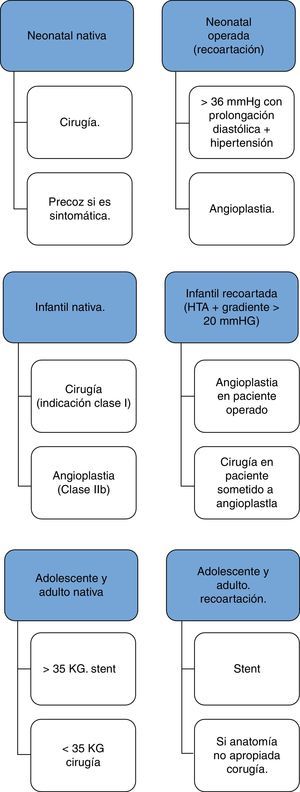
La indicación quirúrgica o intervencionista está clara en el caso de recién nacidos sintomáticos con obstrucciones significativas o con lesiones severas asociadas. Sin embargo, en caso de niños o adultos asintomáticos, la indicación está menos clara, sobre todo si no existe hipertensión arterial asociada. La mayoría de los autores están de acuerdo en establecer como coartación significativa cuando el gradiente de presión es mayor de 20mmHg, aunque en pacientes con colaterales bien desarrolladas esta cifra no puede ser el único criterio que marque la indicación16.
Tratamiento quirúrgicoLa cirugía permanece siendo el tratamiento convencional para la mayoría de los niños portadores de CoAo. Muchas son las técnicas para su reparación y cada una tiene ventajas e inconvenientes en lo que se refiere a la resolución de la obstrucción aórtica, la mortalidad y el porcentaje de recurrencias. Ninguna técnica es superior en todos los pacientes.
- 1.
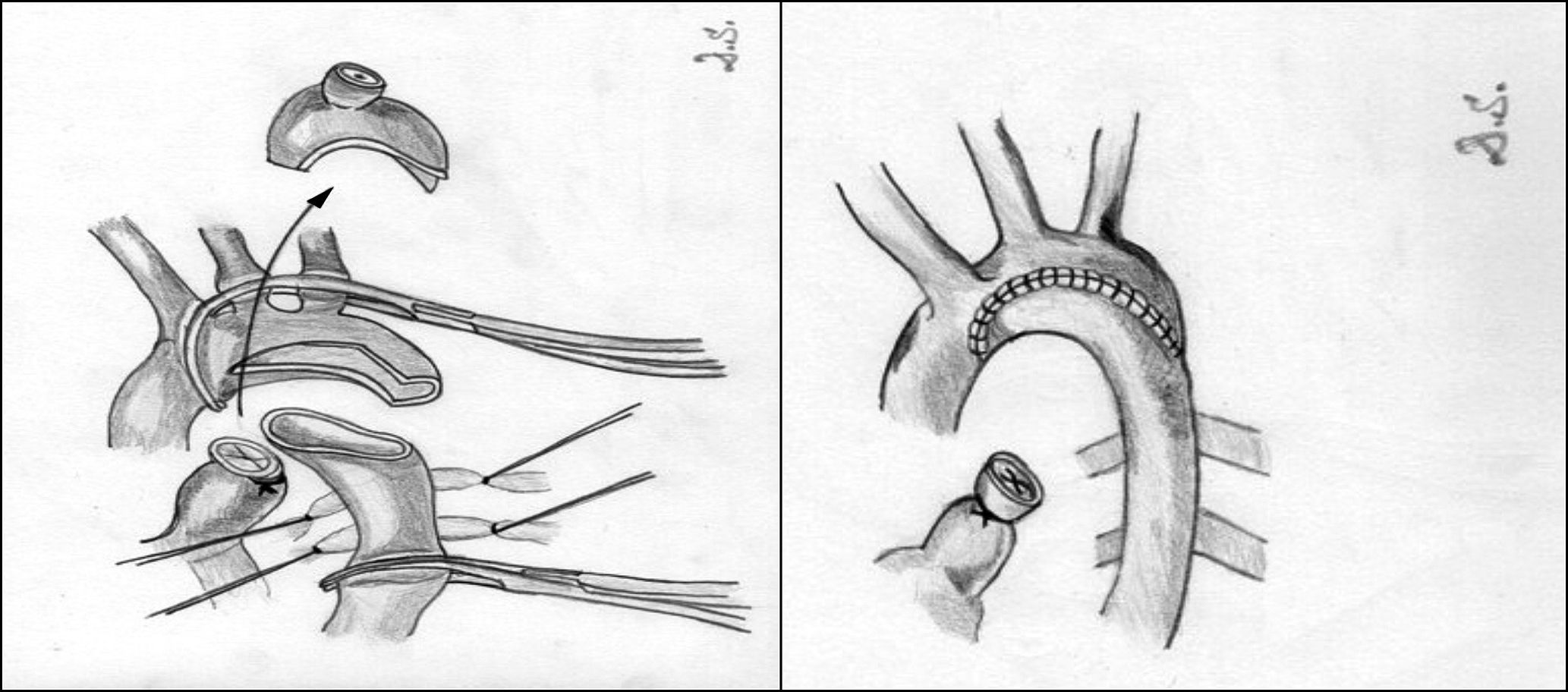
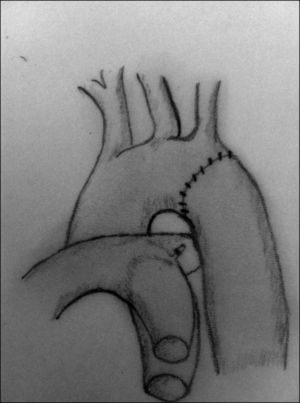
Resección y anastomosis término-terminal. La resección del segmento coartado descrita por Crafoord en 194417 ha sido la técnica de elección comparada con los resultados de otras técnicas, aunque exige una disección y una movilización mayor de la aorta proximal y distal a la zona de coartación (figs. 4-6). Una vez que la aorta ha sido correctamente movilizada y controladas las arterias colaterales, se procede al pinzamiento de ambos segmentos aórticos y a la resección de la zona de coartación, teniendo especial cuidado en resecar la zona ductal para minimizar el riesgo de recoartación. En neonatos, el porcentaje de recurrencia es alto en algunos centros18, por lo que en los últimos años han disminuido los casos de anastomosis circunferenciales, utilizándose cada vez más frecuentemente la anastomosis término-terminal extendida19 (fig. 6). Con esta técnica, se reseca la totalidad del tejido ductal, ampliando el istmo aórtico y la posible hipoplasia del arco. Si bien generalmente se realiza a través de una toracotomía lateral, no es infrecuente que sea necesario realizarla a través de esternotomía media cuando la hipoplasia del arco aórtico es marcada. Los índices de recoartación con esta técnica oscilan entre el 4 y el 13% según las series20,21.
- 2.
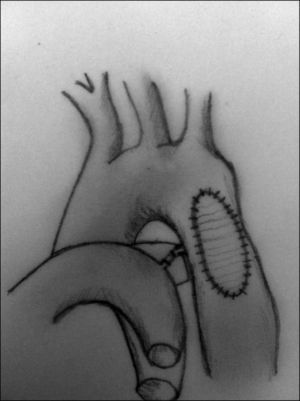
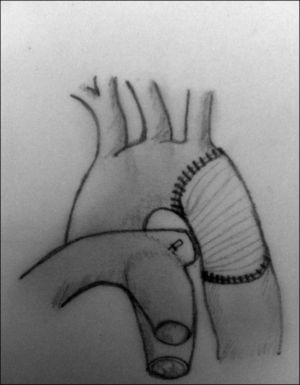
Aortoplastia con parche (fig. 7). Vosschulte en 196122 describe esta técnica en un intento de disminuir el porcentaje de recoartaciones que inicialmente presentaba la técnica anterior. Esta técnica consiste en la realización de una incisión longitudinal en la zona de la coartación, tras la movilización y el pinzamiento de la aorta proximal y distal a la misma, y la interposición de un parche ampliando la zona estenótica. Inicialmente, se utilizó dacrón como material protésico, aunque la presencia de aneurismas desarrollados en la pared posterior al parche hizo que se comenzara a utilizar politetrafluoroetileno, que, al ser menos distensible, se pensaba que podría reducir la incidencia de aneurismas. No obstante, se ha descrito una incidencia de recoartaciones de alrededor del 25% y de aneurismas del 7% cuando se utiliza esta técnica23-25. La principal complicación cuando se realiza a través de toracotomía lateral es la presencia de problemas neurológicos derivados de la necesidad de pinzar el 50% del tronco braquicefálico, la arteria carótida izquierda y la arteria subclavia izquierda, por ello, algunos autores prefieren la vía de la esternotomía media mediante el uso de circulación extracorpórea y perfusión arterial selectiva.
- 3.
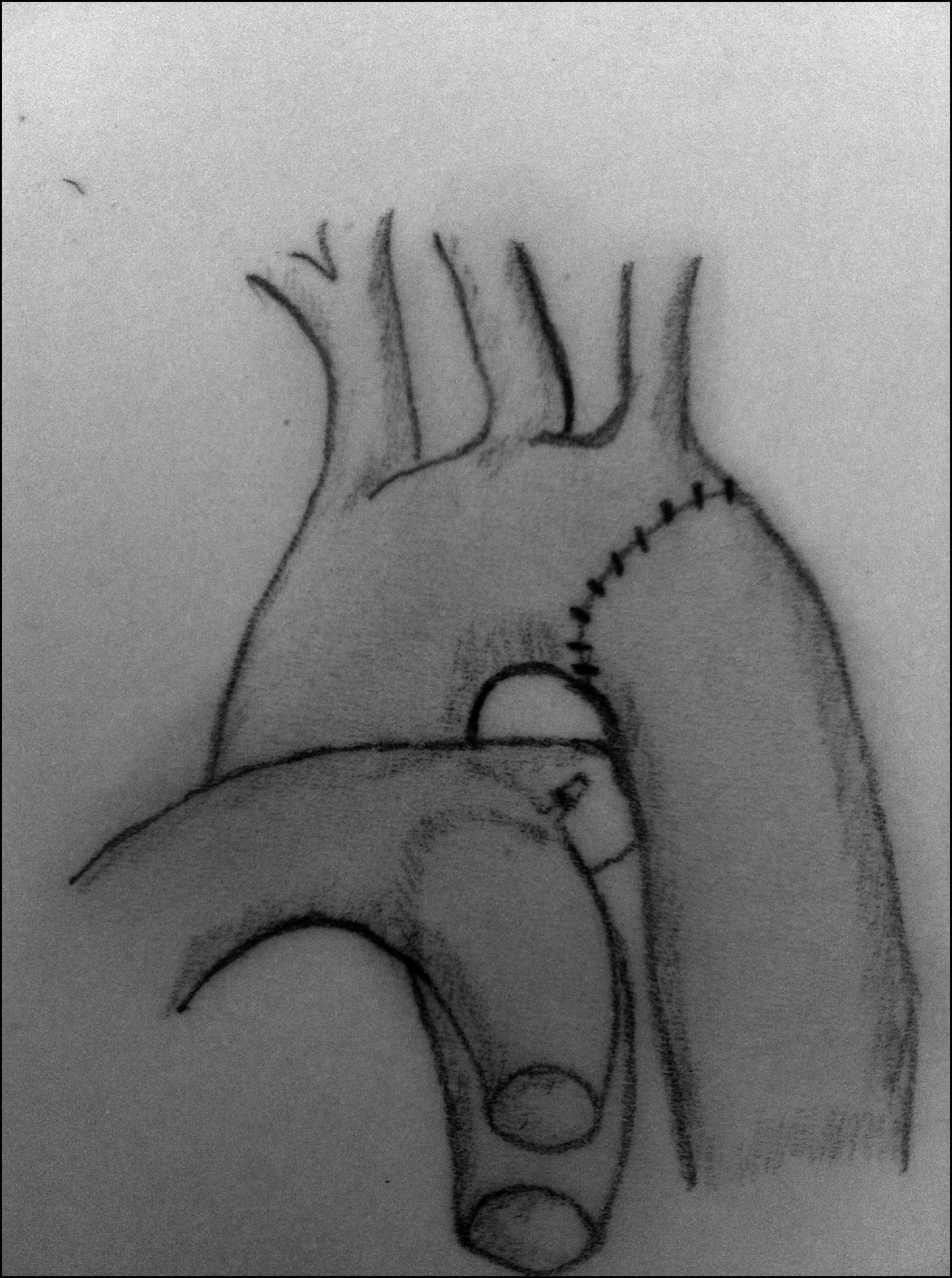
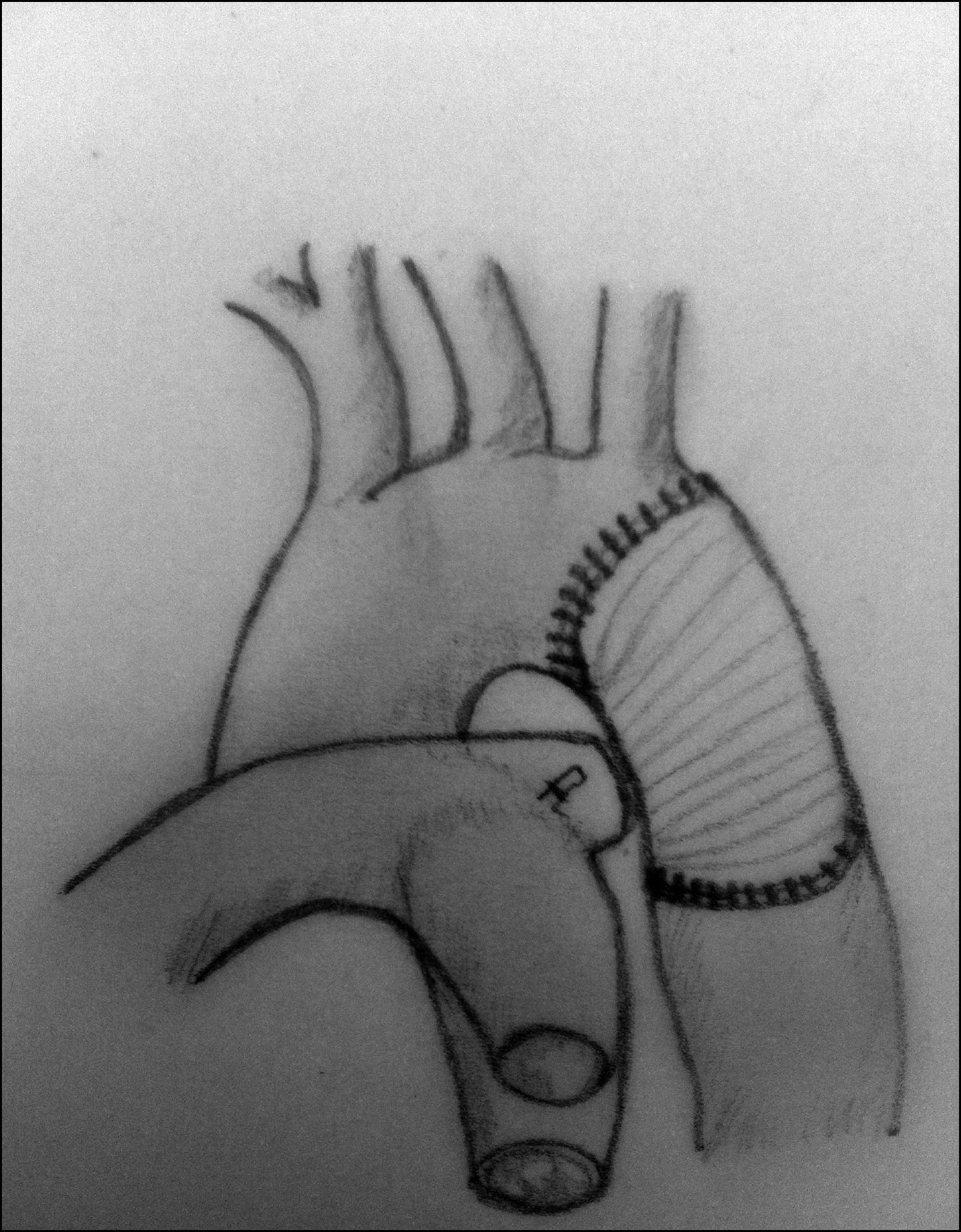
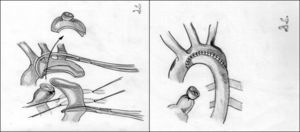
Aortoplastia con flap de subclavia. Esta técnica, descrita por Waldhausen y Nahrwold en 196626, se realiza como las técnicas anteriores a través de una toracotomía lateral, pinzando la aorta proximal a la arteria subclavia izquierda y distal a la zona de coartación. Posteriormente, tras la ligadura y la escisión del ductus, la arteria subclavia izquierda se liga cerca de la salida de la arteria vertebral izquierda, seccionándola y abriéndola longitudinalmente, llegando a sobrepasar su incisión en la aorta hasta pasar distalmente la zona de la coartación. El flap de subclavia se desliza como parche ampliando la zona obstruida (fig. 8). También se ha utilizado de forma inversa para ampliar el arco aórtico en caso de hipoplasia27. El porcentaje de recurrencias alcanza cifras de hasta el 23% y, aunque la presencia de isquemia severa en el miembro superior es rara, no son infrecuentes las alteraciones en el crecimiento de la extremidad, así como la presencia de claudicación en la misma28.
Figura 8.Técnica de Waldhause (aortoplastia con flap de subclavia). A) Se puede observar la aorta descendente y la arteria subclavia izquierda abiertas longitudinalmente. Posteriormente, se secciona la arteria subclavia. B) Se desliza sobre la aorta sobrepasando la zona de la coartación ampliando esta.
DA: ductus arterioso; S.I.: arteria subclavia izquierda.
(1,18MB). - 4.
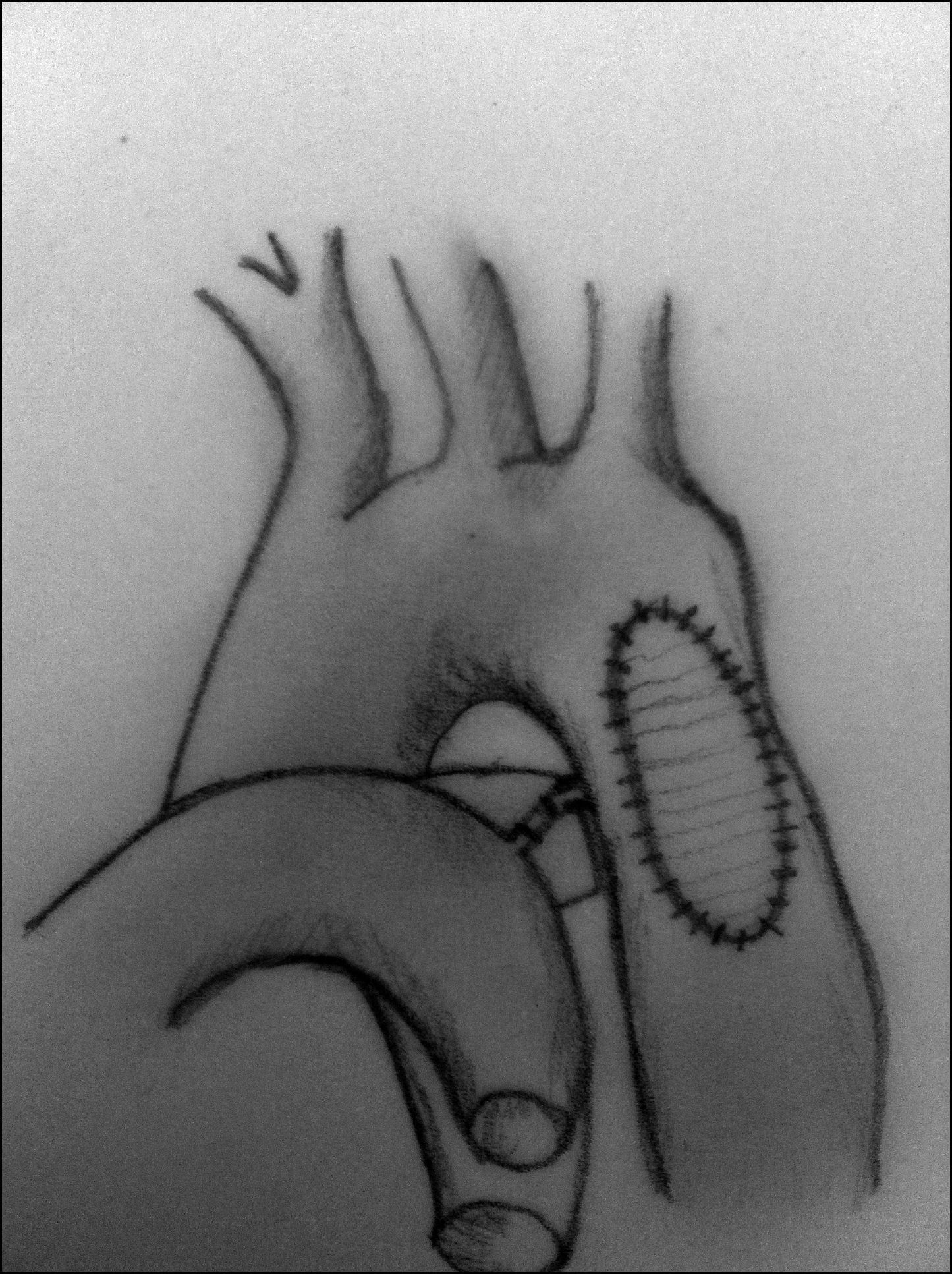
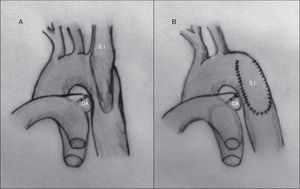
Interposición de injerto. Esta técnica se reserva para pacientes adultos, o niños mayores, que hayan terminado la etapa de crecimiento. Consiste en la resección del tejido obstructivo, colocando en su lugar un homoinjerto o un tubo de dacrón en el lugar del segmento de aorta resecado29 (fig. 9). La principal desventaja de esta técnica es el tiempo de oclusión aórtica.
Una variación de esta técnica, también utilizada en adultos, consiste en la interposición de un injerto entre la arteria subclavia izquierda y la zona aórtica distal a la obstrucción, mediante un bypass extraanatómico, lo que permite realizar un pinzamiento parcial de la aorta, disminuyendo así los riesgos de isquemia en la aorta distal.
Tratamiento percutáneoEl tratamiento de la coartación mediante técnicas percutáneas consistió inicialmente en la introducción de un catéter por vía femoral a través de la zona estenótica con un balón de angioplastia que, inflado a alta presión, conseguía romper la íntima y la media del segmento aórtico coartado30. Sin embargo, aunque los resultados iniciales fueron buenos, cuando esta técnica se utilizaba en niños pequeños con coartaciones nativas el índice de recurrencias llegaba hasta el 80% a corto plazo31. Sin embargo, estos porcentajes disminuían cuando la técnica se utilizaba en adolescentes y pacientes adultos, aunque comparados con los resultados quirúrgicos, tanto el número de recurrencias, como el porcentaje de pacientes que presentaban dilataciones aneurismáticas, seguían siendo mayores, si bien con menor número de complicaciones precoces32.
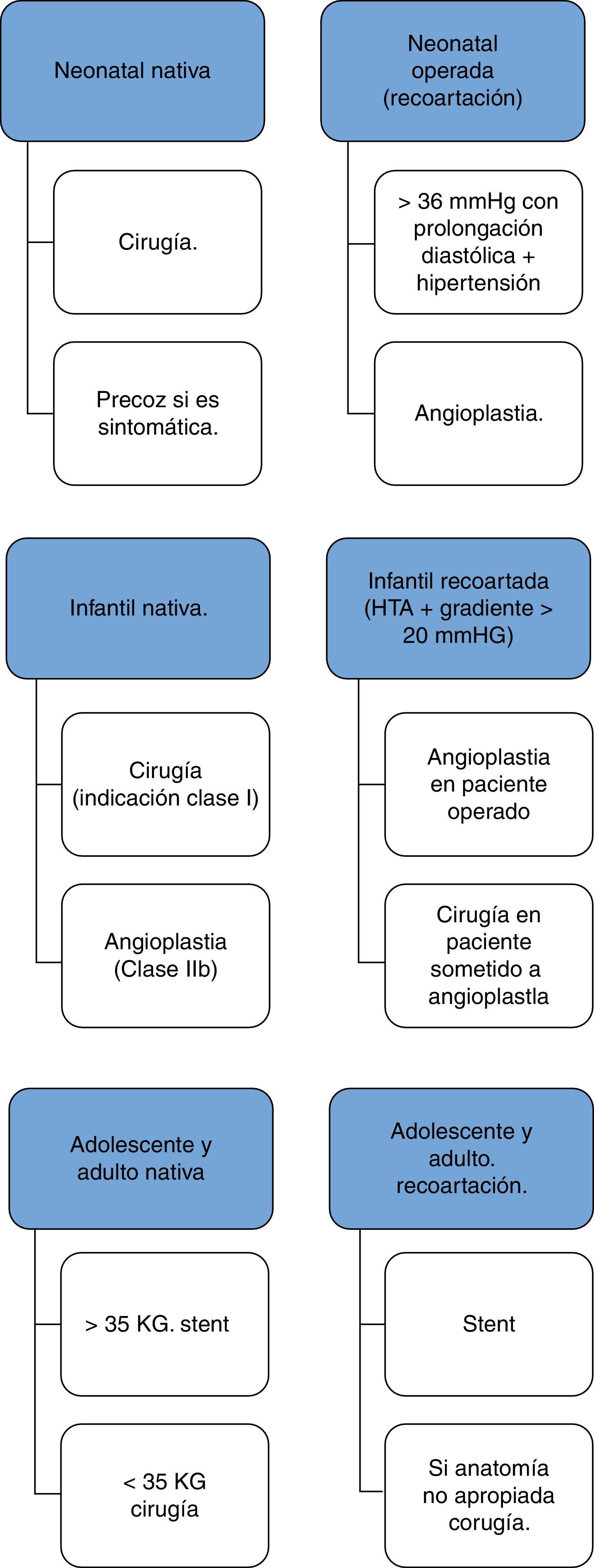
Progresivamente, se han desarrollado diferentes tipos de stents que han demostrado resultados comparables en determinados casos con los obtenidos mediante tratamiento quirúrgico, aunque con menor número de complicaciones33 (fig. 10). La figura 11 muestra un esquema del tratamiento más frecuentemente aceptado según la edad del paciente y el tipo de coartación.
Actualmente, se están desarrollando nuevos stents biodegradables que se absorben en unos 3-6 meses tras su colocación y que no afectarían al crecimiento34.
Complicaciones posquirúrgicas- –
Recoartación: se define como la obstrucción que presenta un gradiente superior a 20mmHg en el lugar de la reparación y que oscila entre el 7 y el 43%, dependiendo de la edad de reparación y la técnica utilizada.
- –
Paraplejía. La incidencia es del 0,41%35, dependiendo del tiempo de pinzamiento y del daño que puedan presentar las colaterales aórticas.
- –
Aneurismas. Más frecuentes tras la corrección con parche.
- –
Hipertensión arterial. Aproximadamente, el 30% de los pacientes presentan hipertensión arterial posquirúrgica, independientemente del éxito de la corrección. Su incidencia aumenta con la edad de la corrección.
- –
El dolor abdominal puede producirse a los 2 o 3 días de la cirugía y se cree relacionado con un componente vascular mesentérico que, en raras ocasiones, requiere tratamiento quirúrgico.
- –
La insuficiencia renal puede presentarse incluso antes de la cirugía en neonatos que presentan sintomatología grave.
- –
En raras ocasiones, durante la cirugía el conducto torácico puede resultar dañado, por lo que en el postoperatorio puede observarse un quilotórax que puede necesitar intervención. Lo más frecuente es que se observen pequeños derrames linfáticos secundarios a la disección y la rotura de pequeños vasos linfáticos periaórticos.
- –
La parálisis del nervio laríngeo recurrente puede darse durante la movilización y la escisión del ductus arterioso, si bien suele ser una complicación infrecuente.
El momento de reparación de la CIV cuando se asocia se asocia a la CoAo sigue siendo motivo de controversia. Se han utilizado diferentes tipos de cirugía en función de la significación hemodinámica que la CIV represente. Algunos autores abogaron por la realización de un cerclaje o banding de la arteria pulmonar, en el momento de la corrección de la coartación por toracotomía, para en un segundo tiempo retirar el banding y cerrar la CIV.
Otros autores proponen la corrección de ambas patologías en un solo tiempo, a través de esternotomía media, con circulación extracorpórea e hipotermia profunda con parada circulatoria, lo que permite realizar una anastomosis término-terminal radicalmente extendida, además del cierre de la CIV36.
PronósticoIndependientemente del procedimiento utilizado, la aorta de los pacientes que tienen coartación presenta anomalías estructurales que pueden dar lugar a diferentes complicaciones a largo plazo. La mortalidad tardía depende de la edad y el peso en el momento de la intervención, así como de la severidad de la lesión y la presencia de lesiones cardiacas asociadas. La supervivencia quirúrgica actual se sitúa alrededor del 98%, siendo a los 5 y 10 años. Alrededor del 80-90% de las muertes después de la cirugía de CoAo se deben a complicaciones cardiovasculares, operaciones de recoartaciones o de valvulopatía aórtica, rotura de aneurismas, endocarditis infecciosa, infarto de miocardio, complicaciones cerebrales, insuficiencia cardiaca o muerte súbita37,38.
ConclusionesEl tipo ideal de reparación de la CoAo permanece sin ser definido. Son varias las preguntas que debemos hacernos ante la presencia de un paciente con esta patología. Es importante definir el tipo de coartación: aislada, con afectación del istmo aórtico, con hipoplasia del arco aórtico. En general, existe consenso en que el segmento enfermo debe ser eliminado, por lo que la opción quirúrgica preferida debería ser la anastomosis término-terminal. Las lesiones cardiacas asociadas deben ser cuidadosamente evaluadas, así como la decisión del momento de su reparación. Del conocimiento de la anatomía de esta patología, su asociación con hipoplasia del arco así como de las técnicas quirúrgicas de que disponemos, se derivará la disminución de complicaciones y la mejor supervivencia de los pacientes.
Interrupción del arco aórticoDefiniciónLa interrupción del arco aórtico (IAAo) es una malformación infrecuente que alcanza alrededor del 0,003 por cada 1.000 nacidos vivos (1% de los niños con cardiopatías congénitas complejas)39. Se caracteriza por la falta de continuidad luminal y anatómica entre la aorta ascendente y la aorta descendente. Aunque sin tratamiento la mortalidad es muy alta, la introducción de la PGE1 y la evolución en las técnicas quirúrgicas han mejorado el pronóstico de esta patología.
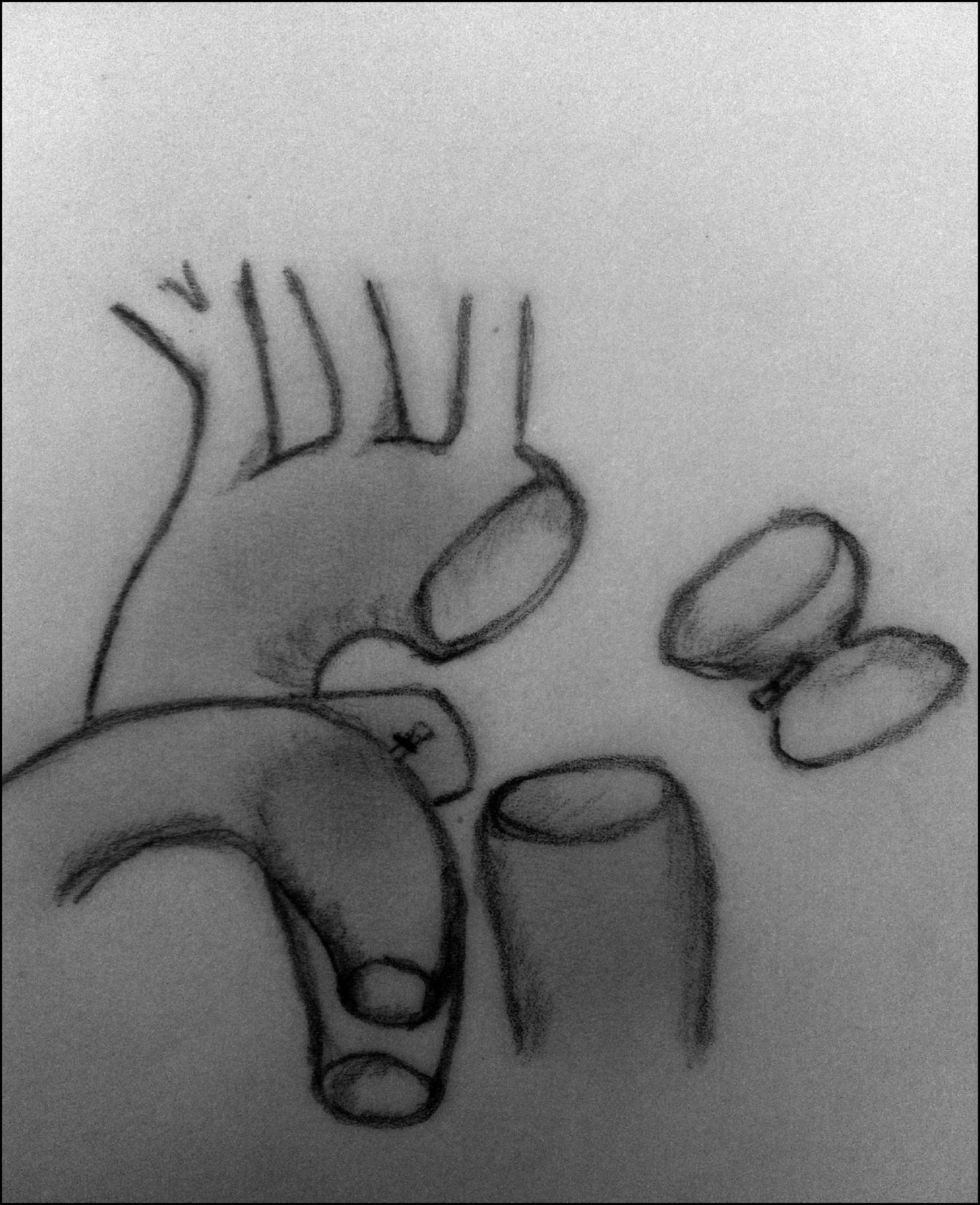
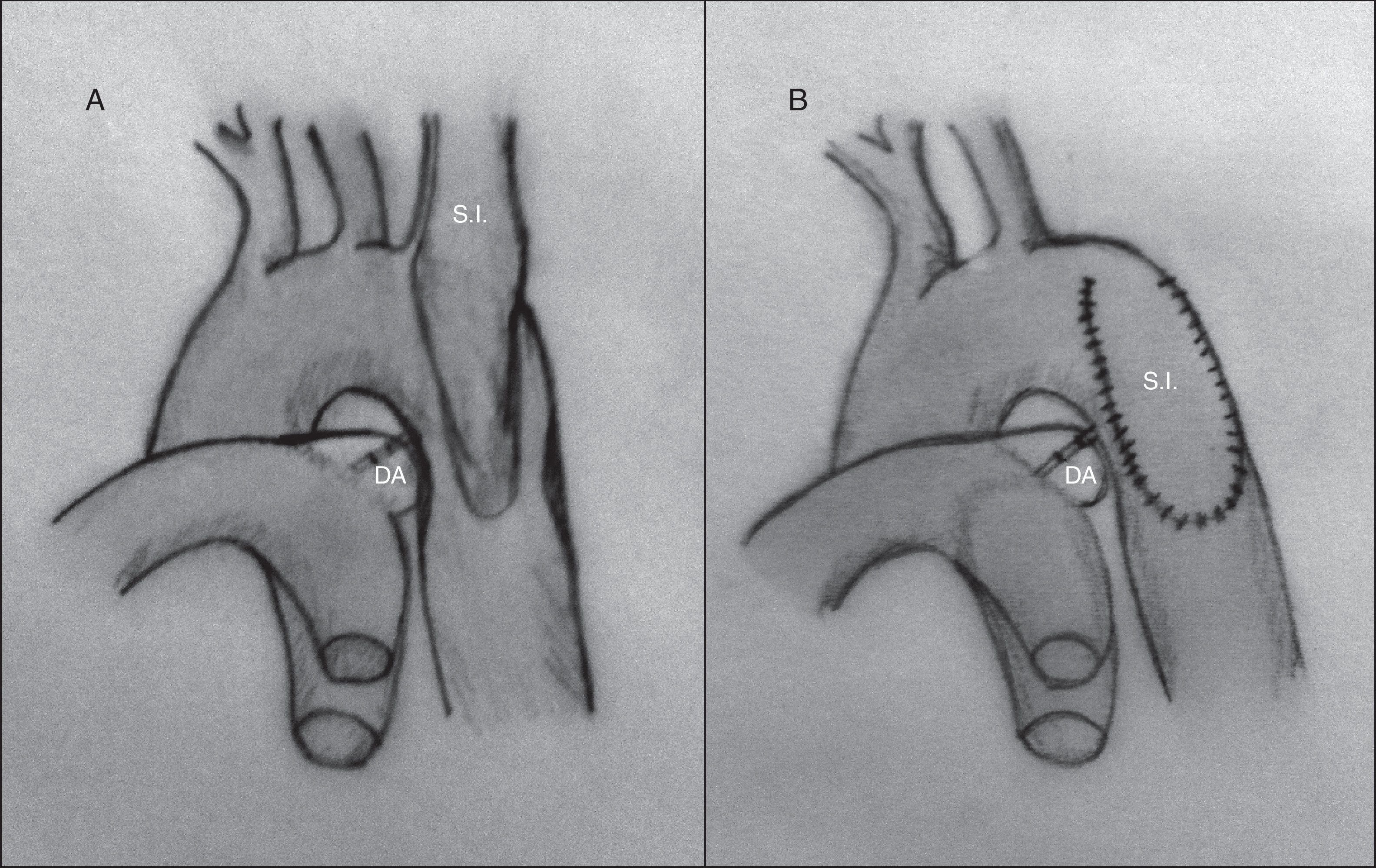
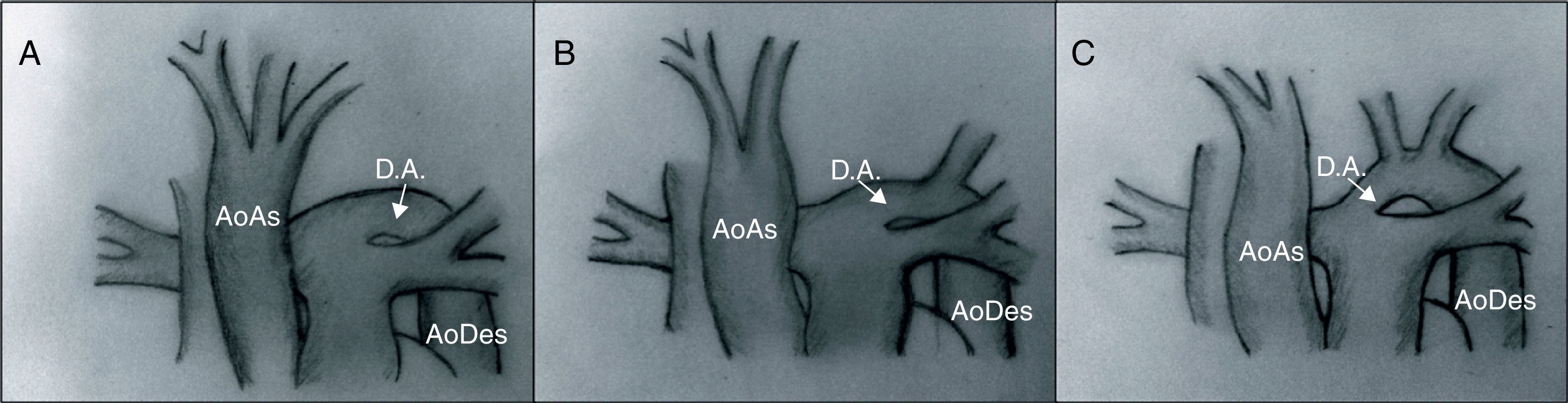
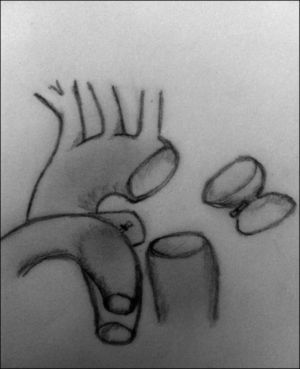
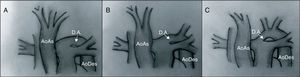
ClasificaciónLa clasificación más utilizada es la descrita por Celoria y Paton40 en 1959, que divide esta patología en 3 tipos según la localización de la obstrucción (fig. 12):
- –
Tipo A. La obstrucción se sitúa a nivel del istmo aórtico: distal a la arteria subclavia izquierda.
- –
Tipo B. Entre la arteria carótida izquierda y la subclavia izquierda. Es el tipo más frecuente.
- –
Tipo C. Entre el tronco braquiocefálico y la arteria carótida izquierda. Es la forma más rara de presentación.
Tipos de interrupción del arco aórtico. En el tipo A, la interrupción se sitúa tras la salida de la arteria subclavia izquierda. En el tipo B se sitúa entre las arterias carótida y subclavia izquierdas. El tipo C presenta una interrupción del arco aórtico tras la salida del tronco braquiocefálico.
AoAs: aorta ascendente; AoDes: aorta descendente; D.A.: ductus arterioso.
La IAAo es una entidad que en raras ocasiones se presenta de forma aislada. En la gran mayoría de las ocasiones existe un ductus arterioso permeable, que proporciona el flujo a la aorta descendente, así como una CIV que está presente en alrededor del 50% de las IAAo tipo A y en más del 80% en el tipo B41. Esta CIV se debe al desplazamiento hacia la izquierda del septo infundibular y se asocia a menudo a cierto grado de obstrucción del tracto de salida del VI42.
La válvula aórtica es bicúspide hasta en el 30% de los pacientes, el anillo aórtico suele ser pequeño, así como la aorta ascendente. También es frecuente encontrar anomalías de los vasos braquiocefálicos, siendo el más frecuente el origen de la arteria subclavia derecha, sobre todo en la IAAo tipo B. Otras malformaciones asociadas con menor frecuencia son la TGA, el canal AV, la ventana aorto-pulmonar, la doble salida de VD y el drenaje venoso pulmonar anómalo.
Aproximadamente, el 68% de los pacientes con IAAo tipo A presentan síndrome de DiGeorge asociado43, definido como la coexistencia de IAAo, malformaciones cráneo-faciales, hipocalcemia y disminución en el recuento de linfocitos T CD4+. Asimismo, en el 24% de los casos de pacientes con anomalías del arco aórtico se observa una deleción del cromosoma 22q1144.
FisiopatologíaEn esta malformación, la presencia de un ductus permeable resulta indispensable, ya que a través del mismo se proporciona flujo hacia el territorio de la aorta descendente distal a la obstrucción. Por ello, en el neonato, una vez que disminuyen las resistencias pulmonares y el ductus se cierra, el recién nacido presenta signos de bajo gasto e hipertensión pulmonar secundaria a la obstrucción del flujo sistémico, al que se asocian oliguria y acidosis metabólica. Los pacientes con ductus permeable presentan una clínica más larvada con presentándose tras semanas o meses después del nacimiento, signos de insuficiencia cardiaca congestiva, retraso en el crecimiento y episodios de neumonías de repetición.
Manifestaciones clínicasActualmente, la mayoría de los recién nacidos con esta patología han sido diagnosticados durante el embarazo, por lo que la infusión de PGE1 está indicada inmediatamente después del nacimiento para evitar el cierre del ductus. Los recién nacidos que no han sido diagnosticados durante la vida fetal presentan en su mayoría signos de insuficiencia cardiaca, cianosis y dificultad respiratoria durante la primera semana de vida. La diferencia de pulsos entre las extremidades dependerá del tipo de interrupción. Cuando se cierra el ductus arterioso se producen un aumento de flujo al territorio pulmonar y una disminución hacia la aorta descendente que da lugar a todos los signos derivados del bajo gasto subsiguiente.
DiagnósticoLa radiografía de tórax, aun siendo anormal, la cardiomegalia, el aumento de la vascularización pulmonar y los signos de hiperaflujo no son específicos de esta patología. El electrocardiograma puede ser normal o presentar signos de hipertrofia de ambos ventrículos, del VD o crecimiento biauricular.
El ecocardiograma es la prueba de elección para realizar el diagnóstico tanto de la IAAo como de los posibles defectos cardiacos asociados. Es importante que se defina la longitud del territorio obstruido, las dimensiones del tracto de salida del VI, los diámetros del anillo aórtico y de la aorta ascendente. También puede observarse mediante ecocardiografía la presencia o ausencia de timo, hecho este que nos haría pensar en la asociación con microdeleción del cromosoma 22 y el síndrome de DiGeorge asociado.
La realización de cateterismo cardiaco y angiografía raras veces es necesaria y además no está exenta de riesgos en neonatos en situación grave. La resonancia magnética también puede proporcionar una imagen detallada del tipo y las características de esta patología.
TratamientoTratamiento médicoAunque el tratamiento de esta patología es quirúrgico, es fundamental que el recién nacido llegue en las mejores condiciones posibles a la cirugía. La infusión de PGE1 a una dosis inicial de 0,05 a 1 μg/kg/min debe comenzar inmediatamente para mantener el ductus arterioso permeable. Asimismo, deben adoptarse las medidas necesarias para corregir la acidosis, mantener la perfusión renal y aumentar el gasto cardiaco41.
Tratamiento quirúrgicoAunque hace unos años, la media de edad en el momento de la reparación oscilaba entre los 40-45 días de vida, actualmente se considera que debe realizarse durante la primera semana de vida41.
Las técnicas utilizadas para la reparación de la IAAo pasan por la realización de una anastomosis directa entre la aorta ascendente y la descendente, y la interposición de algún tipo de parche o de un conducto45. La presencia de anomalías cardiacas asociadas va a ser fundamental en el planteamiento quirúrgico y el abordaje utilizado.
Técnicas de reparación del arco aórticoLa anastomosis término-terminal de la aorta ascendente y la descendente implica una movilización extensa de ambas estructuras, con resección del tejido ductal posibilitando el crecimiento de la zona. Sin embargo, en algunos tipos de IAAo la distancia entre ambas zonas puede ser hasta de 3cm, sobre todo en presencia de subclavia derecha aberrante, por lo que puede ser necesaria la reimplantación de una o las 2 arterias subclavias para conseguir la movilización adecuada46.
Para algunos autores, la anastomosis directa con utilización de parche (pericardio autólogo u homoinjerto) constituye un método de reparación que proporciona menos tensión a la anastomosis y tiene menor incidencia de recoartaciones47.
Manejo en una etapa versus varias de la IAAo con lesiones asociadasLa reparación en una sola etapa es la preferida por muchos autores, ya que proporciona algunas ventajas obvias como el menor número de reoperaciones. Sin embargo, cuando el neonato pesa menos de 1.500 g, se recomienda la corrección en 2 etapas, así como en presencia de infección severa, hemorragia intracraneal, morfología muy desfavorable o situación crítica del neonato48. En estos casos, el abordaje se realiza a través de toracotomía lateral mediante la técnica de la anastomosis término-terminal radicalmente extendida.
Las diferencias en la mortalidad según el tipo de cirugía están relacionadas fundamentalmente con el tipo de lesiones asociadas. Actualmente, la mayoría de los autores utilizan el abordaje por esternotomía media y con circulación extracorpórea para la corrección en un solo tiempo de la IAAo y las lesiones cardiacas asociadas45,49.
La asociación con malformaciones cardiacas complejas supone un reto quirúrgico importante. En general, se recomienda la reparación completa en un solo tiempo en el período neonatal, ya que la cirugía paliativa no proporciona resultados satisfactorios, especialmente en aquellos pacientes que presentan IAAo con truncus arterioso, ventana aorto-pulmonar o TGA asociados41,50.
ResultadosLos avances en el tratamiento médico preoperatorio, y sobre todo la utilización de PGE, han contribuido sobremanera a mejorar los resultados de la cirugía de la IAAo. Algunos autores publican cifras de mortalidad en casos de IAAo con CIV de entre el 5 y el 10%51, con cifras de supervivencia muy variables a los 5 años, entre el 63 y el 90%, y a los 10 años (47-85%)51-53.
Los resultados a largo plazo dependen básicamente de la necesidad de reoperación, así como de las secuelas neurológicas y psicomotoras que estos pacientes puedan presentar.
ConclusionesEl manejo de la IAAo y sus malformaciones asociadas siguen constituyendo un importante reto quirúrgico. La mejora en el tratamiento médico prequirúrgico ha proporcionado una disminución significativa de la mortalidad precoz. Los resultados de la corrección en una sola cirugía proporcionan buenos resultados a corto y medio plazo; sin embargo, el debate continúa, sobre todo en los casos en los que se asocia a malformaciones cardiacas complejas. Dada la baja incidencia de esta patología, serían necesarios estudios multicéntricos con mayor número de pacientes para resolver alguna de estas preguntas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.