Identificación de parámetros de remodelado auricular anatomoeléctrico preoperatorios que permitan seleccionar un subgrupo de pacientes favorable al restablecimiento del ritmo sinusal (RS) a largo plazo tras ablación quirúrgica concomitante de fibrilación auricular (FA) persistente-permanente.
MétodosCincuenta pacientes consecutivos sometidos a ablación quirúrgica concomitante de FA persistente-permanente por patrón Maze IV mediante crioblación y radiofrecuencia bipolar.
Preoperatorio: se consideraron variables demográficas, morbilidad, tiempo de evolución de FA, estudio de ecocardiografía transtorácica y registro de electrocadiograma digital para análisis de organización de señal de ondas f (entropía muestral [SampEn]). Valoración de la asociación individual y conjunta de los parámetros de remodelado auricular con la restauración de RS mediante área bajo la curva ROC (ABC).
ResultadosSeguimiento medio 22,32±3,19 meses. Tiempo medio de evolución de FA 4,00±4,28 años. Diámetro auricular izquierdo medio 49,90±8,18mm (rango=32–81mm). Restauración RS 62% al cierre del seguimiento. Los parámetros que mejor se asociaron con la restauración de RS postoperatorio fueron el diámetro auricular izquierdo (ABC=0,848) y SampEn (ABC=0,845). Hallados puntos de corte para ambos en 50mm y 0,0857, respectivamente; se obtuvo un modelo con capacidad predictiva ABC=0,893.
ConclusionesEl análisis del grado de remodelado auricular anatomoeléctrico preoperatorio mediante variables indirectas incruentas podría ser útil para seleccionar los pacientes más favorables para el restablecimiento de RS tras ablación concomitante de FA.
To identify preoperative parameters of anatomo-electrical atrial remodelling in order to identify the subgroup of patients more favourable to long-term sinus rhythm (SR) re-establishment after concomitant ablation of persistent-permanent atrial fibrillation (AF).
MethodsThe study included 50 consecutive patients undergoing concomitant surgical ablation of persistent-permanent AF with cryoablation and bipolar radiofrequency Maze IV pattern. The variables collected before the operation were; demographic variables, morbidity, AF evolution time, transthoracic echocardiographic study, and digital electrocardiogram register for f-wave signal organisation analysis (sample entropy [SampEn]). An assessment was also made of the individual and combined association of atrial remodelling parameters with SR restoration by area under ROC curve (AUC).
ResultsFollow-up 22.32±3.19 months. Mean AF onset time 4.00±4.28 years. Mean left atrium diameter 49.90±8.18mm (range=32 – 81mm), and SR restoration of 62% at the end of follow-up. Parameters best linked to postoperative SR restoration were left atrium diameter (AUC=0.848) and SampEn (AUC=0.845). Cut-off points were 50mm and 0.0857, respectively, obtaining a model with a predictive accuracy when both parameters combined with an AUC=0.893.
ConclusionsPreoperative anatomo-electrical remodelling analysis through indirect non-invasive variables could be useful to select patients more favourable to SR restoration after concomitant ablation of AF.
La ablación quirúrgica de la fibrilación auricular (FA), como cualquier procedimiento invasivo, es exigible que se aplique bajo indicaciones consensuadas, con una probabilidad de éxito alta y no suponiendo un incremento significativo de la morbilidad ni de la complejidad; sobre todo si se realiza de forma concomitante a otro procedimiento quirúrgico, principal indicación de la intervención. No obstante, si se revisa la evidencia recogida en las guías clínicas1,2 y otros documentos de consenso3, dada la relativa juventud del procedimiento2, su aplicación se rige por indicaciones basadas en la voluntad de tratar al paciente por un esquema de control de ritmo, con razonable probabilidad de éxito. Su beneficio sobre el tratamiento médico para el control del ritmo está consolidado, pero aún hoy existen controversias por resolver como: su superioridad respecto de la ablación percutánea, los beneficios del esquema de control de ritmo frente a control de frecuencia, el manejo farmacológico postoperatorio tras la ablación exitosa (retirada de anticoagulación oral, tratamiento antiarrítmico) y la optimización del abanico de posibilidades técnicas en lo que respecta al patrón de ablación y la fuente de energía aplicada2.
La falta de especificidad de las indicaciones va pareja a la de contraindicaciones, que quedan resumidas en que la adición de la ablación quirúrgica al procedimiento principal no sea desfavorable a la vista del balance riesgo-beneficio de la intervención globalmente considerada. A este efecto, la contraindicación del procedimiento vendría también dada según parámetros objetivos que pudiesen predecir una inaceptable probabilidad de éxito1, preponderando entonces el principio de primum non nocere. La literatura al respecto recoge un notable volumen de trabajos que permiten predecir la recurrencia de la arritmia en base a criterios clínicos, especialmente la edad, tiempo en FA y el tamaño auricular izquierdo; aunque también la presencia de hipertensión arterial, insuficiencia cardiaca congestiva, cardiopatía congénita, enfermedad valvular (en especial la de origen reumático) y apnea del sueño4,5. Estos factores están relacionados con grados aumentados de remodelado auricular, fenómeno de modificación de las propiedades eléctricas, mecánicas y anatomopatológicas del miocardio auricular relacionados con el desencadenamiento y perpetuación de la FA, pre- y postablación, funcionando a modo de círculo vicioso6 con mecanismos moleculares mal definidos que implican, entre otros a la reducción de los canales de calcio tipo L funcionantes, fenómenos de muerte celular programada y estrés oxidativo que permiten explicar los pertinentes cambios histopatológicos7-9.
La relación del tamaño auricular izquierdo con el remodelado y la recurrencia postablación quirúrgica han sido bien definidas5,10, pero existen escasos estudios que analicen el remodelado auricular eléctrico en este escenario. La mayoría de la evidencia viene proporcionada por datos de la ablación percutánea, con la utilización de sistemas de mapeo y con menor presencia de la asociación de cardiopatía estructural y FA persistente-permanente, combinación habitual en el 65% de los procedimientos en nuestro medio11. A este hecho se suma la práctica habitual en nuestro entorno de realización de la ablación quirúrgica en ausencia de un estudio de parámetros electrofisiológicos preoperatorios más allá del electrocardiograma de superficie (ECG) o el Holter-ECG. El análisis de la organización eléctrica de la señal electrocardiográfica en FA ha sido propuesta por algunos autores como buen predictor del grado de remodelado auricular. Entre los parámetros analizados, la entropía muestral (SampEn) demostró una capacidad predictiva superior al 75% en la discriminación de diferentes grados de organización de la FA12, alcanzando un éxito superior al 90% en la discriminación entre registros de FA paroxística y persistente-permanente13. A pesar de que las anteriores investigaciones se han centrado en campos no estrictamente relacionados con la ablación quirúrgica consideramos que, análogamente, la aplicación de estudios no invasivos de la organización eléctrica de la señal ECG podría ser de utilidad en la caracterización preoperatoria del grado de remodelado eléctrico de la FA y de las potenciales posibilidades de recuperación sostenida de ritmo sinusal (RS) postablación. Así, SampEn constituye un método no lineal que permite cuantificar la regularidad de una serie temporal, por así decirlo, la probabilidad de que patrones dentro de una serie sean o no seguidos por patrones similares. Constituye, por tanto, una forma de medir el orden dentro del caos que supone la actividad eléctrica auricular de la FA, incluso obtenida a partir de registros de corta duración y/o con cierto grado de ruido eléctrico derivado de la actividad muscular y de los propios sistemas de registro. Tratándose de un parámetro probabilístico, sus valores oscilarán teóricamente entre 0 y 1, siendo tanto superiores cuanto mayor sea el grado de desorganización de un sistema o señal.
Por ello, en el presente trabajo tratamos de caracterizar mendiante parámetros no invasivos la relación del remodelado auricular eléctrico ponderado por SampEn con factores clínico-anatómicos de remodelado, así como determinar su utilidad en la optimización de la indicación de la ablación concomitante en una población de pacientes con cardiopatía estructural quirúrgica y FA persistente-permanente.
Material y métodosCincuenta pacientes consecutivos sometidos a ablación quirúrgica concomitante de FA persistente-permanente mediante crioablación y radiofrecuencia bipolar entre mayo de 2010 a junio de 2011.
Análisis de la señal electrocardiográficaPreoperatoriamente, menos de 24 h antes de la intervención quirúrgica, fue realizado un registro electrocardiográfico de superficie mediante el sistema EKG máster USB® (TEPA, Inc., Ankara, Turquía), dispositivo para registro digitalizado de electrocardiograma desde un ordenador personal, operado mediante software WinEKG Pro® (TEPA, Inc., Ankara, Turquía). Dicho registro consistió en un electrocardiograma de superficie continuo, con el paciente consciente y en reposo absoluto, de 3 min de duración y con distribución convencional de las 12 derivaciones estándar. Posteriormente, se llevaría a cabo el análisis del grado de organización de la señal eléctrica en V1 mediante el software MATLAB® (MathWorks®, MA, EE. UU.), en un proceso secuencial de tratamiento matemático de la señal para: 1) filtrado de interferencias y depurado, 2) cancelación de los complejos QRST de actividad eléctrica ventricular mediante la definición matemática de un complejo QRST medio y 3) una vez aisladas las ondas f de actividad auricular fibrilatoria, definición de una onda auricular principal por medio de descomposición de armónicos basada en una transfomada de Fourier a partir de la cual, 4) calcular el parámetro de desorganización, la entropía muestral (SampEn). La metodología utilizada ha sido desarrollada en extenso en las citas13,14.
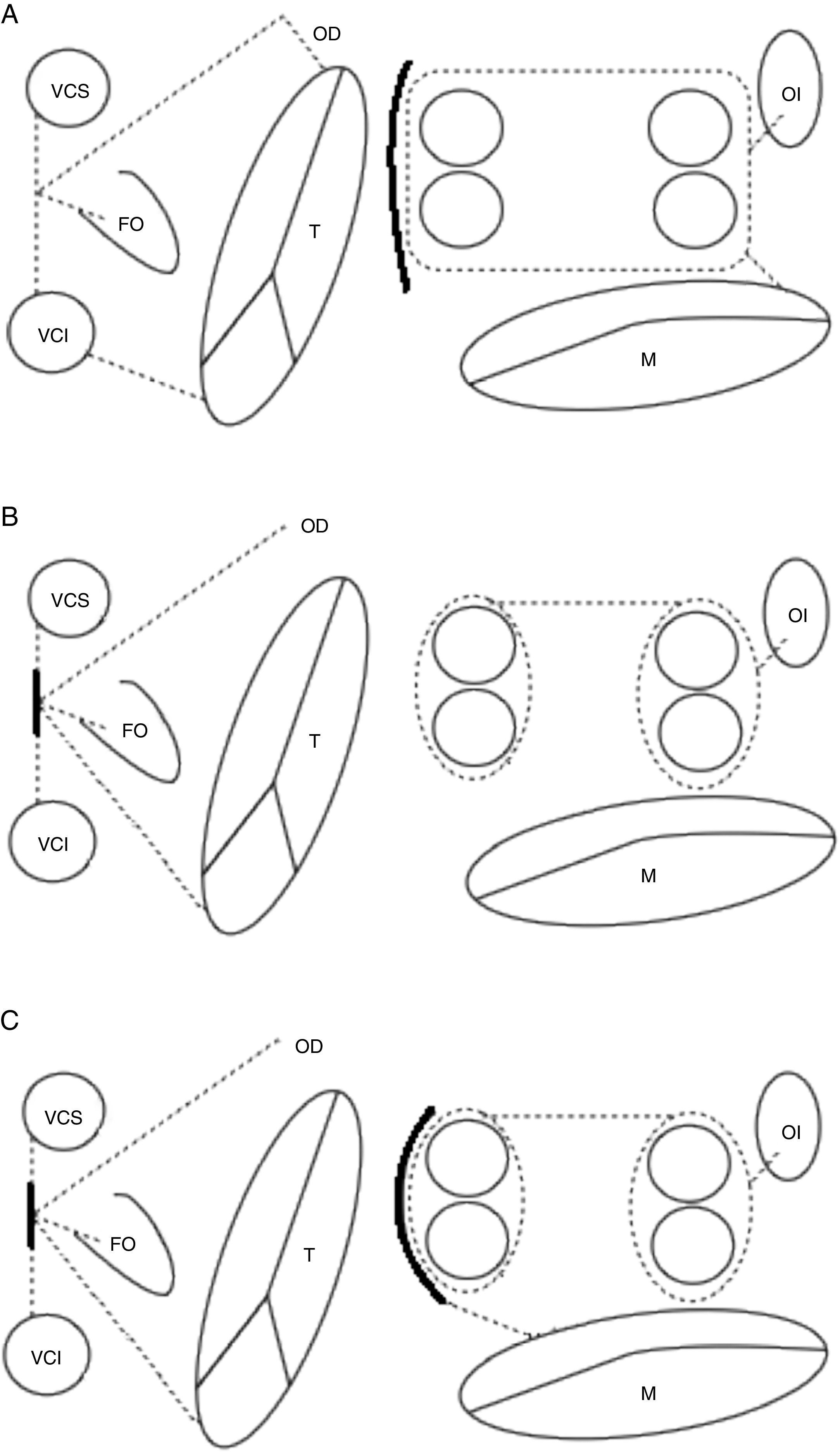
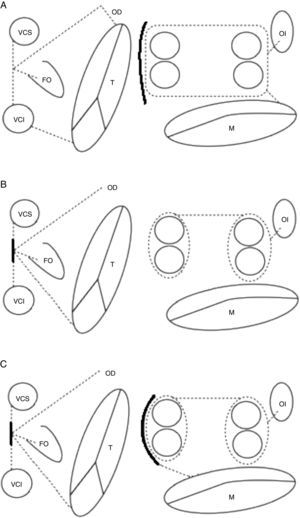
Protocolo técnicoRealización de la ablación quirúrgica concomitante de la fibrilación auricular en circulación extracorpórea, bajo hipotermia moderada (32°C), utilizando solución cardiopléjica hemática fría anterógrada y retrógrada (4°C). El procedimiento fue realizado concomitantemente a otros procedimientos de cirugía cardiaca, generalmente de tipo valvular (reparación o sustitución valvular mitral). Las fuentes de energía utilizadas fueron indistintamente, a elección del cirujano, crioablación y radiofrecuencia bipolar. En todos los casos se llevó a cabo patrón de ablación completo o biauricular. La crioablación se aplicó en aurícula izquierda de forma endocavitaria bajo paro cardiopléjico y epicárdica en el caso de la aurícula derecha una vez retirado el pinzado aórtico. Se llevó a cabo patrón tipo Maze III en todos los casos (fig. 1A.). En el caso de la ablación con radiofrecuencia bipolar, esta se aplicó por vía endoepicárdica (12/14 casos) mediante aislamiento individual de las venas pulmonares, salvo en aquellos casos donde el procedimiento concomitante no exigía la realización de una atriotomía izquierda por el surco de Söndegaard (2/14 casos) en cuyo caso tuvo aplicación epicárdica pura. En el primer caso, tuvo lugar la realización de un patrón completo biauricular tipo Maze IV, con conexión a los anillos mitral y tricúspide de las líneas de ablación por extensión a través de sendas atriotomías izquierda y derecha, sin necesidad de combinar fuentes de energía monopolar a la radiofrecuencia bipolar (fig. 1B.). En el caso de la ablación epicárdica pura, la conexión de las lesiones del aislamiento independiente de las venas pulmonares no tuvo lugar, así como tampoco la conexión con el anillo valvular mitral (fig. 1C.). La ablación de la aurícula derecha con radiofrecuencia bipolar tuvo lugar siguiendo un patrón radial, endoepicárdico, mediante la introducción de una de las fauces de la pinza a través de la bolsa de tabaco de la cánula de retroplejia para, pivotando desde este punto, completar el patrón lesional, incluyendo la conexión con el anillo valvular tricúspide (fig. 1B y C.). La exclusión del apéndice auricular izquierdo fue desigual en la serie y se llevó a cabo mediante sutura endocavitaria o exclusión epicárdica según elección del cirujano responsable y características anatómicas15,16. Cuando este tuvo lugar, fue comprobada la adecuada exclusión en el mismo acto quirúrgico mediante ecocardiografía transesofágica.
Patrones de ablación utilizados con cada fuente de energía y esquema de intervención quirúrgica. Líneas continuas: atriotomías. Líneas discontinuas: ablación mediante fuente de energía. A) Patrón Maze III para crioablación, endocavitario en aurícula izquierda y epicárdico en derecha. B) Patrón Maze IV para radiofrecuencia bipolar sin abordaje de atriotomía izquierda, epicárdico puro en aurícula izquierda y endoepicárdico en derecha a través de miniincisión. C) Patrón Maze IV para radiofrecuencia bipolar con abordaje de atriotomía izquierda, endoepicárdico en aurículas izquierda y derecha. Modificado de Dalmau MJ et al.11.
Todos los pacientes recibieron al alta tratamiento dicumarínico al menos durante los primeros tres meses postablación, manteniéndose siempre que no se cumpliese alguna de las condiciones necesarias para su retirada a lo largo del seguimiento: CHA2DS2VASc≤1 punto; exclusión de apéndice auricular izquierdo con remanente de<1cm. en ecocardiografía transesofágica intraoperatoria; ausencia de recurrencia de FA postablación; ausencia de prótesis mecánica/s; función de transporte auricular eficaz, onda S transmitral>0,3m/s. El tratamiento antiarrítmico17 se mantuvo en el postoperatorio, indicándose el fármaco a utilizar en función de la cardiopatía concomitante tratada: betabloqueantes (atenolol 25-50mg/12-24h o bisoprolol 2,5-10mg/12-24h) en presencia de hipertrofia ventricular concéntrica y/o cardiopatía isquémica, amiodarona 200mg/24-48h en el resto de los casos; considerándose asimismo intolerancias farmacológicas, interacciones y/o contraindicaciones. Solo en aquellos casos donde, tras recurrencia de la FA postablación se prefirió una pauta de control de frecuencia cardiaca en ausencia de hipertrofia ventricular izquierda, cardiopatía isquémica y/o presencia de contraindicación para el betabloqueo, se aplicó digoxina 0,25mg/24-48h, de forma aislada o en combinación con betabloqueantes.
Variables consideradas y seguimientoSe consideraron variables preoperatorias (demográficas, morbilidad preoperatoria, tiempo de evolución de FA/tiempo en anticoagulación oral, diámetro auricular izquierdo por estudio de ecocardiografía transtorácica y SampEn como parámetro de organización de señal de las ondas f), intraoperatorias (procedimiento concomitante y tipo de fuente de energía utilizada) y postoperatorias (morbimortalidad global y específica).
El seguimiento ambulatorio se llevó a cabo en intervalos establecidos por protocolo entre 1 y 3 meses de postoperatorio (superado el «periodo de blanking»), a los 6 meses y al año; obteniéndose registro clínico del ritmo auricular mediante ECG estándar durante 10 segundos. A partir del año de seguimiento, la valoración se realizó de igual forma cada 6 meses. Fue considerado éxito de la ablación en aquellos pacientes que, al término del seguimiento, no presentaron en ninguno de los registros de ECG episodios de FA ni refirieron sintomatología o presentaron episodios compatibles documentados.
Análisis estadísticoEl análisis estadístico se realizó utilizando el Pack Estadístico de Estudios Sociológicos 19.0 (SPSS®, IBM® Statistics, IBM®, NY, EE. UU.). Se comprobó la normalidad de los parámetros cuantitativos mediante el test de Kolmogorov-Smirnov. La capacidad predictiva de modelos/parámetros fue determinada mediante el cálculo del área bajo la curva ROC (ABC) con determinación del punto de corte óptimo de la misma, definido como aquel con mejor par sensibilidad-especificidad.
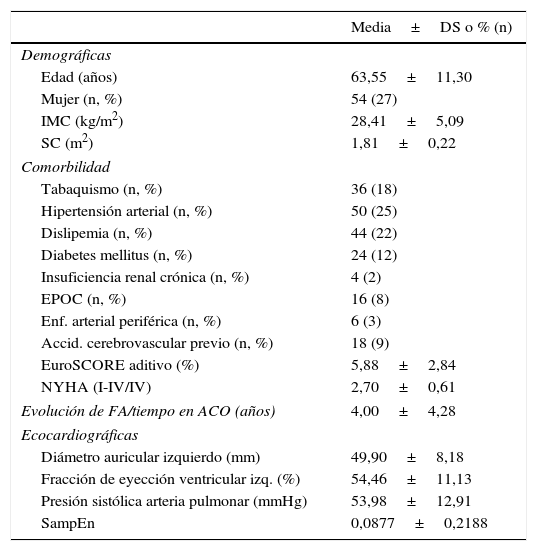
ResultadosCaracterísticas pre-, intra- y postoperatoriasLas características preoperatorias quedan resumidas en la tabla 1. Fue destacable la elevada incidencia de factores de riesgo cardiovascular arterioscleróticos a pesar de tratarse de un subgrupo de pacientes con predominio de patología valvular. El rango de medidas del diámetro auricular izquierdo por ecocardiografía osciló entre 32 y 81mm. La fracción de eyección ventricular izquierda media se situó en el límite de la normalidad y la hipertensión pulmonar media se presentó en grado moderado, ambos fenómenos en asociación con una clase funcional de los pacientes próxima a NYHA III.
Variables preoperatorias de la muestra estudiada
| Media±DS o % (n) | |
|---|---|
| Demográficas | |
| Edad (años) | 63,55±11,30 |
| Mujer (n, %) | 54 (27) |
| IMC (kg/m2) | 28,41±5,09 |
| SC (m2) | 1,81±0,22 |
| Comorbilidad | |
| Tabaquismo (n, %) | 36 (18) |
| Hipertensión arterial (n, %) | 50 (25) |
| Dislipemia (n, %) | 44 (22) |
| Diabetes mellitus (n, %) | 24 (12) |
| Insuficiencia renal crónica (n, %) | 4 (2) |
| EPOC (n, %) | 16 (8) |
| Enf. arterial periférica (n, %) | 6 (3) |
| Accid. cerebrovascular previo (n, %) | 18 (9) |
| EuroSCORE aditivo (%) | 5,88±2,84 |
| NYHA (I-IV/IV) | 2,70±0,61 |
| Evolución de FA/tiempo en ACO (años) | 4,00±4,28 |
| Ecocardiográficas | |
| Diámetro auricular izquierdo (mm) | 49,90±8,18 |
| Fracción de eyección ventricular izq. (%) | 54,46±11,13 |
| Presión sistólica arteria pulmonar (mmHg) | 53,98±12,91 |
| SampEn | 0,0877±0,2188 |
ACO: anticoagulación oral; DS: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IMC: índice de masa corporal; NYHA: clasificación de grado funcional de disnea según la New York Heart Association; SampEn: entropía muestral; SC: superficie corporal.
La tabla 2 resume las características de los procedimientos quirúrgicos de ablación de la FA y concomitantes. El 98% de los procedimientos presentaron cirugía valvular concomitante y el 86% fue sobre la válvula mitral; en el 60% se llevaron a cabo dos procedimientos valvulares. Las etiologías que afectaron a la válvula mitral fueron reumáticas en el 65,9% (29), degeneración fibroelástica 18,2% (8), funcional 11,4% (5) y postendocarditis infecciosa 4,5% (2). La cirugía de reparación valvular correspondió fundamentalmente a la anuloplastia de la válvula tricúspide y, en el caso de la mitral, representó la tercera parte de los procedimientos, en probable relación a la elevada incidencia registrada de valvulopatía reumática. En lo que respecta a la ablación quirúrgica, el procedimiento mayoritario incluyó la utilización de crioablación 72% (36) frente a la radiofrecuencia 28% (14). La exclusión del apéndice auricular izquierdo fue llevada a cabo en casi la mitad de los casos con predominio del abordaje epicárdico. Los pacientes con valvulopatía reumática presentaron grados más avanzados de remodelado eléctrico (SamEn valvulopatía reumática 0,9081±0,0228 vs. no reumática 0,0847±0,0212; p=0,342) y anatómico (diámetro auricular izquierdo valvulopatía reumática 49,90±9,00 vs. valvulopatía no reumática 49,65±7,18; p=0,919).
Variables intraoperatorias de procedimiento concomitante y ablación quirúrgica
| Media±DS o % (n) | |
|---|---|
| Reoperación (n, %) | 16% (8) |
| Válvulas intervenidas | |
| Media | 1,64±0,80 |
| Proc. válvula aórtica | 44 (22) |
| Reparación | 9,1 (2) |
| Sustitución | 90,9 (20) |
| Proc. válvula mitral | 88 (44) |
| Reparación | 38,6 (17) |
| Sustitución | 61,4 (27) |
| Proc. válvula tricúspide | 32 (16) |
| Reparación | 100 (16) |
| Bypass coronario | 18 (9) |
| Ablación quirúrgica | |
| Crioablación | 72 (36) |
| RF bipolar | 28 (14) |
| Exclusión orejuela izquierda | 56 (28) |
| Epicárdica | 28,6 (8) |
| Endocavitaria | 71,4 (20) |
| Reducción auricular | 6 (3) |
RF: radiofrecuencia.
La mortalidad de la serie fue de dos pacientes, presentada en el seguimiento precoz (4 días: probable muerte súbita) y tardío (42 días: descompensación de insuficiencia cardiorrespiratoria y posterior fallo multiorgánico), siendo incluidos en el análisis y seguimiento global de la serie. Los resultados de morbilidad postoperatoria fueron recogidos en la tabla 3. La morbilidad global fue 20% (10 pacientes) y, entre las específicas, la más frecuente fue la necesidad de revisión quirúrgica de sangrado en 3 pacientes. La morbilidad respiratoria incluyó necesidad de intubación/soporte de ventilación mecánica prolongada, la cual se asoció a los casos con comorbilidad neurológica. La necesidad de implante de MP se situó en los estándares comunicados en la literatura y un caso de parálisis diafragmática «a frigore» detectada fue reversible a lo largo del seguimiento (<3 meses). Ninguno de los pacientes suspendió la terapia anticoagulante en el seguimiento, permaneciendo el 84% (42) con alguna pauta de tratamiento antiarrítmico con intención de control de ritmo (betabloqueo 45,2% [19] y amiodarona 54,8% [23]). El 22% (11) recibieron pauta de tratamiento para control de frecuencia con digoxina, betabloqueantes o combinaciones de los mismos.
Morbilidad postoperatoria de la serie estudiada
| % (n) | |
|---|---|
| Morbilidad (n, %) | 20 (10) |
| Neurológica | 4 (2) |
| Ictus | 2 (1) |
| Coma | 2 (1) |
| BAV III con implante de MP definitivo | 4 (2) |
| Respiratoria | 4 (2) |
| Sangrado con revisión quirúrgica | 6 (3) |
| Parálisis diafragmática | 2 (1) |
BAV: bloqueo auriculoventricular; MP: marcapasos.
El seguimiento tuvo una duración media de 22,32±3,19 meses donde se registró un 62% de restablecimiento de ritmo sinusal. No existieron diferencias significativas entre las tasas de éxito de ablación de ambas fuentes de energía utilizadas, crioablación 61,1% (22) y radiofrecuencia 64,3% (9); p=0,363. Se evaluaron diferentes parámetros relacionados con el remodelado auricular reconocidos en la literatura4–8 relacionados con el éxito postablación: edad, tiempo de evolución de la FA, diámetro auricular izquierdo y SampEn. La capacidad predictiva (ABC) fue, respectivamente, 0,744; 0,802; 0,848 y 0,845; p<0,001. Para los dos parámetros con superior capacidad predictiva, fue calculado el punto de corte óptimo mostrando sensibilidad (S) y especificidad (E): 50mm para el diámetro auricular izquierdo, S=0,692 y E=0,875; 0,0857 para SampEn, S=0,815 y E=0,826.
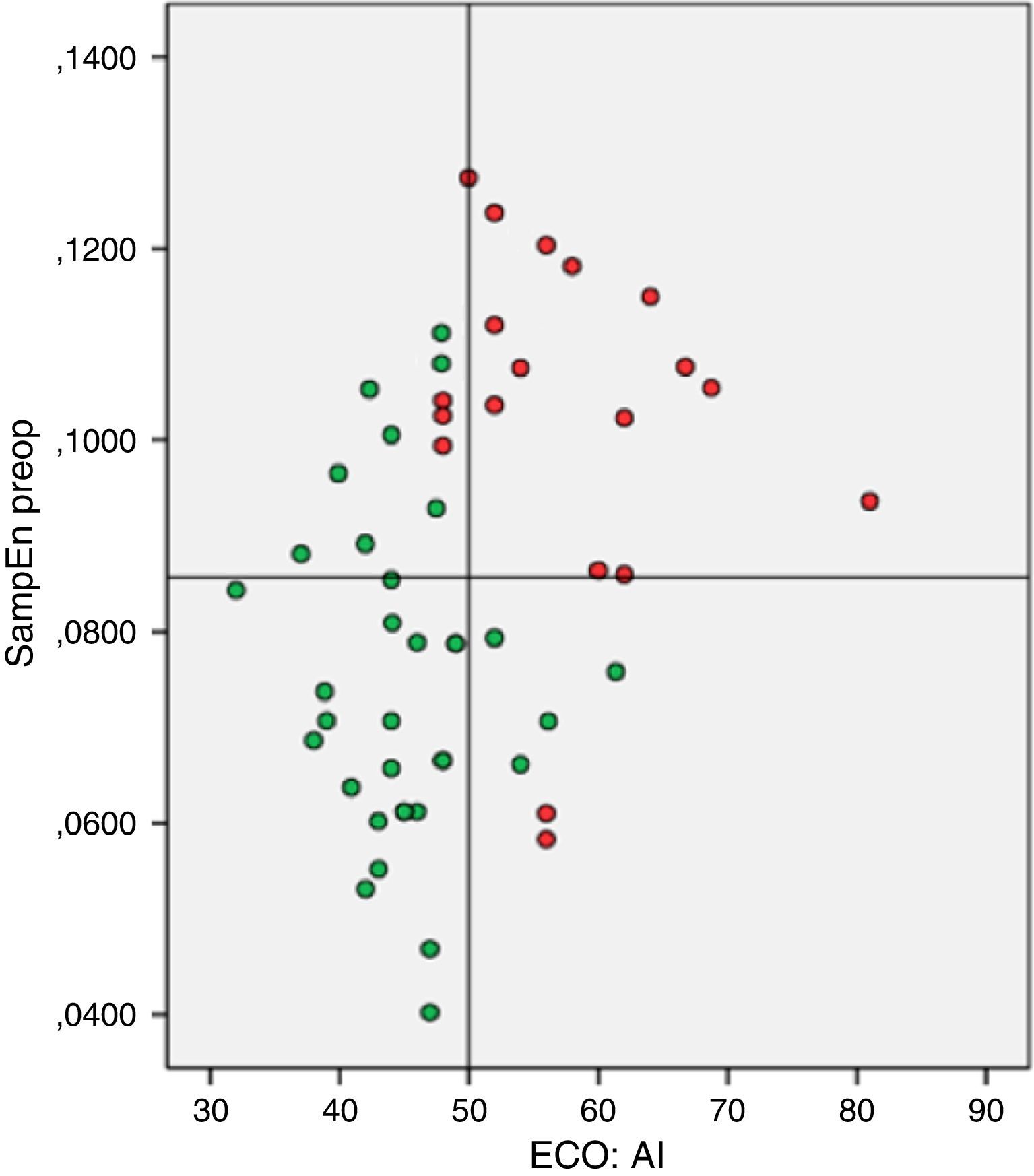
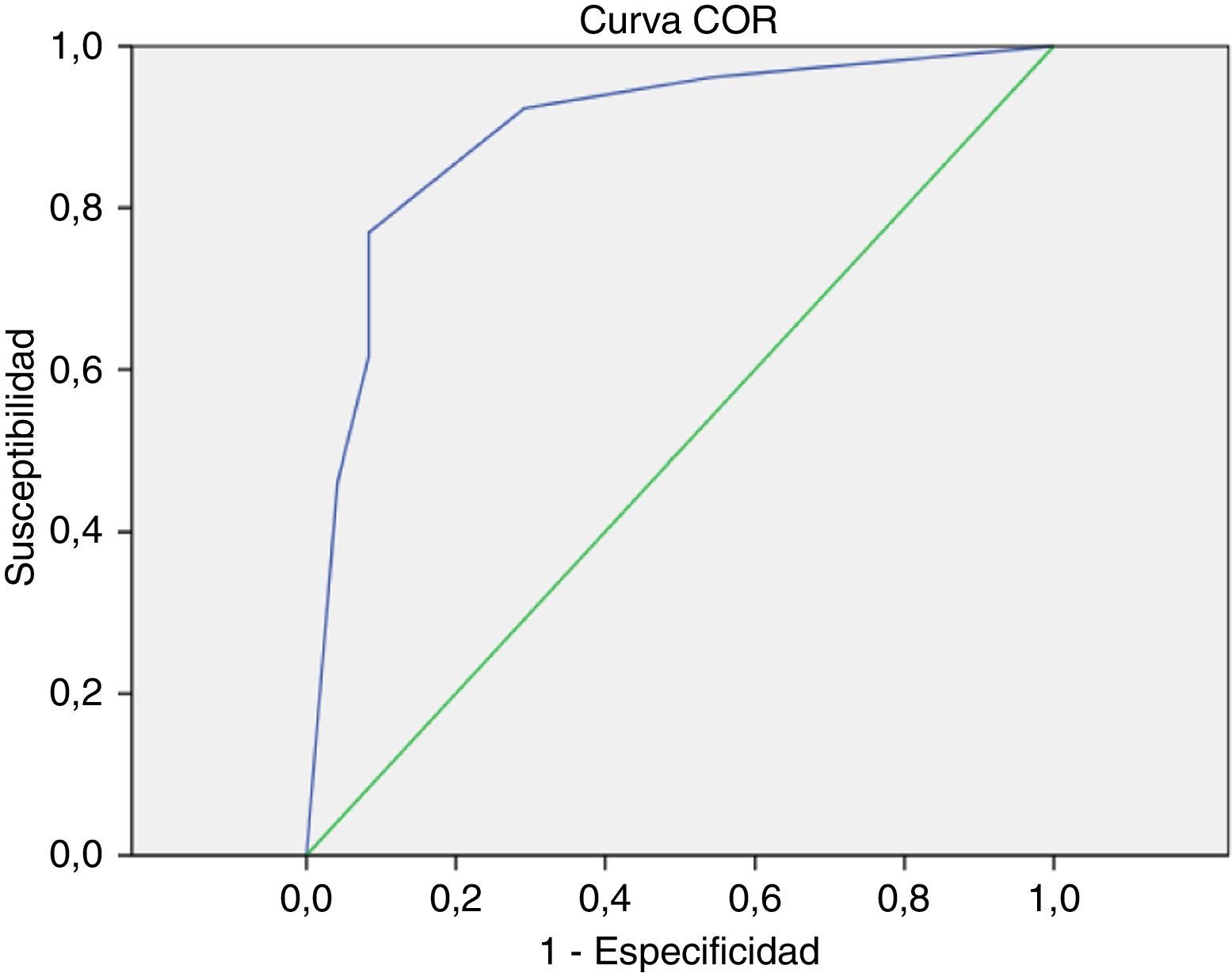
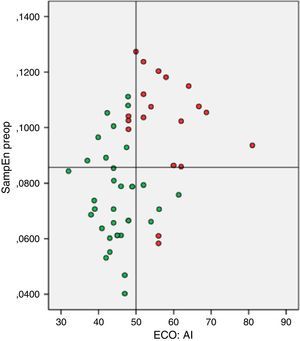
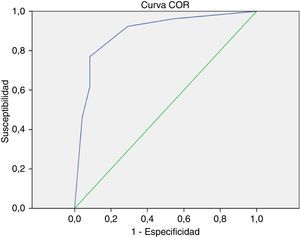
Modelo predictivo del éxito de la ablación quirúrgica basado en remodelado auricular anatomoeléctricoSe seleccionaron el diámetro auricular izquierdo y la SampEn como parámetros clínicos representantes del grado de remodelado auricular anatómico y eléctrico, respectivamente. Se elaboró el figura 2 de dispersión. Se aplicaron los puntos de corte calculados con anterioridad en dicho gráfico, quedando dividido en 4 cuadrantes. Una vez extrapolados los resultados de ablación al cierre del seguimiento en cada uno de los puntos, pudo determinarse el porcentaje de éxito de ablación de los pacientes seleccionados en cada uno de los cuadrantes. Diecinueve (38%) pacientes quedaron contenidos en el cuadrante con condiciones óptimas de remodelado auricular (inferior izquierdo), hallándose un 100% de éxito de ablación. En los restantes cuadrantes se registraron: superior izquierdo 11 (22%) con 72,7% (8) de éxito; superior derecho 14 (28%) con un 0% de éxito de restablecimiento de ritmo sinusal y en el inferior derecho 6 (12%) con un 66,7% (4) de restauración de ritmo sinusal postablación. La capacidad predictiva del modelo para la detección de pacientes en el cuadrante inferior izquierdo fue de ABC=0,893 (fig. 3.).
Casos sometidos a ablación concomitante de FA según valores de entropía muestral (SampEn) y diámetro auricular izquierdo (AI) con sus puntos de corte. Fallo (puntos rojos) o restauración (puntos verdes) de RS al cierre del seguimiento. El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
Curva ROC correspondiente al modelo gráfico SampEn – diámetro auricular izquierdo (fig. 2) que muestra la capacidad predictiva para identificar casos con diámetro auricular izquierdo < 50mm y SampEn<0,0857 (situados en el cuadrante inferior izquierdo) con mejores condiciones para permitir el restablecimiento de ritmo sinusal postablación. Área bajo la curva (ABC)=0,893.
La evidencia recogida en la literatura a cerca de la asociación del grado de organización de la arritmia y el resultado de la ablación quirúrgica es escasa. Hornero et al. en una serie de 70 pacientes sometidos a ablación quirúrgica de FA, tras estudiar la organización de la arritmia según los tipos de Wells, observó que la FA de tipo III se comportó como un factor predictivo tardío de bajo éxito de ablación18.
Es destacable la elevada frecuencia de cardiopatía reumática lo cual, junto a la ausencia de selección de pacientes apreciable en el amplio rango de dispersión de los diámetros auriculares, probablemente haya podido perjudicar el resultado de restablecimiento de ritmo sinusal postablación. No obstante, el rango ampliado de grados de remodelado incluido en el estudio se justifica por el objetivo del mismo de profundizar en la relación entre los parámetros de remodelado anatómicos y eléctricos, lo cual justifica la variabilidad incluida en la muestra a costa de grabar los resultados de restablecimiento de ritmo sinusal. La prevalencia de cardiopatía reumática en la muestra seleccionada es elevada en comparación con resultados publicados en nuestro medio19. La enfermedad valvular reumática ha sido reconocida como un factor adverso para el éxito de la ablación de la FA debido a una frecuente progresión del remodelado anatómico (y seguramente también eléctrico) en el momento de la ablación debido a la afectación mitral por estenosis de larga evolución y con frecuente asociación con alteraciones del sustrato miocardio auricular de cicatrización y calcificación parietal10. En la serie estudiada se asocia a grados de remodelado más avanzados, particularmente el eléctrico, clínica aunque no estadísticamente significativos.
La exclusión del apéndice auricular izquierdo sistemática es controvertida y en nuestro estudio fue llevada a cabo de forma desigual, influyendo en dicha decisión la elevada tasa de reoperaciones incluidas que limitó el abordaje epicárdico, preferido en nuestra institución. El cierre endocavitario con sutura se reservó para aquellos casos con la calidad del tejido auricular suficiente.
El parámetro individual que mostró mejor capacidad predictiva del éxito de la ablación quirúrgica para el seguimiento contemplado en el presente trabajo fue el diámetro auricular izquierdo (ABC=0,848). El modelo gráfico bidimensional mejoró la capacidad predictiva individual de este parámetro al incorporar la dimensión eléctrica del remodelado (ABC=0,893). Así, los pacientes del cuadrante inferior izquierdo presentaron condiciones óptimas, registrándose los fallos en aquellos con remodelado anatómico y/o eléctrico por encima de los puntos de corte. De igual forma, los pacientes hallados en el cuadrante superior derecho mostraron las peores condiciones de remodelado para la consecución de éxito postablación de la FA. A pesar de que la utilización del modelo combinado respecto del diámetro auricular izquierdo aislado incrementa la capacidad predictiva de forma limitada, consideramos dicha diferencia relevante en aras de optimizar la selección de los pacientes sometidos a ablación. Asimismo, al obtenerse SampEn a partir de un estudio preoperatorio no invasivo, podría integrarse su determinación de forma regular en la práctica clínica cotidiana realizando el registro inicial conjuntamente con el resto de estudios preoperatorios, e incluso automatizarse su obtención por sistemas informáticos a partir de un simple registro de ECG digital. A pesar de disponerse de la tecnología necesaria para tal fin, son diferentes los sistemas que deben implicarse en los diferentes pasos del análisis lo cual, junto a la falta de automatización en algunos pasos como el reconocimiento correcto de los complejos QRST y su cancelación para el aislamiento de la actividad eléctrica auricular, así como la obtención de la onda auricular principal a partir de la cual obtener los diferentes parámetros de organización de señal, queda limitada aun hoy su extensión a la práctica clínica. No obstante la metodología empleada es reproducible, y podría convertirse una herramienta futura no invasiva para la toma de decisiones en campos como la ablación quirúrgica o percutánea y la cardioversión eléctrica.
Otros autores han propuesto parámetros de organización de señal eléctrica auricular diferentes de SampEn, con buenas capacidades predictivas del éxito de restablecimiento del ritmo sinusal tras ablación quirúrgica como la frecuencia auricular dominante y la potencia de las ondas f (fWP) relacionada con la amplitud de la señal eléctrica20,21.
El estudio asume las siguientes limitaciones. Primero, el tamaño de la muestra estudiada es limitado, en relación con lo elaborado de la obtención del registro ECG y su análisis preoperatorio y el volumen de actividad quirúrgica en nuestro medio. No obstante, las series comunicadas en la literatura también presentan limitadas series de pacientes debido a la elevada especificidad del procedimiento. Segundo, la metodología del protocolo de seguimiento ambulatorio, mediante registros clínicos y de ECG puntuales puede haber infraestimado la tasa de recurrencia postablación. Dándose importancia al carácter eficiente y no invasivo de los métodos utilizados para caracterizar pre- y postoperatoriamente la actividad eléctrica cardiaca, no se consideró la aplicación de sistemas de registro continuo implantables. La discriminación ofrecida por un Holter-ECG, ante lo dilatado del seguimiento, habría sido asimismo limitada22. Tercero, la caracterización del remodelado anatómico fue realizada por medio de la determinación del diámetro auricular izquierdo anteroposterior por ecocardiografía transtorácica. Desde un punto de vista de eficiencia e indicación clínica, no se consideró la utilización de métodos de valoración por TC, RMN o ecocardiografía transesofágica23, a pesar de su mayor fiabilidad. Si bien el área auricular por proyección de 4 cámaras en la ecocardiografía transtorácica habría sido un parámetro de mayor calidad, la disponibilidad de esta medición fue limitada. Cuarto, la valoración del tiempo en FA fue realizada fundamentalmente por el tiempo durante el cual el paciente había seguido tratamiento con anticoagulación oral. Aunque asimilables, particularmente en casos de FA asintomática de larga evolución como la asociada a valvulopatía reumática podría haber incurrido en mayor imprecisión en la determinación, pudiendo explicar la pérdida de capacidad predictiva del éxito de ablación de este parámetro y por ende su falta de relación con el grado de remodelado auricular.
No obstante, se considera que se ha aplicado una metodología válida y replicable en futuras investigaciones que pudiesen ofrecer un modelo extrapolable a la actividad quirúrgica en otros centros para optimizar la selección de casos y, con ello, los resultados de la ablación quirúrgica de la FA. La utilización de parámetros no invasivos para la valoración del grado de remodelado no se considera una limitación dado que el estudio persigue optimizar la eficiencia en la aplicación de la ablación quirúrgica, por lo que los parámetros registrados no podrían encarecer ni suponer una trastorno/riesgo para el paciente. Esta metodología aplicada posibilita una fácil integración en la práctica clínica cotidiana.
ConclusionesEl análisis del grado de remodelado auricular anatomoeléctrico preoperatorio mediante variables clínicas no invasivas podría ser útil para seleccionar los pacientes más favorables para el restablecimiento de RS tras ablación concomitante de FA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.