La endocarditis infecciosa (EI) sobre prótesis valvulares (EIPV) es una de las formas más graves de esta enfermedad y se asocia con elevada mortalidad intrahospitalaria y necesidad de cirugía. Todo paciente con EIPV debe ser atendido en centros hospitalarios de referencia en endocarditis, en los que exista un equipo de endocarditis muldisciplinar que incluya a cardiólogos clínicos y expertos en imagen cardiaca, cirujanos cardiacos, microbiólogos y especialistas en enfermedades infecciosas con experiencia en EI. En este trabajo se revisan los aspectos diagnósticos, terapéuticos y pronósticos de esta entidad.
Prosthetic valve endocarditis (PVE) is one the most severe forms of infective endocarditis, with the highest risk of death and need for surgery. Patients with PVE should be evaluated and managed in reference centres, with immediate surgical facilities and the presence of a multidisciplinary endocarditis team, including a cardiologist, imaging specialists, a cardiac surgeon, a microbiologist, and a specialist in infectious diseases. A review is presented of the diagnostic, therapeutic and prognostic aspects of this entity.
La endocarditis infecciosa (EI) sobre prótesis valvulares (EIPV) representa un 10-30% de todos los casos de endocarditis1-3 y es una de las formas más graves de esta enfermedad, con una mortalidad intrahospitalaria del 20-40%1,4. Se estima que la infección ocurre en alrededor de un 1-6%4 de los pacientes portadores de prótesis valvulares, con una incidencia del 0,3-1,2% por paciente y año1,5.
En la EIPV se han diferenciado clásicamente 2 grupos, la EI protésica precoz, que es aquella que ocurre en el primer año tras la cirugía, y la protésica tardía, que aparece después del primer año6. Quizá la diferencia más importante entre ambos grupos radique en el perfil microbiológico, ya que la primera se adquiere en el periodo perioperatorio, en el quirófano durante la intervención o por infección de la herida quirúrgica o a través de catéteres intravasculares en la unidad de cuidados posquirúrgicos, por lo que en ella predominan los estafilococos coagulasa-negativos, Staphylococcus aureus (S. aureus), enterococos, hongos y bacilos gramnegativos. Así, en un amplio estudio multicéntrico, más de un tercio de las EIPV fueron de adquisición nosocomial o relacionadas con cuidados sanitarios1.
En la EI protésica tardía los microorganismos implicados son similares a los encontrados en EI sobre válvula nativa, principalmente estafilococos, estreptococos del grupo viridans y enterococos5,6.
Las manifestaciones clínicas de los pacientes con EIPV son análogas a las de los pacientes con EI sobre válvula nativa en la mayoría de los casos. Por tanto, pueden darse desde manifestaciones clásicas, como la presencia simultánea de fiebre, nuevo soplo de insuficiencia valvular y manifestaciones cutáneas, hasta manifestaciones inespecíficas y con evolución más tórpida que dificultan el diagnóstico y retrasan el inicio del tratamiento.
Para poder alcanzar un diagnóstico precoz, debe considerarse siempre la posibilidad de EI en pacientes portadores de prótesis valvular con fiebre, disfunción protésica (nueva insuficiencia valvular o perivalvular) y embolias.
La evolución de la enfermedad puede tener un curso clínico agudo, subagudo o crónico. En la forma aguda, los síntomas aparecen desde unos pocos días hasta 2 semanas previas al diagnóstico, habitualmente cursa con fiebre alta, tiritona e insuficiencia cardiaca. El microorganismo más frecuente en esta forma de presentación es S. aureus. En la forma subaguda, predominan los síntomas constitucionales (pérdida de peso, astenia, anorexia) y la febrícula. En este caso, los microorganismos causantes suelen ser estreptococos o estafilococos coagulasa-negativos, o Propionibacterium acnes7,8.
DiagnósticoCriterios de DukeEl diagnóstico de la EIPV se establece según los criterios de Duke modificados9, que se basan fundamentalmente en hallazgos clínicos, ecocardiográficos y microbiológicos. Los criterios mayores incluyen el aislamiento en cultivos de microorganismos típicos y la presencia de lesiones ecocardiográficas típicas de EI. Los criterios menores comprenden la presencia de valvulopatía predisponente (lo que incluye las prótesis valvulares), el uso de drogas por vía parenteral, la fiebre y la existencia de fenómenos vasculares e inmunológicos.
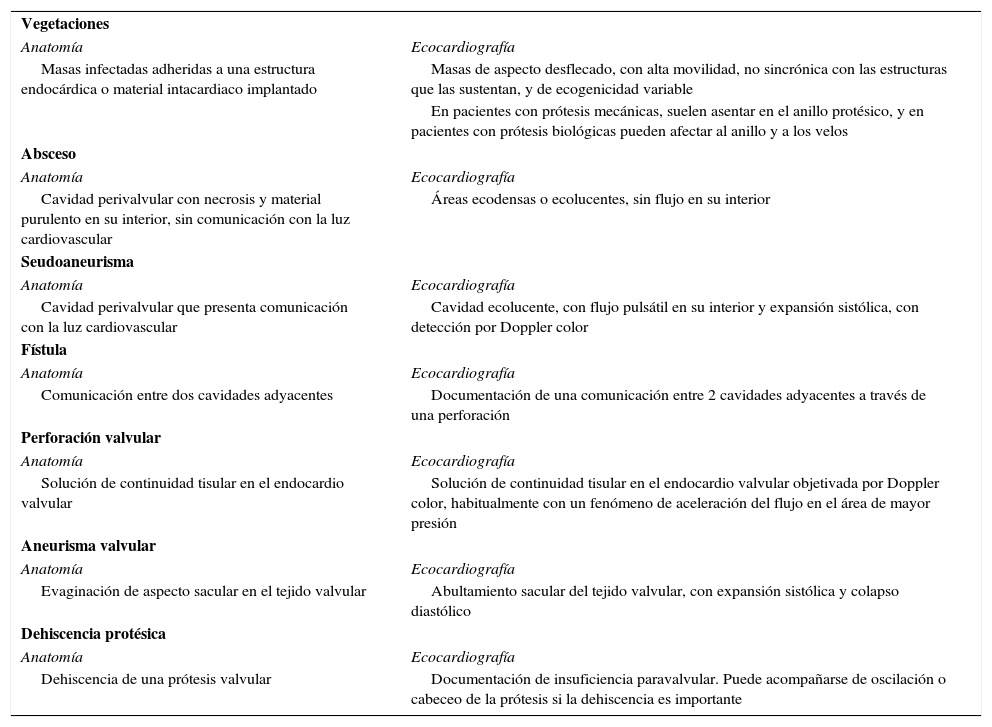
Hallazgos anatómicos y ecocardiográficosDesde la publicación de las últimas guías europeas de EI5, son 7 los signos ecocardiográficos que se consideran un criterio mayor de EI (tabla 1). La vegetación es la lesión más característica de la infección. Se detecta como una masa oscilante, móvil en la mayoría de los casos, con un movimiento independiente de la válvula. Fundamentalmente, se encuentran adheridas al anillo protésico en las prótesis mecánicas y en los velos valvulares en las prótesis biológicas5.
Lesiones de la endocarditis infecciosa: hallazgos anatómicos y ecocardiográficos
| Vegetaciones | |
| Anatomía | Ecocardiografía |
| Masas infectadas adheridas a una estructura endocárdica o material intacardiaco implantado | Masas de aspecto desflecado, con alta movilidad, no sincrónica con las estructuras que las sustentan, y de ecogenicidad variable |
| En pacientes con prótesis mecánicas, suelen asentar en el anillo protésico, y en pacientes con prótesis biológicas pueden afectar al anillo y a los velos | |
| Absceso | |
| Anatomía | Ecocardiografía |
| Cavidad perivalvular con necrosis y material purulento en su interior, sin comunicación con la luz cardiovascular | Áreas ecodensas o ecolucentes, sin flujo en su interior |
| Seudoaneurisma | |
| Anatomía | Ecocardiografía |
| Cavidad perivalvular que presenta comunicación con la luz cardiovascular | Cavidad ecolucente, con flujo pulsátil en su interior y expansión sistólica, con detección por Doppler color |
| Fístula | |
| Anatomía | Ecocardiografía |
| Comunicación entre dos cavidades adyacentes | Documentación de una comunicación entre 2 cavidades adyacentes a través de una perforación |
| Perforación valvular | |
| Anatomía | Ecocardiografía |
| Solución de continuidad tisular en el endocardio valvular | Solución de continuidad tisular en el endocardio valvular objetivada por Doppler color, habitualmente con un fenómeno de aceleración del flujo en el área de mayor presión |
| Aneurisma valvular | |
| Anatomía | Ecocardiografía |
| Evaginación de aspecto sacular en el tejido valvular | Abultamiento sacular del tejido valvular, con expansión sistólica y colapso diastólico |
| Dehiscencia protésica | |
| Anatomía | Ecocardiografía |
| Dehiscencia de una prótesis valvular | Documentación de insuficiencia paravalvular. Puede acompañarse de oscilación o cabeceo de la prótesis si la dehiscencia es importante |
La extensión perivalvular de la infección incluye la presencia de abscesos, seudoaneurismas, fístulas y dehiscencia protésica, y es más frecuente en EIPV precoz10,11. Los abscesos se observan como áreas ecodensas o ecolucentes, sin flujo en su interior y los seudoaneurismas como cavidades ecolucentes con flujo pulsátil en su interior y expansión sistólica. El desarrollo de una fístula puede ser una complicación tanto de abscesos como de fístulas, pero en algunas ocasiones ocurre directamente como consecuencia de necrosis y rotura tisular. Las fístulas se visualizan por Doppler color como flujos que comunican dos cavidades10,11.
La dehiscencia protésica, en ausencia de otras lesiones, constituye por sí sola un criterio diagnóstico mayor. Sin embargo, hasta un 15% de los pacientes con prótesis en ausencia de infección pueden tener insuficiencia valvular periprotésica de grado leve. Por ello, es importante cerciorarse de que se trata de un hallazgo nuevo12. En casos de amplia dehiscencia periprotésica, la prótesis presenta un movimiento característico denominado cabeceo protésico, que se define como oscilaciones de la prótesis superiores a 15° en al menos una dirección, acompañados de flujo regurgitante paravalvular.
Los nuevos criterios ecocardiográficos mayores son la presencia aneurismas en los velos o la perforación de los mismos5,12,13.
Aunque la EI ocurre por igual en prótesis biológicas y mecánicas14, la patogénesis y las manifestaciones anatomopatológicas y ecocardiográficas de uno y otro tipo de prótesis son diferentes6,12,15,16. Así, en las prótesis mecánicas, fundamentalmente cuando la contaminación se ha producido en el periodo perioperatorio, la infección afecta fundamentalmente a la unión entre el anillo y la sutura quirúrgica, lo que conduce a una mayor incidencia de complicaciones perianulares, mientras que en las bioprótesis la infección puede localizarse tanto a nivel del anillo como en los velos de la prótesis, y es más frecuente la presencia de vegetaciones en los velos, perforaciones y rotura de los mismos12.
Otra manifestación anatómica y ecocardiográfica específica de las prótesis biológicas infectadas, aunque no se considera un criterio principal, es la valvulitis, que acontece en ocasiones en EIPV en el contexto de microorganismos poco virulentos12. En este caso, en la ecocardiografía se objetiva únicamente la presencia de engrosamiento de los velos, los cuales tienen bordes irregulares y desflecados. En muchos casos, no se ve afectada la función de la bioprótesis y, por tanto, no existe insuficiencia valvular significativa.
Diagnóstico por imagen en la endocarditis protésicaA pesar de la utilidad de los criterios de Duke, es bien conocido que estos son menos sensibles en el contexto de EIPV, debido a que con más frecuencia, tanto la ecocardiografía como los hemocultivos son negativos17,18. La sensibilidad de la ecocardiografía transtorácica (ETT) es limitada en los pacientes con sospecha de EI sobre válvula protésica y, por esta razón, la ecocardiografía transesofágica (ETE) es la técnica de elección19 para su diagnóstico. Un metaanálisis reciente demostró que la sensibilidad de la ETT y la ETE para la detección de vegetaciones en EIPV es del 30 y el 80%, respectivamente, mientras que la sensibilidad para la detección de complicaciones perianulares es del 36 y 86%, respectivamente. La especificidad de ambas técnicas es similar y superior al 90%20.
En los últimos años, el empleo de ETE tridimensional ha demostrado ser particularmente útil en la valoración de las complicaciones paravalvulares, la dehiscencia protésica y la cuantificación de la insuficiencia periprotésica. Además, permite definir con mayor precisión que la ETE convencional la relación que existe entre la extensión paravalvular de la infección, las prótesis y el resto de estructuras anatómicas adyacentes, información particularmente relevante a la hora de planificar la intervención quirúrgica21,22.
Si bien la ETE tiene una elevada exactitud diagnóstica, en algunas ocasiones van a existir falsos negativos de la técnica. Esto ocurre principalmente en aquellos pacientes con complicaciones perianulares localizadas a nivel de la cara anterior de la raíz aórtica, cuya visualización se ve dificultada por la sombra acústica de la prótesis20. Además, ciertas particularidades específicas de las prótesis valvulares pueden dificultar el diagnóstico diferencial en pacientes con sospecha EI. Entre ellas están la presencia de hilos de sutura o restos del aparato subvalvular en pacientes con prótesis mitrales, la existencia de hematoma periaórtico en postoperados recientes, así como la formación de trombos o pannus a nivel de las prótesis. En estos casos, es fundamental considerar los hallazgos ecocardiográficos en el contexto clínico del enfermo y repetir la ETE en unos días (3-5 días en función del microorganismo aislado).
En los últimos años, nuevas técnicas de imagen, principalmente la tomografía computarizada (TC)/tomografía por emisión de positrones con 18F-FDG (PET/TC) y, en menor medida, la TC multidetector, han demostrado su utilidad en el contexto de la EIPV23-27.
El principal valor añadido de la técnica de medicina nuclear se encuentra en la reclasificación de aquellos episodios categorizados como «EI posible» según los criterios de Duke, así como en la detección de embolias periféricas5. Así, exceptuando el postoperatorio inmediato, donde la captación de 18F-FDG puede representar simplemente un estado hipermetabólico por la inflamación postoperatoria28, la PET/TC ha demostrado que puede aportar información complementaria en aquellos pacientes con sospecha de infección protésica que no cumplen el diagnóstico de EI definitiva23,24. Es por esta razón que en las últimas guías europeas5 el hallazgo de captaciones patológicas por esta técnica se ha incluido como criterio mayor en pacientes portadores de prótesis valvulares, una vez transcurridos los 3 primeros meses tras la intervención quirúrgica (tabla 2). De la misma manera, el hallazgo de complicaciones perianulares por TC multicorte también se considera en la actualidad un criterio diagnóstico mayor5.
Criterios modificados de la Sociedad Europea de Cardiología en 2015 para el diagnóstico de endocarditis infecciosa
| Criterios mayores |
| 1. Hemocultivos positivos para endocarditis infecciosa |
| a) Microorganismos típicos de endocarditis infecciosa en 2 hemocultivos separados: – Estreptococos del grupo viridans, S. bovis, grupo HACEK, S. aureus, o enterococos adquiridos en la comunidad en ausencia de un foco primario |
| b) Hemocultivos persistentemente positivos por microorganismos compatibles con endocarditis: – Dos o más hemocultivos positivos separados por un periodo de más de 12 h – Tres de 3 o la mayoría de cuatro o más hemocultivos positivos con una diferencia de una hora o más entre el primero y el último |
| c) Un único hemocultivo positivo para C. burnetii o un título de anticuerpos IgG antifase i ≥ 1:800 |
| 2. Evidencia de afectación endocárdica |
| a) Ecocardiografía positiva para EI: – Vegetación en la válvula, en las estructuras adyacentes o en las áreas de choque del chorro de regurgitación valvular – Absceso, seudoaneurisma o fístula intracardiaca – Perforación valvular o aneurisma – Dehiscencia parcial de una válvula protésica que no existía previamente |
| b) Actividad metabólica intensa detectada en la zona de implantación de una prótesis valvular por 18F-FDG PET/TC (en prótesis implantadas más allá de 3 meses), o por SPECT/TC con leucocitos marcados |
| c) Lesiones paravalvulares identificadas mediante TC cardiaca multicorte |
| Criterios menores |
| 1. Predisposición: una cardiopatía predisponente o uso de drogas por vía parenteral |
| 2. Fiebre ≥ 38°C |
| 3. Fenómenos vasculares: embolias en arterias mayores, infartos pulmonares sépticos, aneurismas micóticos, hemorragia intracraneal, hemorragia conjuntival y lesiones de Janeway. Se incluyen aquellos clínicamente silentes detectados por imagen |
| 4. Fenómenos inmunitarios (glomerulonefritis, nódulos de Osler, manchas de Roth y factor reumatoide) |
| 5. Evidencia microbiológica: hemocultivos positivos que no cumplen los criterios mayores o evidencia serológica de infección activa por un microorganismo que puede producir EI |
El tratamiento de la EIPV sigue los principios generales para cualquier EI29,30:
- 1.
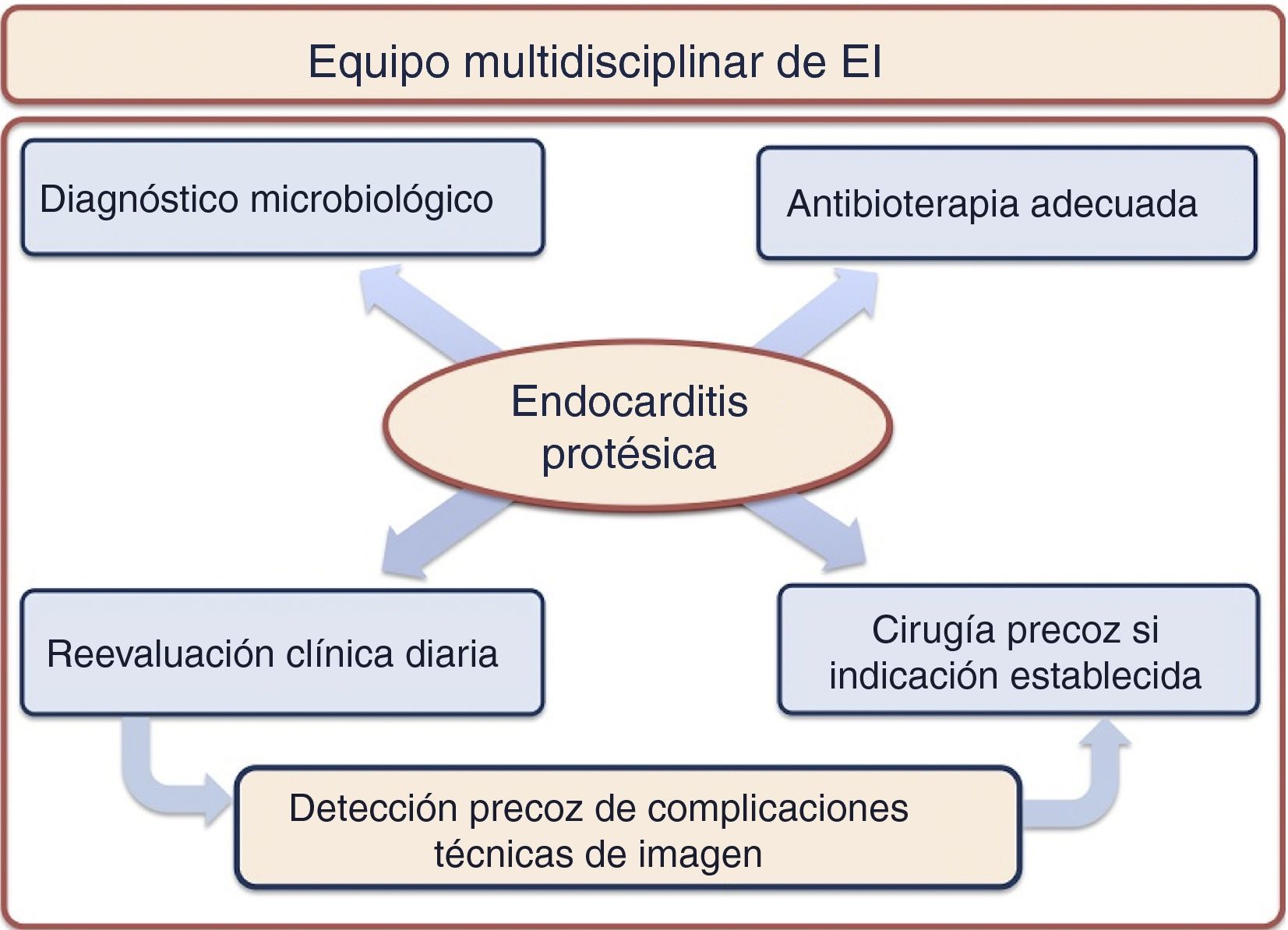
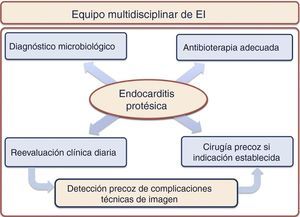
Todo paciente con EIPV debe ser atendido en centros hospitalarios de referencia en endocarditis, en los cuales exista un equipo de endocarditis muldisciplinar (fig. 1) que incluya a cardiólogos clínicos y expertos en imagen cardiaca, cirujanos cardiacos, microbiólogos y especialistas en enfermedades infecciosas con experiencia en EI5,31.
- 2.
Es fundamental establecer el diagnóstico microbiológico siempre que sea posible, por lo que es imprescindible la extracción de hemocultivos antes del inicio del tratamiento antibiótico empírico.
- 3.
En los pacientes graves se debe iniciar tratamiento empírico inmediatamente después de la extracción de los hemocultivos. La identificación de la puerta de entrada de la infección siempre se debe buscar, para resolver el foco de sepsis y porque nos puede orientar sobre cuál es el microorganismo causal. Una vez se identifique el microorganismo responsable y, en función del antibiograma obtenido, se podrá modificar la pauta antibiótica.
- 4.
En general, deben emplearse antibióticos bactericidas a dosis elevadas, durante largo tiempo y muchas veces en combinación. Además, estos antibióticos deben administrarse por vía parenteral y en unos intervalos de tiempo determinados. Esto es así debido a las características de las vegetaciones (avasculares, con escasa presencia de células fagocíticas) y a las propiedades farmacodinámicas de antibióticos como los betalactámicos y glucopéptidos, que determinan que su actividad bactericida dependa, sobre todo, del intervalo durante el cual su concentración supera a la concentración mínima inhibitoria y no tanto del pico alcanzado32. Si existen alternativas eficaces, es conveniente evitar o acortar la duración del tratamiento con antibióticos que tengan una elevada incidencia de efectos adversos, como los aminoglucósidos y la vancomicina, y cuando se utilicen es necesaria una monitorización de sus niveles plasmáticos para asegurar la eficacia del tratamiento y disminuir la posibilidad de reacciones adversas.
- 5.
Es imprescindible completar el ciclo de tratamiento antibiótico. La esterilización de la vegetación es un proceso largo y para evitar recaídas es necesario completar la pauta de antibiótico recomendada (habitualmente 6 semanas).
- 6.
Se debe realizar una exploración clínica diaria y análisis sanguíneos periódicamente para detectar precozmente cambios en la situación hemodinámica de los pacientes y la presencia de complicaciones (embolias periféricas, infección persistente, afectación renal…). En la endocarditis protésica aórtica, especialmente en los primeros 15 días, se debe realizar electrocardiograma con frecuencia con el fin de poder detectar la aparición de trastornos de la conducción, especialmente aurículo-ventriculares, pues con frecuencia traducirán la existencia de complicaciones perianulares.
- 7.
La anticoagulación debe evitarse, excepto en los casos en que resulte imprescindible (válvulas mecánicas, fibrilación auricular), en los que se optará por el empleo de heparina no fraccionada en infusión intravenosa continua. Si se produjese un episodio vascular cerebral hemorrágico, será necesario suspender y, en ocasiones, corregir la anticoagulación. Si la complicación es isquémica, inicialmente no será necesario suspender la anticoagulación, salvo que se convirtiese en hemorrágico o que sea muy extenso33.
- 8.
Es fundamental asegurar un adecuado soporte nutricional para el mantenimiento del enfermo y la mejoría de su estado general.
- 9.
Una vez resuelto el episodio, se debe educar al paciente y su familiar en las medidas para prevenir reinfecciones y explicar en qué consiste la profilaxis de EI y cuáles son las situaciones ante las cuales debe recibirla5.
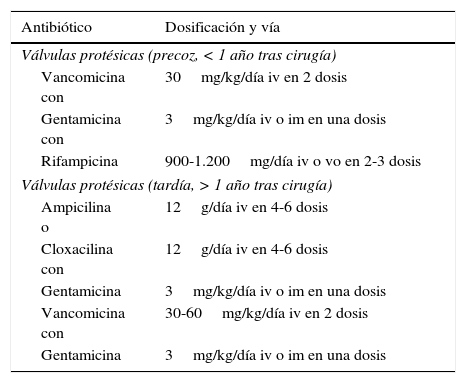
Los antibióticos para el tratamiento empírico deben ser escogidos en función del microorganismo causal más probable, según las características del paciente y la forma de presentación clínica de la infección. En las EIPV precoces, deben cubrirse principalmente estafilococos coagulasa-negativos resistentes a meticilina y S. aureus5,6. Tal y como se ha mencionado previamente, después del primer año, la distribución microbiológica de la EIPV se parece más a la de las endocarditis sobre válvula nativa, aunque Staphylococcus epidermidis es particularmente frecuente (tabla 3).
Tratamiento antibiótico empírico recomendado en endocarditis infecciosa sobre prótesis valvulares
| Antibiótico | Dosificación y vía |
|---|---|
| Válvulas protésicas (precoz, < 1 año tras cirugía) | |
| Vancomicina con | 30mg/kg/día iv en 2 dosis |
| Gentamicina con | 3mg/kg/día iv o im en una dosis |
| Rifampicina | 900-1.200mg/día iv o vo en 2-3 dosis |
| Válvulas protésicas (tardía, > 1 año tras cirugía) | |
| Ampicilina o | 12g/día iv en 4-6 dosis |
| Cloxacilina con | 12g/día iv en 4-6 dosis |
| Gentamicina | 3mg/kg/día iv o im en una dosis |
| Vancomicina con | 30-60mg/kg/día iv en 2 dosis |
| Gentamicina | 3mg/kg/día iv o im en una dosis |
Habitualmente, el tratamiento antibiótico de la EIPV es más prolongado (al menos 6 semanas) que el de la EI sobre válvula nativa, pero una vez establecido el diagnóstico microbiológico, los antibióticos empleados deben ser los mismos5. La única excepción es la EIPV por estafilococo, en la cual se recomienda el empleo de rifampicina, por su importante y rápida potencia antiestafilocócica y gran capacidad para penetrar en las biocapas que forman estos microorganismos. La rifampicina debe iniciarse 3-5 días tras el inicio de un tratamiento antibiótico efectivo una vez eliminada la bacteriemia. Esta última recomendación está basada en el efecto sinérgico de la rifampicina con las combinaciones antibióticas en el caso de bacterias inactivas de las biopelículas y la probable actividad antagonista contra las bacterias planctónicas/duplicadoras5.
En esta revisión no se profundiza en el tratamiento antibiótico más adecuado para cada microorganismo. Consideramos que las guías ofrecen esta información y que además es muy conveniente la consulta al especialista en enfermedades infecciosas de cada centro.
Tratamiento quirúrgicoEn la EIPV, en más del 50% de los casos va a ser necesario el concurso de la cirugía para la erradicación definitiva de la infección3,5, y la gran mayoría de los pacientes con EI protésica precoz van a requerir cirugía6,14,34.
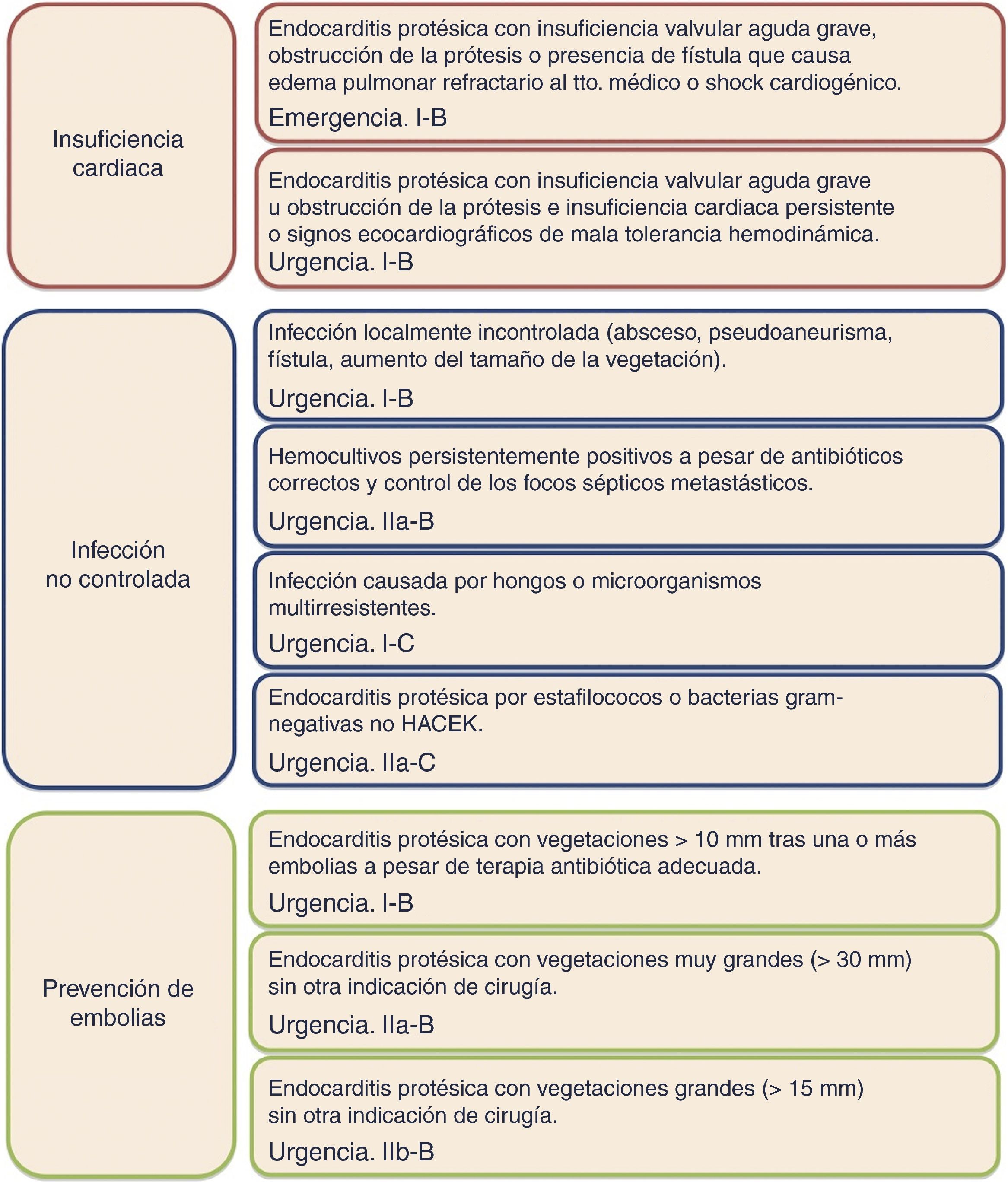
Las indicaciones de cirugía en pacientes con EIPV activa son similares a las de EI sobre válvula nativa5 y se pueden agrupar en 3 tipos: una indicación hemodinámica, otra infecciosa y otra cuyo objetivo principal es prevenir embolias (fig. 2). En esta figura viene indicado el momento más adecuado para la realización de la cirugía, de acuerdo con las guías europeas de cardiología. Nuestro grupo considera que una vez establecida la indicación de cirugía el paciente debe ser intervenido cuanto antes.
Indicaciones y momento de la cirugía en la endocarditis protésica izquierda. Recomendaciones y nivel de evidencia.
Emergencia: cirugía que se realiza en las primeras 24h una vez establecida la indicación. Urgencia: cirugía que se realiza en los primeros días (habitualmente en las primeras 48h) una vez establecida la indicación.
De los 3 tipos de indicación, la hemodinámica por insuficiencia cardiaca es la más frecuente. En la mayoría de los casos, la clínica es secundaria a la destrucción valvular por la infección en las prótesis biológicas y a insuficiencia periprotésica grave en las mecánicas. En algunos pacientes, sobre todo en prótesis aórticas, la evolución es aguda, con muy mala tolerancia hemodinámica, edema agudo de pulmón y shock cardiogénico, lo que la hace una indicación establecida de cirugía urgente. La mortalidad de los pacientes con insuficiencia cardiaca no operados alcanza el 55-85%, mientras que en los pacientes intervenidos quirúrgicamente es del 10-35%35.
La infección no controlada, definida como la presencia de fiebre y hemocultivos positivos persistentes después del tercer día de tratamiento antibiótico36, es la segunda indicación de cirugía, y una de las complicaciones de mayor mortalidad de esta enfermedad. La extensión perivalvular de la infección es la causa más frecuente de infección incontrolada y se asocia a mal pronóstico6,37, incluso a pesar de la realización de cirugía.
Por último, la prevención de embolias es una indicación difícil de cirugía. Una instauración precoz del tratamiento antibiótico correcto supone una importante disminución del riesgo embólico de los pacientes con EI38. Sin embargo, a pesar de la instauración del tratamiento antimicrobiano existen una serie de factores predictores de complicaciones embólicas que se consideran indicación de cirugía. Entre ellas, se encuentra el antecedente de embolia y la persistencia de vegetaciones mayores de 15mm, sobre todo si el agente infeccioso es S. aureus5,39,40.
No obstante, el beneficio de la cirugía precoz para el caso de una vegetación grande aislada es controvertido5 y en la decisión de operar precozmente se deben tener en consideración otras variables como la movilidad de las vegetaciones, el antecedente de eventos embólicos previos, la duración del tratamiento antibiótico, el tipo de microorganismo y el riesgo quirúrgico5,41. En pacientes con riesgo embólico elevado y riesgo quirúrgico bajo, la realización de una intervención quirúrgica precoz es razonable. Si se toma la decisión de operar para prevenir embolias, la cirugía debe llevarse a cabo de forma muy precoz (en 48h), ya que es cuando va a aportar mayor beneficio en este contexto39.
En definitiva, en la EIPV la cirugía precoz se ha asociado con menor mortalidad, tanto intrahospitalaria como a largo plazo, principalmente en aquellos pacientes de mayor riesgo42, fundamentalmente aquellos con disfunción protésica e insuficiencia cardiaca, y los pacientes con complicaciones perianulares e infección no controlada.
En algunos casos de EIPV por microorganismos distintos de estafilococos u hongos, sobre todo en prótesis biológicas, sin otras complicaciones asociadas, se puede optar por un tratamiento conservador5,43-46. Sin embargo, estos pacientes requieren un seguimiento muy estrecho por el mayor riesgo de recurrencias de la infección.
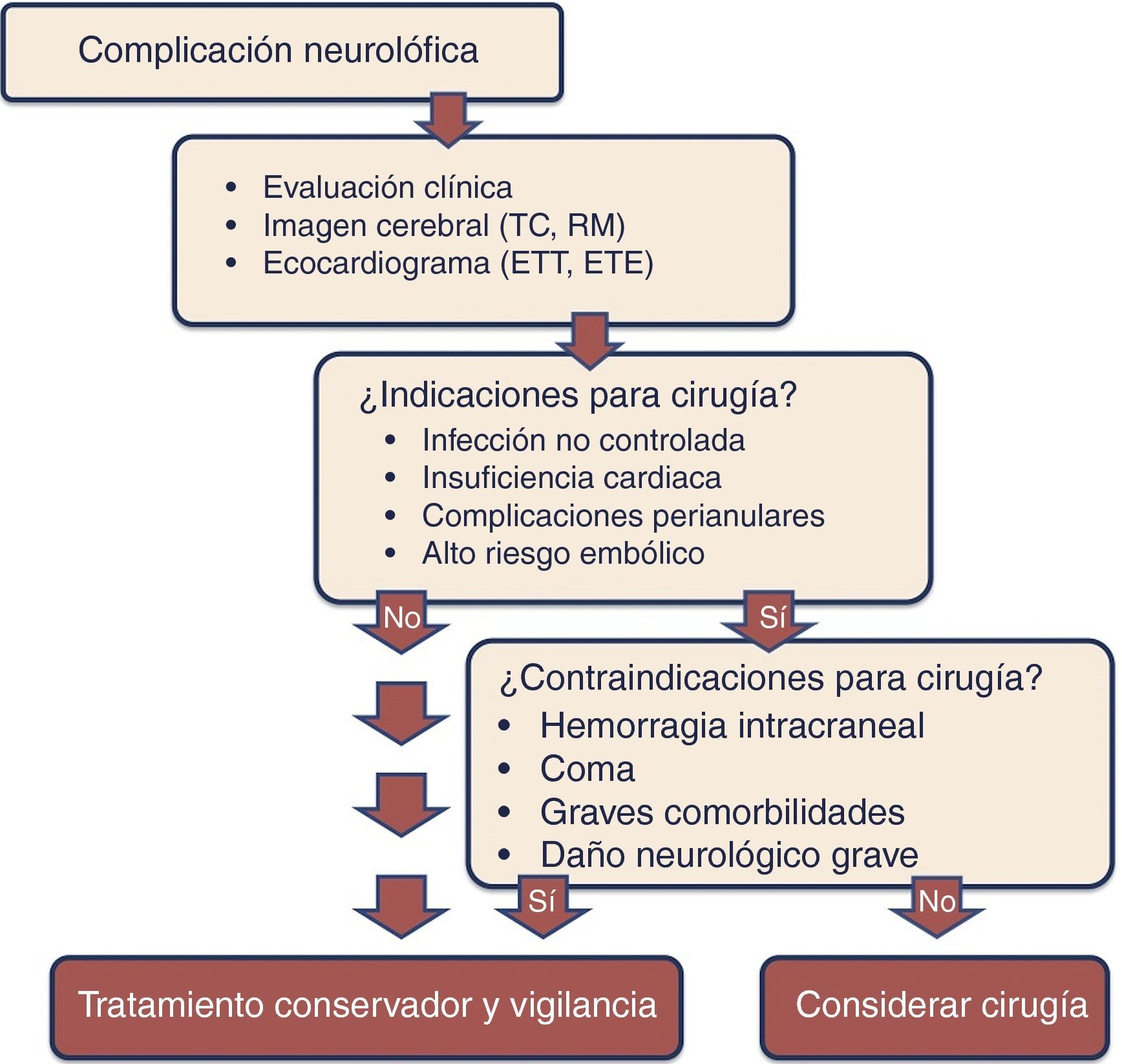
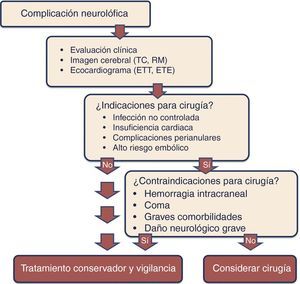
Indicación de cirugía en endocarditis infecciosa sobre válvula protésica y complicaciones neurológicasSegún distintas series, hasta un 25-30% de los pacientes con EI pueden presentar complicaciones neurológicas, si bien en algunos casos éstas son silentes.
La presencia de complicaciones neurológicas graves se asocia a un aumento de la mortalidad47, sin embargo, la cirugía cardiaca no está contraindicada si el paciente tiene una indicación quirúrgica a menos que se considere que el pronóstico neurológico vaya a ser demasiado malo48. Muchos de los pacientes con complicaciones neurológicas y EIPV presentan además alguna indicación para realización de cirugía urgente.
En todo paciente con sospecha de complicaciones neurológicas será fundamental la realización de pruebas de imagen cerebral (TC y/o RM) para la detección de las lesiones cerebrales de la EI, incluida la presencia de aneurismas micóticos, y planificar la cirugía (fig. 3).
Aunque en estos pacientes existe un riesgo de aparición de hemorragia cerebral tras la cirugía que pueda complicar el cuadro neurológico subyacente (3-6%), estudios recientes han demostrado que la cirugía cardiaca es segura en pacientes con ictus embólicos de pequeño tamaño, no hemorrágicos49,50, y por tanto, en estos casos, si existe una indicación de cirugía, la intervención se debe realizar sin demora51,52. En los pacientes con infartos de gran tamaño o hemorrágicos, sin embargo, se recomienda retrasar la intervención al menos 4 semanas5,53,54.
Indicación de cirugía en endocarditis infecciosa sobre válvula protésica y shock sépticoEl shock séptico es una de las complicaciones más temidas de la EI y la manifestación más evidente de infección no controlada. Se asocia a una mortalidad intrahospitalaria muy elevada55-57, y entre sus factores predisponentes se encuentran la presencia de signos de infección persistente, la infección por S. aureus, la insuficiencia renal aguda y la diabetes mellitus55.
En los pacientes con EI y shock séptico, los 3 factores fundamentales para controlar la infección son una pronta administración de dosis elevadas de antibióticos por vía intravenosa, un adecuado uso de la fluidoterapia y de soporte vasoactivo para revertir la hipotensión y la hipoperfusión tisular, y una resección precoz de los tejidos infectados. Respecto a este último punto, sin embargo, se ha sugerido que, a pesar de que la extirpación de los focos infecciosos es un elemento indiscutible para el control del shock séptico, esta intervención entraña tan alto riesgo en pacientes con EI que ello justifica un tratamiento conservador58.
Así, los pacientes que se encuentran en situación de shock séptico se operan mucho menos frecuentemente que aquellos sin esta complicación. Sin embargo, en un estudio realizado por nuestro grupo, observamos que los pacientes que se operan tienen menor mortalidad que los que reciben únicamente tratamiento médico55. No obstante, al tratarse de un estudio sin aleatorización, existe un posible sesgo por el cual es probable que sean intervenidos aquellos que tienen menos riesgo.
Por todo ello, no está establecido si la cirugía puede mejorar el pronóstico en este tipo de pacientes y la decisión de realizar una intervención quirúrgica precoz debe tomarse de forma individualizada valorando cuidadosamente el riesgo quirúrgico del paciente.
PronósticoComo se ha mencionado, la EIPV se asocia a una elevada mortalidad intrahospitalaria1,4. En estos pacientes, es crucial una adecuada valoración del riesgo en el momento del ingreso, así como una revaluación precoz en los primeros días tras el diagnóstico y el inicio de la antibioterapia, para poder detectar de forma precoz complicaciones y establecer la indicación de cirugía en los casos necesarios.
Los factores asociados a peor pronóstico incluyen edad avanzada, diabetes mellitus, infección por hongos o estafilococos, presencia de complicaciones perianulares, signos de infección persistente, ictus, shock séptico e insuficiencia cardiaca refractaria35,43,54,59,60. En estos pacientes, un manejo agresivo de la infección y la realización de cirugía precoz una vez establecida la indicación quirúrgica, si el riesgo quirúrgico no es prohibitivo, son esenciales para mejorar el pronóstico.
Profilaxis y seguimientoLos pacientes portadores de prótesis valvulares cardiacas tienen un riesgo mayor que la población general de presentar EI. Por tanto, se incluyen dentro de los grupos de alto riesgo en los que la profilaxis antibiótica está recomendada, más aún si ya han tenido un episodio previo de EI. En la actualidad, solo se recomienda la realización de profilaxis ante procedimientos dentales que requieran manipulación gingival o periapical del diente, o perforación de la mucosa oral. No existe evidencia de que otros procedimientos (en tracto respiratorio, gastrointestinal, etc.) puedan causar bacteriemia que origine EI5.
Los antibióticos recomendados para la profilaxis son amoxicilina/ampicilina (2g en dosis única por vía oral o intravenosa) o clindamicina (600mg en dosis única por vía oral o intravenosa) en aquellos pacientes alérgicos a penicilina.
Además de insistir en la profilaxis de EI al paciente y su familia, se debe instruir al paciente y al personal sanitario en la prevención de la enfermedad, que consiste básicamente en: 1) adecuada higiene oral y dentaria; 2) limpieza rápida de cualquier herida cutánea; 3) evitar en la medida de lo posible el mantenimiento prolongado de vías intravenosas; 4) tratamiento precoz de la flebitis; 5) consultar de forma precoz ante la aparición de fiebre sin foco de infección aparente y también ante la presencia de síntomas o signos de insuficiencia cardiaca, con o sin fiebre, y 6) desaconsejar los tatuajes y el piercing, especialmente el de las mucosas.
Aquellos pacientes con prótesis valvulares que ya han presentado un episodio de EI deben recibir un seguimiento periódico a largo plazo por un equipo especializado en EI5, con controles ecocardiográficos durante el primer año tras completar el tratamiento61, así como análisis y hemocultivos en la primera visita tras el alta.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.